Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.17 no.2 Montevideo dic. 2013
Cría artificial de abejorros nativos Bombus atratus y Bombus bellicosus (Hymenoptera, Apidae)
Salvarrey Sheena1, Arbulo Natalia2, Santos Estela1, Invernizzi Ciro1
1Facultad de Ciencias,Sección Etología, Universidad de la República. Iguá 4225, 11400 Montevideo, Uruguay. Correo electrónico: lepetite22@gmail.com
2Centro Universitario de la Región Este, Universidad de la República, Sede Rocha. Rincón esquina Florencio Sánchez, 27000, Rocha, Uruguay.
Recibido: 1/10/12 Aceptado: 9/5/13
Resumen
Los abejorros del género Bombus son excelentes polinizadores que contribuyen al mantenimiento de muchos ecosistemas y a la producción de cultivos comerciales. La cría comercial de abejorros se realiza desde hace 30 años con algunas especies euroasiáticas y norteamericanas. Uruguay cuenta con dos especies nativas de abejorros: Bombus atratus y Bombus bellicosus cuya cría artificial es considerada difícil. Durante la primavera y verano de los años 2009-2010 y 2010-2011 se realizaron experiencias de cría con ambas especies de abejorros. La cría se inició con reinas fecundadas recién salidas de su hibernación capturadas en primavera. Estas se colocaron dentro de cajas de madera de 5x10x10 cm con una pelota de polen de 1,5-2 cm de diámetro y jarabe de azúcar al 50%, y se mantuvieron en una estufa a 28 ºC. La experiencia del periodo 2009-2010 se inició con 42 reinas (40 B. atratus y 2 B. bellicosus) y la del periodo 2010-2011 con 89 reinas (82 B. atratus y 7 B. bellicosus). El 21,5 y 30,3% de las reinas en la primera y segunda experiencia respectivamente, tuvieron al menos una obrera. La mayor pérdida de reinas se constató en el periodo transcurrido desde la introducción de la reina en la caja hasta el comienzo de la oviposición (64,3 y 53,9% para la primera y segunda experiencia, respectivamente). Los resultados obtenidos en estas experiencias a pequeña escala se encuentran en el rango de los reportados en condiciones similares para otras especies de abejorros.
Palabras clave: THORACOBOMBUS, CRÍA, POLINIZADORES, URUGUAY
Summary
Artificial Breeding of Native Bumblebees Bombus atratus y Bombus bellicosus (Hymenoptera, Apidae)
Bumblebees (Bombus) are excellent pollinators that contribute to the maintenance of many ecosystems and commercial crop production. Commercial rearing of bumblebees has been performed for 30 years with some Eurasian and Northamerican species. Uruguay has two native bumblebees: Bombus atratus y B. bellicosus, whose artificial rearing is considered difficult. During the spring and summer of 2009-2010 and 2010-2011 breeding experiments were performed with both species of bumblebees. Experiences started with mated queens recently emerged from hibernation captured during spring. Queens were placed in wooden boxes of 5x10x10 cm with a pollen ball of 1.5-2 cm diameter and sugar syrup 50%, and were kept in an oven at 28 ºC. The 2009-2010 experience started with 42 queens (40 B. atratus and 2 B. bellicosus) and the 2010-2011 experience with 89 queens (82 B. atratus and 7 B. bellicosus). The 21.5 and 30.3% of the queens in the first and second experience respectively, had at least one worker. The greatest loss of queens was found in the period from the introduction of the queen in the box until the onset of oviposition (64.3 and 53.9% for the first and second experience, respectively). Results obtained in these small scale experiences are in the range of those reported under similar conditions for other bumblebee species.
Keywords: THORACOBOMBUS, REARING, POLLINATORS, URUGUAY
Introducción
Los abejorros del género Bombus (Hymenoptera: Apidae) son insectos eusociales de ciclo anual que juegan un rol importante en el mantenimiento de muchos ecosistemas y en la producción de diversos cultivos por su enorme capacidad como polinizadores (Michener, 1974; Free, 1993; Goulson, 2003; Heinrich, 2004).
Para Uruguay están citadas cuatro especies: Bombus atratus, B. bellicosus, B. brasiliensis y B. morio (Abrahamovich y Díaz, 2002; Abrahamovich et al., 2004), todas ellas pertenecientes al subgénero Thoracobombus (Williams et al., 2008). Sin embargo, en los últimos años sólo B. atratus y B. bellicosus han sido encontradas (Arbulo et al., 2011).
A principio del siglo XX, el interés de investigadores por ampliar el conocimiento acerca de diversos aspectos de la biología de los abejorros impulsó el comienzo de la cría artificial de colonias de abejorros. En 1912, se reportaron los primeros resultados exitosos, logrando obtener colonias de algunas especies europeas del género a partir de reinas recolectadas al finalizar su hibernación y confinadas a recintos artificiales con suplementación de alimento y material aislante (Salden, 1912). Al mismo tiempo y en años siguientes, varios investigadores obtuvieron resultados similares en otras especies europeas y norteamericanas empleando básicamente la misma técnica pero utilizando diversos diseños de recintos, distintos materiales de aislamiento, diferentes maneras de estimular a las reinas y varias formas de mantener a las reinas durante su hibernación (Plath, 1923; Frison, 1927). A lo largo del siglo XX, numerosos estudios contribuyeron a mejorar la técnica de cría, desarrollando métodos para controlar cada uno de los pasos del ciclo de vida de los abejorros y así alcanzar un completo proceso de domesticación. Entre estos se pueden destacar los avances obtenidos en la década del 60 en cuanto a las condiciones adecuadas de temperatura, iluminación y humedad para inducir a las reinas a iniciar una colonia (Velthuis y van Doorn, 2006) lo que permitió la cría en total confinamiento y potencialmente su realización durante todo el año. Lograr el apareamiento de machos y hembras en laboratorio también fue un paso importante en la domesticación de los abejorros (Duchateau, 1985). El desarrollo de una metodología que permitió evitar o cortar la diapausa de las reinas (Röseler, 1985) fue un progreso muy importante ya que posibilitó la generación de un sistema de cría continuo a lo largo del año. Luego de varias décadas de investigación, la domesticación de los abejorros fue un hecho (Velthuis y van Doorn, 2006).
A fines de los 80 se inicia en los Países Bajos la comercialización de colonias de abejorros para la polinización de tomate (Lycopersicon esculentum) en invernadero, principal cultivo en el que son utilizados hasta la actualidad (Velthuis, 2002; Velthuis y van Doorn, 2006). Desde entonces la comercialización de colonias se expandió principalmente en Europa y América del Norte, así como también en varios países asiáticos, en Nueva Zelanda y en Chile (Velthuis y van Doorn, 2006). Actualmente las colonias son comercializadas tanto para cultivos en invernadero como a campo entre los que se encuentran diversas hortalizas, frutales y forrajeras (Matheson, 1996; Velthuis y van Doorn, 2006; Estay, 2007).
En las últimas décadas, centros de investigación en distintas partes del mundo han buscado mejorar la técnica de cría para hacerla más eficiente, generalmente trabajando con B. terrestris. Las investigaciones se han focalizado en desarrollar diferentes métodos de estimulación de la reina para que inicie un nido (Gretenkord y Drescher, 1997; Kwon et al., 2003, 2006), en estudiar la diapausa de las reinas (Beekman et al., 1998, 1999) y en determinar las condiciones ambientales óptimas en las diversas etapas del ciclo de cría (Jie et al., 2005; Duchateau, 2006; van Doorn, 2006; Yoon et al., 2010a, 2010b; Amin y Kwan, 2011a, 2011b).
A pesar de que la información acerca de la metodología general de cría está disponible en numerosos artículos científicos (Röseler, 1985; Ptacek, 1991; van den Eijnde et al., 1991; Gretenkord y Drescher, 1997; Kwon et al., 2003, 2006; Ptacek y Drobna, 2006; Velthuis y van Doorn, 2006; Yoon et al., 2010a; Amin y Kwan, 2011a, 2011b) y en libros específicos del tema (Evans et al., 2007) o de temas relacionados (Free, 1993; Matheson, 1996; O‘Toole, 2003), los detalles que la hacen eficiente no son totalmente conocidos.
La cría artificial de abejorros puede realizarse a partir de reinas fecundadas recolectadas en el campo en primavera cuando emergen de su hibernación, lo que resulta en un 20 a 50% de éxito en el inicio de la colonia; o, una vez que el sistema de cría está establecido, puede hacerse con reinas producto del mismo, que han sido apareadas e hibernadas en condiciones controladas, obteniéndose en estos casos mayor éxito de inicio de colonia (Evans et al., 2007). Las reinas fecundadas son confinadas en pequeñas cajas-inicio y son aprovisionadas regularmente con jarabe de azúcar y una mezcla de polen fresco de abejas melíferas con jarabe. El diseño y el material de las cajas son variados, siendo madera y plásticos los más utilizados. Las medidas interiores en general no superan los 5x10x15 cm. Las reinas confinadas son mantenidas en total oscuridad o con iluminación roja a temperatura y humedad constantes; los rangos utilizados para estas variables van desde los 27 ºC a los 30 ºC y desde 50% a 70% de humedad relativa. Las reinas pueden ser colocadas solas o pueden utilizarse distintos métodos para una mayor estimulación de la puesta por parte de la reina. Colocar dos reinas juntas, una reina con algunas obreras de su especie o de otras especies del género, o con varias abejas melíferas recién emergidas, o con pupas de abejorro e incluso pupas artificiales, son algunos de los métodos que han sido utilizados. Una vez que la reina comienza a oviponer la cantidad de alimento suministrado va aumentando gradualmente, continuándose este incremento al emerger las obreras. Cuando la primer camada de obreras ha emergido (de 4 a 8 obreras), la colonia es transferida a cajas-nido de mayor tamaño. El diseño y el material de estas cajas-nido también son variables y muchas veces depende de la utilidad que se le dará a la colonia. Nuevamente, madera y plásticos son los materiales más frecuentemente utilizados y las dimensiones interiores son en general no menores a 20x20x15 cm. El nido puede mantenerse cerrado a temperatura controlada y provisto con suficiente alimento, o puede ser trasladado al campo y permitir a las obreras pecorear libremente para abastecer a la colonia (Evans et al., 2007).
La mayoría de las especies que han sido y son criadas artificialmente en la actualidad, tanto para investigación como para su comercialización, son de origen euroasiático y norteamericano. La principal, es la especie euroasiática Bombus terrestris, que incluso es comercializada fuera de su rango geográfico natural llegando a Japón, China, Chile y Nueva Zelanda (Velthuis y van Doorn, 2006). Conociendo el riesgo que puede traer la introducción de especies exóticas (competencia con especies nativas, introducción de nuevos parásitos y enfermedades, entre otros) (de Ruijter, 1997; Goulson, 2003, 2010; Inoue et al., 2008; Dafni et al., 2010), la mejor estrategia es intentar utilizar las especies nativas (Evans et al., 2007; Ings et al., 2006). La principal dificultad para esto es que se debe adecuar la técnica para la cría de las especies nativas. Desde el comienzo de la domesticación de los abejorros es claro que no todas las especies pueden ser criadas con la misma facilidad (Plath, 1923). En este sentido, es sabido que la cría en condiciones controladas de las especies pertenecientes al grupo denominado «hacedores de bolsillo» (se refiere a la forma en que las crías son alimentadas), es más complicada y demandante que la del otro grupo denominado «almacenadores de polen» al cual pertenecen las cinco especies comercializadas en el mundo (Plath, 1923; Griffin et al., 1991; Ptacek y Drobna, 2006; Velthuis y van Doorn, 2006). Las especies sudamericanas, incluidas B. atratus y B. bellicosus presentes en Uruguay, pertenecen al grupo «hacedores de bolsillo». A pesar de las dificultades, es posible criar las especies de este grupo adecuando y mejorando la técnica, existiendo experiencias de cría exitosa en Brasil (Garófalo, 1979), Colombia (Aldana et al., 2007; Cruz et al., 2008) y Chile (Patricia Estay com. pers.).
En Uruguay la primera experiencia de cría artificial de abejorros fue reportada por Varela y Rebuffo (1999). Estas investigadoras, siguiendo la técnica sugerida en la bibliografía del momento, lograron que un alto porcentaje de las reinas de B. bellicosus utilizadas pusieran huevos, llegando al estado larval un 65,2% de las posturas y al estado adulto un 13% de la misma. A pesar de obtener resultados exitosos los trabajos fueron discontinuados. Transcurrido más de una década, en la Facultad de Ciencias un grupo de investigación, siguiendo la técnica sugerida en la bibliografía y las recomendaciones de investigadores chilenos, inició la cría de abejorros en laboratorio a pequeña escala de las dos especies nativas encontradas más comúnmente en el país. En este trabajo se muestran los resultados obtenidos en las experiencias realizadas en dos temporadas.
Materiales y métodos
Las experiencias de cría artificial de abejorros se realizaron durante los meses de primavera y verano de los años 2009-2010 y 2010-2011 en la Sección Etología de la Facultad de Ciencias.
La cría se inició con reinas fecundadas de B. atratus y B. bellicosus recién salidas de su hibernación, capturadas en los meses de primavera mientras se encontraban pecoreando. Las reinas, con no más de 24 horas de capturadas, se colocaban dentro de cajas de madera (cajas de inicio) de 5x10x10 cm con paredes laterales de vidrio removibles. En un extremo de la caja de inicio se colocaba sobre una pequeña cajita de cartón una pelota de polen de 1,5-2 cm de diámetro elaborada con polen corbicular de abejas melíferas y jarabe de azúcar. En un orificio de la parte superior de la caja de inicio se insertaba un dispensador con jarabe de azúcar al 50%. Las cajas de inicio conteniendo las reinas fueron mantenidas a 28 ºC en una estufa de 180x50x50 cm. La fuente de calor de la estufa provenía de lámparas de color rojo, cuya luz no puede ser percibida por los abejorros.
Las tareas de mantenimiento se realizaron con la habitación oscurecida iluminando las cajas con luz roja para evitar perturbar a los insectos.
Cada 2-3 días se inspeccionaban las cajas de inicio registrando la situación de las reinas, las obreras y el nido, a la vez que se recambiaba el jarabe de azúcar. Si se encontraban celdas con el característico bolsillo lateral por donde los abejorros colocan el polen para alimentar a las larvas, este se llenaba de una pasta de textura cremosa hecha con polen y jarabe de azúcar con ayuda de una jeringa.
Cuando las colonias contaban con aproximadamente 4-8 obreras, se transferían a cajas de madera de 40x 20x 20 cm. Estas cajas cuentan con una tapa de madera y una contratapa corrediza de vidrio que permite la observación y un buen acceso a la colonia. Las actividades de mantenimiento básicamente fueron las mismas que en la etapa anterior: recambio de jarabe y alimentación de larvas. Cuando las colonias superaban los 10 individuos se trasladaban al campo terminando con las actividades de mantenimiento.
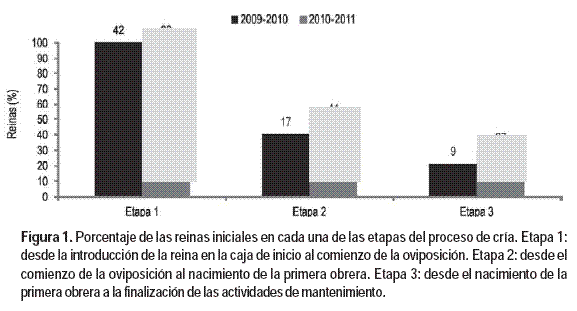
Para el análisis de los datos se determinaron tres etapas en el proceso de cría:
Etapa 1: desde la introducción de la reina en la caja de inicio al comienzo de la oviposición.
Etapa 2: desde el comienzo de la oviposición al nacimiento de la primera obrera.
Etapa 3: desde el nacimiento de la primera obrera a la finalización de las actividades de mantenimiento.
Resultados
La experiencia del periodo 2009-2010 se inició con 42 reinas (40 B. atratus y 2 B. bellicosus) y la del periodo 2010-2011 con 89 reinas (82 B. atratus y 7 B. Bellicosus).
A lo largo del proceso de cría el número de reinas que pasaban a las etapas 2 y 3 fue disminuyendo, verificándose la mayor reducción entre las etapas 1 y 2 (Figura 1). La experiencia del periodo 2010-2011 fue más eficiente que la del periodo 2009-2010 presentando un incremento en el número de reinas que tuvieron al menos una obrera (30,3 y 21,5%, respectivamente) (Figura 1).
Durante la experiencia del periodo 2009-2010 murieron 27 reinas (64,3% del número inicial) y en la del periodo 2010-2011 murieron 48 reinas (53,9% del número inicial). La Figura 2 muestra cómo se distribuyeron las reinas muertas entre las tres etapas de la cría. El mayor número de pérdidas de reinas en las dos experiencias ocurrió en la primera etapa, entre la introducción de las reinas a las cajas de inicio y el comienzo de la oviposición. Una vez iniciada la postura de huevos la pérdida de reinas disminuyó en forma marcada, verificando en la última etapa menos del 7% del total de las reinas muertas.
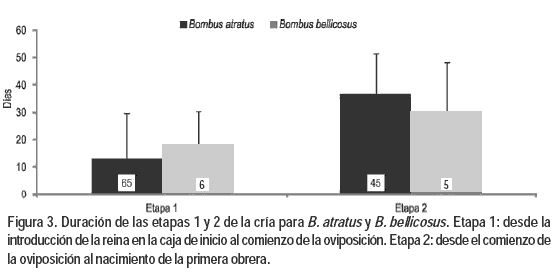
La duración de las etapas 1 y 2 se determinó analizando conjuntamente los registros de las dos experiencias. Tanto en B. atratus como en B. bellicosus la duración de las dos etapas mostró una gran variabilidad (Figura 3). Las reinas de B. atratus iniciaron antes la oviposición que las reinas de B. bellicosus, mientras que la duración del ciclo de cría de B. atratus fue en promedio casi siete días más largo que el de B. bellicosus (Figura 3).
Discusión
Las especies de abejorros que integran el grupo de «hacedores de bolsillo», entre las que se encuentran B. atratus y B. bellicosus son consideradas difíciles de criar artificialmente (Plath, 1923; Griffin et al., 1991; Ptacek y Drobna, 2006; Velthuis y van Doorn, 2006). Sin embargo, las dos experiencias de cría artificial a pequeña escala realizadas con estas dos especies de abejorros nativos mostraron resultados satisfactorios, consiguiendo formar colonias con el 21,5 y el 30,3% de las reinas iniciales en la primera y segunda experiencia, respectivamente. Estos resultados se encuentran dentro del rango de éxito de cría obtenido a partir de reinas capturadas en el campo (20 a 50%) reportado para especies euroasiáticas y norteamericanas del grupo de «almacenadores de polen» (Evans et al., 2007).
Los resultados obtenidos en las dos experiencias de cría son mejores que el reportado por Varela y Rebuffo (1999) para B. bellicosus (13%), siendo este el único antecedente nacional de cría de abejorros.
La muerte de las reinas, especialmente en los días siguientes a introducirlas en las cajas de inicio, es el principal problema encontrado en las dos experiencias de cría. Los abejorros son hospederos de una gran variedad de parásitos como virus, bacterias, hongos, protozoos, nematodos, himenópteros y dípteros parasitoides y ácaros (Schmid-Hempel, 2001). Es posible que en la situación de confinamiento en que se encuentran las reinas, sin poder realizar vuelos y defecando dentro de la caja, aumente la incidencia de diferentes patógenos y parásitos deteriorando su condición sanitaria. En este estudio frecuentemente se observaron ácaros sobre el cuerpo de las reinas. Los abejorros pueden albergar un número importante de ácaros que se transmiten verticalmente a través de la reina (Maggi et al., 2011). Por otro lado, recientemente se ha encontrado en diferentes poblaciones de B. atratus y B. bellicosus de Uruguay una alta prevalencia del microsporidio Nosema ceranae (Natalia Arbulo, datos sin publicar). Este microsporidio se encuentra infectando a las abejas melíferas en todos los continentes (Klee et al., 2007; Fries 2010; Aurori et al., 2011) incluido Uruguay (Invernizzi et al., 2009) y podría estar afectando también a las poblaciones de abejorros.
En este estudio se determinaron dos parámetros relevantes de la biología reproductiva de B. atratus y B. bellicosus, como son el tiempo transcurrido entre el confinamiento de las reinas y el inicio de la oviposición, y entre la oviposición y el nacimiento de la primer obrera, que es importante tener en cuenta en la cría artificial de abejorros. Ambos registros mostraron una alta variabilidad, pese a que las reinas se encontraban en condiciones controladas y uniformes. Es posible que el tiempo transcurrido entre la introducción de las reinas a las cajas de inicio y la construcción del nido no sea representativo del que se da naturalmente como consecuencia de las condiciones completamente distintas en las que se encuentran las reinas. Además, no se conocía el tiempo transcurrido desde que la reina culminó su hibernación hasta que fue capturada, ni si había iniciado la oviposición. Ambos factores seguramente afecten el inicio de la puesta de huevos en las reinas confinadas. Sin embargo, el tiempo entre la oviposición y el nacimiento de la primera obrera podría ser similar al encontrado en la naturaleza. La duración de este ciclo de desarrollo varía dependiendo de la especie, de la temperatura y de la cantidad y calidad del alimento (Michener, 1974; Goulson, 2003; Heinrich, 2004). En este estudio se determinó que, bajo las condiciones de cautiverio utilizadas, la duración promedio del ciclo de cría de B. atratus es de 36,8 días y la de B. bellicosus es de 30 días. No se cuenta con datos de la duración del ciclo en condiciones naturales para ninguna de estas especies. Por otro lado, en condiciones de cautiverio similares a las de este estudio, en Colombia la duración del ciclo de cría de B. atratus varía entre 24 días (Cruz et al., 2008) y 33 días (Torres y Gómez, 2009). La menor duración del ciclo de cría obtenida en estos trabajos podría deberse a que las poblaciones de B. atratus en Colombia tienen un ciclo más corto por estar adaptadas a un clima tropical. Otro factor que puede influir en esas diferencias, es la calidad del alimento que se le proporcionó a las larvas. Aunque en todos los casos fue una pasta de polen corbicular de abejas melíferas, este puede ser de orígenes botánicos muy diferentes y por tanto su calidad puede variar considerablemente (Roulston y Cane, 2000). Este es un aspecto esencial a tener en cuenta en futuras experiencias de cría ya que la calidad del alimento no sólo puede afectar la duración del ciclo, sino también el tamaño y el número de las obreras producidas y por ende, el desarrollo de la colonia.
El tiempo transcurrido entre el encierro de la reina en la caja de inicio y el nacimiento de la primera obrera, es de aproximadamente 50 días para ambas especies. Esta información es relevante para planificar la cría artificial de abejorros con vistas a obtener colonias en periodos definidos, por ejemplo para polinizar cultivos específicos. En futuros estudios se deben determinar las curvas de crecimiento poblacional para conocer el tiempo completo que insume obtener una colonia en condiciones adecuadas para ser trasladada al campo. De todos modos, teniendo en cuenta que las reinas empiezan a salir de la hibernación a comienzos de primavera, con los tiempos de cría mencionados anteriormente no parece posible obtener colonias pobladas (por ejemplo con 50 obreras) antes de 90 días de la captura de las reinas. Esta dificultad se puede superar si la cría se inicia a partir de reinas fecundadas e hibernadas en el laboratorio durante el otoño. Esta técnica es usada ampliamente en la cría de abejorros para fines comerciales o de investigación ya que permite contar con colonias a lo largo del año (Velthuis y van Doorn, 2006; Evans et al., 2007; Yoon et al., 2010a, 2010b) pero es necesario adaptarla para la cría de B. atratus y B. Bellicosus.
En las experiencias de cría realizadas, las colonias que contaban con más de 10 obreras se trasladaron al campo y no recibieron más alimento de forma controlada. En estas condiciones, se observó que el crecimiento poblacional se detenía y las colonias no conseguían sobrevivir demasiado tiempo. Es necesario realizar nuevos estudios para mejorar el éxito del traslado de las colonias del laboratorio al campo. En este sentido, es posible que el problema se deba únicamente al pequeño tamaño de las colonias al momento de sacarlas del laboratorio.
En suma, este estudio muestra que es factible la cría artificial de las dos especies de abejorros nativos del Uruguay, B. atratus y B. bellicosus, generando la posibilidad de manejar las colonias para polinizar eficientemente diferentes cultivos.
Agradecimientos
A la Sección Etología de Facultad de Ciencias por brindar el espacio para realizar las experiencias de cría; a la Cátedra de Entomología de Facultad de Agronomía y a la familia Sánchez-Santos por permitir mantener los nidos en sus predios una vez que se trasladaron al campo; al Laboratorio de Entomología del INIA La Platina de Chile por el asesoramiento y a CSIC por la financiación de las pasantías de Sheena Salvarrey y Natalia Arbulo en dicho laboratorio.
Bibliografía
Abrahamovich AH, Díaz NB, Morrone JJ. 2004. Distributional patterns of the neotropical and andean species of the genus Bombus (Hymenoptera: Apidae). Acta Zoológica Mexicana, 20: 99 -117.
Abrahamovich AH, Díaz NB. 2002. Bumble bees of the Neotropical region (Hymenoptera: Apidae). Biota Colombiana, 3: 199 - 214.
Aldana J, Cure JR, Almanza MT, Vecil D, Rodríguez D. 2007. Efecto de Bombus atratus (Hymenoptera: Apidae) sobre la productividad de tomate (Lycopersicon esculentum Mill.) bajo invernadero en la Sabana de Bogotá, Colombia. Agronomía Colombiana, 25: 62 -72.
Amin MR, Kwan YJ. 2011a. Photoperiod and relationship with body mass and size in bumblebee, Bombus terrestris L. (Hymenoptera: Apidae) workers. Bangladesh Journal of Scientific and Industrial Research, 46: 447-450.
Amin MR, Kwan YJ. 2011b. Time and age specific mating success of bumblebee (Bombus terrestris l.) reared at different photoperiodic regimes. Bangladesh Journal of Agricultural Research, 36: 13 -20.
Arbulo N, Santos E, Salvarrey S, Invernizzi C. 2011. Effect of proboscis length on resource utilization in two Uruguayan bumblebees: Bombus atratus Franklin and Bombus bellicosus Smith (Hymenoptera, Apidae). Neotropical Entomology, 40: 72 -77.
Aurori CM, Dezmirean DS, Marghitas LA, Moritz RFA. 2011. Nosema apis and N. ceranae in Western honeybee (Apis mellifera) – geographical distribution and current methods of diagnosis. Bulletin UASVM Animal Science and Biotechnologies, 68: 63-70.
Beekman M, van Stratum P, Veerman A. 1999. Selection for non-diapause in the bumblebee Bombus terrestris, with notes on the effect of inbreeding. Entomologia Experimentalis et Applicata, 93: 69 -75.
Beekman M, van Stratum P, Lingeman R. 1998. Diapause survival and postdiapause performance in bumblebee queens (Bombus terrestris). Entomologia Experimentalis et Applicata, 89: 207-214.
Cruz B, Cure JR, Almanza MT. 2008. Implementación de mejoras para la cría en cautiverio de colonias del abejorro nativo Bombus pauloensis (= B. atratus) (Hymenoptera: Apoidea). Revista Facultad de Ciencias - Universidad Militar Nueva Granada, 4: 70-83.
Dafni A, Kevan P, Gross CL, Goka K. 2010. Bombus terrestris, pollinator, invasive and pest:An assessment of problems associated with its widespread introductions for commercial purposes. Applied Entomology and Zoology, 45: 101-113.
de Ruijte A. 1997. Commercial bumblebee rearing and its implications. Acta Horticulturae, 437: 261-269.
Duchateau MJ. 2006. Aspectos biológicos del comportamiento de los abejorros. En: Segundas Jornadas de Polinización en Plantas Hortícolas. Almería : CIFA, IFAPA, Agrobio. pp. 220-227.
Duchateau MJ. 1985. Analysis of some methods for rearing bumblebees’ colonies. Apidologie, 16: 225-227.
Estay P. 2007. Bombus en Chile: especies, biología y manejo. Santiago de Chile : Instituto Nacional de Investigaciones Agropecuarias, Ministerio de Agricultura. 82p. (Libros INIA ; 22).
Evans E, Burns I, Spivak M. 2007. Befriending bumble bees : A practical guide raising local bumblebees. Minnesota : University of Minnesota Extension. 65p.
Free JB. 1993. Insect pollination of crops. 2a ed. Londres : Academic Press. 684p.
Fries I. 2010. Nosema ceranae in European honey bees (Apis mellifera). Journal of Invertebrate Pathology, 103: 73-79.
Frison TH. 1927. Experiments in rearing colonies of bumblebees (Bremidae) in artificial nests. Biological Bulletin, 52: 51-67.
Garófalo C. 1979. Observacoes preliminaries sobre a fundacao solitaria de colonias de Bombus (Fervido Bombus) atratus Franklin (Hymenoptera, Apidae). Boletim de Zoología, Universidade Sâo Paulo. 4: 53-64.
Goulson D. 2010. Impacts of non-native bumblebees in Western Europe and North America. Applied Entomology and Zoology, 45: 7-12.
Goulson D. 2003. Bumblebees: their behaviour and ecology. Oxford : Oxford University Press. 236p.
Gretenkord C, Drescher W. 1997. Successful colony foundation and developement of experimentally hibernated Bombus terrestris queens depending on defferent starting methods. Acta Horticulturae, 437: 271-276.
Griffin RP, Macfarlane RP, van den Ende HJ. 1991. Rearing and domestication of long tongued bumblebees in New Zeland. Acta Horticulturae, 288: 149-153.
Heinrich B. 2004. Bumblebee economics. Cambridge : Harvard University Press. 251p.
Ings TC, Ward NL, Chittka L. 2006. Can commercially imported bumblebees out-compete their native conspecific? Journal of Applied Ecology, 43: 940-948.
Inoue MN, Yokoyama J, Washitani I. 2008. Displacement of Japanese native bumblebees by the recently introduced Bombus terrestris (L.) (Hymenoptera: Apidae). Journal of Insect Conservation, 12: 135-146.
Invernizzi C, Abud C, Tomasco I, Harriet J, Mendoza Y, Ramallo G, Campá J, Katz E, Gardiol G, Mendoza Y. 2009. Presence of Nosema ceranae in honeybees (Apis mellifera) in Uruguay. Journal of Invertebrate Pathology, 101: 150-153.
Jie W, Wenjun P, Jiandong A, Zhanbao G, Yueming T, Jilian L. 2005. Techniques for year-round rearing of Bombus terrestris L. (Hymenoptera, Apoidea) in China. Journal of Apicultural Science, 49: 65-69.
Klee J, Besana AM, Genersch E, Gisder S, Nanetti A, Tam DQ, Chinh TX, Puerta F, Ruz JM, Kryger P, Message D, Hatjina F, Korpela S, Fries I, Paxton RJ. 2007. Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera. Journal of Invertebrate Pathology, 96: 1-10.
Kwon Y J, Than KK, Suh SJ. 2006. New method to stimulate the onset of Bombus terrestris (Hymenoptera: Apidae) rearing: using worker helpers in the presence of frozen pupae. Entomological Research, 36: 202-207.
Kwon YJ, Saeed S, Duchateau MJ. 2003. Stimulation of colony initiation and colony development in Bombus terrestris by adding a male pupa: the influence of age and orientation. Apidologie, 34: 429 -437.
Maggi M, Lucía M, Abrahamovich AH. 2011. Study of the acarofauna of native bumblebee species (Bombus) from Argentina. Apidologie, 42: 280 -292
Matheson A. 1996. Bumble Bees for pleasure and profit. Cardiff : International Bee Research Association. 47p.
Michener CD. 1974. The social behavior of bees : A comparative study. Cambridge : Harvard University Press. 404p.
O´Toole C. 2003. Bumblebees. Gardens need bees; bees need homes. Rothley : Osmia Publications.
Plath OE. 1923. Breeding experiments with confined Bremus (Bombus) queens. Biological Bulletin, 45: 325-341.
Ptacek V. 1991. Trials to rear bumble bees. Acta Horticulturae, 288: 144-148.
Ptacek V, Drobna J. 2006. Cría y uso de los abejorros para la polinización de los recursos genéticos de legumbres forrajeras. En: Segundas Jornadas de Polinización en Plantas Hortícolas. Almería : CIFA, IFAPA, Agrobio. pp. 124-138.
Röseler PF. 1985. A technique for year-round rearing of Bombus terrestris (Apidae, Bombini) colonies in captivity. Apidologie, 16: 165 -170.
Roulston T, Cane JH. 2000. Pollen nutritional content and digestibility for animals. En: Dafni A, Hesse M, Paccini E. [Eds.]. Pollen and pollination. Viena : Springler. pp. 187-209.
Schmid-Hempel P. 2001. On the evolutionary ecology of host-parasite interactions: addressing the question with regard to bumblebees and their parasites. Naturwissenschaften, 88: 147-158.
Sladen FWL. 1912. The humble-bee. Its life-history and how to domesticate it. MacMillan and Co., London. 283p.
Torres E, Gomez J. 2009. Evaluación de diferentes tipos de dieta para la iniciación de colonias de Bombus atratus (Hymenoptera: Apidae) en cautiverio. Trabajo de grado. Universidad Militar Nueva Granada, Colombia.
van den Eijnde J, de Ruijter A, van der Steen J. 1991. Method for rearing Bombus terrestris continuously and the production of bumblebee colonies for pollination purposes. Acta Horticulturae, 288: 154-158.
van Doorn A. 2006. Factores que influyen en el funcionamiento de las colonias de abejorros en invernadero. En: Segundas Jornadas de Polinización en Plantas Hortícolas. Almería : CIFA, IFAPA, Agrobio. pp. 158-171.
Varela G, Rebuffo M. 1999. Utilización de abejorros (Bombus sp.) para aumentar la producción de semilla de trébol rojo (Trifolium pratense) en túneles de aislación. Montevideo : PROVA, INIA. 41p.
Velthuis HHW. 2002. The historical background of the domestication of the bumble-bee, Bombus terrestris, and its intrduction to agriculture. En: Kevan P, Imperatriz Fonseca VL. [Eds.]. Pollinating bees – The conservation link between agriculture and nature. Brasilia : Ministry of Environment. pp. 177-184.
Velthuis HHW, van Doorn. A. 2006. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination. Apidologie, 37: 421-451.
Williams PH, Cameron SA, Hines HM, Cederberg B, Rasmont P. 2008. A simplified subgeneric classification of the bumblebees (genus Bombus). Apidologie, 39: 46-74.
Yoon HJ, Lee KY, Lee SB, Park IG. 2010a. Wake-up treatments for improving oviposition and colony development of the bumblebees Bombus ignitus and B. terrestris. International Journal of Industrial Entomology, 20: 19 -24.
Yoon HJ, Lee KY, Hwang JS, Park I.G. 2010b. Chilling temperature and humidity to break diapause of the bumblebee queen Bombus terrestris. International Journal of Industrial.