Services on Demand
Journal
Article
Related links
Share
Agrociencia (Uruguay)
Print version ISSN 1510-0839On-line version ISSN 2301-1548
Agrociencia Uruguay vol.17 no.1 Montevideo June 2013
Nota Técnica
Análisis multiresiduo de 41 pesticidas en miel por LC-MS/MS: evaluación de dos métodos de clean-up
Niell Silvina1, Cesio Verónica2, Hepperle Julia3, Roux Daniela3, Kirsch Larissa3, Kolberg Diana3, Anastassiades Michelangelo3, Heinzen Horacio2
1Polo Agroalimentario y Agroindustrial, Departamento de Química del Litoral, Centro Universitario Paysandú, Universidad de la República. Paysandú, Uruguay.
2Cátedra de Farmacognosia y Productos Naturales, Departamento de Química Orgánica, Facultad de Química, Universidad de la República, General Flores 2124, 11800, Montevideo, Uruguay.
3CVUA Stuttgart, European Union Reference Laboratory-Single Residue Methods, Fellbach, Alemania. Correo electrónico: heinzen@fq.edu.uy
Recibido: 23/3/12 Aceptado: 9/5/13
Resumen
El monitoreo de residuos de pesticidas en miel es importante debido al riesgo potencial que estos representan para la salud y porque ambientalmente permite obtener información de los pesticidas que han sido usados en los cultivos alrededor de la colmena. Para que los resultados tengan relevancia real es importante elegir cuidadosamente cuáles pesticidas monitorear. La selección de los 41 pesticidas evaluados se realizó en base a la probabilidad de ser encontrados en miel y productos de la colmena, determinada mediante la frecuencia de aparición de muestras positivas en la bibliografía y en la base de datos pesticides-online. Se consideraron además datos recientes de la importación de pesticidas en Uruguay. Se presenta una simple variación del método QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) para la determinación de residuos de pesticidas en miel. Se evaluaron dos métodos de clean-up: freeze-out (extracto a -20 °C durante 15 h) y d-SPE (Extracción en Fase Sólida dispersiva) utilizando como sorbente PSA (Primary and Secondary Amine). Los pesticidas fueron determinados por LC-MS/MS (QTrap) en modo positivo y negativo. Las recuperaciones estuvieron entre 81-111% para el clean-up dispersivo con excepción de cinco pesticidas ácidos que si se recuperaron al realizar freeze-out (recuperaciones entre 80-114% con excepción de tres pesticidas). Los porcentajes de DER (Desviación Estándar Relativos) fueron menores a 16% en un mismo día y menores a 20% entre distintos días para la mayoría de los pesticidas. Todos los pesticidas presentaron buenas linealidades con R2>0,99 en el rango 0,01-0,4 mg/L. La mayoría de los pesticidas presentan límites de cuantificación de 0,01mg/kg que es el menor límite máximo de residuos establecido por la Unión Europea para miel. Este método se ajusta al doble objetivo de evaluar la calidad de las mieles uruguayas, cumpliendo con conceptos de seguridad alimentaria, facilitar el comercio internacional así como encaminar los intentos de utilizar la colmena como bioindicador de calidad ambiental de una región.
Palabras clave: ANÁLISIS MULTIRESIDUO, PESTICIDAS, MIEL, LC-MS/MS
Summary
Multiresidue Analysis of 41 Pesticides in Honey by LC-MS/MS: Evaluation of Two Clean-up Methods
Monitoring of pesticide residues in honey is important due to the risk they pose to human health, but also from an environmental point of view, because they provide relevant data on the pesticides that have been used in the hive surroundings. Which pesticides are monitored is crucial for the real significance of the results obtained. The selection of the 41 pesticides employed in this study was based on their relevance for bee products as reflected by the frequency of residue findings in the literature and the pesticides-online database. Recent data concerning the import of pesticides in Uruguay were also considered. A simple variation of the QuEChERS method (Quick, Easy, Cheap, Effective, Rugged and Safe) for the pesticide multiresidue analysis of honey is presented. Two clean-up methods were evaluated: freeze-out (extract placed at -20 °C for 15 h) and d-SPE (dispersive Solid Phase Extraction) using PSA (Primary and Secondary Amine) as sorbent. Pesticides were determined by LC-MS/MS (QTrap) in positive and negative mode. Recoveries were between 81-111 % for the dispersive clean-up except for five acidic pesticides which were recovered by freezing-out (recoveries between 80-114% except for three pesticides). RSD percentages (Relative Standard Deviation) were less than 16% in one day and less than 20% between different days for most of the studied pesticides. All pesticides showed good linearity, with R2> 0.99 in the range 0.01-0.4 mg/L. Most of the studied pesticides have a limit of quantification of 0.01 mg/kg which is the lowest maximum residue limit set by the European Union for honey. This method serves the double purpose of evaluating the quality of Uruguayan honeys, in terms of food safety with commerce exchange parameters, as well as an input provider for the use of the hive as a bioindicator of environmental quality of a region.
Key words: MULTIRESIDUE ANALYSIS, PESTICIDES, HONEY, LC-MS/MS
Introducción
Del monitoreo de residuos de pesticidas en miel es posible colectar datos relevantes con relación al riesgo potencial que representan para la salud de los consumidores, pero además se obtiene información de los pesticidas que han sido usados en los cultivos alrededor de las colmenas de donde esta proviene (Porrini et al., 2002, 2003; Rissato et al., 2007; Balayiannis y Balayiannis, 2008). Recientemente se han realizado distintos monitoreos y estudios en Europa y Estados Unidos encontrándose residuos de pesticidas en productos de la colmena (Porrini et al., 2003; Fell y Cobb, 2009; Johnson et al., 2010; Mullin et al., 2010), lo que ha motivado el establecimiento de medidas rígidas de control para-arancelario que regula la entrada de productos apícolas en esos mercados. La determinación de residuos de pesticidas en miel se realiza empleando métodos multiresiduo, donde un número elevado de pesticidas es monitoreado en una sola determinación analítica. El problema que se presenta muchas veces en un método multiresiduo es cuáles pesticidas pueden o no ser analizados para que los resultados tengan relevancia real. Esta selección define el alcance del método y su aplicabilidad y generalmente se hace en base a la disponibilidad instrumental para realizar estas determinaciones. Existen distintos métodos analíticos para el análisis de residuos en miel donde se utiliza, para la determinación instrumental de los pesticidas, tanto cromatografía líquida como gaseosa acoplada a detectores clásicos como arreglo de diodos, detector fotométrico de llama, de nitrógeno y fósforo, así como detectores de última generación como masas en tándem (Fernandez et al., 2002a, 2002b; Herrera et al., 2005; Pirard et al., 2007; Rissato et al., 2007; Bargañska y Namieœnik, 2010; Bonzini et al., 2011; Tomasini et al., 2011; Wiest et al., 2011). Las ventajas de los detectores de masa en tándem comparados con los detectores clásicos son su exactitud en la determinación del compuesto, y su capacidad para detectar concentraciones de pesticidas mucho más bajas (Fernandez et al., 2002a; Wiest et al., 2011).
Se presenta un método para la determinación de los residuos de pesticidas en miel que se evaluaron como más relevantes por ser los empleados en Uruguay, que cumple con el triple propósito de asegurar la salud de los consumidores, de controlar la calidad de la miel para exportación y de realizar las determinaciones para encaminar los intentos de utilizar la colmena y sus productos como bioindicadores de calidad ambiental de una región.
Materiales y métodos
Reactivos y estándares
Se utilizó acetonitrilo (MeCN) y metanol de calidad HPLC de Merck (Darmstadt, Germany). El agua fue desionizada en el laboratorio con un purificador de agua Millipore (Billerica, MA, USA) Direct-Q 3. Se utilizó formiato de amonio de Sigma-Aldrich Buchs, sulfato de magnesio anhidro ppa de Sigma-Aldrich (St. Louis, MO, USA) y ácido fórmico pa (98–100%) de Merck. El sorbente amina primaria y secundaria (Bondesil-PSA, 40 mm) utilizada es de Varian (Palo Alto, CA, USA). Los estándares analíticos de pureza ≥95% son de Dr. Ehrenstorfer (Augsburg, Germany), Riedel-de Haen (Seelze, Germany) y LGC Promochem (Wesel, Germany). Las soluciones stock de estándares de 1 mg/mL se prepararon en acetonitrilo, considerando la pureza del estándar, pesando cada estándar analítico individualmente en matraces aforados disolviendo y llevando a volumen.
Las soluciones mezcla de estándares de trabajo se prepararon mezclando y diluyendo exacta y apropiadamente múltiples soluciones stock con acetonitrilo. Todas las soluciones se conservaron en la oscuridad por debajo de 4 °C. La solución stock del estándar interno (EI) Clorpirifos deuterado se preparó de la misma forma que las soluciones stock de pesticidas. La solución de trabajo del EI se preparó a una concentración de 10 mg/L en acetonitrilo y se agregó a las muestras al inicio de la preparación de muestras. Una dilución apropiada de esta solución a 1 mg/L en acetonitrilo se utilizó para la preparación de los estándares de calibración.
Instrumentos
Se trabajó con pipetas automáticas adecuadas para volúmenes de 10-100 μL, 200-1000 μL y 1-10 mL de Eppendorf (Hamburg, Germany), balanzas analíticas con capacidad de medir hasta 0,1 mg o hasta 0,01 g de Mettler-Toledo (Greifensee, Switzerland), dispensador automático OPUS model (20 o 50 mL) de Hirschmann Laborgeräte (Eberstadt, Germany), tubos de centrífuga de 50 mL PP descartables con tapa rosca, 114×28 mm, de Sarstedt (Nümbrecht, Germany) y de 10 mL PP descartables con tapa rosca, 17×84 mm, de Simport (Beloeil, QC, Canada), dispensador de solvente de 10 mL para acetonitrilo de Eppendorf, centrífuga capaz de alcanzar al menos 3000 × g, Rotana 460 model de Hettich (Tuttlingen, Germany), viales de autosampler de 1,5 mL y viales con tapa rosca de 20-mL de Ziemer GmbH (Mannheim, Germany), potes de plástico (apilables) para almacenar las sales de partición ya pesadas y mezcladas utilizados de Juro-Labs (Henfenfeld, Germany). Un divisor de muestras Repro highprecision de Bürkle (Bad Bellingen, Germany) se empleó para repartir los sólidos necesarios para la d-SPE. LC-MS/MS se realizó con un equipo de Waters (Milford, USA) Acquity UPLC system acoplado a un API 4000 Qtrap MS/MS de Applied Biosystems (Foster City, CA, USA). La separación se realizó en una columna Phenomenex (Torrance, CA, USA) Aqua 150 mm×2 mm, 3 mm particle size, C18.
Análisis por LC–MS/MS: se empleó un gradiente con una fase móvil compuesta por A: formiato de amonio 5 mM en agua; B: formiato de amonio 5 mM en metanol. Se utilizó un flujo de 100 μL/min comenzando con 100% A al momento de la inyección y se cambia gradualmente a 30% A (70% B) durante 3 min, luego se cambia a 15% A (85% B) durante 3 min a 300 μL/min, siguiendo a 10% A (90% B) durante 3 min. Esta composición de eluente se mantuvo durante 3 min y luego se cambió en 0,5 min a las condiciones iniciales (100% componente A) hasta completar 22 min post inyección. El volumen de inyección fue 5 μL. La detección en MS/MS se realizó en modo monitoreo de reacción múltiple (MRM) usando una interfase de ionización por electrospray (ESI) en modo de ionización positiva y negativa. El voltaje de ionización fue 4500 V, el gas de nebulización fue aire a 70 psi, y el curtain gas fue nitrógeno a 30 psi. La evaporación por solvente en la fuente fue asistida por un gas para secado (aire calentado a 425 °C/ 50 psi). Se realizaron numerosos experimentos utilizando soluciones de analitos por separado para determinar los modos de ionización y transiciones MRM óptimas, energías de colisión y potenciales de declustering para cada compuesto individualmente. Para esto se utilizó una bomba de jeringa a flujo constante para la inyección directa al equipo de MS/MS de la solución de estándar. Los parámetros del MS/MS utilizados en este estudio están listados en el Cuadro 1.
Preparación de muestras
Se probó la metodología de análisis multiresiduo denominada QuEChERS (Anastassiades et al., 2007) y se compararon dos opciones (a y b) de purificación del extracto:
Extracción
En un tubo de centrífuga se pesa 5,00 ± 0,01 g miel, se agrega 10 mL H2O, 10 mL MeCN y 100 µL de Clorpirifos deuterado 10 mg/L (estándar interno) y se agita manualmente durante 1minuto. Agregar la mezcla de sales previamente preparada: 4 g MgSO4 anhidro, 1 g NaCl, 1 g Na3citrato.2H2O, 0,5 g Na2Hcitrato.1,5H2O, agitar manualmente durante 1 minuto, centrifugar durante 5 min a 3000 x g, tomar 6 mL sobrenadante.
Purificación
Opción a:
Freeze-out: Colocar el extracto en freezer a -20 °C durante 15 h. Filtrar inmediatamente al sacar del freezer por embudo con algodón. Tomar alícuota para inyectar en LC-MS/MS.
Opción b:
Extracción en fase sólida dispersiva (d-SPE): colocar el extracto en un tubo de 10 mL conteniendo PSA (25 mg/mL) y MgSO4 (150 mg/mL), agitar 30 segundos en vortex, centrifugar durante 5 min a 3000 x g, tomar sobrenadante y colocar en vial de 20 mL, agregar Ácido Fórmico 5% en MeCN (10 µL/mL), homogeneizar. Tomar alícuota para inyectar en LC-MS/MS.
Resultados y discusión
Para el presente estudio, la selección de los 41 pesticidas evaluados se realizó en base a la probabilidad de ser encontrados en miel y productos de la colmena, determinada mediante la frecuencia de aparición de muestras positivas en la bibliografía y en la base de datos pesticides-online (CVUA Stuttgart, 2007). Se consideraron además datos recientes de la importación de pesticidas en Uruguay (DGSA, 2010).
El método desarrollado es una simple variación del método QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) (Anastassiades et al., 2007) para la determinación de residuos de pesticidas en miel. Se evaluaron dos métodos de clean-up: freeze-out (extracto a -20 °C durante 15 h) y d-SPE (Extracción en Fase Sólida dispersiva) utilizando como sorbente PSA (Primary and Secondary Amine). Los pesticidas fueron determinados por LC-MS/MS cromatografía líquida acoplada a masas en tándem (QTrap) en modo positivo y negativo.
La comparación entre las dos opciones de purificación se realizó evaluando cuál de los dos procedimientos permite alcanzar un valor más cercano al valor teórico que se debería obtener cuando se adiciona una cantidad preestablecida del pesticida a monitorear a la muestra blanco (previamente analizada para verificar que no contenga los pesticidas a estudiar). Este valor llamado recuperación es uno de los parámetros establecidos por las guías europeas para la validación de una metodología para análisis de residuos de pesticidas en alimentos de la Dirección General de Sanidad y de los Consumidores (DG-SANCO) (Pihlström, 2011). El parámetro «recuperación» se obtiene calculando el porcentaje para cada pesticida que es posible determinar efectivamente luego de haber realizado todos los pasos del método analítico en una muestra blanco a la que se le adicionó previamente una cantidad exactamente conocida de pesticida. Estos resultados se resumen en la Figura 1. Se tomó para la evaluación y comparación el criterio establecido en la DG-SANCO que define como aceptables las recuperaciones que se encuentran entre 70 y 120%. Las recuperaciones para el clean-up dispersivo fueron aceptables para un método multiresiduo (81-111%) con excepción de los cinco pesticidas ácidos de los cuales Haloxifop e Imazapir fueron analizados con ionización positiva y Dicamba, Picloram e Imazetapir con ionización negativa (Figura 2).
Para el clean-up con freeze-out las recuperaciones también fueron aceptables: estuvieron entre 80-114% con excepción de Tiametoxam, Metsulfuron-metil y Ometoato.
Ambos métodos de clean-up dieron resultados igualmente buenos para 36 pesticidas con recuperaciones aceptables de acuerdo a la reglamentación citada anteriormente.
Se observaron diferencias entre ambos clean-up para los pesticidas ácidos marcados en la Figura 2. Estos quedan retenidos al realizar el clean-up con PSA, pero sí se obtienen buenas recuperaciones con el freeze-out.
En el caso de encontrarse un residuo de estos pesticidas ácidos en una muestra real se debe realizar freeze-out como purificación del extracto en la repetición del análisis con fines confirmatorios y cuantitativos y con PSA para el caso de Tiametoxam, Metsulfuron-metil y Ometoato.
Estos métodos han sido desarrollados en un equipo LC MS/MS (Qtrap) similar al disponible en el Polo Agroalimentario y Agroindustrial de Paysandú de la Universidad de la República donde ya han sido reevaluados y validados los métodos. De ahí su importancia, ya que se ajustan al triple objetivo de evaluar la calidad de las mieles uruguayas, cumpliendo con conceptos de seguridad alimentaria, de facilitar de comercio internacional, y de comenzar los estudios para utilizar la colmena y sus productos como bioindicadores de la calidad ambiental de agroecositemas uruguayos.
Validación del método
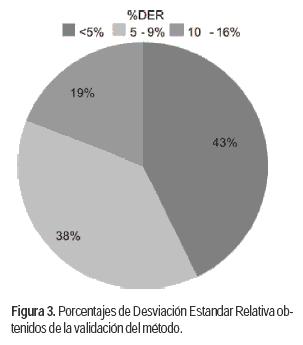
Para realizar la validación del método se estudiaron los niveles 0,01 mg/kg y 0,05 mg/kg que son los niveles que la Unión Europea establece como límites máximos de residuos tolerables en miel. La exactitud del método fue estudiada mediante los porcentajes de recuperación de cinco réplicas, obtenidas como se detalló anteriormente. La precisión fue estudiada mediante el porcentaje de Desviación Estándar Relativa (%DER) de las mismas cinco réplicas (Figura 3). Estas se encontraron por debajo de 16%, lo cual es aceptable según la guía SANCO que establece un 20% como máximo permitido, con excepción de Imazapir que presentó un 26% DER. La reproducibilidad intermedia o también llamada precisión entre-días, evaluada mediante el %DER de estudios realizados distintos días, también fue aceptable (<20%) con excepción de Imazapir.
Se obtuvieron límites de cuantificación o límites de reporte, como se denominan en la guía SANCO de 0,01 mg/kg, para la mayoría de los pesticidas en estudio, con excepción de Boscalid (0,05 mg/kg), Metsulfuron metil, Imazapir y Amitraz (0,2 mg/kg).
Se realizaron curvas de calibración en solvente y en matriz, que consiste en adicionar los pesticidas en cantidades conocidas a un extracto de miel blanco. Todos los pesticidas estudiados presentan buena linealidad, R2>0,99 en el rango 0,01 a 0,4 mg/L. Se calculó además el efecto matriz como el porcentaje de la diferencia entre las pendientes de las curvas de calibración en matriz y en solvente respecto a la pendiente de la curva de calibración en solvente, (pendiente curva calibración en matriz-pendiente curva calibración en solvente)/pendiente curva calibración en solvente*100. Los pesticidas estudiados presentaron un efecto matriz moderado (<11%) excepto Amitraz (-48%), Clorpirifos (17%) e Imazapir (43%) por lo que se utilizaron las curvas de calibración preparadas en matriz para la cuantificación de todos los experimentos. Este parámetro es importante porque se debe al aumento o supresión de la señal del analito que pueda ocasionar la matriz y su subestimación al emplear curvas de calibración en solvente lleva a errores en la cuantificación.
Agradecimientos
El presente trabajo se realizó durante una pasantía co-financiada por el Programa de Desarrollo de las Ciencias Básicas (PEDECIBA) Química y Comisión Sectorial de Investigación Científica (CSIC) de la Universidad de la República, Uruguay.
Bibliografía
Anastassiades M, Tasdelen B, Scherbaum E, Stajnbaher D. 2007. Recent developments in QuEChERS methodology for pesticide multiresidue analysis. En: Ohkawa H, Miyagawa H, Lee PW. [Eds.]. Pesticide chemistry: Crop protection, public health, environmental safety. Weinheim : Wiley-VCH. pp. 439 - 458.
Balayiannis G, Balayiannis P. 2008. Bee honey as an environmental bioindicator of pesticides’ occurrence in six agricultural areas of Greece. Archives of Environmental Contamination and Toxicology, 55: 462 - 470.
Bargañska ¯, Namieœnik J. 2010. Pesticide analysis of bee and bee product samples. Critical Reviews in Analytical Chemistry, 40: 159 - 171.
Bonzini S, Tremolada P, Bernardinelli I, Colombo M, Vighi M. 2011. Predicting pesticide fate in the hive (part 1) : experimentally determined ô-fluvalinate residues in bees, honey and wax. Apidologie, 42: 378 - 390.
CVUA Stuttgart. 2007. Pesticides Online website [En línea]. Consultado 13 mayo 2013. Disponible en: http://www.pesticides-online.com.
DGSA. 2010. Prod. Fitosanitarios : Importaciones del año 2010 según toxicidad [En línea]. Consultado 13 mayo 2013. Disponible en: http://www.mgap.gub.uy/DGSSAA/DivAnalisisDiagnostico/documentosDAYD/estadisticas/Importacion%20categoria%20toxicologica2010.pdf.
Fell R, Cobb J. 2009. Miticide residues in Virginia honeys. Bulletin of Environmental Contamination and Toxicology, 83: 822 - 827.
Fernandez M, Picó Y, Manes J. 2002a. Rapid screening of organophosphorus pesticides in honey and bees by liquid chromatography-mass spectrometry. Chromatographia, 56: 577 - 583.
Fernández M, Picó Y, Mañes J. 2002b. Analytical methods for pesticide residue determination in bee products. Journal of Food Protection, 65: 1502 - 1511.
Herrera A, Pérez-Arquillué C, Conchello P, Bayarri S, Lázaro R, Yagüe C, Ariño A. 2005. Determination of pesticides and PCBs in honey by solid-phase extraction cleanup followed by gas chromatography with electron-capture and nitrogen–phosphorus detection. Analytical and Bioanalytical Chemistry, 381: 695 - 701.
Johnson R, Ellis M, Mullin C, Frazier M. 2010. Pesticides and honey bee toxicity — USA. Apidologie, 41: 312 - 331.
Mullin CA, Frazier M, Frazier JL, Ashcraft S, Simonds R, vanEngelsdorp D, Pettis JS. 2010. High levels of miticides and agrochemicals in North American apiaries : implications for honey bee health. PLoS ONE, 5: e9754.
Pihlström T. 2011. Method validation and quality control procedures for pesticide residues analysis in food and feed [En línea]. 40p. (Document No. SANCO/12495/2011). Consultado 13 mayo 2013. Disponible en: http://ec.europa.eu/food/plant/protection/resources/qualcontrol_en.pdf.
Pirard C, Widart J, Nguyen BK, Deleuze C, Heudt L, Haubruge E, de Pauw E, Focant JF. 2007. Development and validation of a multi-residue method for pesticide determination in honey using on-column liquid-liquid extraction and liquid chromatography-tandem mass spectrometry. Journal of Chromatography A, 1152: 116 - 123.
Porrini C, Sabatini AG, Girotti S, Ghini S, Medrzycki P, Grillenzoni F, Bortolotti L, Gattavecchia E, Celli G. 2003. Honey bees and bee products as monitors of the environmental contamination. Apiacta, 38: 63 - 70.
Porrini C, Ghini S, Girotti S, Sabatini A, Celli G, Gattavecchia E. 2002. Use of honey bees as bioindicators of environmental pollution in Italy. En: Honey Bees : Estimating the environmental impact of chemicals. London : CRC Press. pp. 186 - 247.
Rissato SR, Galhiane MS, de Almeida MV, Gerenutti M, Apon BM. 2007. Multiresidue determination of pesticides in honey samples by gas chromatography-mass spectrometry and application in environmental contamination. Food Chemistry, 101: 1719 - 1726.
Tomasini D, Sampaio MRF, Cardoso LV, Caldas SS, Primel EG. 2011. Comparison of dispersive liquid-liquid microextraction and the modified QuEChERS method for the determination of fipronil in honey by high performance liquid chromatography with diode-array detection. Analytical Methods, 3: 1893 - 1900.
. Multi-residue analysis of 80 environmental contaminants in honeys, honeybees and pollens by one extraction procedure followed by liquid and gas chromatography coupled with mass spectrometric detection. Journal of Chromatography A, 1218: 5743 - 5756.