Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Agrociencia (Uruguay)
versão impressa ISSN 1510-0839versão On-line ISSN 2301-1548
Agrociencia Uruguay vol.17 no.1 Montevideo jun. 2013
Resistencia a la marchitez bacteriana de la papa en Solanum commersonii Dun.
González Matías1,Galván Guillermo2, Siri María Inés 3 , Borges Alejandra4, Vilaró Francisco5
1Instituto Nacional de Investigación Agropecuaria. Estación Experimental Salto Grande Camino al Terrible, Salto, Uruguay. Correo electrónico: matgon@inia.org.uy
2Departamento de Producción Vegetal, Centro Regional Sur (CRS), Facultad de Agronomía, Universidad de la República.
3Cátedra de Microbiología, Departamento de Biociencias, Facultad de Química, Universidad de la República. Av. General Flores 2124, 11800, Montevideo, Uruguay.
4Unidad Biometría, Estadística y Cómputos, Facultad de Agronomía, Universidad de la República.Garzón 780, 12900, Montevideo, Uruguay.
5Instituto Nacional de Investigación Agropecuaria, Estación Experimental INIA Las Brujas. Ruta 48 km 10, Rincón del Colorado, Canelones, Uruguay.
Recibido: 7/2/12 Aceptado: 20/12/12
Resumen
Los niveles de resistencia a la marchitez bacteriana (MB) de la papa causada por Ralstonia solanacearum (Rs) son limitados. Solanum commersonii (cmm) es una especie silvestre destacada por su resistencia a MB. Los objetivos de este trabajo fueron (i) caracterizar genotipos de cmm para resistencia a Rs (raza 3, biovar 2) utilizando un método de inoculación en suelo, (ii) determinar en qué medida la resistencia de cmm es transmisible por vía sexual en un trasfondo genético susceptible, y (iii) determinar la relación entre un grupo de cepas de Rs raza 3 biovar 2 y genotipos de cmm en la expresión de la resistencia. Se utilizó una metodología de inoculación en suelo bajo condiciones de temperatura y luz controladas. Para genotipos de cmm colectados en distintas regiones de Uruguay, se encontró variabilidad en la resistencia a MB, desde respuesta asintomática en algunos genotipos hasta síntomas en nivel similar al control susceptible. Mediante el cruzamiento de dos genotipos de cmm con respuestas contrastantes a MB se obtuvo una progenie de 121 genotipos. La distribución de los niveles de resistencia en la progenie indicaría un control poligénico, aunque esta conclusión es preliminar, ya que se encontró que uno de los parentales era triploide. Un ensayo factorial utilizando cinco cepas de Rs aisladas en Uruguay y cinco genotipos de cmm, reveló diferencias en la virulencia entre cepas. No se observó interacción entre genotipo y cepa, por lo que en las condiciones de este trabajo la resistencia no fue dependiente del aislamiento del patógeno.
Palabras clave: INOCULACIÓN, MARCHITEZ BACTERIANA, RALSTONIA SOLANACEARUM, SOLANUM COMMERSONII, RESISTENCIA A ENFERMEDADES
Summary
Resistance to Bacterial Wilt in Solanum commersonii Dun.
The levels of resistance to bacterial wilt (BW) of potato caused by Ralstonia solanacearum (Rs) are limited. Solanum commersonii (cmm) is a wild tuber-bearing potato highlighted for its resistance to BW. This research aimed to (i) characterize cmm genotypes for resistance to Rs (race 3, biovar 2) using a soil inoculation method, (ii) determine to what extent resistance in cmm is transmissible through sexual reproduction to a susceptible genetic background, and (iii) determine the relationships between a set of Rs strains (race 3, biovar 2) and cmm genotypes in the expression of resistance. The screening was performed under controlled conditions of temperature and light. Accessions collected from different regions of Uruguay showed diversity for resistance to BW: some genotypes were asymptomatic in the response, while for others the symptoms were similar to the susceptible control. Two cmm genotypes with contrasting responses to BW were crossed, and an offspring of 121 genotypes was obtained. The distribution of BW resistance levels in the progeny suggested a polygenetic control for BW resistance; though this conclusion is preliminary regarding that one of the cmm parents was triploid. A factorial experiment using five R. solanacearum strains isolated in Uruguay and five cmm clones showed differences in the virulence between strains. There was no interaction between plant genotype and bacterial isolate, and therefore, under the conditions of this research, BW resistance in cmm was not dependent on the isolate of the pathogen.
Key words: INOCULATION, BACTERIAL WILT, RALSTONIA SOLANACEARUM, SOLANUM TUBEROSUM, DISEASE RESISTANCE
Introducción
La resistencia genética es un factor clave a la hora de integrar una estrategia de control para la Marchitez Bacteriana de la papa (MB) causada por la bacteria Ralstonia solanacearum (Rs). La generación y utilización de germoplasma de papa con niveles estables de resistencia al marchitamiento, sin embargo, ha sido muy limitada (Priou et al., 2005; Lopes, 2009).
Solanum commersonii Dun. (cmm) (Hawkes, 1994) es una especie diploide destacada por su resistencia a MB (Laferriere et al., 1999; Kim-Lee et al., 2004; Galván et al., 2006; Carputo et al., 2009; Siri et al., 2009). El uso de cmm en el mejoramiento genético de la papa ha sido escaso, entre otros factores, por barreras a la hibridación post-cigóticas con Solanum tuberosum que involucran el balance del endosperma (Johnston et al., 1980). No obstante, se han reportado experiencias exitosas de introgresión utilizando diferentes mecanismos para evadir las barreras de incompatibilidad (Laferriere et al., 1999; Carputo et al., 1997; González et al., 2010) que posibilitan la utilización de cmm en el mejoramiento de papa.
Laferriere et al. (1999) y Carputo et al. (2009) encontraron resistencia en cmm para Rs raza 3 biovar 2 (R3bv2). En cada uno de estos casos se utilizó un genotipo de cmm y una única cepa de Rs. Kim-Lee et al. (2004) evaluaron cuatro genotipos diferentes de la misma accesión de cmm (PI320266) para diferentes cepas de la raza 1 y 3. Por primera vez, concluyeron la variabilidad para la resistencia a Rs dentro de cmm, y la necesidad de contar con germoplasma caracterizado para el mejoramiento genético. Los primeros trabajos comprehensivos de caracterización de germoplasma de cmm por resistencia a la R3bv2 fueron reportados por Galván et al. (2006) y Siri et al. (2009), con un método de inoculación basado en heridas en la parte aérea de la planta que no representa el proceso natural de infección. En efecto, con esa inoculación algunos mecanismos activos de defensa de la planta podrían ser evadidos, dado que la bacteria es un patógeno de suelo que ingresa a la planta por heridas en las raíces. La utilización de un método de inoculación de Rs bajo condiciones controladas representativo del proceso natural de infección en raíces sería de gran utilidad para caracterizar germoplasma de cmm en los programas de pre-mejoramiento por resistencia a MB.
La utilización efectiva de la resistencia a MB se ve limitada por el escaso conocimiento de su base genética. Ese conocimiento sería útil para definir estrategias de cruzamientos eficientes en la incorporación de la resistencia en germoplasma susceptible. Solanum phureja es probablemente la fuente de resistencia más estudiada. Trabajos realizados con poblaciones segregantes inoculadas con una cepa de la raza 1, sugirieron la acción de tres genes dominantes e independientes con un posible efecto de otros genes modificadores (Rowe y Sequeira, 1970). Posteriormente, se encontró resistencia de tipo cepa específica para la raza 1 y para la raza 3 en S. phureja, y pérdida de efectividad de la resistencia asociada a temperaturas altas (French y de Lindo, 1982; Tung et al., 1990a). Estos trabajos señalaron la fuerte variabilidad en el fenotipo resistente como una dificultad en el análisis de los datos, en especial por la temperatura y la luz.
Posteriormente, algunos trabajos incorporaron resistencia aportada por el clon «Cruza 148», de origen mexicano y pedigrí desconocido, y por «AVRDC-1287.19», de origen taiwanés y producto del cruzamiento entre S. chacoense y S. raphanifolium (Schmiediche, 1988). Se determinó resistencia parcial para una cepa de la raza 1, muy estrechamente relacionada a la adaptación ambiental a temperaturas elevadas, lo que determinaría una resistencia de herencia compleja y poligénica (Tung et al., 1990b). En estudios posteriores, los mismos autores detectaron significativa interacción planta-patógeno-ambiente. Los cambios de agresividad de las cepas utilizadas asociados a cambios de temperatura, fueron la principal fuente de inestabilidad en estos experimentos (Tung et al., 1990a).
La R3bv2 de R. solanacearum cuenta con muy poca variabilidad genética (Fegan y Prior, 2005), resultado confirmado por Siri et al. (2011) para cepas de Uruguay. No obstante, las cepas de Uruguay se distinguieron en su virulencia sobre tomate, papa y tres genotipos de cmm (Siri et al., 2011). Determinar diferencias en la virulencia entre cepas, o la expresión de resistencia cepa-específica, orientaría la elección de la cepa adecuada para la evaluación de genotipos de cmm para resistencia a MB. El análisis de la interacción cepa x hospedero, además, generaría indicios sobre la base genética de la resistencia.
Los objetivos de este trabajo fueron (i) caracterizar diferentes genotipos de cmm para resistencia a la R3bv2 del patógeno utilizando un método de inoculación en suelo bajo condiciones ambientales controladas, (ii) determinar en qué medida la resistencia de cmm es transmisible por vía sexual en un trasfondo genético susceptible, y (iii) determinar la relación entre cinco cepas de Rs R3bv2 y cinco genotipos de cmm en la expresión de la resistencia a MB.
Materiales y métodos
Material vegetal
Se realizaron tres ensayos independientes: (i) evaluación de una colección de genotipos de cmm, (ii) evaluación de una progenie F1 de cmm y (iii) evaluación de la interacción entre genotipos de cmm y cepas de Rs.
Para la caracterización de la resistencia a MB, se evaluaron 32 clones provenientes de distintas regiones de Uruguay. Se incluyeron además dos clones de S. phureja (phu) (192 y 195) del proyecto de mejoramiento genético de papa del INIA Uruguay (no evaluados previamente) y el cultivar de S. tuberosum (tbr) ‘Chieftain’ (Estados Unidos) como testigo susceptible. Luego de la primera caracterización de la resistencia, los clones de cmm 05.02.6 y 04.204.3 fueron seleccionados como parentales de la progenie dada la resistencia y susceptibilidad que mostraron respectivamente dentro de un mismo patrón de características morfológicas. Los clones de cmm F97, F102, F118, 05.02.6 y 04.204.3 y el cultivar ‘Chieftain’ fueron seleccionados por sus diferentes niveles de resistencia en la caracterización de la progenie para realizar el ensayo de interacción entre genotipo y cepa. Todo el material para la evaluación se obtuvo del banco de germoplasma activo in vitro del Instituto Nacional de Investigación Agropecuaria (INIA).
Cruzamiento
Los genotipos de cmm 05.02.6 y 04.203.4 seleccionados para realizar el cruzamiento fueron cultivados en invernadero con condiciones de temperatura (25 ºC) y fotoperíodo (14 horas de luz) controladas. El polen del genotipo 04.204.3 utilizado como progenitor masculino fue colectado para polinizar flores emasculadas de las plantas utilizadas como hembra (genotipo 05.02.6). A los 50 días de la polinización se cosecharon las bayas. Las semillas extraídas se trataron mediante inmersión en una solución de 1500 ppm de ácido giberélico durante 24 horas con el fin de levantar la dormición. Luego se sembraron in vitro en medio MS (Murashige y Skoog, 1962) con el fin de introducir y conservar la progenie para evaluaciones y utilización en el mejoramiento. Se obtuvieron 145 individuos de la progenie (nominados con la letra F).
Evaluación de la resistencia al marchitamiento bacteriano
La cepa utilizada en la caracterización de accesiones de cmm fue UY036. Por la disponibilidad en el momento del experimento, la cepa utilizada para la caracterización de la progenie de los genotipos cmm 05.02.6 y 04.203.4 fue UY043. En el experimento de interacción entre genotipos hospederos y cepas se utilizaron las cepas UY031, UY035, UY036, UY041 y UY043. Todas las cepas fueron colectadas en cultivos de papa comerciales infectados en Uruguay y pertenecen a la R3bv2A del patógeno (Filotipo II, Secuevar 1-2) (Siri et al., 2011). Las cepas se conservan a 70 ºC en la Facultad de Química, Universidad de la República.
Se utilizó una metodología de inoculación en suelo que permite diferenciar grados de resistencia a MB en plántulas provenientes de multiplicación in vitro, basada en Montanelli et al. (1995). El inóculo se preparó como una suspensión de bacterias en suero fisiológico (Thurston y Lozano, 1968), a una concentración de 1 x 108 ufc·mL-1. Se partió de colonias incubadas en placas de Petri durante 48 horas a 28 °C en medio de crecimiento Kelman conteniendo clorato de 2,3,5-trifenil tetrazolio (TTC) (Kelman, 1954). La concentración del inóculo se estimó mediante absorbancia de 0,1 en espectrofotómetro (OD 550 nm), y se corroboró mediante la siembra de diluciones a 1 x 105 y 1 x 106 en medio TTC, con las cuales se obtuvieron recuentos de 100 a 300 ufc para la dilución de 1 x 105, y 0 a 100 ufc para la dilución de 1 x 106.
Para las evaluaciones de resistencia se utilizaron plántulas con cinco a ocho hojas expandidas, derivadas de la micropropagación in vitro a los efectos de asegurar la uniformidad y la obtención de réplicas (clones) de cada genotipo. Para ello, esquejes mono-nodales fueron cultivados en medio MS por tres semanas, seguido de dos semanas de aclimatación en invernadero en el recipiente a usarse en la inoculación. El recipiente consistió de celdas de 17 cm3 individuales para cada plántula, con 4 g de sustrato hortícola comercial libre de patógenos. En el ensayo de caracterización de una colección de cmm se utilizaron 12 repeticiones (plántulas) por cada genotipo, mientras que en los otros dos ensayos se utilizaron 26 repeticiones por genotipo, a excepción de algunos individuos de la progenie que presentaron menor tasa de multiplicación in vitro. En todos los experimentos se inocularon plántulas con suero fisiológico sin bacterias como control negativo.
Para la inoculación, se hizo un orificio en el sustrato con una punta plástica de micropipeta con el fin de generar heridas a nivel radicular. El orificio de alrededor de 1 cm de profundidad, se realizó a 0,5 cm de la plántula. Seguidamente, en cada orificio se aplicó 1 ml de la suspensión bacteriana utilizando una pipeta. Después de la inoculación, las plantas se mantuvieron en una cámara con luz artificial (12 horas de luz, 78 ìmol·m-2·s-1) y 28 °C a nivel radicular. La localización de las plantas/clones de cada genotipo no fue aleatorizada dentro de la cámara bajo el supuesto de condiciones de homogeneidad ambiental. Se realizaron riegos diarios para mantener húmedo el sustrato, sin provocar excesos de agua. La evaluación de síntomas se hizo a los 28 días posteriores a la inoculación (dpi). A cada una de las plantas de cada genotipo se le asignó un valor de «0» correspondiente a ausencia de síntomas, o «1» a la presencia de marchitez.
Análisis de los datos
Para determinar el grado de resistencia de cada genotipo se calculó la proporción de plantas marchitas sobre el total de plantas inoculadas. Luego se asignó una categoría de reacción a la enfermedad, según el siguiente criterio arbitrario: R=resistente (0,00-0,25), MR=medianamente resistente (0,26-0,50), MS=medianamente susceptible (0,51-0,75) y S=susceptible (0,76-1,00).
Los valores de resistencia de los genotipos de la progenie se compararon mediante un Modelo Lineal Generalizado, asumiendo distribución binomial de la variable P (proporción de plantas enfermas de cada genotipo) (McCullagh y Nelder, 1989). Solamente los tratamientos (genotipos) que tenían entre 20 y 26 plantas inoculadas se ingresaron en el análisis, totalizando 124 genotipos (121 genotipos de la progenie, los dos parentales y el testigo susceptible ´Chieftain´). Trece genotipos asintomáticos para todas sus repeticiones (completamente resistentes) fueron analizados por fuera de este método, ya que la estimación de la varianza para la variable P fue igual a 0. Para las comparaciones se calculó el intervalo de confianza (95% de confianza) partiendo de la proporción estimada de plantas enfermas. Adicionalmente, para visualizar las diferencias entre genotipos de la progenie se realizó un análisis de conglomerados. La matriz de distancia fue elaborada utilizando las diferencias entre las proporciones estimadas de plantas enfermas de cada genotipo. Se usó el método de agrupamiento de Ward y se utilizó como criterio de corte para determinar el número de grupos el índice pseudo F y pseudo t2.
La interacción entre genotipos hospederos y cepas de Rs se evaluó mediante un diseño experimental completamente al azar con arreglo factorial de los tratamientos (6 x 5), inoculando 26 plantas para cada una de las 30 combinaciones entre genotipos y cepas. Cada tratamiento fue inoculado y analizado de la misma forma que en el experimento de evaluación de la resistencia en la progenie. Se analizaron los efectos de las fuentes de variación (genotipo, cepa, genotipo x cepa) utilizando un Modelo Lineal Generalizado y asumiendo distribución binomial de la variable P (proporción de plantas enfermas de cada genotipo). La significancia de los efectos se probó mediante una prueba F que se origina del cociente de dos Chi-cuadrados que surgen de la devianza del modelo y la devianza residual.
Resultados
Evaluación de genotipos de S. commersonii colectados en Uruguay
La evaluación de los niveles de resistencia a MB en 32 genotipos cmm utilizando la cepa UY036 de Rs mostró amplia variabilidad (Cuadro 1). De los genotipos evaluados, 25% fueron R (P entre 0,00-0,25), 19% MR (P entre 0,26-0,50), 50% MS (P entre 0,51-0,75) y 6% S (P entre 0,75-1,00). El testigo susceptible cv. ‘Chieftain’ mostró una proporción de plantas enfermas de 0,83. Los genotipos de S. phureja 192 y 195 tuvieron un comportamiento intermedio y susceptible respectivamente. Los genotipos de cmm 05.02.6 (R) y 04.203.4 (MS) fueron seleccionados por sus niveles de resistencia contrastantes para realizar un cruzamiento.
Obtención de una progenie cmm segregante para resistencia a MB
El genotipo 05.02.6 fue usado como hembra dado su bajo porcentaje de polen fértil (11%) estimado mediante una técnica de tinción. Además, se obtuvo bajo número de semillas por baya (5,64) en comparación con otros cruzamientos entre genotipos de esta especie. Esto indica baja fertilidad como hembra del genotipo 05.02.6 o alguna condición de incompatibilidad entre ambos parentales utilizados.
Debido a la baja eficiencia del cruzamiento, se estudió la ploidía de los progenitores por citometría de flujo. Se comparó el contenido C de ADN genómico con un diploide conocido de cmm (genotipo 04.02.3). Se confirmó que el genotipo 05.02.6 tiene un 50% más de genoma que el testigo diploide, y el genotipo 04.203.4 la misma cantidad que el testigo diploide. Por lo tanto, en base a citometría de flujo, se postuló que el progenitor femenino 05.02.6 sería triploide y el progenitor masculino 04.203.4 sería diploide (F. Santiñaque, com. Pers.).
Distribución de niveles de resistencia en la progenie
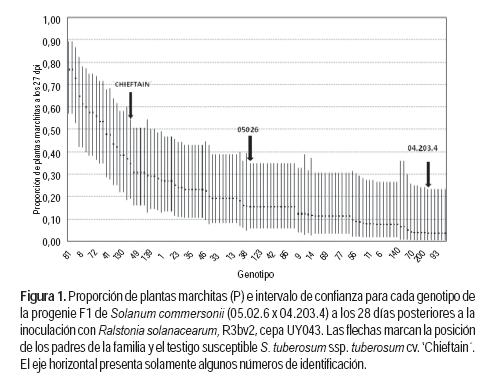
La resistencia a MB (proporción de plantas con marchitamiento) presentó un comportamiento continuo en la progenie F1 (05.02.6 x 04.203.4) con un valor P promedio de 0,19 y un rango desde P=0,00 (plantas asintomáticas) hasta P=0,77 (alta susceptibilidad). La comparación de los intervalos de confianza asignados a las medias estimadas de cada genotipo (excluidos 13 genotipos asintomáticos que por tanto presentaron varianza cero) mostró que únicamente los genotipos más resistentes y los más susceptibles difirieron significativamente (Figura 1).
No se encontraron diferencias significativas entre la mayor parte de los genotipos de la progenie F1, los progenitores y el testigo susceptible ‘Chieftain’. En consecuencia, en este experimento en el cual se utilizó la cepa UY043, no se confirmó el contraste originalmente observado entre los padres de la progenie cuando fueron inoculados con la cepa UY036. El 76% de los genotipos (92 de 121) presentaron una proporción de plantas enfermas estimada menor a 0,25. Solo 9% de la progenie (11 genotipos de 121) presentó una proporción de plantas enfermas mayor a 0,50. El testigo susceptible ‘Chieftain’ presentó bajo número de plantas enfermas (P=0,35) con respecto al ensayo anterior (P=0,83), cuando se había utilizado la cepa UY036.
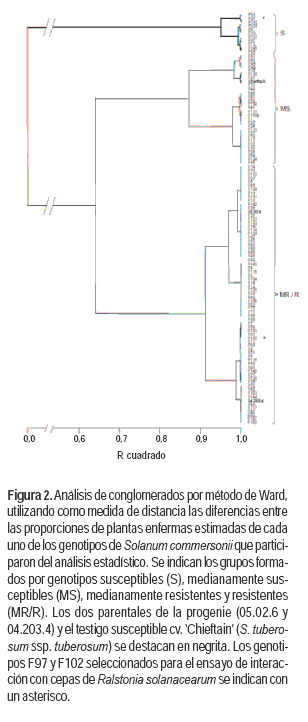
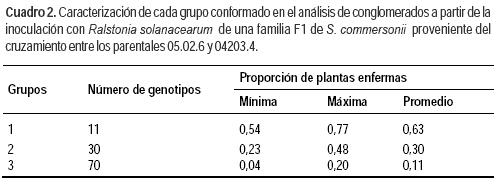
Con el objetivo de obtener agrupamientos de los genotipos de acuerdo a la similitud de niveles de resistencia, se realizó un análisis de conglomerado utilizando como medida de distancia las diferencias entre las proporciones estimadas de plantas enfermas de cada genotipo que participó en el análisis (Figura 2). El análisis de conglomerados coincidió con el modelo lineal generalizado en la formación de tres grupos de genotipos (Cuadro 2). El «grupo 1» son los 11 individuos con mayor nivel de susceptibilidad. El testigo susceptible ‘Chieftain’ integró el «grupo 2» que incluye 30 de los 111 genotipos analizados. Por último, los dos genotipos parentales de la familia integraron el «grupo 3» junto a los 70 genotipos F con mayor nivel de resistencia dentro de los incluidos en el análisis.
Los genotipos de cmm elegidos para este experimento representaron niveles de resistencia diferentes dentro de la inoculación de la progenie con la cepa UY043: 05.02.6 (P=0,154), 04.203.4 (P=0,040), F97 (P=0,769), F102 (P=0,080) y F118 (P=0,000). Los efectos del genotipo y la cepa fueron significativos, mientras que la interacción genotipo x cepa no fue significativa (Cuadro 3). Por tanto, la respuesta de resistencia o susceptibilidad no estuvo afectada por la cepa utilizada. El cultivar ‘Chieftain’ fue el más susceptible para todas las cepas (Cuadro 4). El genotipo F102 y los genotipos parentales 05.02.6 y 04.203.4 tuvieron una respuesta intermedia, no discriminados entre sí por ninguna de las cepas. La cepa UY043 fue la única que en promedio obtuvo menos muertes (menor virulencia) de planta para todos los genotipos (Cuadro 4). Esta cepa, que se utilizó para caracterizar la progenie entre los genotipos 05.02.6 y 04.203.4, es la única que no pudo discriminar entre los genotipos más resistentes y aquellos con resistencia intermedia (por ejemplo, los genotipos F118 y F102).
Discusión
El método de inoculación en suelo que se utilizó en este trabajo permitió explorar una colección de genotipos de cmm como fuente de resistencia a la MB de la papa. Con este método, el cv. ‘Chieftain’ incluido como control susceptible, efectivamente presentó altos niveles de susceptibilidad a MB. La evaluación de la respuesta de clones de cmm reveló diversidad, desde individuos con resistencia extrema (asintomáticos) hasta individuos con niveles de susceptibilidad similares al cv. ‘Chieftain’. Los niveles de resistencia fueron mayores que los obtenidos por Montanelli et al. (1995) para la misma especie aplicando un método de inoculación similar. En ese trabajo, el cultivar ‘Cruza 148’ y S. phureja ‘BR-63.65’ (cv. ´Molinera`), conocidos por su buena resistencia a campo, fueron los de mejor comportamiento y aun así presentaron plantas con síntomas.
Nuestros resultados confirman los altos niveles de resistencia encontrados para la especie por Laferriere et al. (1999), Kim-Lee et al. (2004), Galván et al. (2006), Carputo et al. (2009) y Siri et al. (2009). Se desconoce si los materiales más resistentes podrían tener infección latente de la bacteria en tubérculos asintomáticos, aspecto que debería ser objeto de futuros trabajos. Por otro lado, la variabilidad encontrada confirma la necesidad de realizar tamizados dentro de la especie antes de su utilización en el mejoramiento.
La presencia de citotipos triploides de cmm fue descripta por Correll (1962) y por Tam y Hawkes (1986). La utilización de un triploide como parental (05.06.2) dificulta el análisis de la distribución de niveles de resistencia en la progenie, ya que la producción de gametos es diferente a la esperable para un diploide (Ramsey y Schemske, 1998). A su vez, no conocemos cuáles de estos gametos aportarán el complemento materno necesario para generar un endosperma viable al combinarse con gametos provenientes del padre (Johnston et al., 1980). La producción de gametos 2n por parte del progenitor masculino es otra complejidad adicional. Todas estas condicionantes limitan el análisis de la distribución de niveles de resistencia en la progenie, ya que no es predecible cuántas copias de alelos provenientes del padre o de la madre recibió cada individuo.
Por otro lado, la cepa que se utilizó para analizar los niveles de resistencia de la progenie F1 fue muy poco agresiva, lo que se evidencia en la baja proporción de plantas enfermas del testigo susceptible ´Chieftain´ (0,35). La baja agresividad de la cepa UY043, confirmada en el experimento de interacción entre genotipo y cepa (Cuadro 4), tuvo como consecuencia un bajo poder de discriminación entre individuos con niveles de resistencia altos e intermedios. Tanto por los intervalos de confianza a partir del modelo lineal generalizado, que solo pudo diferenciar los extremos más resistentes y más susceptibles de la distribución, así como por el análisis de conglomerados que agrupó a 70 de 122 genotipos como resistentes, se tuvo un bajo poder de discriminación. La utilización de una cepa más virulenta podría determinar diferencias significativas entre genotipos de estratos de resistencia más estrechos.
El hecho de que, bajo las condiciones de este trabajo, surgieran individuos completamente susceptibles del cruzamiento entre dos individuos con resistencia parcial podría tener alguna(s) de las siguientes explicaciones: (i) que esos individuos hayan recibido menos o más copias de algún(os) locus/loci, dada la segregación desbalanceada del triploide y/o la producción de gametos masculinos 2n; (ii) que hayan locus/loci recesivos de padres en heterocigocis (tratándose de efectos aditivos, dominancia o sobredominancia); y (iii) que existan efectos genéticos complejos producto de interacciones específicas entre el cruzamiento de los genotipos seleccionados. Estos tres puntos también explicarían la aparición de individuos más resistentes que los dos padres (no comprobado estadísticamente en este trabajo), y en consecuencia la tendencia a la segregación transgresiva observada.
Una distribución continua de las frecuencias de fenotipos de resistencia, como la que se obtuvo, es por lo general explicada por varios genes. Un control poligénico para la resistencia a MB en diferentes Solanum silvestres diploides fue encontrado por Tung et al. (1990b) utilizando cepas de la raza 1 y 3. El control poligénico se explicaría por la inexistencia de co-evolución entre el patógeno y el huésped, y la consecuente ausencia de presión de selección para genes con efectos específicos de resistencia (Tung et al., 1990a). Esta podría ser también la situación para cmm y Rs. En otras especies como tomate, el control poligénico de la resistencia a MB también es la forma de herencia más común (Yang y Francis, 2007). Para estos casos y desde el punto de vista del mejoramiento genético, la acumulación de genes con efecto positivo en un mismo individuo es una estrategia clave. Este proceso de acumulación o piramidación puede ser usado para acumular genes de resistencia de una misma fuente (por ejemplo, cmm), y para combinar resistencias de distintas especies. La combinación de diversas fuentes de resistencia contribuiría a la efectividad y estabilidad a la característica, por ejemplo ante cambios en el ambiente.
En este trabajo no se detectó resistencia de tipo cepa-especifica entre las cepas utilizadas de la R3bv2 y los genotipos de cmm. El análisis de los niveles de resistencia promedio por cepa detectó diferencias significativas en la virulencia. Un grupo conformado por las cuatro cepas más agresivas se distinguió de la cepa UY043 menos agresiva, en coincidencia con Siri et al. (2011). La existencia de diferentes niveles de virulencia en la R3bv2 había sido previamente reportada (French y de Lindo, 1982; Watanabe et al., 1992). La conformación de únicamente dos grupos podría deberse al limitado número de cepas analizadas en este trabajo, así como a la escasa diversidad genética encontrada en general en la R3bv2 de Rs (Fegan y Prior, 2005) y en particular en las cepas uruguayas (Siri et al., 2011).
Diferencias genéticas entre las cepas de Rs evaluadas explicarían las diferencias en su habilidad patogénica y su virulencia, pero estas diferencias no determinaron interacciones con los genotipos de cmm. Con la salvedad del limitado número de genotipos hospederos evaluados, que impide la generalización para la especie, los resultados indican que el tipo de resistencia a MB en cmm no sería cepa-específica. Este resultado difiere de la interacción entre cepas de R3bv2 y genotipos de S. phureja encontrada por French y de Lindo (1982). Las cepas utilizadas en ese caso, provenientes de orígenes geográficos distantes, probablemente tuvieran mayor variabilidad que las que participaron en nuestro ensayo. A su vez, la resistencia cepa-especifica encontrada en S. phureja se corresponde con la oportunidad de co-evolución en el largo plazo entre el patógeno y el hospedero, lo que también puede explicar la poca cantidad de genes postulados para esa resistencia (Rowe y Sequeira, 1970).
El primer ensayo con la cepa UY036 diferenció el nivel de resistencia de los parentales de la progenie, resultado que no fue confirmado por los experimentos siguientes. Al descartar cambios en el orden de la resistencia debidos a efectos de interacción entre cepa y hospedero, las diferencias en los resultados se explicarían por variaciones a nivel ambiental que modifiquen las respuestas de los genotipos con determinadas cepas. Varios trabajos han marcado esta dificultad a la hora de realizar tamizados bajo condiciones controladas (Rowe y Sequeira, 1970; Tung et al., 1990a, 1990b.) A pesar de trabajar bajo condiciones experimentales controladas, pequeños cambios de temperatura podrían provocar cambios en la agresividad de las cepas o en el nivel de expresión de resistencia. Este efecto pudo cobrar importancia por la falta de aleatorización de los genotipos en el experimento. Por tanto, la repetición de los experimentos y la realización de diseños de bloques, aun cuando las variaciones en la uniformidad del ambiente sean mínimas, deberían incorporarse en la metodología. La utilización de cepas virulentas que logren discriminar mejor los diferentes grados de resistencia, y la utilización de la proporción de plantas con síntomas del control susceptible cv. ‘Chieftain’ para evaluar la virulencia de la cepa y/o el ajuste de otras condiciones del experimento, son otros elementos a incorporar en la metodología del mejoramiento por resistencia a MB.
Agradecimientos
Agradecemos las sugerencias sobre un manuscrito anterior realizadas por las Dras. Elsa Camadro, Clara Pristch, María Julia Pianzzola, y el Dr. Pablo Speranza. Agradecemos al personal del laboratorio de Fitopatología, Facultad de Agronomía, y a la Ing. Agr. Alicia Castillo y personal del área de cultivo de tejidos en el Laboratorio de Biotecnología del INIA. Este trabajo contó con financiamiento parcial del Proyecto PDT «Estudio multifactorial de la biodiversidad de Solanum commersonii como fuente de resistencia natural para el mejoramiento de la papa». Matías González agradece a INIA por la Beca de Maestría con la cual se realizó este trabajo.
Bibliografía
Carputo D, Aversano R, Barone A, Di Matteo A, Iorizzo M, Sigillo L, Zoina A, Frusciante L. 2009. Resistance to Ralstonia solanacearum of sexual hybrids between Solanum commersonii and S. tuberosum. American Journal of Potato Research, 86: 196-202.
Carputo D, Barone A, Cardi T, Sebastiano A, Frusciante L, Peloquin S. 1997. Endosperm balance number manipulation for direct in vivo germplams introgression to potato from a sexually isolate relative (Solanum commersonii Dun.). Proceedings of the National Academy of Sciences, 94: 12013- 2017.
Correll DS. 1962. The potato and its wild relatives. En: Contributions from the Texas Research Foundation : Botanical Studies vol. 4. Literary Licensing. 517p.
Fegan M, Prior P. 2005. How complex is the «Ralstonia solanacearum species complex»? En: Allen C, Prior, P, Hayward AC. [Eds.]. Bacterial wilt disease and the Ralstonia solanacearum species complex. Minnesota: APS Press. pp. 449-462.
French ER, De Lindo L. 1982. Resistance to Pseudomonas solanacearum in potato: specificity and temperature sensitivity. Phytopathology, 72: 1408-1412.
Galván G, Franco Fraguas L, Quirici L, Santos C, Silvera E, Siri MI, Villanueva P, Raudiviniche L, González M, Torres D, Castillo A, Dalla Rizza M, Vilaró F, Gepp V, Ferreira F, Pianzzola MJ. 2006. Solanum commersonii: una especie con gran potencial para el mejoramiento genético de papa por resistencia a Ralstonia solanacearum. En: Avances de investigación en recursos genéticos en el cono sur II. Montevideo: Procisur, IICA. pp. 87-102.
González M, Vilaró F, Galván G. 2010. Introgresión de la resistencia a la marchitez bacteriana de Solanum commersonii en el germoplasma de papa. En: Trabajos presentados al 24 Congreso de la Asociación Latinoamericana de la papa (ALAP); 23 - 28 mayo 2010. Cuzco : ALAP.
Hawkes JG. 1994. Origin of the cultivated potato and species relationship. En: Bradshaw JE. Mackay GR. [Eds.]. Potato genetics. Wallingford: CAB International. pp. 3 - 42.
Johnston SA, den Nijs, TPN, Peloquin SJ, Hanneman RE. 1980. The significance of genic balance to endosperm development in interspecific crosses. Theoretical and Applied Genetics, 57: 5-9.
Kelman A. 1954. The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology, 44: 693-695.
Kim-Lee H, Moon JS, Hong YS, Kim MS, Cho HM. 2004. Bacterial wilt resistance in the progenies of the fusion hybrids between haploid of potato and Solanum commersonii. American Journal of Potato Research, 82: 129-137.
Laferriere LT, Helgeson JP, Allen C. 1999. Fertile Solanum tuberosum + S. commersonii somatic hybrids as sources of resistance to bacterial wilt caused by Ralstonia solanacearum. Theoretical and Applied Genetics, 98: 1272-1278.
Lopes CA. 2009. Progressos na seleção de clones de batata para resistência à murcha-bacteriana no Brasil: 20 anos de história na Embrapa. En: I Seminario Iberoamericano CYTED sobre Ralstonia solanacearum ; 28-29 mayo 2009; Montevideo, Uruguay. Montevideo: Facultad de Química.
McCullagh R, Nelder JA. 1989. Generalized linear models. 2nd ed. London: Chapman and Hall. 511p.(Monographs on statistics and applied probability; 37).
Montanelli C, Chiari A, Chiari T, Stefanini F, Nascari G. 1995. Evaluation of resistance to Pseudomonas solanacearum in potato under controlled conditions. Euphytica, 81: 35-43.
Murashige T, Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15: 473-497.
Priou S, Aley P, Gutarra L. 2005. Assessment of resistance to bacterial wilt in CIP advanced potato clones. En: Allen C, Prior P, Hayward AC. [Eds.]. Bacterial wilt disease and the Ralstonia solanacearum species complex. Minnesota: APS Press. pp. 261-268.
Ramsey J, Schemske DW. 1998. Pathways, mechanisms and rates of polyploid formation in flowering plants. Annual Review of Ecology and Systematics, 29: 467-501.
Rowe PR, Sequeira L. 1970. Inheritance of resistance to Pseudomonas solanacearum in Solanum phureja. Phytopathology, 60: 1499-1502.
Schmiediche P. 1988. Breeding for resistance to Pseudomonas solanacearum. En: French ER. [Ed.]. Report of the planning conference on bacterial diseases of the potato in 1987. Lima: International Potato Center. pp. 19 -28.
Siri MI, Sanabria A, Pianzzola MJ. 2011. Genetic diversity and aggressiveness of Ralstonia solanacearum strains causing bacterial wilt of potato in Uruguay. Plant Disease, 95: 1292-1301.
Siri MI, Galván GA, Quirici L, Villanueva P, Ferreira F, Franco Fraguas L, Pianzzola MJ. 2009. Molecular marker diversity and bacterial wilt resistance in wild Solanum commersonii accessions from Uruguay. Euphytica, 165: 371 - 382.
Tam TR, Hawkes JG. 1986. Cytogenetic studies and the occurrence of triploidy in the wild potato species Solanum commersonii Dun. Euphytica, 35: 293-302.
Thurston HD, Lozano JC. 1968. Resistance to bacterial wilt of potatoes in Colombian clones of Solanum phureja. American Potato Journal, 45: 51-55.
Tung PX., Rasco ET, Van der Zaag P, Schmiediche P. 1990a. Resistance to Pseudomonas solanacearum in the potato: II: Aspects of host-pathogen-environment interaction. Euphytica, 45: 211-215.
Tung PX, Rasco ET, Van der Zaag P, Schmiediche, P. 1990b. Resistance to Pseudomonas solanacearum in the potato. I : Effects of sources of resistance and adaptation. Euphytica, 45: 203-210.
Watanabe JA, El-Nashaar HM, Iwanaga M. 1992. Transmission of bacterial wilt resistance by first division restitution (FDR) 2n pollen via 4x x 2x crosses in potatoes. Euphytica, 60: 21-26.
Yang W, Francis DM. 2007. Genetics and breeding for resistance to bacterial diseases in tomato: prospects for marker-assisted selection. En: Razdan MK, Mattoo AK. [Eds.]. Genetic improvement of Solanaceous crops: Volume 2: Tomato. Enfield: Science Publishers. pp. 379 -419.