Services on Demand
Journal
Article
Related links
Share
Agrociencia (Uruguay)
Print version ISSN 1510-0839On-line version ISSN 2301-1548
Agrociencia Uruguay vol.17 no.1 Montevideo June 2013
Sistemas de fenotipado para la evaluación de las respuestas al estrés salino en Lotus
Quero Gastón Eduardo1, Borsani Omar1, Gutiérrez Lucía 3, Melchiorre Mariana 2, Monza Jorge1, Lascano Ramiro2
1Laboratorio de Bioquímica, Facultad de Agronomía, Universidad de la República. Av. Garzón 780, 12900 Montevideo, Uruguay. Correo electrónico: gastonquero@gmail.com
2Instituto de Fisiología y Recursos Genéticos Vegetales (IFRGV ) CIAP-INTA , Camino 60 Cuadras km 5 (X5020ICA), Córdoba, Argentina y Cátedra de Fisiología Vegetal. Av. Vélez Sarsfield 290, 5000 Córdoba, Argentina.
3Departamento de Biometría, Estadística y Computación, Facultad de Agronomía, Universidad de la República. Av. Garzón 780, 12900 Montevideo, Uruguay.
Recibido: 4/6/12 Aceptado: 10/2/13
Resumen
La tolerancia al estrés salino es un carácter complejo determinado por la sumatoria de los efectos de numerosos genes, cuya identificación es necesaria para la definición de estrategias de mejoramiento. En este sentido, el uso de plantas modelo genotipadas y la disponibilidad de métodos de fenotipado masivo son útiles para asistir a los programas de mejoramiento. Lotus japonicus (Regel) K. Larsen es un modelo de leguminosa con nodulación determinada, que puede ser utilizada en la identificación de determinantes genéticos en programas de mejoramiento de Lotus y otras leguminosas forrajeras. En este trabajo, para establecer un sistema de cultivo adecuado para el fenotipado masivo, se compararon cuatro sistemas experimentales para evaluar respuestas a estrés salino: placas, pouch, hidroponía y macetas. Los resultados obtenidos permitieron elegir el sistema de hidroponía como el más adecuado para evaluar el estrés salino, dado que se pudieron establecer diferencias en las respuestas fisiológicas basadas en parámetros de crecimiento y desarrollo en los genotipos Lotus japonicus Gifu y Lotus burttii. Además, el sistema de hidroponía permitió discriminar respuestas en una población de líneas recombinantes puras (RILs), producto del cruzamiento de Lotus japonicus Gifu x Lotus burttii. Contar con un sistema de cultivo que permita realizar de manera precisa el fenotipado masivo de plantas, es necesario para identificar regiones del genoma implicadas en las respuestas a estrés salino.
Palabras clave: SISTEMAS DE CULTIVO, HIDROPONÍA, FENOTIPADO MASIVO, RILS, NACL
Summary
Phenotyping Systems for Evaluating Saline Stress Response in Lotus
Salt stress tolerance is a complex trait which is determined by the additive effects of several genes whose identification is necessary to define improvement strategies. In this sense, the use of model plants genotyped and the availability of massive phenotyping methods are useful to assist breeding programs. Lotus japonicus (Regel) K. Larsen has been adopted as a determined nodulating legume model, which can be used for identification of the genetic determinants in the breeding program of Lotus and other forage legumes. In this work, in order to establish a growth system suitable for massive phenotyping, we compared four experimental systems for evaluating saline stress responses: plates, pouch, hydroponic and pots. Results allow to choose the hydroponic system as the most suitable for evaluating saline stress, since it is able to establish differences in responses based on physiological parameters of growth and development in Lotus japonicus (Gifu) and Lotus burttii genotypes. Moreover, the hydroponic system allowed to discriminate the responses in a population of recombinant inbreed lines (RILs) originated by the crossing of Lotus japonicus Gifu x Lotus burttii. Having a culture system that allows precise and massive phenotyping is necessary for detecting genomic regions involved in the responses to saline stress.
Keywords: CULTURE SYSTEM, HYDROPONIC SYSTEM, MASSIVE PHENOTYPING, RILS, NACL
Introducción
Aproximadamente el 37% de las pérdidas potenciales en la productividad de los cultivos a nivel mundial se deben a la sequía y a la salinidad, y el 10% de las tierras cultivables están afectadas por estas condiciones medioambientales, que para el año 2050 aumentará más del 50% (Athar y Ashraf, 2009; Munns y Tester, 2008; Flowers, 2004; Zhang et al., 2001).
La tolerancia a estreses abióticos involucra respuestas morfológicas, fisiológicas y bioquímicas, que permiten mantener procesos como respiración, fotosíntesis y transporte de nutrientes (Munns y Tester, 2008; Díaz et al., 2005; Wang et al., 2003).
En la respuesta a altas concentraciones de NaCl se diferencian dos fases, en la primera se produce estrés osmótico por la diferencia de potencial hídrico generado por la mayor concentración de sal en el medio (Munns y Tester, 2008). En la segunda fase se produce estrés iónico, consecuencia del desbalance de la relación K+/Na+ y del aumento de Na+ y Cl- a niveles letales (Munns y Tester, 2008; Díaz et al., 2005; Borsani et al., 2003; Munns, 2002). En esta fase, la planta acumula iones en hojas viejas que comienzan a morir y la capacidad fotosintética cae, lo que lleva a una reducción de la tasa de crecimiento (Munns, 2009). A nivel celular, la tolerancia a estrés salino está determinada inicialmente por la compensación osmótica seguida por las respuestas tendientes a mantener la homeostasis celular (Borsani et al., 2001). A nivel de planta entera la tolerancia está definida por la capacidad de excluir y traslocar Na+, por lo que una alta relación tallo/raíz, así como una mayor tasa de crecimiento, son necesarias para mantener bajos los niveles de Na+ en hoja (Yamaguchi y Blumwald, 2005; Munns et al., 2002).
El fenotipo de una planta resulta de la interacción de su genoma con condiciones ambientales cambiantes, e involucra procesos de regulación génica que modulan respuestas de adaptación, aclimatación y tolerancia a condiciones desfavorables (Mazzucotelli et al., 2008; Asíns, 2002; Tuberosa et al., 2002). Para el mejoramiento de la tolerancia al estrés salino interesa conocer los determinantes genéticos asociados a este tipo de respuesta (Ashraf, 2010; Yamaguchi y Blumwald, 2005; Flowers, 2004). La tolerancia al estrés salino es un rasgo complejo de base multigénica, determinado por muchos loci de efecto cuantitativo (QTL, quantitative trait loci) (Cuartero et al., 2006; Flowers, 2004; Borsani et al., 2003). Por esta razón, el mejoramiento de la tolerancia al estrés salino en cultivares de interés agronómico no ha tenido el éxito esperado (Athar y Ashraf, 2009).
En los últimos años el esfuerzo puesto en estudios genómicos/genéticos incrementó la generación de información en estas áreas, en un amplio rango de especies (Miflin, 2000). Inicialmente, las investigaciones se enfocaron en el estudio de la función de cada gen en particular y se desarrollaron métodos de transgénesis para sobrexpresión, silenciamiento de genes y obtención de bancos de mutantes. Sin embargo, el énfasis puesto en la genómica no se correspondió con similares esfuerzos en lo que hace al entendimiento del fenotipo expresado, lo cual ha llevado a incrementar lo que se conoce como phenotype gap (Verslues et al., 2006; Miflin, 2000).
En este sentido el uso de plantas modelo y métodos de fenotipado masivo son de gran importancia para asistir a los programas de mejoramiento (Botella et al., 2005). A pesar de que las plataformas de fenotipado en condiciones controladas han tenido un avance importante en los últimos años (Rascher et al., 2011), su uso no es generalizable a todas las especies vegetales ni adaptable a requerimientos específicos en la evaluación de un estrés abiótico en particular.
Las respuestas a estrés salino en plantas implica el uso de un sistema de cultivo en particular, lo que ha sido reportado en numerosas comunicaciones, pero hasta el momento hay pocos trabajos donde se compare el efecto de los sistemas de cultivo sobre la respuesta de la planta y de cómo esto puede afectar la definición del concepto de tolerancia / sensibilidad el estrés salino (Verslues et al., 2006).
Por otra parte, si bien se han realizado caracterizaciones fisiológicas bajo estrés salino y osmótico en los Lotus modelo (Sánchez et al., 2010; Melchiorre et al., 2009) la información sobre el fenotipado en el género no es abundante. Lotus japonicus ha sido adoptada como modelo de leguminosas con nodulación determinada (Sato et al., 2008; Udvardi et al., 2005) ya que tiene sintenia con especies de interés agronómico como L. corniculatus, L. glaber y L. uliginosus (Nelson et al., 2010; Tsubokura et al., 2008; Zhu et al., 2005) y con otras especies de leguminosas de nodulación determinada (Hougaard et al., 2008; Gondo et al., 2007). Esto hace posible que la información generada en L. japonicus pueda ser utilizada en los programas de mejoramiento de leguminosas forrajeras.
Los ecotipos Gifu y MG20 de L. japonicus y dos especies relacionadas, L. filicaulis y L. burttii, han sido elegidas como líneas parentales para estudios genéticos (Kawaguchi et al., 2005; Sandal et al., 2002; Jiang y Gresshoff, 1997; Handberg y Stougaard, 1992). A partir del cruzamiento de estos parentales se han desarrollado poblaciones de líneas recombinantes puras (RILs, recombinant inbred line). Las poblaciones de RILs son obtenidas a partir de una F2, seguida por una serie de autofecundaciones hasta construir un nuevo panel de líneas puras cuyo genoma es un mosaico de las dos líneas iniciales. En estas poblaciones se pueden fenotipar múltiples individuos por línea, lo que reduce la varianza individual y ambiental y mejora la evaluación fenotípica de un carácter complejo como la tolerancia al estrés salino (Broman y Sen, 2009; Broman, 2005; Asíns, 2002). El objetivo de este trabajo fue establecer un sistema de cultivo que permita caracterizar fenotípicamente las respuestas al estrés salino en L. japonicus Gifu y L. burttii y en una población de RILs producto del cruzamiento de ambas especies.
Materiales y métodos
Material vegetal
Se usaron las isolíneas contrastantes para estrés salino (Melchiorre et al., 2008), B-303-S9 de Lotus burttii (Kawaguchi et al., 2005) y B-129-S9 de Lotus japonicus Gifu (Stougaard y Beuselinck, 1996), de ahora en adelante L. burttii y Lj. Gifu respectivamente, y una población de 147 líneas recombinantes puras (RILs) producto del cruzamiento interespecífico de Lj. Gifu x L. burttii (Kawaguchi et al., 2005). Cada RIL fue desarrollada por autofecundación a partir de una F2 hasta una F8 y F9 según los descrito en Sandal et al. (2012). Las semillas fueron provistas por el Dr. Niels Sandal (Universidad de Aarhus, Dinamarca) y multiplicadas por la. Ing. Agr. Mónica Rebuffo (INIA La Estanzuela, Uruguay).
La escarificación de las semillas se realizó mecánicamente con papel lija fino Nº 2, y se desinfectaron 1 min en etanol al 70% (v/v) y 20 min en una solución de hipoclorito de sodio comercial (55 mg de Cloro activo) 20 % (v/v) con 0,1%Tween-20. Después de seis lavados y de permanecer durante 4 h en agua estéril para su imbibición, las semillas se germinaron en placas de Petri con agar agua 8% (p/v) estéril, a 28 ºC en estufa de crecimiento, donde se mantuvieron hasta que las radículas tuvieron 2-3 mm. En este estadio, se trasplantaron a cada sistema de cultivo.
Condiciones de crecimiento
Los sistemas de cultivo se mantuvieron en cámara de crecimiento a 28 ºC, con un fotoperíodo de 16 h luz a una intensidad de 150 µmol de fotones m-2· s-1. En todos los sistemas se usó medio B&D (Broughton y Dilworth, 1971) sin NaCl durante el período de aclimatación de siete días. Luego de este período los tratamientos fueron 0 y 125 mM NaCl y el medio de cultivo se renovó cada cuatro días para asegurar una concentración de NaCl constante. Los datos de crecimiento y desarrollo se determinaron a los 0, 7 y 14 días de aplicados los tratamientos (dat), es decir a los 7, 14 y 21 días de transferidas las semillas a los sistemas de crecimiento.
Sistemas de crecimiento
Placas
Se usaron placas de Petri de 14 cm de diámetro con medio B&D estéril solidificado con 8% de agar (Figura 1A). En cada placa se colocaron cinco plantas y se usaron seis placas (unidad experimental) por tratamiento.

Bolsas plásticas
Se usaron bolsas plásticas de crecimiento (pouches) de 18 x 16,5 cm (Mega International, USA) con 20 mL de medio B&D líquido estéril (Figura 1B). Los pouches se colocaron verticalmente en un organizador, y se mantuvo oscura la zona radicular. En cada pouch se colocaron ocho plantas y se usaron tres pouches (unidad experimental) por tratamiento.
Hidroponía
El sistema de hidroponía completo consistió en seis bandejas de 400 mL, interconectadas por tubos flexibles de plástico de 0,5 cm de diámetro. El flujo de aire continuo fue suministrado por una bomba de acuario modelo CX-0098 Champion®. En cada bandeja se dispusieron tiras de acrílico perforadas donde se colocaron las semillas germinadas (Figura 1C). En cada bandeja se colocaron 20 plantas y se usaron tres bandejas (unidad experimental) por tratamiento.
Macetas
Las macetas plásticas de 250 mL se llenaron con vermiculita expandida de granulometría media (Figura 1D) y se regaron por subirrigación con medio B&D. En cada maceta se colocaron cinco plantas y, se usaron cuatro macetas (unidad experimental) por cada tratamiento.
Estrategia experimental
El efecto del sistema de cultivo sobre las respuestas de crecimiento y desarrollo de las plantas se evaluó en L. burttii cultivado bajo condición control en los cuatro sistemas experimentales definidos. La capacidad del sistema de cultivo para identificar respuestas diferenciales frente a estrés salino se evaluó utilizando dos genotipos contrastantes L. burttii y Lj. Gifu cultivados en el sistema de hidroponía. La capacidad del sistema de cultivo para diferenciar respuestas en genotipos altamente emparentados se evaluó utilizando una población RILs de Lotus en el sistema de hidroponía.
Parámetros de crecimiento y desarrollo
Para cuantificar el crecimiento y desarrollo de las plantas se midió la longitud de tallo, raíz y total, y el número de trifolios. Las longitudes fueron tomadas de manera no destructiva mediante el análisis de imágenes usando el software libre ImageJ (Abramoff et al., 2004).
La Tasa de Elongación Relativa (TER) se definió como parámetro de crecimiento y se calculó como:
TER= (ln Lf – ln Li) / (tf – ti)
donde: Lf y Li, corresponde a la de longitud final e inicial, y tf y tf al tiempo final e inicial. Las variables de crecimiento quedaron definidas como TERt, TERr y TERtotal, para tasa de elongación relativa de tallo, raíz y total respectivamente.
Para cuantificar el desarrollo se definieron tres parámetros:
1) Relación Tallo/Raíz (RTR) calculada como:
RTR= Lt / Lr
donde: Lt es la longitud del tallo y Lr es la longitud de la raíz.
2) Tasa de Desarrollo Foliar (TDF) calculada como:
TDF= nº de trifolios/d
donde: d es el número de días desde el cultivo.
3) Nº de trifolios por tallo (Nt/T) calculado como:
Nt/T= nº de trifolios / longitud de tallo.
Marcadores moleculares de la población de RILs
Se trabajó sobre un mapa genético consistente en seis grupos de ligamiento que corresponden a los seis cromosomas de Lotus japonicus según lo descrito por Sandal et al. (2002) y Pedrosa et al. (2002). Los marcadores moleculares son del tipo microsatélite desarrollados según lo descrito en Sandal et al. (2012) para detectar polimorfismos entre Lj. Gifu y L. burttii. La información de los marcadores moleculares está disponible en el sitio (http://www.kazusa.or.jp/lotus/markerdb_index.html). La matriz de similitud del genoma de cada línea respecto a sus parentales fue obtenida utilizando en software libre Flapjack (Milne et al., 2010).
Análisis estadístico
Se utilizaron modelos lineales con efectos fijos según el diseño experimental usado en cada sistema de crecimiento. En placas, pouches y macetas los tratamientos se aplicaron en un diseño completamente al azar con submuestreo. En hidroponía los tratamientos se aplicaron bajo un diseño en bloques completos al azar, para las líneas parentales. Para las RILs, por tratarse de un gran número de genotipos, se utilizó un diseño de bloques incompletos en parcelas divididas con dos a tres repeticiones por línea, donde cada bandeja (parcela dividida) tenía 60 líneas. Para la identificación de diferencias significativas entre tratamientos se utilizó un test de comparación de medias, ajustadas según cada modelo, en base al estadístico de Tukey. El análisis de los datos se realizó con el software Infostat (Universidad Nacional de Córdoba, 2010).
Resultados
Evaluación del efecto del sistema de cultivo sobre los parámetros de crecimiento y desarrollo
Para el establecimiento de un sistema de fenotipado que permita la máxima expresión del fenotipo, se evaluó el efecto de cuatro sistemas de cultivo: placas, pouches, hidroponía y macetas sobre el crecimiento y desarrollo de L. burttii en ausencia o presencia de NaCl .
Las plantas cultivadas en ausencia de estrés en placas y pouches mostraron similares patrones de crecimiento y desarrollo; del mismo modo lo hicieron las plantas crecidas en macetas e hidroponía, las que a su vez mostraron mayores valores absolutos (Figura 2).
En todos los sistemas de cultivos ensayados, y en concordancia con resultados obtenidos por Melchiorre et al. (2008), la tasa de elongación relativa total (TERtotal), la radicular (TERr) y la de tallo (TERt) de L. burttii se redujeron en la concentración 125 mM de NaCl respecto al control. En todos los sistemas y en ambas condiciones, las tasas de crecimiento tendieron a disminuir a los 14 días respecto a los valores obtenidos a los siete días (Cuadro1).
La relación tallo/raíz (RTR) disminuyó significativamente respecto al control en plantas de L. burttii cultivadas en hidroponía y en macetas a los 14 días de aplicado el NaCl; pero en este mismo tiempo el NaCl en el sistema en placas incrementó la RTR (Cuadro 2).
El tratamiento con NaCl no modificó la tasa de desarrollo foliar (TDF) en las plantas creciendo en sistemas de hidroponía y placas, mientras que ésta se redujo en el sistema de pouches y macetas a partir de los 7 y 14 dat respectivamente (Cuadro 2). Respecto al número de trifolios en los tallos (Nt/T) éste se incrementó respecto al control en plantas cultivadas en los sistemas de hidroponía y macetas, mientras que a los 14 dat no se observaron diferencias significativas en los sistemas de placas y pouches (Cuadro 2).
Evaluación del sistema de hidroponía para discriminar respuestas diferenciales de genotipos al estrés salino
Una vez establecido que los cuatro sistemas de crecimiento permiten fenotipar a L. burttii en condiciones de estrés salino, y en base a los resultados obtenidos y mostrados en la Figura 2, se eligió al sistema de hidroponía para evaluar a los 14 dat las diferencias fenotípicas entre los genotipos de Lotus, para lo que se usó Lj. Gifu y L. Burttii.
Si bien en ambos genotipos el NaCl tuvo un efecto negativo sobre los parámetros de crecimiento evaluados, Lj. Gifu tuvo tasas de crecimiento mayores que L. burttii (Cuadro 3).
Cuando se evaluaron los parámetros de desarrollo de estos genotipos se observó que en ausencia de NaCl las RTR y TDF de L. burttii fueron mayores que las de Lj. Gifu, sin embargo con 125 mM de NaCl Lj. Gifu presentó mayores RTR y TDF (Cuadro 4).
Uso del sistema de hidroponía para el fenotipado masivo de una población de RILs (Lj. Gifu x L. Burttii)
El sistema de hidroponía permitió discriminar el comportamiento frente a estrés salino de Lj. Gifu y L. burttii. Para establecer si este sistema puede ser usado para analizar la respuesta de una cruza de ambos genotipos se decidió evaluar en el sistema de hidroponía una población de RILs, Lj. Gifu x L. burttii compuesta por 147 líneas.
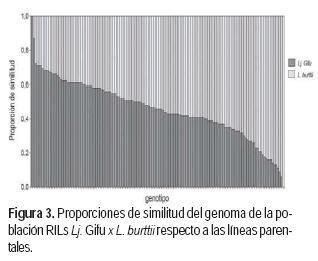
En la población de RILs se observó que la proporción de similitud del genoma de cada línea respecto de sus parentales fue variable dentro de la población. El 3% de las RILs poseen un porcentaje de similitud del genoma mayor al 70% respecto a Lj. Gifu (parental femenino) en tanto que, el 15% de las líneas tienen un porcentaje de similitud mayor al 70% respecto a L. burttii (parental masculino). Por otra parte, el 3% de la población posee un genoma con el 50% de similitud para cada parental (Figura 3).
La distribución de frecuencia de la variable TERt en la población de RILs fue diferente según la condición experimental analizada. En la condición control la TERt tuvo una distribución unimodal (Figura 4A), pero en NaCl esta distribución de frecuencia se modificó hacia una de tipo bimodal (Figura 4B).
Discusión
El contar con sistemas de fenotipado robustos y confiables que permitan caracterizar parámetros morfológicos, fisiológicos y bioquímicos frente a diferentes condiciones ambientales es importante para aprovechar distintas herramientas genéticas y genómicas (Melchiorre et al., 2009). Recientemente, se ha revalorizado el aporte de la genética cuantitativa asistida por marcadores moleculares en el estudio de determinantes de caracteres complejos de la productividad bajo condiciones adversas (Mackay et al., 2009).
Evaluar poblaciones genotipadas en sistemas de fenotipado permitiría establecer correlaciones entre variables genotípicas y fenotípicas tendientes a identificar los determinantes de las respuestas de interés. En este sentido, este tipo de evaluación en líneas parentales diploides del género Lotus es una estrategia que aportará información que puede ser transferida a los programas de mejoramiento de las especies tetraploides usadas como forrajeras (Hougaard et al., 2008; Kawaguchi et al., 2005; Udvardi et al., 2005; Flowers, 2004; Sandal et al., 2002).
La estrategia experimental usada en este trabajo, basada en la comparación de distintos sistemas de cultivo, permitió identificar respuestas diferenciales frente a estrés salino en Lotus. Más aún, se pudo establecer un sistema de crecimiento para discriminar respuestas fenotípicas en genotipos muy relacionados.
El análisis de los distintos sistemas de crecimiento mostró que los patrones de respuestas de la planta en condiciones control fueron similares en todos los sistemas de cultivo. Esto demuestra que los sistemas no tienen incidencia sobre el patrón de crecimiento, lo que significa que no es esperable que exista una interacción fuerte entre el sistema y el genotipo. Estudios realizados en otras especies de Lotus mostraron resultados similares a los observados en este trabajo para L. burttii (datos no mostrados).
El análisis del crecimiento absoluto de raíz, tallo y total mostró que cada sistema de cultivo tuvo efectos diferentes sobre estas variables. Particularmente en macetas el tamaño final alcanzado fue mayor al que se logró en cualquiera de los otros sistemas. Sin embargo las macetas no permiten una cuantificación del crecimiento no destructiva, por lo que para ensayos que involucran el seguimiento de la respuesta en el tiempo, sería necesario tener un número determinado de macetas por tiempo por genotipo por condición, lo que aumenta significativamente la dimensión del ensayo. Por esto, parece deseable encontrar un sustituto a este sistema, ya que en análisis genómicos es necesario el fenotipado rápido y masivo de respuestas.
Si bien en este estudio la maceta fue el sistema que menos restricciones impuso al crecimiento de la planta, las placas, pouches e hidroponía permitieron realizar muestreos consecutivos no destructivos de parámetros de crecimiento y desarrollo del mismo individuo. En estos sistemas fue posible obtener cinéticas de crecimiento frente a estrés y determinar condiciones de intensidad discriminantes dadas por el tiempo y el nivel de estrés. Estos estudios cinéticos permitieron definir qué etapa del desarrollo de la planta fue más sensible a la condición de estrés, lo que se conoce como período crítico. Este período se situó entre los 7 y 14 días de transferidas las semillas a los sistemas de crecimiento, y durante el mismo se observaron las mayores tasas de crecimiento así como el mayor efecto del NaCl. La identificación de este período es interesante ya que las respuestas de la planta a la salinidad están directamente relacionadas con la intensidad del estrés y con el estado de desarrollo de la planta (Khan et al., 2010; Munns, 2009; Melchiorre et al., 2009; Verslues et al., 2006).
Por otro lado, los distintos sistemas impusieron limitaciones en cuanto al número de plantas que se puede evaluar por tipo de dispositivo y por ensayo. Este aspecto es determinante para definir el diseño experimental y el análisis estadístico más adecuado según sean los objetivos que se buscan en los distintos ensayos (i.e. evaluación de RILs, evaluación de genotipos contrastantes, tratamientos de estrés, etc.). En este sentido luego de ensayar los cuatro sistemas de fenotipado, concluimos que el sistema de hidroponía aporta ventajas respecto a los otros, ya que se puede cultivar simultáneamente un número elevado de plantas / genotipos con un nivel de expresión del fenotipo similar al de la maceta, en un espacio relativamente reducido. Esto permite disminuir considerablemente las variaciones dadas por el error experimental del sistema y la varianza genética sobre las variables de respuestas estudiadas. El control de estas variables es crítico en el diseño de experimentos dirigidos a la identificación de componentes genéticos asociados a la expresión de rasgos cuantitativos como el crecimiento y desarrollo (Broman y Sen, 2009).
El sistema de hidroponía permitió aplicar un diseño experimental en el cual fue posible la evaluación simultánea de 147 RILs. Cuando se analizó la TERt en la población de RILs se observó una distribución de frecuencia del tipo unimodal en la condición control, mientras que cuando se impuso el estrés salino, la TERt tuvo una distribución de frecuencia del tipo bimodal. Esto es interesante ya que como cada RIL es un genotipo individual, este comportamiento puede ser asociado a una característica genética particular (Broman y Sen, 2009; Collard et al., 2005; Tuberosa et al., 2002; Tanksley, 1993). La evaluación de las respuestas a estrés salino en la población de RILs mediante un sistema de hidroponía se propone entonces como una estrategia válida para la identificación de QTLs asociados a la tolerancia a estrés salino.
Contar con un sistema de cultivo que permita de manera precisa el fenotipado masivo de plantas contribuirá a identificar regiones del genoma implicados en las respuestas a estrés salino, lo que es importante para el mejoramiento de genotipos cultivables de Lotus frente a estrés iónico / osmótico.
Agradecimientos
Los autores agradecen a Paola Suárez, Daniela López Miró y Daniela Gómez por su asistencia técnica y al Dr. Niels Sandal y a la Ing. Agr. Mónica Rebuffo por facilitar las semillas tanto de las líneas parentales como de RILs. Este trabajo fue financiado parcialmente por la Unión Europea (FP6-2003 INCO-DEV2- 517617, LOTASSA Project).
Bibliografía
Abramoff MD, Magalhaes PJ, Ram SJ. 2004. Image Processing with ImageJ. Biophotonics International, 11(7): 36 - 42.
Ashraf M. 2010. Inducing drought tolerance in plants: Recent advances. Biotechnology Advances, 28(1):169 -183.
Asíns MJ. 2002. Present and future of quantitative trait locus analysis in plant breeding. Plant Breeding, 121(4): 281-291.
Athar HR, Ashraf M. 2009. Strategies for crop improvement against salinity and drought stress : An overview. En: Ashraf M, Ozturk MÑ, Athar HR. [Eds.]. Salinity and water stress improving crop efficiency. Osnabrueck: Springer. (Springer series editor in Tasks for Vegetation Sciences; 44). pp. 1-16.
Borsani O, Valpuesta V, Botella MA. 2003. Developing salt tolerant plants in a new century: a molecular biology. Plant Cell Tissue and Organ Culture, 73(2002): 101 - 115.
Borsani O, Cuartero J, Fernández JA, Valpuesta V, Botella MA. 2001. Identification of Two Loci in Tomato Reveals Distinct Mechanisms for Salt Tolerance. The Plant Cell, 13(4): 873 - 887.
Botella MA, Rosado A, Bressan RA, Hasegawa PM. 2005. Plant adaptive responses to salinity stress. En: Jenks MA, Hasegawa PM. [Eds.]. Plant abiotic Stress. Oxford: Blackwell Publishing. pp. 38 - 62.
Broman KW. 2005. The Genomes of Recombinant Inbred Lines. Genetics, 169(2): 1133 -1146.
Broman KW, Sen S. 2009. Experimental design and power. En: Gail M, Krickeberg K, Samet J, Tsiatis A, Wong W. [Eds.]. A Guide to QTL Mapping with R/qtl. New York: Springer. (Springer series Statistics for Biology and Health;12). pp. 153 - 177.
Broughton WJ, Dilworth MJ. 1971. Control of leghaemoglobin synthesis in snake beans. Biochemical Journal, 125(4): 1075 -1080.
Collard BCY, Jahufer MZZ, Brouwer JB, Pang ECK. 2005. An introduction to markers, quantitative trait loci (QTL) mapping and marker-assisted selection for crop improvement: The basic concepts. Euphytica, 142(1-2): 169 -196.
Cuartero J, Bolarín MC, Asíns MJ, Moreno V. 2006. Increasing salt tolerance in the tomato. Journal of Experimental Botany, 57(5): 1045 -1058.
Díaz P, Monza J, Márquez A. 2005. Drought and saline stress in Lotus japonicus. En: Márquez AJ. [Ed.] Lotus japonicus Handbook. Dordrecht: Springer. pp. 39 - 50.
Flowers TJ. 2004. Improving crop salt tolerance. Journal of experimental botany, 55(396): 307-319.
Gondo T, Sato S, Okumura K, Tabata S, Akashi R, Sachiko I. 2007. Quantitative trait locus analysis of multiple agronomic traits in the model legume Lotus japonicus. Genome, 50(7): 627-637.
Handberg K, Stougaard J.1992. Lotus japonicus, an autogamous, diploid legume species for classical and molecular genetics. The Plant Journal, 2(4): 487-496.
Hougaard BK, Madsen LH, Sandal N, Moretzsohn MDC, Fredslund J, Schauser L, Nielsen AM, Rohde T, Sato S, Tabata S, Bertioli DJ, Stougaard J. 2008. Legume Anchor Markers Link Syntenic Regions Between Phaseolus vulgaris, Lotus japonicus, Medicago truncatula and Arachis. Genetics, 179(4): 2299-2312.
Jiang Q, Gresshoff PM. 1997. Classical and Molecular Genetics of the Model Legume Lotus japonicus. Molecular Plant-Microbe Interactions, 10(1): 59-68.
Kawaguchi M, Pedrosa-Harand A, Yano K, Hayashi M, Murooka Y, Saito K, Nagata T, Namai K, Nishida H, Shibata D, Sato S, Tabata S, Hayashi M, Harada K, Sandal N, Stougaard J, Bachmair A, Grant WF. 2005. Lotus burttii Takes a Position of the Third Corner in the Lotus. DNA Research, 12(1): 69 -77.
Khan HR, Paull JG, Siddique KHM, Stoddard FL. 2010. Faba bean breeding for drought-affected environments: A physiological and agronomic perspective. Field Crops Research, 115(3): 279-286.
Mackay TFC, Stone EA, Ayroles JF. 2009. The genetics of quantitative traits: challenges and prospects. Nature reviews Genetics, 10(8): 565-577.
Mazzucotelli E, Mastrangelo A, Crosatti C, Guerra D, Stanca A, Cattivelli L. 2008. Abiotic stress response in plants: When post-transcriptional and post-translational regulations control transcription. Plant Science, 174(4): 420-431.
Melchiorre M, Quero GE, Parola R, Racca R, Trippi VS, Lascano R. 2009. Physiological characterization of four model Lotus diploid genotypes: L. japonicus (MG20 and Gifu), L. filicaulis, and L. burttii under salt stress. Plant Science,177(6): 618-628.
Melchiorre M, Quero GE, Racca RW, Lascano HR. 2008. Lotus RILs analyses under salt stress: Establishing discriminative growth conditions. Lotus Newsletter, 38(2): 99-100.
Miflin B. 2000. Crop improvement in the 21st century. Journal of Experimental Botany, 51(342): 1-8.
Milne I, Shaw P, Stephen G, Bayer M, Cardle L, Thomas WTB, Flavell AJ, Marshall D. 2010. Flapjack graphical genotype visualization. Bioinformatics, 26(24): 313 -3134.
Munns R. 2009. Strategies for crop improvement in saline soils. En: Ashraf M, Ozturk MÑ, Athar HR. [Eds.]. Salinity and water stress improving crop efficiency. Osnabrueck: Springer. (Springer series editor in Tasks for Vegetation Sciences; 44). pp. 99-110.
Munns R. 2002. Comparative physiology of salt and water stress. Plant Cell Environ, 25(2): 239-250.
Munns R, Tester M. 2008. Mechanisms of Salinity Tolerance. Annual Review of Plant Biology, 59(1): 651-681.
Munns R, Husain S, Rivelli AR, James RA, Condon AG, Lindsay MP, Lagudah ES, Schachtman DP, Hare RA. 2002. Avenues for increasing salt tolerance of crops, and the role of physiologically based selection traits. Plant and Soil, 247(1): 93-105.
Nelson MN, Moolhuijzen PM, Boersma JG, Chudy M, Wolko B, Lesniewska K, Bellgard M, Oliver RP, Swiecicki W, Cowling WA, Ellwood SR. 2010. Aligning a New Reference Genetic Map of Lupinus angustifolius with the Genome Sequence of the Model Legume, Lotus japonicus. DNA Research, 17(2): 73-83.
Pedrosa A, Sandal N, Stougaard J, Schweizer D, Bachmair A. 2002. Chromosomal Map of the Model Legume Lotus japonicus. Genetics 161 (4): 1661-1672.
Rascher U, Kuhn AJ, Matsubara S, Märtin LLA, Merchant A, Metzner R, Blossfeld S, Fiorani F, Jahnke S, Jansen M, Müller-Linow M, Nagel KA, Pieruschka R, Pinto F, Schreiber CM, Temperton VM, Thorpe MR, Van Dusschoten D, Van Volkenburgh E, Windt CW, Schurr U. 2011. Non-invasive approaches for phenotyping of enhanced performance traits in bean. Functional Plant Biology, 38 (12): 968-983.
Sánchez DH, Szymanski J, Erban A, Udvardi MK, Kopka J. 2010. Mining for robust transcriptional and metabolic responses to long-term salt stress: a case study on the model legume Lotus japonicus. Plant, cell & environment, 33(4): 468-480.
Sandal N, Jin, H Rodríguez-Navarro, DN, Temprano F, Cvitanich C, Brachmann A, Sato S, Kawaguchi M, Tabata S, Parniske M, Ruiz-sainz JE, Andersen SU, Stougaard J. 2012. A Set of Lotus japonicus Gifu x Lotus burttii Recombinant Inbred Lines Facilitates Map-based Cloning and QTL Mapping. DNA Research, 19(4): 317-323.
Sandal N, Krusell L, Radutoiu S, Olbryt M, Pedrosa A, Bachmair A, Ketelsen T, Stracke S, Sato S, Kato T, Parniske M, Tabata S, Stougaard J. 2002. A genetic linkage map of the model legume Lotus japonicus and strategies for fast mapping of New Loci. Genetics, 161(4): 1673-1683.
Sato S, Nakamura Y, Kaneko T, Asamizu E, Kato T, Nakao M, Sasamoto S, Watanabe A, Ono A, Kawashima K, Fujishiro T, Katoh M, Kohara M, Kishida Y, Minami C, Nakayama S, Nakazaki N, Shimizu Y, Shinpo S, Takahashi C, Wada T, Yamada M, Ohmido N, Hayashi M, Fukui K, Baba T, Nakamichi T, Mori H, Tabata S. 2008. Genome Structure of the Legume, Lotus japonicus. DNA Research, 15(4): 1-13.
Stougaard J, Beuselinck PR. 1996. Registration of GIFU B-129-S9 Lotus japonicus germplasm. Crop Science, 36(2): 476.
Tanksley SD. 1993. Mapping Polygenes. Annual Review of Genetics, 27(1): 205-233.
Tsubokura Y, Onda R, Sato S, Xia Z, Hayashi M, Fukushima Y, Tabata S, Harada K. 2008. Characterization of soybean genome based on synteny analysis with Lotus japonicus. Breeding Science, 58(2): 157-167.
Tuberosa R, Salvi S, Sanguineti MC, Landi P, Maccaferri M, Conti S. 2002. Mapping QTLs regulating morpho-physiological traits and yield : case studies , shortcomings and perspectives in drought-stressed maize. Annals of Botany, 89(7): 941-963.
Udvardi MK, Tabata S, Parniske M, Stougaard J. 2005. Lotus japonicus: legume research in the fast lane. Trends in Plant Science, 10(5): 222-228.
Universidad Nacional de Córdoba. 2010. InfoStat : software estadístico. Córdoba: Universidad Nacional de Córdoba. Versión actualizada: 29 diciembre 2012. Consultado 6 febrero 2013. Disponible en: http://www.infostat.com.ar.
Verslues PE, Agarwal M, Katiyar-Agarwal S, Zhu J, Zhu JK. 2006. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. The Plant Journal, 45(4): 523-539.
Wang W, Vinocur B, Altman A. 2003. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta, 218(1): 1-14.
Yamaguchi T, Blumwald E. 2005. Developing salt-tolerant crop plants: challenges and opportunities. Trends in Plant Science, 10(12): 615-620.
Zhang HX, Hodson JN, Williams JP, Blumwald E. 2001. Engineering salt-tolerant Brassica plants: characterization of yield and seed oil quality in transgenic plants with increased vacuolar sodium accumulation. Proceedings of the National Academy of Sciences of the United States of America, 98(22): 12832-12836.
Zhu H, Choi HK, Cook DR, Shoemaker RC. 2005. Bridging model and crop legumes through comparative genomics. Plant Physiology, 137(4): 1189-1196.