Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.16 no.2 Montevideo dic. 2012
Emisiones de CH4 y N2O en un arrozal: primeras medidas en el sistema productivo uruguayo
Irisarri Pilar1, Pereyra Virginia2, Fernández Ana2, Terra José3, Tarlera Silvana2
1Departamento de Biología Vegetal. Facultad de Agronomía. Universidad de la República. Garzón 809, CP 12900. Sayago. Montevideo, Uruguay.
2Laboratorio de Ecología Microbiana y Ambiental. Facultad de Química. Universidad de la República. Avenida General Flores 2124, 11800 Montevideo, Uruguay. Correo electrónico: starlera@fq.edu.uy
3Instituto Nacional de Investigación Agropecuaria, Treinta y Tres, Uruguay.
Recibido: 18/5/12 Aceptado: 4/9/12
Resumen
Los arrozales son fuente de dos importantes gases de efecto invernadero (GEI), metano y óxido nitroso. Como un paso inicial hacia la obtención de información local, se midieron las emisiones de CH4 y N2O del suelo y de las plantas de arroz mediante la técnica de la cámara estática en experimentos en invernáculo y a campo en el este de Uruguay. En el experimento en invernáculo, se estudió el efecto del momento de inundación (21 y 45 días después de la emergencia) y de la fertilización nitrogenada (0 y 50 kg N ha-1) sobre las emisiones. La inundación temprana y la fertilización nitrogenada tendieron a aumentar las emisiones de N2O. En el experimento a campo, se estudió el efecto de la cobertura invernal y de la fertilización nitrogenada (0 y 82 kg N ha-1). Se detectaron mayores flujos de CH4 durante la etapa reproductiva de la planta en el tratamiento fertilizado con cobertura invernal previa de raigrás. El flujo de N2O fue máximo después de los baños. Los resultados indican que el uso del cultivo de cobertura podría incrementar las emisiones de GEI durante el ciclo del arroz. A pesar de las distintas prácticas de manejo del cultivo empleadas en Uruguay, los flujos de CH4 y N2O se encuentran dentro de los valores informados previamente para arrozales de otras partes del mundo.
Palabras clave: SUELO INUNDADO CULTIVADO CON ARROZ, GASES DE EFECTO INVERNADERO, FERTILIZACIÓN N
Summary
CH4 and N2O Emissions in a Rice Field: First Measurements in the Uruguayan Productive System
Irrigated rice fields are major sources of two important greenhouse gases (GHG), methane and nitrous oxide. As an initial step towards obtaining local information, emissions of CH4 and N2O from rice paddy soil were measured by the static chamber technique in greenhouse and field experiments conducted in eastern Uruguay. In the greenhouse experiment, the effect of two flooding moments (21 and 45 days after emergency) and nitrogen fertilization (0 and 50 kg N ha-1) on gas emissions was studied. Early flooding and nitrogen fertilization tended to increase N2O emissions. In the field experiment, effect of winter soil cover crop and nitrogen fertilization (0 and 82 kg N ha-1) were tested. Higher CH4 fluxes were observed mainly during the reproductive stage of the plant in the N-fertilized treatment with ryegrass winter crop. N2O flux peaked at flushing. Results indicate that the use of cover crops might increase GHG emissions during the rice cycle. Despite differences in agronomic management practices employed in Uruguay, CH4 and N2O fluxes are within magnitudes previously reported for rice fields worldwide.
Key words: RICE PADDY SOIL, GREENHOUSE GASES, N FERTILIZATION
Introducción
Los suelos agrícolas son fuentes globales importantes de metano (CH4) y óxido nitroso (N2O) (IPCC, 2007). En Uruguay, el CO2 capturado por los montes forestales casi duplica su emisión, razón por la que CH4 y N2O resultan los principales gases de efecto invernadero (GEI). Se estima que la agropecuaria es responsable del 92,6 % de las emisiones de CH4 y de casi la totalidad de las de N2O (MVOTMA et al., 2010). Los gases de efecto invernadero (GEI) tienen diferente capacidad de calentamiento, basado en su impacto en la energía radiante y su duración en la atmósfera respecto al gas de referencia, el dióxido de carbono (CO2). El CH4 y el N2O tiene un potencial de calentamiento 25 y 298 veces mayor que el CO2 respectivamente, para una escala de tiempo de 100 años (IPCC, 2007).
El arroz es el principal cultivo irrigado en Uruguay, un 55% del área cultivada está en la zona Este del país y aproximadamente un 90% de la producción se exporta (ACA, 2011). En el inventario nacional de GEI emitidos se estima que el cultivo de arroz es responsable de un 4% del CH4 emitido en Uruguay (MVOTMA et al., 2010). Uno de los desafíos ambientales de los sistemas que incluyen el cultivo de arroz con inundación es reducir la emisión de GEI producidos principalmente por actividades microbianas. Las emisiones están fuertemente influenciadas por la fertilización nitrogenada, el manejo del suelo y de los residuos de la cosecha durante el barbecho y el manejo del agua de riego. El cultivo de arroz es considerado la principal fuente antropogénica global de CH4 (Jacobson, 2005). Las emisiones de CH4 dependen del cultivar de arroz (Kerdchoechuen, 2005), pero también aumentan por la incorporación de materia orgánica al suelo (Yagi y Minami, 1990; Bronson et al., 1997), y su mitigación se basa en la reducción del tiempo en que el cultivo permanece inundado (Yagi et al., 1996; Cai et al., 1997).
El N2O se produce mayoritariamente en la interfase entre suelo seco e inundado (Cai et al., 2001; Xing et al., 2002). Su emisión depende del drenado del suelo (Towprayoon et al., 2005) y se estimula con la fertilización nitrogenada (Bronson et al., 1997; Crutzen y Lelieveld, 2001). La emisión de CH4 resulta del balance entre las actividades de las arqueas metanogénicas, estrictamente anaeróbicas, y las bacterias metanótrofas, aeróbicas (Macalady et al., 2002). Por otra parte, el N2O es producto de las transformaciones microbianas incompletas de los compuestos nitrogenados incorporados al suelo como fertlizante, bajo condiciones óxicas (nitrificación) o anóxicas (desnitrificación principalmente y nitrificación desnitrificante) (Smith et al., 2003; Baggs y Philippot, 2011). El cultivo de arroz en Uruguay es único en el mundo ya que comparte el uso de suelos con pasturas para la ganadería y otros cultivos en rotación (ACA, 2011). El arroz integrado a esos sistemas produce altos rendimientos con aplicación de bajas dosis de agroquímicos y conserva la calidad del suelo (Deambrosi, 2003; Méndez et al., 2003). El comercio mundial presenta crecientes exigencias sobre los impactos ambientales de los procesos productivos y su documentación, incluyendo la exigencia de uso del agua, destino medioambiental de agroquímicos y emisión de GEI entre otros (Itoh et al., 2011). El objetivo de este trabajo fue obtener los primeros datos locales de emisiones de CH4 y N2O en el sistema particular de producción de arroz en nuestro país. Además se realizó una primera aproximación al impacto de algunas prácticas de manejo, fertilización nitrogenada, manejo del agua y coberturas invernales, sobre los flujos de estos GEI.
Materiales y métodos
Experimento en invernáculo
El experimento de invernáculo se desarrolló en el Instituto Nacional de Investigación Agropecuaria (INIA) del departamento de Treinta y Tres. Se sembró arroz (Oryza sativa L., cultivar «El Paso 144») en cajones de plástico con suelo tomado de los 0,30 m superiores en la Unidad Experimental «Paso de la Laguna» del INIA Treinta y Tres, con las siguientes características: textura franco limoso, pH (H2O) 5,2; N-NH4+ 0,3 mmol L-1; C orgánico 30-35 g kg-1 y materia orgánica 50-55 g kg-1. La densidad aparente del suelo fue 1,36 g cm-3. Este ensayo se realizó para evaluar los efectos del momento de inundación y la fertilización nitrogenada sobre las emisiones. Se utilizó un diseño de parcelas al azar, con cuatro repeticiones y dos cámaras en cada cajón.
Se colocaron 52 kg de suelo por cajón y se aplicó una fertilización basal con 120 kg ha-1 de fosfato de amonio (18-46-0). El arroz se sembró con una densidad de 180 kg ha-1 y las plántulas se regaron semanalmente hasta capacidad de campo. El tratamiento con nitrógeno consistió en la aplicación de urea 50 kg ha-1 al macollaje y a los 21 días después de la emergencia (DDE) de las plántulas. Las plantas de arroz emergieron nueve días después de la siembra. El tratamiento de manejo del agua consistió en dos fechas de establecimiento de la inundación, 21 DDE (inundación temprana) y 45 DDE (inundación tardía). El nivel de agua durante la inundación se mantuvo en 5-6 cm por encima del suelo hasta la cosecha, que se realizó a los 134 DDE.
Experimento de campo
El experimento se realizó en la Unidad Experimental Paso de la Laguna del INIA, (33º16´S, 54º16´W) durante la zafra de arroz 2008-09 para conocer el efecto de la inclusión de cultivos de cobertura invernal sobre las emisiones de CH4 y N2O durante el cultivo de arroz. El suelo era Albic Natraqualf (USDA, 1998) con tres años previos de descanso sin arroz. Las características físico-químicas del suelo se muestran en el Cuadro 1.
Los tratamientos fueron el arreglo factorial de dos manejos del suelo durante el invierno, raigrás (Lolium multiflorum Lam.) como cobertura o suelo desnudo, y dos dosis de fertilización nitrogenada, 0 y 82 kg N ha-1. El diseño fue de parcelas al azar de 10 m x 9,2 m con cuatro repeticiones y dos cámaras en cada parcela. El raigrás se sembró el 30 de marzo a una densidad de 20 kg de semillas ha-1, 10 días después de una aplicación de 1,5 kg ia ha-1 de glifosato (Terra et al., 2009). El tratamiento de suelo desnudo (sin vegetación) recibió el 20 de junio una segunda dosis de glifosato, además de la del 20 de marzo. En ambos tratamientos el barbecho químico se inició el 19 de setiembre con una aplicación de 2,5 kg ha-1 de glifosato. La materia seca total cosechada de raigrás fue 4940 kg ha-1 con una relación C/N de 47/1 (Terra et al., 2009). El laboreo del suelo se realizó el verano previo (enero 2008) y consistió en una pasada de excéntrica pesada, dos pasadas de rastra de discos y dos pasadas de landplane.
El cultivo de arroz (cv. INIA Olimar) se instaló el 13 de octubre con siembra directa a una densidad de 150 kg de semilla ha-1. La inundación se realizó 22 DDE y se mantuvo una lámina de agua de 10 cm hasta cinco días antes de la cosecha. Se realizaron dos baños previos a la inundación del cultivo, a los 1 y 4 DDE.
La fertilización nitrogenada fraccionada consistió en la aplicación, a la siembra, de fosfato de amonio (22 kg N ha-1, 23 DDE), urea al macollaje (21 DAE) 30 kg N ha-1 sobre suelo seco, y al primordio (51 DDE) 30 kg N ha-1. Los tratamientos sin N no recibieron ninguna aplicación de fertilizante nitrogenado.
Los parámetros de rendimiento como peso de grano ajustado al 13%, número de tallos m-2, granos por panoja, materia seca en etapas de floración y primordio, se evaluaron según Terra et al. (2009). La estimación del contenido de clorofila de las hojas del arroz se midió en la hoja superior más desarrollada con un SPAD 502 Plus Chlorophyll meter (Terra et al., 2009).
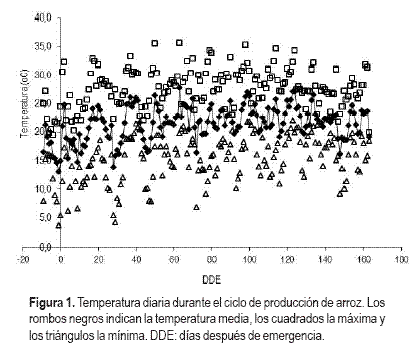
La información meteorológica se registró en la estación ubicada en «Paso de la Laguna». La temperatura promedio fue 21,5 °C durante el ciclo del cultivo (Figura 1) y la precipitación 576 mm, de los cuales solo se registraron 36 mm previo a la inundación. La amplitud térmica tuvo un valor promedio de 12 °C a lo largo del ciclo del arroz.
Muestro y mediciones de flujos de CH4 y N2O
Los flujos de gases emitidos se monitorearon usando la técnica de cámaras cerradas estáticas descritas para arroz por Lindau et al. (1991) en las fechas indicadas para cada experimento en las Figuras 3 y 4 y entre las 13 y 15 h. Las cámaras consistieron en bases de acero inoxidable de 40 cm de diámetro y 20 cm de altura parcialmente insertas (5 cm) en el suelo que permanecieron instaladas durante todo el ciclo de cultivo. En cada fecha de muestreo se colocaron cilindros de acrílico de 60 cm de altura sobre las bases con un sello de agua para evitar el escape de gases. Las cámaras contaban con un ventilador operado con una batería que se prendía cinco minutos antes de cada medición para asegurar la homogeneidad de la atmósfera dentro de la cámara y un dispositivo para equilibrar la presión interna y la externa (Figura 2). Las muestras de gases del interior de las cámaras se tomaron con jeringas plásticas de 25 mL a los tiempos 0, 30 y 60 minutos y se almacenaron en tubos con vacío (10mL) hasta su análisis. Se registraron la temperatura de las cámaras, la profundidad del agua de inundación y la altura del espacio de aire en cada cámara para calcular los flujos de gases con el tiempo. Las concentraciones de CH4 se analizaron con un cromatógrafo de gases Chrompack CP 9001 equipado con un detector FID (detector de ionización de llama). El análisis de N2O se realizó con un cromatógrafo de gases Shimadzu 14B modificado con detector ECD (de captura electrónica) descrito en Perdomo et al. (2009). La tasa de emisión de ambos gases se calculó según Watanabe et al. (2000): F = ñ.h(dC/dt); donde F corresponde a la tasa de emisión de N-N2O o C-CH4 en g ha-1 d-1; ñ es la densidad de N-N2O o C-CH4 corregida por la temperatura existente en el interior de la cámara de muestreo; h es la altura de la cámara desde el suelo o el nivel de agua, y dC/dt es el incremento de la concentración de N2O o CH4 dentro de la campana con el tiempo. Previamente al cálculo de tasas de emisión, se confirmó para cada caso la existencia de una relación lineal entre la concentración del gas correspondiente y el tiempo. La tasa de emisión obtenida para las repeticiones de cada tratamiento fue promediada para determinar el valor final de emisión por tratamiento.

El flujo integrado estacional emitido (Fie) se calculó a partir de las áreas bajo las figuras de emisiones de gases durante todo el tiempo del cultivo del arroz para cada una de las cámaras.
Análisis de suelo
Se colectaron muestras compuestas al azar de ocho cilindros de 0-10 cm de profundidad para determinar nitrato (NO3 -). Las muestras se secaron en estufa de aire forzado a 40 ºC, se pasaron por tamiz de 2 mm y el NO3- se analizó por colorimetría después de su extracción con KCl 2M en relación 5:1. El contenido de NO3- se determinó después de su reducción a través de una columna de Cd reacción de Griess-Ilosvay; (Mulvaney, 1996).
Análisis estadístico
Los datos de emisión obtenidos en los ensayos de invernáculo y campo fueron evaluados ajustando Modelos de Efectos Mixtos mediante el Software R (2009). Para el análisis de los resultados obtenidos en invernáculo, se consideraron los tratamientos (combinaciones de distintos momentos de inundación y niveles de fertilización nitrogenada), la covariable tiempo y su interacción como efectos fijos, mientras que las repeticiones fueron consideradas como efectos aleatorios. Los datos del ensayo de campo fueron analizados considerando la covariable tiempo, las coberturas invernales, el nivel de fertilización nitrogenada y la interacción entre estas dos últimas variables como efectos fijos. Se comparó mediante un análisis de varianza (ANOVA) el ajuste de modelos alternativos a los grupos de datos y se seleccionó el modelo más adecuado. Se aplicó un análisis de varianza (P=0,05) a los resultados obtenidos con el modelo finalmente ajustado.
Resultados y discusión
Ensayo en invernáculo
La Figura 3a muestra los flujos de CH4 de los experimentos en invernáculo. No se detectaron emisiones de CH4 durante el período de crecimiento vegetativo del arroz (0 a 50 DDE), independiente de la fecha de inundación. Este período abarcó hasta los 34 días después de la inundación en el tratamiento de inundación temprana y cinco días en la inundación tardía. En ambos tratamientos el estadio del arroz a los 50 DDE, cuando se detectó la emisión de CH4, era macollaje avanzado.
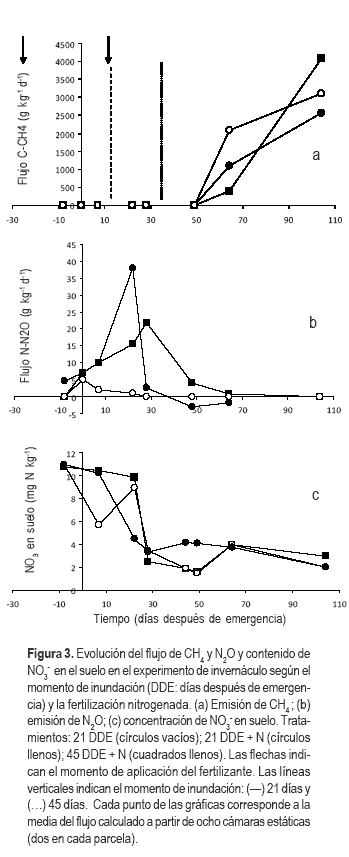
Para el tratamiento de inundación temprana, el primer valor de emisión fue detectado cinco semanas después de la inundación, mientras que para inundación tardía fue dos semanas después de inundado el cultivo. En esa fecha (64 DDE), con ambos tratamientos en estadio de iniciación de la floración, no se registraron diferencias significativas entre las emisiones. A los 104 DDE, el arroz estaba en etapa de floración en el tratamiento de inundación tardía, pero las plantas sometidas a inundación temprana estaban más adelantadas, en etapa de maduración. La práctica de adelantar el comienzo de la inundación ha sido reportada como promotora de la madurez del cultivo (Deambrosi, 2003). Coincidentemente con nuestros resultados, se ha comunicado que alrededor de un 90% del total del CH4 en todo el ciclo de cultivo se emite en floración, debido al máximo incremento de la biomasa en esa etapa (Holzapfel-Pschorn et al., 1986; Schütz et al., 1989; Neue et al., 1997).
En el Cuadro 2 se observa el efecto positivo de la fertilización nitrogenada sobre el rendimiento de arroz con inundación temprana. Sin embargo, las diferencias no fueron significativas en los flujos de CH4 entre estos tratamientos. Los resultados comunicados sobre el efecto de los fertilizantes-N minerales y la emisión de CH4 en arrozales inundados son contradictorios (Wassmann et al., 1993). Diferentes estudios han revelado que es un efecto relativamente complejo que aún no se comprende cabalmente (Bodelier et al., 2000), ya sea porque estimula o reprime las principales poblaciones microbianas involucradas en la generación y oxidación de CH4. Debe considerarse además que la fertilización no solo afecta a los microorganismos sino también a las plantas, agregando complejidad al resultado final. Estos resultados sugieren que los flujos de CH4 son dependientes de la etapa de desarrollo de la planta y que la inundación tendría una influencia indirecta en la emisión de CH4 al regular el ciclo del cultivo.
El pico más alto de N2O (38 g N ha-1 día-1) se registró en el tratamiento de inundación temprana al día siguiente de la fertilización con urea e inundación (Figura 3b) y este flujo fue significativamente diferente al de los demás tratamientos (p<0,01). Este evento coincidió con una disminución de la concentración de NO3- del suelo (Figura 3c). Este pico de emisión de N2O podría atribuirse a la aplicación de fertilizante-N si se compara con el tratamiento con la misma fecha de inundación pero sin fertilizar y en el que las emisiones de N2O permanecieron bajas y constantes a lo largo del ciclo del cultivo. Sin embargo, la inundación en sí misma contribuyó a este incremento de la emisión si comparamos ambos tratamientos fertilizados. En la misma fecha, para el tratamiento que permanecía sin inundar se registró menor flujo de N2O (14 g N ha-1 día-1).
Durante el período sin inundar, las emisiones de N2O probablemente se debieron a la nitrificación del NH4+. Cuando el suelo se inundó en forma temprana (21 DDE), los microorganismos desnitrificantes actuaron sobre el pool de NO3- liberado por la nitrificación produciendo N2O. La desnitrificación es considerada normalmente la principal fuente de N2O en los suelos (Kravchenko y Yu, 2006). El flujo de N2O disminuyó drásticamente después que el suelo permaneció inundado en forma permanente (lámina de agua de 10 cm) (Figura 3b), lo que puede atribuirse a la recaptura del N2O y reducción a N2 en condiciones de anaerobiosis estricta. De hecho, una de las formas de mitigar las emisiones de N2O que más se estudia actualmente es el aumento de la reducción de N2O a N2 (Baggs et al., 2010). En el tratamiento 45 DDE, la inundación se realizó con el arroz en macollaje tardío, cuando el NO3- disponible para la desnitrificación era menor debido probablemente a una mayor absorción por las plantas. Los flujos de N2O fueron apenas detectables durante el resto del ciclo del cultivo de arroz (Figura 3b).
Ensayo de campo
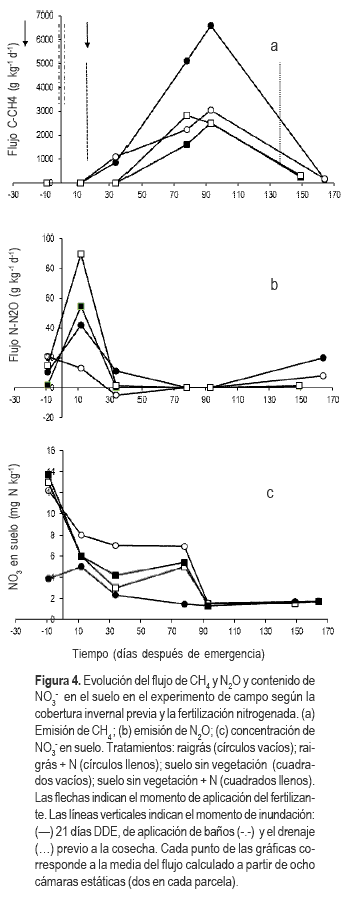
Los patrones de emisión de CH4 fueron similares para el cultivo de arroz con los dos manejos del suelo en el invierno previo: raigrás y suelo sin vegetación (Figura 4a). Sin embargo, la emisión de CH4 comenzó a registrarse dos semanas después de la inundación (34 DDE) en las parcelas que habían tenido raigrás como cobertura, mientras que en ese momento la emisión fue despreciable para las parcelas sembradas en suelo sin vegetación. De igual forma que en el ensayo de invernáculo, el flujo de CH4 aumentó en la fase reproductiva (inicio de floración, 78 DDE) y el pico máximo se registró a los 93 DDE (floración) en todos los tratamientos. Estos resultados concuerdan con reportes previos que mostraron una correlación positiva entre una alta producción de CH4 y la etapa de floración, debido al aumento de los exudados radicales orgánicos en este estadio de la planta (Holzapel-Pschorn et al., 1986).
En varios estudios se ha enfatizado en que el aumento de los flujos de CH4 en las etapas tardías del crecimiento de la planta sería causado por la proliferación de exudados radicales o productos de la autolisis de raíces (Holzapfel-Pschorn et al., 1986; Lindau et al., 1991; Neue y Sass, 1994; Chidthaisong y Watanabe, 1997). El Cuadro 3, indirectamente, ilustra este punto ya que en la floración se observó un aumento considerable en la materia seca de todos los tratamientos. Como una consecuencia de este aumento en la biomasa hubo una mayor disponibilidad de carbono descomponible proveniente de los exudados radicales que, a su vez sirven como fuente de carbono y energía para la microflora. Después de la cosecha (149 y 163 DDE, para suelo desnudo y raigrás respectivamente) se registraron muy pocas emisiones.
Se observó una interacción significativa (p=0,01) entre la cobertura con raigrás y la fertilización-N, con los mayores flujos de CH4 para el tratamiento de arroz fertilizado y con raigrás como cobertura invernal. Generalmente se considera que los diferentes agregados orgánicos estimulan el flujo de CH4 al aumentar el suministro de carbono para los metanógenos (Yagi et al., 1996; Bronson et al., 1997; Wassmann et al., 2000). Especialmente, si el material incorporado tiene una alta relación C/N, como en el caso del rastrojo de raigrás. La absorción de nutrientes por la planta deja menos N disponible para los microorganismos y por lo tanto el N podría estar limitando la actividad bacteriana.
El rendimiento de arroz del tratamiento con raigrás, independientemente de la dosis de N, fue menor (Cuadro 3). Ambos tratamientos presentaron menor acumulación de materia seca, número de panojas por m2 y granos por panoja. Por el contrario, la tendencia del contenido de clorofila fue opuesta, con los mayores valores observados en los tratamientos de raigrás independientemente de la fertilización. Recientemente, Baruah et al. (2010) han reportado una correlación positiva entre la emisión de CH4 y la actividad fotosintética.
Como se observa en Figura 4b se pudo detectar una emisión inicial de N2O en todos los tratamientos. Este pico de N2O ocurrió inmediatamente después de un baño en un momento en que los contenidos de NO3- del suelo habían disminuido (Figura 4c). En estas condiciones redox del suelo, tanto los organismos nitrificantes como los desnitrificantes podrían ser los principales productores de N2O (Müller et al., 2004). Aunque no hubo diferencias significativas, los tratamientos que habían tenido cobertura invernal mostraron una tendencia a reducir su emisión de N2O antes de establecida la inundación respecto al los suelos sin cobertura. De hecho, el uso de cultivos de no-leguminosas en invierno se ha postulado como un práctica efectiva para reducir las emisiones de N2O (Gomes et al., 2009), debido a una competencia con los microorganismos del suelo por el NO3- disponible. No hubo un efecto significativo de la fertilización con N sobre los flujos de N2O en ningún tratamiento. Generalmente se acepta que la emisión de N2O aumenta inmediatamente después de la fertilización en suelos secos (Bronson et al., 1997; Yagi et al., 1996; Cai et al., 1997). En el caso del arroz que se sembró directamente sobre el barbecho de raigrás, los microorganismos podrían haber inmovilizado N debido a la alta relación C/N del raigrás. Sin embargo Dobermann y Cassman (2002) han sugerido que el principal factor que afecta la emisión de N2O es la velocidad de recambio del N, tomando en cuenta la sincronización entre mineralización de N y absorción por la planta. La aplicación fraccionada de N, método recomendado de aplicación para este cultivo, probablemente aumente la eficiencia de uso del N por la planta (Irisarri et al., 2007), lo cual tiene una relación inversa con la emisión de N2O (Kroeze y Mosier, 2000). Un evento de un pequeño flujo de emisión de N2O se midió después de drenar el campo al final del cultivo. Este flujo podría deberse a la liberación del N2O atrapado en el suelo y a las condiciones redox óptimas para la producción de N2O. Los cultivos de no-leguminosas se han reportado como eficientes consumidores del NO3- residual del suelo (Gomes et al., 2009) y por lo tanto capaces de reducir sus pérdidas. De este modo, durante la etapa en que el cultivo de arroz no está ocupando el suelo, deben medirse las emisiones a efectos de considerar el sistema global.
Por último, ambos experimentos, en invernáculo y a campo, mostraron que la emisión de CH4 coincidió con la etapa reproductiva del arroz, mientras que la emisión de N2O estuvo más influenciada por las prácticas agrícolas tales como el manejo del agua, la fertilización nitrogenada y el uso previo del suelo. Aunque nuestros datos fueron obtenidos durante una sola zafra, con condiciones climáticas particulares, los resultados de los ensayos de invernáculo y de campo son consistentes.
Flujos estacionales
El Cuadro 4 muestra los flujos acumulados de CH4 y N2O a lo largo del ciclo del cultivo de arroz. Si bien las fechas de muestreo son escasas para sacar conclusiones definitivas, los flujos integrados de CH4 fueron en todos los casos por lo menos 18 veces mayores que los de N2O en equivalentes de CO2 (en 100 años). Aunque el N2O es un gas de efecto invernadero mucho más potente que el CH4 en términos de calentamiento global, su emisión estacional por hectárea fue mucho más baja.
El Fie (flujo integrado estacional emitido) de CH4 del arroz fertilizado posterior a una cobertura invernal con raigrás fue significativamente mayor que el de los demás tratamientos (Cuadro 4). Una posible explicación de este resultados es que la combinación de siembra directa, cobertura de raigrás y fertilización nitrogenada pudo haber aumentado el suministro de carbono a los organismos metanogénicos (Wassmann et al., 2000). En el caso del N2O, ninguno de los tratamientos registró una emisión estacional diferente al resto, aunque la alta variabilidad de los Fie pudo haber ocultado los efectos potenciales de los tratamientos. Debe considerarse además, que las tasas de emisión pueden estar sobreestimadas ya que las mediciones de los flujos se realizaron en el período más caluroso del día (13:00 -15:00 h), cuando ocurren las máximas tasas de emisión (Hou et al., 2000).
La mediana de las emisiones estacionales de otros arrozales irrigados en diferentes partes del mundo varía en un rango entre 34 g CH4 m-2 (China) a 25 g CH4 m-2 (USA). Nuestros datos estacionales oscilan entre 17 y 21 g CH4 m-2 para el arroz sembrado sobre suelo desnudo en invierno, y entre 32 y 64 g CH4 m-2 para el cultivo sembrado sobre la cobertura de raigrás. De acuerdo a nuestros resultados el establecimiento de una cobertura invernal de raigrás aumentó el flujo de CH4. Una revisión reciente de las emisiones de N2O de varios arrozales reporta medias estacionales de 0,667 ± 0,885 kg N ha-1, lo que revela la gran variabilidad en el flujo de este GEI y la consiguiente dificultad para comparar datos (Akiyama et al., 2005). Por otro lado, al comparar los valores de las emisiones por hectárea hay que considerar los altos rendimientos de arroz en Uruguay (8000 - 8500 kg ha-1; ACA 2011) y los rendimientos promedio de los países asiáticos (5000 kg ha-1, AFSIS). Esto resultaría en menores emisiones en equivalentes CO2 por kg de arroz en el caso de Uruguay, aunque sería necesario aumentar las fechas de muestreo para convalidar esta conclusión.
Las medidas de estos gases durante el transcurso del día y durante el invierno permitirían obtener datos de emisión anual que serían comparables a las emisiones reportadas por otros países.
Conclusiones
Esta primera aproximación a la emisión de GEI en arrozales uruguayos confirmó que el CH4 es el principal gas emitido y que los patrones de emisión de ambos gases tienen un comportamiento opuesto a lo largo del ciclo del cultivo. El arroz sembrado sobre una cobertura de raigrás y fertilizado con nitrógeno emitió más del doble de CH4 que el sembrado sobre suelo desnudo. Tanto en el ensayo de invernáculo como en el de campo las mayores emisiones de CH4 coincidieron con la etapa reproductiva del arroz, mientras que en el caso del N2O se produjeron en la fase vegetativa y estuvieron influenciadas por el manejo del agua y la fertilización nitrogenada. Estos resultados preliminares sobre el efecto de algunas prácticas de manejo del cultivo sobre las emisiones de GEI refuerzan la necesidad de contar con datos locales que contribuyan a elaborar el inventario nacional de GEI, el cálculo de la huella de C y el diseño de estrategias de mitigación de las emisiones.
Agradecimientos
Este proyecto fue financiado por INIA-FPTA Nº 238. Agradecemos por su colaboración en las mediciones a: Estefanía Geymonant, Mariana Urraburu, Leticia Pérez y Germán Pérez.
Bibliografía
ACA. 2011. Datos estadísticos [En línea]. Consultado 12 diciembre 2011. Disponible en: http://www.aca.com.uy/index.php?option=com_content&view=section& layout=blog&id=3&Itemid=9
Akiyama H, Yagi K, Yan X. 2005. Direct N2O emissions from rice paddy fields: summary of available data. Global Biogeochemical Cycles, 19(1): GB1005.
Baggs EM, Philippot L. 2011. Nitrous oxide production in the terrestrial environment. En: Moir JWB. [Ed.]. Nitrogen cycling in bacteria. Norkfolk: Caister Academic Press. pp. 211-232.
Baggs EM, Smales CL, Bateman EJ. 2010. Changing pH shifts the microbial source as well as the magnitude of N2O emissions form soil. Biology and Fertility of Soils 46: 793 – 805.
Baruah KK, Gogoi B, Gogoi P. 2010. Plant physiological and soil characteristics associated with methane and nitrous oxide emission from rice paddy. Physiology and Molecular Biology of Plants, 16: 79 – 91.
Bodelier PL, Rslev P, Henckel T, Frenzel P. 2000. Stimulation by ammonium-based fertilizers of methane oxidation in soils around rice roots. Nature, 403: 421 – 424.
Bronson KF, Neue HU, Singh U, Abao EB. 1997. Automated chamber measurements of methane and nitrous oxide flux in a flooded rice soil : I. Residue, nitrogen, and water management. Soil Society of American Journal, 61: 981- 987.
Cai Z, Laughlin R, Stevens RJ. 2001. Nitrous oxide and dinitrogen emissions from soils under different water regimes and straw amendment. Chemosphere, 42: 113 – 121.
Cai ZC, Xing GX, Yan XY, Xu H, Tsuruta H, Yagi K, Minami K. 1997. Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilisers and water management. Plant and Soil, 196: 7 -14.
Chidthaisong A, Watanabe I. 1997. Methane formation and emission from flooded rice soil incorporated with 13C-labeled rice straw. Soil Biology and Biochemistry, 29: 1173 – 1181.
Crutzen PJ, Lelieveld J. 2001. Human impact on atmosphere chemistry. Annual Review of Earth and Planetary Sciences, 29: 17 – 45.
Deambrosi E. 2003. Rice production system in Uruguay and its sustainability. En: Proceedings of the III International Conference of Temperate Rice; Punta del Este, Uruguay. Montevideo: INIA. p. 19.
Dobermann A, Cassman KG. 2002. Plant nutrient management for enhanced productivity in intensive grain production systems of the United States and Asia. Plant and Soil, 247: 153 – 175.
Gomes J, Bayer C, de Souza F, Costa M, de Cássia Piccol Zanatta JA, Beber Vieira FC, Six J. 2009. Soil nitrous oxide emissions in long-term cover crops-based rotations under subtropical climate. Soil Tillage Research, 106: 36 – 44.
Holzapfel-Pschorn A, Conrad R, Seiler W. 1986. Effect of vegetation on the emission of methane from submerged paddy soil. Plant and Soil, 92: 223 -233.
Hou AX, Chen GX, Wang ZP, Van Cleemput O, Patrick WH. 2000. Methane and nitrous oxide emissions from a rice field in relation to soil redox and microbiological processes. Soil Science Society of America Journal, 64: 2180 – 2186.
IPCC. 2007. Climate change 2007 : The physical science basis. Cambridge : Cambridge University Press. pp. 137 - 153.
Irisarri P, Gonnet S, Deambrosi E, Monza J. 2007. Cyanobacterial inoculation and nitrogen fertilization in rice. World Journal of Microbiology and Biotechnology, 23: 237 – 243.
Itoh M, Sudo S, Mori S, Saito H, Yoshida T, Shiratori Y, Suga S, Yoshikawa N, Suzue Y, Mizukami H, Mochida T, Yagi K. 2011. Mitigation of methane emissions from paddy fields by prolonging midseason drainage. Agriculture, Ecosystems and Environment, 141: 359 – 372.
Jacobson MZ. 2005. Atmospheric pollution: history, science and regulation. New York : Cambridge University Press. pp. 3 – 226.
Kerdchoechuen O. 2005. Methane emission in four rice varieties as related to sugars and organic acids of roots and root exudates and biomass yield. Agriculture, Ecosystems and Environment, 108: 155 -163.
Kravchenko IK, Yu K. 2006. Relationship between major soil properties and culturable microorganisms affecting methane and nitrous oxide dynamics in rice soils. Archives of Agronomy and Soil Science, 52: 607-615.
Kroeze C, Mosier AR. 2000. New estimates for emission of nitrous oxide. En: van Ham JEA [Ed.]. Non-CO2 Greenhouse gases: scientific understanding, control and implementation. Netherlands : Kluwer Academic Publishers. pp. 45 – 64.
Lindau CW, Bollich PK, Delaune RD, Patrick WH, Law VJ. 1991. Effect of urea fertilizer and environmental factors on CH4 emissions from a Louisiana, USA rice field. Plant and Soil, 136: 195 – 203.
Macalady JL, MacMillan AMS, Dickens AF, Tyler SC, Scow KM. 2002. Populations dynamics of type I and II methanotrophs bacteria in rice soils. Environmental Microbiology, 4: 148 – 157.
Méndez R, Deambrosi E, Blanco P, Saldain N, Pérez de Vida F, Gaggero M. 2003. Technology for rice seeding with reduced or no-till for the Eastern zone of Uruguay. En: Proceedings of the III International Conference of Temperate Rice; Punta del Este, Uruguay. Montevideo: INIA. p. 64.
Müller C, Stevens RJ, Laughlin RJ, Jäger HJ. 2004. Microbial processes 1 and the site of N2O production in a temperate grassland soil. Soil Biology and Biochemistry, 36: 453 - 461.
Mulvaney RL. 1996. Chemical Methods Nitrogen - inorganic forms. En: Methods of Soil Analysis : Part 3. Madison : Soil Science Society of America. pp. 1162-1171.
MVOTMA, DINAMA, Unidad de Cambio Climático. 2010. Tercera comunicación nacional a la conferencia de las partes en la convención marco De las naciones unidas sobre cambio climático: Resumen ejecutivo. Montevideo: MVOTMA. 34 p.
Neue H-U, Sass RL. 1994. Trace gas emissions from rice fields. En: Prinn RG. [Ed.]. Global atmospheric-biospheric chemistry. New York : Plenum Press. pp. 119-147.
Neue H-U, Wassmann R, Kludze HK, Bujun W, Lantin RS. 1997. Factors and processes controlling methane emissions from rice fields. Nutrient Cycling in Agroecosystems, 49: 111-117.
Perdomo C, Irisarri P, Ernst O. 2009. Nitrous oxide emissions from an uruguayan argiudoll under different tillage and rotation treatments. Nutrient Cycling in Agroecosystems, 84: 119 – 128.
Schutz H, Holzaptel-Pschorn H, Conrad R, Rennenberg H, Seiler W. 1989. A three-year continuous record on the influence of day time season and fertilizer treatment on methane emission rates from an Italian rice paddy. Journal of Geophysical Research, 94: 16405-16416.
Smith KA, Ball T, Conen F, Dobbie KE, Massheder J, Rey A. 2003. Exchange of greenhouse gases between soil and atmosphere : interactions of soil physical factors and biological processes. European Journal of Soil Science, 54: 779 – 791.
Terra J, Sanchez A, Deambrosi E, Méndez R. 2009. Efecto de cultivos de cobertura invernal sobre la respuesta a N en el cultivo de arroz en siembra directa. En: Arroz : Resultados experimentales 2009 - 2010. Montevideo : INIA. (Actividades de Difusión ; 611). pp. 9 – 20.
Towprayoon S, Smakgahn K, Poonkaew.S 2005. Mitigation of methane and nitrous oxide emissions from drained irrigated rice fields. Chemosphere, 59: 1547 – 1556.
USDA. 1998. Keys to Soil Taxonomy. 8th ed. Washington : USDA. 326p.
Wassmann R, Neue HU, Lantin RS, Makarim K, Chareonsilp N, Buendia LV, Rennenberg H. 2000. Characterization of methane emissions from rice fields in Asia : II. Differences among irrigated, rainfed and deepwater rice. Nutrient Cycling in Agroecosystems, 58: 13 – 22.
Wassmann R, Papen H, Rennenberg H. 1993. Methane emission from rice paddies and possible mitigation strategies. Chemosphere, 26: 201 – 217.
Watanabe T, Chairoj P, Tsuruta H, Masarngsan W, Wongwiwatchai C, Wonprasaid S, Cholitkul, W, Minami K. 2000. Nitrous oxide emissions from fertilized upland fields in Thailand. Nutrient Cycling in Agroecosystems, 58: 55 – 65.
Xing GX, Shi SL, Shen GY. 2002. Nitrous oxide emissions from paddy soil in three rice based cropping systems in China. Nutrient Cycling in Agroecosystems, 64: 35 – 43.
Yagi K, Minami K. 1990. Effect of organic matter application 1 on methane emission from some Japanese paddy fields. Soil Science and Plant Nutrition, 36: 599 – 610.
Yagi K, Tsuruta H, Kanda K, Minami K. 1996. Effect of water management on methane emission from a Japanese rice field: automated methane monitoring. Global Biogeochemical Cycles, 10: 255 – 267.