Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.16 no.1 Montevideo jun. 2012
Nota Técnica
Evaluación de métodos para desinfectar semillas de tomate contra cancro bacteriano (Clavibacter michiganensis subsp. michiganensis)
1Instituto Nacional de Investigación Agropecuaria. INIA Las Brujas. Ruta 48 kilómetro 10. Rincón del Colorado. Canelones. CP90200. Correo electrónico: dmaeso@inia.org.uy
Recibido: 1/9/11 Aceptado: 15/12/11
Resumen
El cancro bacteriano es una enfermedad muy importante del tomate en Uruguay. Su agente causal, Clavibacter michiganensis subsp. michiganensis (Cmm) sobrevive en semillas y, dada su eficacia en diseminarse por agua, labores, etc., el uso de semilla infectada, aún en baja proporción, se traduce rápidamente en grandes pérdidas. Se recomiendan varios métodos de desinfección de semilla, pero su eficacia aún no se conoce en nuestras condiciones. En este trabajo se compararon: el baño con hipoclorito de sodio (1% de cloro activo, un minuto) y el baño en agua a 50 ºC, 25 minutos con y sin baño previo a 37 ºC, 10 minutos, frente a un testigo sin tratar. La semilla fue colectada de plantas enfermas (cultivares: Coral, 2006 y Acuario 2007 y 2008). Se realizaron nueve pruebas (aproximadamente 760 semillas por tratamiento). Se evaluaron: germinación y vigor de plántulas. Las plantas resultantes fueron cultivadas en sustrato estéril a 23 ºC y cuando alcanzaron 20 cm, se realizaron aislamientos de tallo en NAD. A las colonias similares a Cmm, se les efectuaron las pruebas: gram (método de KOH), hipersensibilidad en Mirabilis jalapa y DAS-ELISA. No se observaron efectos adversos en germinación o vigor de las plántulas. El porcentaje de plantas con detección de Cmm por DAS ELISA fue: 5,6 (testigo), 2,03 (agua 50 ºC), 1,0 (agua 50 ºC con baño previo) y 0,98 (hipoclorito de sodio). La detección de Cmm fue sensiblemente menor en los plantines de semilla desinfectada, confirmando el beneficio de esta medida en el manejo de la enfermedad.
Palabras clave: CANCRO BACTERIANO, DESINFECCIÓN DE SEMILLAS, CLAVIBACTER MICHIGANENSIS SUBSP. MICHIGANENSIS
Summary
Evaluation of Methods to Disinfect Tomato Seeds Against Bacterial Canker (Clavibacter michiganensis subsp. michiganensis)
Bacterial canker is a very important tomato disease in Uruguay. Its causal agent, Clavibacter michiganensis subsp. michiganensis (Cmm) is seed borne and, due to its high dissemination by water, labor, etc., the use of infected seed, even in low proportion, can lead to huge losses. Several methods for seed disinfection are recommended, but their effect in our conditions is not known yet. Sodium hypochlorite (1% active chlorine, one minute) and hot water baths (50 ºC, 25 minutes with and without a 37 ºC, 10 minutes pre-treatment) were compared to a non treated control. Seed was collected from diseased plants of Coral (2006) and Acuario (2007 and 2008) cultivars. Nine experiments were performed (approximately 760 seeds per treatment). Germination percentages and seedling vigor were evaluated. Seedlings were transplanted to sterilized substrate and cultivated at 23 ºC. Isolation to NAD was performed from stems when plants were over 20 cm high. Bacterial colonies similar to Cmm, were separated and subjected to the following tests: gram (KOH method), hypersensitive reaction on Mirabilis jalapa and DAS-ELISA. Isolates that did not show typical Cmm reaction were discarded. No detrimental effects were observed on the germination or in the vigor of seedlings. The percentage of plants on which Cmm was detected by DAS ELISA was: 5.6 (control), 2.03 (50 ºC water bath), 1.0 (50 ºC water bath with 37 ºC pre-bath) and 0.98 (sodium hypochlorite). Cmm detection was remarkably lower on seedlings derived from disinfected seed, confirming the benefits of this measure in the management of this disease.
Key words: BACTERIAL CANKER, SEED DISINFECTION, CLAVIBACTER MICHIGANENSIS SUBSP. MICHIGANENSIS
Introducción
El cancro bacteriano del tomate causado por el actinomycete gram positivo Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. (Familia Microbacteriaceae) (Gartemann et al., 2008) es una de las enfermedades más importantes del cultivo en Uruguay. C. michiganensis subsp. michiganensis es transmitida por semilla. A pesar que los niveles de transmisión por esta vía determinados experimentalmente son generalmente bajos (Grogan y Kendrick, 1953; Tsiantos, 1987; Chang et al., 1992a), la eficiente diseminación de esta bacteria mediante agua, labores, implementos, suelo, etc. una vez introducida en un cultivo, se traduce en que en poco tiempo la infección sea generalizada y el cultivo sea destruido (Chang et al., 1991). La semilla enferma generalmente da origen a plantas aparentemente sanas las cuales al llegar a la madurez desarrollan síntomas (OEPP/EPPO, 2003; Chang et al., 1992b). Éstos comienzan como un marchitamiento unilateral de las hojas basales que finalmente necrosan y la enfermedad asciende en la planta para finalmente marchitarla totalmente. Al cortar el tallo en la zona afectada los tejidos vasculares se encuentran oscurecidos, pudiendo observarse degradación de los mismos e incluso de la médula. El marchitamiento puede estar o no acompañado de cancros en tallos y pecíolos y manchas necróticas en los folíolos. Una vez introducida en el cultivo se registran síntomas derivados de la transmisión epifita, los cuales se manifiestan como necrosis marginal de la lámina y la característica mancha en ojo de pájaro de los frutos (Jones et al., 1991).
En Uruguay, la mayor parte de la semilla de tomate utilizada es introducida desde el exterior y, muchas veces, producida en zonas donde esta enfermedad es endémica. A pesar que las compañías productoras someten sus semillas a desinfección, es recomendable realizar una desinfección en condiciones locales previo a su plantación. Dado el costo del material, es muy importante ajustar y conocer la eficacia de los métodos antes de llevarlos a la práctica a gran escala. Se citan muchos métodos para desinfección de la semilla de tomate, entre ellos, los más utilizados son los baños con hipoclorito de sodio, diversos ácidos y en agua caliente, los cuales poseen diferente efectividad. Este último método, si bien es de difícil implementación a nivel de cultivo, tiene la ventaja de actuar interna y externamente sobre la semilla (Ivey y Miller, 2005; Fatmi et al., 1991; Miller e Ivey, 2005; Shoemaker y Echandi, 1976; Xu et al., 2009).
El objetivo de este trabajo fue el de conocer la eficiencia de algunos de estos procedimientos: baño con hipoclorito de sodio (recomendado en el Programa de Producción Integrada de Tomate en Uruguay) (Banchero et al., 2008) y en agua caliente para disminuir la transmisión de la enfermedad por semilla.
Materiales y métodos
Se realizaron nueve experimentos (12/9/2006, 11/1, 7/5, 18/5, 30/5, 3/7, y 15/10/2007, 12/6 y 21/10/2008) utilizando semilla colectada de frutos de plantas enfermas de los cultivares híbridos de tomate Coral (7/7/2006), y Acuario (19/4/2007 y 21/3/2008) que presentaban marchitamiento ocasionado por infección sistémica y reacción positiva para C. michiganensis subsp. michignanesis en la prueba ELISA.
La semilla fue separada manualmente de la pulpa, enjuagada en agua, secada a temperatura ambiente y guardada en refrigerador hasta su uso.
Los tratamientos evaluados fueron los siguientes:
1. Sin desinfección.
2. Baño en agua caliente: 50 ºC por 25 minutos y enfriado inmediato en agua corriente por cinco minutos.
3. Ídem a 2 pero con un baño previo de 10 minutos a 37 ºC.
4. Baño en hipoclorito de sodio 1% de cloro activo (solución 10% /agua 1:9) por un minuto, luego enjuagado en abundante agua corriente por cinco minutos.
Los tratamientos con agua caliente fueron realizados en un baño marca Thomastat TN 22 (Thomas Kagaku, Co. Ltd. Japón). Se utilizaron lotes de entre 25-100 semillas por experimento las cuales se colocaron en doble capa de gasa para realizar la desinfección. Para ajustar la metodología, previamente se sometieron 100 semillas del cultivar Loica producida por INIA Las Brujas por tratamiento.
Una vez tratadas, las semillas se hicieron germinar en placas de petri tapizadas con papel de filtro. Se evaluó el porcentaje de germinación en cada tratamiento y la altura de las plántulas obtenidas. Luego de cinco días de germinadas aproximadamente, éstas fueron transplantadas a almácigas con sustrato (Biolan, Finlandia) esterilizado mediante autoclave a 120 ºC por 20 minutos y se cultivaron en cámara de crecimiento a 23 ºC y 12 horas de luz.
Luego que las plantas adquirieron una altura de 20 cm y, por lo menos dos brotes, se tomó una muestra de un centímetro del ápice del tallo, la cual fue desinfectada superficialmente con alcohol y macerada en un mililitro de agua destilada estéril. Se transfirieron 20 µl de ese macerado a medio agar nutriente dextrosa (NAD) (Lelliott y Stead, 1987) en placas de plástico de 12 pocillos (Corning, Cellbind, EE.UU.), las cuales se incubaron a 23 ºC. Las colonias bacterianas con características similares a C. michiganensis subsp. michiganensis (crecimiento lento, lisas, brillantes, redondeadas y amarillas con márgenes enteros) (Alvarez y Kaneshiro, 2005) fueron aisladas y mantenidas individualmente en placas de petri. Posteriormente se les efectuó la prueba gram mediante el método de KOH (Powers, 1995). Aquellas gram positivas fueron analizadas mediante la prueba DAS ELISA utilizando el antisuero monoclonal MAb Cmm1 incluido en un kit comercial y siguiendo el protocolo de uso recomendado (AGDIA Inc., Elkhard, IN46514, EEUU) (Alvarez et al., 1993; Kaneshiro et al., 2006). La patogenicidad de las colonias gram positivas correspondientes a los tres últimos experimentos (15/10/07, 12/6 y 21/10/08) fue comprobada mediante infiltración de hojas de Mirabilis jalapa (Gitaitis, 1990; Alarcon et al., 1998).
A los efectos de realizar el análisis estadístico, cada experimento fue tomado como una repetición, utilizándose el análisis de variancia para bloques al azar y las separación de medias por la prueba Duncan mediante el paquete estadístico Infostat® 2009. Los resultados obtenidos con las diferentes técnicas se correlacionaron entre sí y su relación fue estimada mediante regresión simple usando el mismo paquete estadístico.
Resultados
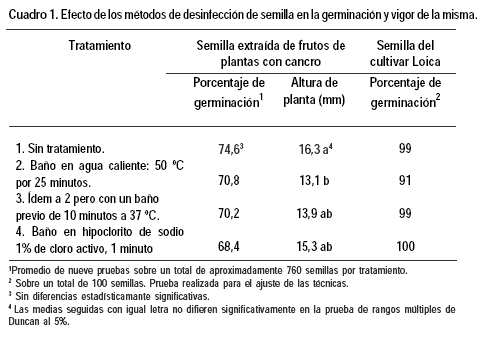
No se encontraron diferencias estadísticamente significativas entre los porcentajes de germinación determinados para la semilla sometida a los diferentes tratamientos. Tampoco se vieron efectos negativos frente a la semilla no desinfectada para la prueba preliminar con semilla del cultivar Loica (Cuadro 1).
Sin embargo, se observó disminución en la altura de la plántula obtenida siendo los tratamientos con agua caliente los que presentaron plántulas de menor tamaño. La altura de las plántulas provenientes de semilla desinfectada con hipoclorito de sodio no fue estadísticamente diferente a las del control sin tratar (Cuadro 1).
En el Cuadro 2 se muestran los porcentajes de plantines derivados de la semilla ensayada en los que se aislaron colonias con características similares a C. michiganensis subsp. michiganensis. En todas las evaluaciones, los mayores porcentajes de detección fueron observados en los plantines provenientes de semilla sin tratar.
En aproximadamente el 13% de los plantines del tratamiento testigo se aislaron bacterias con características similares a Clavibacter michiganensis subsp. michiganensis mientras que en los plantines de semilla tratada ese número fue menor (7-9%), destacándose los tratamientos de desinfección con hipoclorito de sodio y con agua caliente con baño previo a 37 ºC (estadísticamente diferente del resto).
Sin embargo, solamente entre el 43-67%, dependiendo del tratamiento, de esas bacterias aisladas presentaron reacción de gram positiva. En cuanto al porcentaje de bacterias gram positivas determinado, se mantuvo la tendencia anterior separándose los valores correspondientes a los tratamientos de los del testigo (3-5% frente a 9%).
Los porcentajes de bacterias que reaccionaron en la prueba ELISA con los antisueros monoclonales específicos para C. michiganensis subsp. michiganensis, fueron a su vez menores. Para éstos también se separaron estadísticamente los valores obtenidos en plantines de semilla tratada y sin tratar (1-2% frente a 6%). En este caso se puede inferir que de las bacterias gram positivas aisladas solamente entre un 30% y 60% correspondían al patógeno bajo análisis en los tratamientos y el testigo respectivamente.
En el Cuadro 3 se observan los resultados obtenidos en los últimos tres experimentos en los cuales se efectuó a las bacterias gram positivas aisladas la reacción de hipersensibilidad en Mirabilis jalapa. Los resultados de estas pruebas coinciden con los encontrados en el total observándose una similar tendencia en la separación de los tratamientos. De acuerdo a estos resultados solamente el 34-69% de las bacterias gram positivas aisladas serían patogénicas de acuerdo a la hipersensibilidad observada en M. jalapa.
Los resultados de la prueba ELISA muestran que en estos experimentos entre el 40-54% y el 81% de las bacterias gram positivas aisladas (en los tratamientos y el testigo respectivamente) reaccionaron con el antisuero para C. michiganensis subsp. michiganensis, valores un poco superiores a los determinados en el total de los experimentos. Sin embargo, de la comparación de estos coeficientes con las reacciones de hipersensibilidad en M. jalapa podemos inferir que alrededor del 80% de ellas presentarían patogenicidad (existirían algunos aislamientos en el tratamiento con hipoclorito que no reaccionaron por serología).
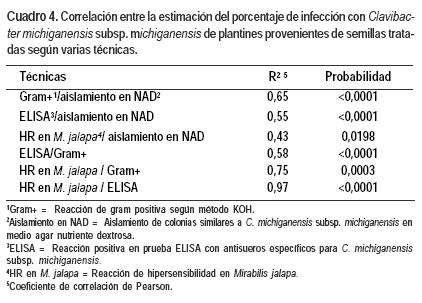
Al correlacionar los resultados de la estimación del probable porcentaje de infección con C. michiganensis subsp. michiganensis entre las diferentes técnicas vemos que en general existe una buena coincidencia entre los estimadores, siendo todos los coeficientes de determinación estadísticamente altamente significativos (Cuadro 4). La mayor asociación se encontró entre la determinación del patógeno por serología y la reacción de hipersensibilidad y la menor entre esta reacción y el aislamiento en NAD.
No se encontraron diferencias significativas al analizar los tratamientos separando los dos orígenes de semilla utilizados en los parámetros evaluados por lo que la información se presenta en forma conjunta.
Discusión
Los resultados obtenidos confirman el beneficio de someter las semillas de tomate a tratamientos de desinfección para prevenir la infección de los plantines derivados de ellas. Estos resultados concuerdan con los encontrados por Dhavantari (1989), Shoemaker y Echandi (1976) y Fatmi et al. (1991). Estos autores recomiendan además otros métodos no evaluados en el presente reporte (ácido clorhídrico, fermentación con la pulpa, acetato cúprico acidificado, etc.) así como diferente concentración de los desinfectantes, temperaturas superiores y mayor duración del proceso de desinfección.
La detección del patógeno en plantines aún luego de la desinfección, genera la necesidad de seguir ampliando el espectro de métodos para la desinfección, aumentar la dosis, y la duración de los procedimientos para obtener una recomendación eficaz.
Sin embargo, la mejora del poder desinfectante no deberá ir acompañada de efectos nocivos sobre la semilla. En estos experimentos no se observaron alteraciones en el poder germinativo de la semilla tratada pero sí cierta disminución en la altura de plántula en el germinador, principalmente en el tratamiento con agua caliente sin acostumbramiento previo. Por ese motivo, hasta no contarse con alternativas mejores evaluadas, por el momento, basados en la información obtenida en este trabajo, solamente podrían ser recomendados a nivel productivo el baño en hipoclorito de sodio (1% cloro activo por un minuto) y el baño en agua caliente a 50 °C por 25 minutos con acostumbramiento previo por diez minutos a 37 °C.
El haber efectuado la prueba con semillas provenientes de plantas enfermas con infección sistémica pudo contribuir a que no se pudiera obtener la erradicación total del patógeno al enfrentar los tratamientos a condiciones extremas, que poco probablemente ocurrirían en condiciones productivas.
Otro factor que pudo haber afectado la eficacia de los tratamientos es el procedimiento usado para extraer la semilla del fruto. El mismo no incluyó un tratamiento que eliminara totalmente los restos de fruto adheridos a ésta. Según Pradhanang y Collier (2009) la presencia de restos disminuye mucho el efecto de la desinfección favoreciendo la permanencia de bacterias.
Los porcentajes de detección de la bacteria en plantines fueron inferiores a los reportados por Dhavantari (1989) (82%) y Tsiantos (1987), en semilla de plantas enfermas sin tratar. Este último autor señala que el porcentaje de detección de bacterias en semilla es afectado por las condiciones ambientales y el método de determinación utilizado y que, además, la presencia del patógeno en la semilla no siempre se traduce en plantas infectadas.
Según Bogo et al. (2002), la infección de Clavibacter michiganensis subsp. michiganensis en semillas de morrón se distribuiría en el pericarpio, el endocarpio y el embrión en una relación aproximada de 7:1:1. La distribución interna del patógeno desestimularía el uso de métodos de desinfección superficial frente a tratamientos que, como el baño en agua caliente, alcanzan el interior de la semilla. A pesar de ello, muchos trabajos han obtenido buenos resultados con la desinfección superficial, al igual que el presente, en que la desinfección con hipoclorito de sodio mostró efectos similares al baño en agua caliente. Quizás eso pueda explicarse por la preponderancia relativa de la infección externa sobre la interna, tal como lo reportan Bogo et al. (2002), y a la existencia de un mecanismo de infección del plantín a partir de las bacterias existentes en la cubierta de la semilla hacia la raíz y los cotiledones durante la germinación (Xu, 2010).
La detección del patógeno en plantines asintomáticos coincide con lo encontrado por Gitaitis et al. (1991), quienes utilizando una metodología similar comprobaron su capacidad de ser fuente de rápida diseminación de la enfermedad por las tareas en cultivo. Shirakawa et al. (1991) y Tsiantos (1987) reportaron la presencia de 103-104 CFU/g del patógeno en brotes y 104-108 CFU/plantín proveniente de semilla naturalmente infectada, respectivamente.
El hecho que los plantines infectados no siempre muestren síntomas o tengan un período variable de latencia (Chang et al., 1992b), desde el punto de vista de manejo de la enfermedad realza la importancia de la desinfección de la semilla para evitar la introducción de la enfermedad en un cultivo. Chang et al. (1991), indican un incremento en 10% de la enfermedad en cultivo cada 0,1% de aumento en la infección asintomática de los plantines en almácigo y mencionan que una infección de semilla del orden de 0,01-0,05% (1-5 semillas en 10000) es capaz de iniciar una epidemia en las condiciones del medio oeste de los EE.UU.
Ninguno de los métodos de detección utilizados en este experimento alcanzan ese nivel de detección (1-5 semillas infectadas en 10.000). Por esa razón se utilizó la detección en plantines de semillas de plantas infectadas sistémicamente. Estos niveles de sensibilidad se logran por técnicas moleculares como la reacción en cadena de la polimerasa con la cual también se ha comprobado el beneficio del buen origen sanitario de la semilla y su desinfección (Hadas et al., 2005).
En el presente trabajo se sobrestimó la infección con Clavibacter michiganensis subsp. michiganensis al realizar el aislamiento en medio agar nutriente dextrosa a partir de plantas, lo cual no se ajusta a la recomendación del uso de medios semiselectivos como procedimiento standard para el aislamiento de este patógeno (OEPP/EPPO, 2003). Al comparar los resultados obtenidos mediante nuestra metodología con otras más específicas se observa que, al no trabajar con medios selectivos, se aisló un porcentaje importante de bacterias que si bien presentaban características de colonias similares, no correspondían al patógeno en estudio (entre un 60-80% si comparamos con los resultados obtenidos con la prueba ELISA). Esto se tradujo en una menor asociación entre el porcentaje de bacterias similares a C. michiganensis subsp. michiganensis aisladas en NAD y el porcentaje de detección serológica (R2 = 0,55) o de reacción de hipersensibilidad (R2 = 0,43), parámetros específicos de este patógeno, a pesar de que dicha asociación fuera estadísticamente significativa. Otro aspecto a tener en cuenta es que no todas las bacterias con esta morfología presentaron reacción gram positiva.
Samish y Etinger-Tulczynska (1963) y Jurkevitch y Shapira (2000) reportan el aislamiento de numerosas bacterias a partir de tejidos de tomate entre las que se incluían especies patógenas y saprofitos además de C.michiganensis subsp. michiganensis. Kaneshiro et al. (2006) en aislamientos a partir de semilla de tomate mencionan varias bacterias similares a C. michiganensis subsp. michiganensis, que no reaccionaron con el antisuero monoclonal Cmm1 (Microbacterium saperdae, M. laevaniformans, Sanguibacter keddieii, Curtobacter citreum, C. pusillhum).
Estos mismos autores y Alvarez et al. (2005) determinaron que un porcentaje importante (81%) de los aislamientos detectados por serología en semilla eran no virulentos o hipovirulentos. En nuestro estudio ese porcentaje fue mucho menor (si consideramos como virulencia el desarrollo de lesiones de hipersensibilidad en M. jalapa) lo cual puede deberse al haber trabajado con bacterias aisladas de plantas y no de semillas. Eso se tradujo en una alta correlación entre el porcentaje de bacterias con reacción serológica frente a antisueros específicos para el patógeno y aquellas que presentaban reacción de hipersensibilidad (R2 = 0,97).
La formación de lesiones necróticas en M. jalapa, inducida por una proteína elicitante del patógeno (Alarcon et al., 1998) es aceptada como una buena medida de la patogenicidad de los aislamientos (Gitaitis, 1990). Por esa razón no se utilizó la inoculación en tomate, ya que, dada la variabilidad del período de latencia en este huésped, hubiera implicado prolongar la duración de la prueba. Tsiantos (1987) menciona una latencia de 70-75 días en invernadero, lo cual no aportaría información relevante al objetivo del trabajo, o sea, medir la efectividad de los métodos de desinfección de semilla frente a C. michiganensis subsp. michiganensis independientemente de su patogenicidad. El significado de las cepas hipovirulentas o no virulentas en el manejo ha sido ya tratado por Alvarez et al. (2005).
Este trabajo permite concluir que por el momento, para la forma en que se realiza el cultivo de tomate en Uruguay, es conveniente la desinfección de la semilla comercial ya sea utilizando hipoclorito de sodio a las dosis y tiempos evaluados o a través del baño en agua caliente. Las técnicas de laboratorio utilizadas para estimar la infección de plantines con este patógeno resultaron ser complementarias y útiles por lo que serán empleadas en posteriores trabajos epidemiológicos tendientes a desarrollar un paquete de medidas para el manejo integrado del cancro del tomate en las condiciones de Uruguay
Bibliografía
Alarcon C, Castro J, Muñoz F, Arce-Johnson P, Delgado J. 1998. Protein(s) from the gram-positive bacterium Clavibacter michiganensis subsp. michiganensis induces a hypersensitive response in plants. Phytopathology, 88(4): 306 - 310.
Alvarez A, Kaneshiro W. 2005. Virulence in bacterial plant pathogens: Significance of diversity in populations that cause bacterial canker of tomato. Consultado agosto 2011. Disponible en: http://www.oardc.ohio-state.edu/sallymiller/TDW%20Presentations/AAlvarez%20TDW2005.pdf.
Alvarez A, Kaneshiro W, Vine BG. 2005. Diversity of Clavibacter michiganensis
subsp. michiganensis populations in tomato seed : What is the significance? Acta Horticulturae, 695: 205 - 214.
Alvarez A, Derie M, Benedict A, Gabrielson R. 1993. Characteristics of a monoclonal antibody to Clavibacter michiganensis subsp. michiganensis. Phytopathology, 83(12): 1331.
Banchero L, González P, Paullier J, Arboleya J, Campelo J, Maeso D. 2008. Programa de producción integrada. Normas de producción de tomate a campo. Consultado agosto 2011. Disponible En: http://www.inia.org.uy/online/files/basesdatos/file_18052009101141.pdf.
Bogo A, Takatsu A, Boff MIC, do Amarante CVT. 2002. Relaçao entre métodos de inoculaçao de sementes de pimentao por Clavibacter michiganensis subsp. michiganensis, causadora do cancro bacteriano. Revista de Ciencias Agroveterinarias, 1(2): 102 - 107.
Chang RJ, Ries SM, Pataky JK. 1992a. Local sources of Clavibacter michiganensis subsp. michiganensis in the development of bacterial canker of tomato. Phytopathology, 82(5): 553 - 560.
Chang RJ, Ries SM, Pataky JK. 1992b. Effects of temperature, plant age, inoculum concentration, and cultivar on the incubation period and severity of bacterial canker of tomato. Plant Disease, 76(11): 1150 - 1155.
Chang RJ, Ries SM, Pataky JK. 1991. Dissemination of Clavibacter michiganensis subsp. michiganensis by practices used to produce tomato transplants. Phytopathology, 81(10): 1276 - 1281.
Dhavantari BN. 1989. Effect of seed extraction methods and seed treatments on control of tomato bacterial canker. Canadian Journal of Plant Pathology, 11: 400 - 408.
Fatmi M, Schaad NW, Bolkan HA. 1991. Seed treatments for eradicating Clavibacter michiganensis subsp. michiganensis from naturally infected tomato seeds. Plant Disease, 75(4): 383 - 385.
Gitaitis RD, Beaver RW, Voloudakis AE. 1991. Detection of Clavibacter michiganensis subsp. michiganensis in symptomless tomato transplants. Plant Disease, 75(8): 834 - 838.
Gitaitis RD. 1990. Induction of a hypersensitivelike reaction in four-o’clock by Clavibacter michiganensis subsp. michiganensis. Plant Disease, 74(1): 58 - 60.
Gartemann KH, Abt B, Bekel T, Burger A, Engemann J, Flügel M, Gaigalat L,Goesmann A, Gräfen I, Kalinowski J, Kaup O, Kirchner O, Krause L, Linke B, McHardy A, Meyer F, Pohle S, Rückert C, Schneiker S, Zellermann EM, Pühler A, Eichenlaub R, Kaiser O, Bartels D. 2008. The Genome Sequence of the Tomato-Pathogenic Actinomycete Clavibacter michiganensis subsp. michiganensis NCPPB382 Reveals a Large Island Involved in Pathogenicity. Journal of Bacteriology, 190(6): 2138 - 2149.
Grogan RG, Kendrick JB. 1953. Seed transmission, mode of overwintering and spread of bacterial canker of tomato caused by Corynebacterium michiganense. (Abstr.) Phytopathology, 43: 473.
Hadas R, Krtzman G, Klietman F, Gefen T, Manulis, S. 2005. Comparison of extraction procedures of the detection threshold for Clavibacter michiganensis subsp. michiganensis in tomato seeds. Plant Pathology, 54: 643 - 649.
Ivey ML, Miller SA. 2005. Evaluation of hot water seed treatment for the control of bacterial leaf spot and bacterial canker on fresh market and processing tomatoes. Acta Horticulturae, 695: 197 -204.
Jones JB, Jones JP, Stall RE, Zitter TA. 1991. Compendium of tomato diseases. St. Paul : American Phytopathological Society. 73p.
Jurkevitch EJ, Shapira G. 2000. Structure and colonization dynamics of epiphytic bacterial communities and of selected component strains on tomato (Lycopersicon esculentum) leaves. Microbial Ecology, 40: 300 - 308.
Kaneshiro W, Mizumoto C, Alvarez A. 2006. Differentiation of Clavibacter michiganensis subsp. michiganensis from seed-borne saprophytes using ELISA, Biolog and 16S rDNA sequencing. European Journal of Plant Pathology, 116: 45 - 56.
Lelliot R, Stead D. 1987. Methods in Plant Pathology : Methods for the Diagnosis of Bacterial Diseases of Plants. Vol. 2. Oxford : Blackwell Scientific Publications. 216p.
Miller SA, Ivey ML. 2005. Hot Water and Chlorine Treatment of Vegetable Seeds to Eradicate Bacterial Plant Pathogens. En: Ohio State University Extension Fact Sheet. Consultado agosto 2011. Disponible en: http://ohioline.osu.edu/hyg-fact/3000/3085.html.
OEPP/EPPO. 2003. Quarantine pest Prepared by CABI and EPPO for the EU under Contract 90/399003 Data Sheets on Quarantine Pests.Clavibacter michiganensis subsp. michiganensis. Consultado agosto 2011.
Disponible en: http://www.eppo.org/QUARANTINE/bacteria/Clavibacter_m_michiganensis/CORBMI_ds.pdf.
Powers EM. 1995. Efficacy of the Ryu nonstaining KOH technique for rapidly determining Gram reactions of food-borne and waterborne bacteria and yeasts. Annals of Applied Microbiology, 61(10): 3756 - 3758.
Pradhanang PM, Collier G. 2009 How effective is hydrochloric acid treatment to control Clavibacter michiganensis subsp. michiganensis contamination in tomato seed? Acta Horticulturae, 808: 81 - 86.
Samish Z, Etinger-Tulczynska R. 1963. Distribution of bacteria within the tissue of healthy tomatoes. Applied Microbiology, 11: 7 - 10.
Shirakawa T, Sasaki T, Ozaki K. 1991. Ecology and control of tomato bacterial canker and detection methods for its pathogen. Japan Agricultural Research Quarterly, 25: 27 - 32.
Shoemaker PB, Echandi E. 1976. Seed and plant bed treatments for bacterial canker of tomato. Plant Disease Reporter, 60: 163 - 166.
Tsiantos J. 1987. Transmission of bacterium Corynebacterium michiganense pv. michiganense by seeds. Journal of Phytopathology, 119: 142 - 146.
Xu X. 2010. Seed Transmission of Clavibacter michiganensis subsp. michiganensis and development of strategies to control the pathogen in seed. (Tesis doctoral). Ohio : Ohio State University. Consultado agosto 2011. Disponible en: http://etd.ohiolink.edu/send-pdf.cgi/Xu%20Xiulan.pdf?osu1291083855.
Xu X, Bennett M, Miller SA. 2009. Evaluation of seed treatments to prevent bacteria canker in greenhouse tomato. Phytopathology, 99: S145.