Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.15 no.2 Montevideo dic. 2011
Micorrizas arbusculares en dos gramíneas nativas de Uruguay en áreas con y sin pastoreo
Parodi Gerardo, Pezzani Fabiana1
1Ecología. Unidad de Sistemas Ambientales. Facultad de Agronomía. Universidad de la República.
Av. E. Garzón 810 C.P. 12900. Montevideo. Uruguay. Correo electrónico: fabiana@fagro.edu.uy
Recibido: 2/12/10 Aceptado: 7/7/11
Resumen
Numerosos trabajos han evidenciado que los hongos micorrizógenos arbusculares (HMA) poseen efectos benéficos sobre las plantas. En Uruguay no existen antecedentes que consideren la asociación entre HMA con especies de los pastizales naturales, el principal ecosistema del país. En este sentido, aumentar el conocimiento de las interacciones planta-herbívoro-microorganismos es importante para entender el funcionamiento del ecosistema pastizal. En este trabajo nos enfocamos en las interacciones entre dos gramíneas nativas (Nassella neesiana, C3, de ciclo invernal, y Coelorhachis selloana, C4, estival) y HMA nativos que colonizan sus raíces, para estudiar la dinámica estacional de la micorrización bajo regímenes contrastantes de pastoreo. Los resultados muestran que los porcentajes de micorrización observados en C. selloana fueron mayores en relación a N. neesiana, lo cual concuerda con estudios en otras partes del mundo en donde las especies C4 muestran mayor presencia micorrícica que las C3. En segundo lugar, se observó que la colonización micorrícica en función de la estación del año fue congruente con el ciclo de C. selloana, que mostró un incremento en la colonización en verano, esperable para una gramínea estival. Para la especie invernal, N. neesiana, la presencia de estructuras de HMA fue muy escasa. Finalmente, aunque no se encontró una relación significativa entre la micorrización y el tratamiento, exclusión al pastoreo y pastoreo, C. selloana mostró una tendencia a una mayor colonización por HMA bajo pastoreo.
Palabras clave: MICORRIZAS ARBUSCULARES, PASTIZALES NATURALES, NASSELLA NEESIANA, COELORHACHIS SELLOANA
Summary
Arbuscular Mycorrhizas in Two Native Grasses of Uruguay in Grazed and Ungrazed Areas
Arbuscular mycorrhiza fungi (AMF) have been reported to have positive effects on plants. Since for Uruguay there are no studies of associations between AMF and native species in natural grasslands, research on mycorrhiza interactions has gained in importance as grasslands are the major Uruguayan ecosystem. In addition, it has been suggested that our understanding about grassland ecosystems would be improved by extending current knowledge on the interactions between grasses, their associated microorganisms and herbivores. Therefore, this work was aimed at comparatively studying the interaction between two native grasses (the cool-season C3 Nassella neesiana, and the warm-season C4 Coelorhachis selloana) and the native AMF associated to their roots, as well as the seasonal dynamic of mycorrizal colonization in grazed and ungrazed areas. Results show, at first, that root colonization was higher in C. selloana than in N. nassella. It agrees with previous studies, which suggests that C4 species are more colonized by AMF than C3 ones. Second, colonization by AMF in C. selloana was congruent with its life cycle, because this warm-season species showed the highest values in summer. Regarding the cool-season N. nassella, it showed a slight higher colonization in summer, when it presents less photosynthetic activity. Third, though we didn’t find a significant effect of grazing treatment on AMF colonization, C. selloana grazed- plants presented higher colonization of fungi structures.
Key words: ARBUSCULAR MYCORRHIZAS, NATURAL GRASSLANDS, NASSELLA NEESIANA, COELORHACHIS SELLOANA
Introducción
La asociación micorrícica constituye uno de los sucesos biológicos de mayor importancia para el normal funcionamiento de las plantas y los ecosistemas terrestres en general, y de relevancia en los sistemas agrarios (Brundrett, 1991, 2002; Vogelsang et al., 2006; Smith y Read, 2008). La palabra micorriza (del griego mykes-hongo, rhiza-raíz) define las asociaciones simbióticas que se establecen entre ciertos hongos y la raíz de las plantas. Existen varios tipos de micorrizas, los que han sido clasificados siguiendo criterios estructurales, funcionales y taxonómicos, destacándose dos tipos principales: ectomicorrizas y endomicorrizas. Las endomicorrizas, se forma en las raíces de la mayoría de las plantas terrestres (van der Heijden et al., 1998; Smith y Read, 2008). Un tipo de endomicorriza son las micorrizas arbusculares, que desarrollan estructuras específicas llamadas arbúsculos los cuales intervienen principalmente en el intercambio de nutrientes entre ambos simbiontes (Brundrett, 2002). En las endomicorrizas, la simbiosis micorrícica arbuscular consiste en una interacción interespecífica entre una amplia variedad de hongos pertenecientes al phylum Glomeromycota (hongos micorrizógenos arbusculares, HMA) y las raíces de las plantas de un gran número de familias (Brundrett, 2004). Actualmente este phylum está integrado por 10 familias con 14 géneros (Schüssler, 2010). Aproximadamente el 80% de las especies de plantas vasculares forman micorrizas arbusculares (Smith y Read, 2008), siendo esta la forma de asociación más abundante en zonas áridas y semiáridas particularmente (Allen, 1989).
Desde la perspectiva fitocéntrica se ha demostrado que este tipo de interacción puede variar entre parasítica y mutualista en función de la relación costo-beneficio, para la planta y para el hongo (Johnson et al., 1997; Klironomos, 2003; Pezzani et al., 2006) dependiendo de la especie de planta, genotipo del hongo y del ambiente abiótico (Sapp, 2004).
La importancia de los HMA radica en su capacidad para incrementar la adquisición de nutrientes beneficiosos para las plantas. Una de las principales funciones que cumplen los HMA es la de extender la superficie de absorción en el suelo a través de sus hifas, lo cual hace que las plantas micorrizadas incrementen la captación de nutrientes minerales, particularmente fósforo (P) (Sanders y Tinker, 1971; Sanders y Fitter, 1992; Jayachandran y Shetty, 2003; Smith y Read, 2008) y algunos otros elementos poco móviles en el suelo. También se ha observado que reducen la tensión fisiológica causada por microorganismos patógenos de la raíz (Azcón-Aguilar y Barea, 1992; Newsham et al., 1995; Auge, 2001; Borowicz, 2001; Sikes et al., 2009) y amortiguan el estrés hídrico (Wallace, 1987; Auge, 2001), esencialmente importante en ambientes con baja disponibilidad de agua. A cambio, los HMA reciben carbohidratos por parte de la planta hospedera (Smith y Read, 2008).
En relación a la absorción de P por parte de los HMA se ha demostrado que las hifas, además de explorar un gran volumen de suelo (lo cual se ve facilitado por sus pequeños diámetros que oscilan entre 2 y 10 μm, Tinker et al., 1992), pueden sobrepasar la zona de agotamiento de nutrientes que se genera alrededor de la raíz, adquirir P en zonas no accesibles para las raíces y luego transferirlo a las mismas (Harley, 1989). Una vez dentro de las hifas, el P se transporta a mayor velocidad que en el suelo (Sanders y Sheikh, 1983). Asimismo, la producción de ácidos orgánicos y fosfatasas por parte de las hifas extraradicales catalizan la liberación de P soluble (Koide y Kabir, 2000; Wang et al., 2004). Otros estudios han demostrado experimentalmente que el resultado de la interacción entre HMA y las plantas depende de la concentración de P disponible en el suelo (Bethenfalvay et al., 1983; Bethenfalvay y Dakessian, 1984) y los mayores beneficios para las plantas se observaron en un rango limitado de concentración de P (4 a 12 mg kg-1).
Con respecto al rol de los HMA en la absorción de nitrógeno, los estudios no han mostrado un patrón claro (Grogan et al., 2000; Treseder y Allen, 2002), aunque recientemente se ha encontrado que las micorrizas participan activamente en la absorción de nitrógeno para las plantas (Govindarajulo et al., 2005).
A lo largo de su ciclo de vida, los HMA desarrollan diferentes estructuras, tanto intra como extraradicales. En el suelo, forman hifas extraradicales y esporas; éstas últimas presentan paredes rígidas y resistentes las cuales les permiten afrontar condiciones ambientales desfavorables posibilitando su permanencia en el suelo por largos periodos. Dentro de la raíz se forman hifas y arbúsculos, y muchas especies de HMA también forman vesículas. Los arbúsculos son los responsables de la transferencia bidireccional de nutrientes entre los simbiontes y las vesículas son estructuras globosas e irregulares que actúan como órganos de reserva de lípidos (Smith y Read, 2008).
Existen estudios que muestran una influencia significativa de los HMA en la estructuración de comunidades vegetales en los ecosistemas terrestres (Bethlenfalvay y Dakessian, 1984; Grime et al., 1987; van der Heijden et al., 1998; van der Heijden, 2002; Koide y Dickie, 2002; Ferrol et al, 2004; Landis et al., 2005). Particularmente en pastizales se ha encontrado que gramíneas características de estos sistemas presentan un grado importante de colonización por HMA y responden favorablemente a dicha asociación (Hetrick et al., 1990; Hartnett y Wilson, 1999, Hartnett, 2002).
El efecto del pastoreo sobre la colonización de las plantas por HMA ha sido estudiado tanto a nivel de la comunidad vegetal como a nivel específico. A este último nivel, los efectos han sido contradictorios dependiendo de la intensidad de pastoreo y de la especie vegetal considerada. Se ha encontrado que bajo regímenes intensos de pastoreo la intensidad de colonización disminuye (Daft y El-Giahmi, 1978; Bethlenfalvay y Dakessian, 1984; Bethlenfalvay et al., 1985; Trent et al., 1988; Hetrick et at., 1990; Gehring y Whitham 1994, Gehring 2002), mientras que en sistemas pastoriles con moderada intensidad de pastoreo la colonización no es afectada (Reece y Bonham, 1978; Borowicz, 1993; Busso et al., 2001; Lugo et al., 2003; Saito et al., 2004; Pietikäinen et al., 2005) o aumenta (Wallace, 1981, 1987; Bayne et al., 1984; Eom et al., 2001; Kula et al., 2005; Wearn y Gange, 2007). En un estudio con herbivoría simulada (tallos cortados a 2 cm del suelo), se encontró que el aumento de la frecuencia de corte de Bromus inermis (Poaceae) disminuyó la colonización por HMA porque se redujo la cantidad de fotosintatos disponibles para el hongo (Klironomos et al., 2004).
En plantas que poseen HMA, se ha observado que puede existir relación entre la magnitud de la colonización micorrícica y ciertos caracteres del hospedante como el ciclo de vida (Roumet et al., 2006), el estadio fenológico (Hetrick et al., 1988, 1992), la vía de asimilación del carbono en el caso de gramíneas (tipo C3 y C4) (Hetrick et al., 1988, 1990; Wilson y Hartnett, 1998; Lugo et al., 2003) y la arquitectura de la raíz (Fitter, 1987; Hetrick et al., 1992; Roumet et al. 2006). Se ha encontrado que el mayor diámetro de raíces fibrosas se vincula con un mayor índice de colonización (Reinhardt y Miller, 1990). En general se espera que aquellas especies o grupos de especies que poseen sistemas radicales con altos valores de frecuencia de ramificación, alta densidad de raíces y raíces muy largas, como en muchas graminoides (Koide, 1991; Brundrett, 2002), sean menos dependientes de la asociación con HMA, aunque esto no siempre se relaciona con una menor colonización (Smith et al., 2003).
La diferencia en el porcentaje de micorrización para plantas con mecanismos fotosintéticos distintos radica en sus diferentes sistemas radicales, relacionados con la estrategia de la planta para conseguir agua y nutrientes. Las gramíneas C3 y C4 coexisten en el mismo hábitat pero difieren significativamente en su fenología, morfología radical y en su dependencia micorrícica. Se ha observado una mayor micorrización en especies C4 en relación a las C3 (Hetrick et al., 1988, 1990).
En Uruguay son escasos los antecedentes sobre micorrizas (Montañez, 2005), y no existe ninguno que considere su asociación con comunidades de pastizales naturales ni con las gramíneas nativas. La formación vegetal predominante es el campo natural (pastizales naturales), que ocupa aproximadamente el 70% del territorio, donde la ganadería, particularmente extensiva, es la práctica más común. Las gramíneas nativas son el principal recurso fitogenético de los pastizales naturales. Recientemente se ha determinado que el número de gramíneas nativas es de 340 especies, entre las cuales 41% poseen mecanismo fotosintético C3 y 59% C4 y hay 2 especies con mecanismo fotosintético intermedio C3-C4 (Cayssials, 2010).
El objetivo general de este trabajo fue estudiar la presencia de hongos micorrizógenos arbusculares en gramíneas de una comunidad de campo natural del Uruguay, y algunas de las variables que influyen en la asociación gramínea-hongo mediadas por el pastoreo. Específicamente nos centramos en analizar la presencia de estructuras fúngicas en dos especies de gramíneas nativas, una C3 de ciclo invernal, y otra C4, de ciclo estival. En ambas especies estudiamos el efecto de la variación estacional y del pastoreo en la colonización por HMA.
Esperamos encontrar un mayor porcentaje de micorrización en la especie C4 en relación a la C3. Asimismo se prevé que el porcentaje de micorrización difiera a lo largo del año en función del ciclo de las especies vegetales. Tomando en cuenta que el régimen de pastoreo es un factor que influye en la asociación micorrícica y que en el área de estudio la intensidad de pastoreo es baja, esperamos encontrar un leve incremento o ausencia del efecto en la intensidad de colonización por parte de los HMA.
Materiales y métodos
El presente estudio se llevó a cabo en la Reserva Privada de Flora y Fauna “El Relincho”, Departamento de San José, Uruguay, ubicado en la Región Centro-Sur del país (34°19’S; 57°02’W). Las parcelas seleccionadas para este estudio pertenecen a uno de los pares de parcelas clausura-pastoreo existente en el establecimiento, sin registro de historia agrícola. La parcela excluida al pastoreo tiene aproximadamente 15 años de clausura, mientras que en la pastoreada la intensidad de pastoreo es baja, con una carga aproximada de 0,5 UG/ha y la práctica es de ganadería extensiva.
Para esta investigación se seleccionaron dos especies de gramíneas nativas: Nassella neesiana (Trin. y Rupr.) Barkworth’, y Coelorhachis selloana (Hack.) A. Camus. Ambas especies son frecuentes en las comunidades de campo natural de Uruguay, y particularmente han sido registradas de forma abundante en el sitio de estudio para este trabajo, tanto en las parcelas bajo pastoreo como en las no pastoreadas (Altesor et al., 2005). N. neesiana es una gramínea nativa, perenne, de ciclo invernal y de mecanismo fotosintético C3. C. selloana es una gramínea nativa y perenne pero su ciclo es estival y de mecanismo fotosintético C4. Ambas han sido reconocidas por su calidad como buenas forrajeras, clasificándose según sus tipos productivos a N. neesiana como pasto tierno-fino y a C. selloana como pasto tierno (Rosengurtt, 1979). En relación a como responden al pastoreo, N. neesiana no muestra respuesta y C. selloana es decreciente bajo pastoreo (Altesor et al., 2005).
Se tomaron muestras de raíces de las dos especies de gramíneas seleccionadas, bajo régimen de pastoreo y de clausura. En cada estación, primavera (octubre 2008), verano (enero 2009), otoño (mayo 2009) e invierno (julio 2009), se seleccionaron (espacialmente separados para evitar que se tratara de ramets de una misma planta) cinco individuos de N. neesiana y cinco de C. selloana pertenecientes a cada uno de los dos tratamientos. Se separaron las raíces de la parte aérea y se almacenaron en vinagre para su posterior procesamiento.
En el laboratorio, las raíces fueron lavadas y aclaradas en una solución de KOH al 10 %, y se tiñeron con azul de tripano a través del método propuesto por Koske y Gemma (1989). Se examinaron 30 segmentos de la raíz de cada individuo (aproximadamente de 1 cm de largo), cubriendo un total de 90 observaciones por individuo, buscando la presencia de estructuras de HMA (hifas, vesículas, arbúsculos, y esporas). En cada segmento se hicieron tres observaciones: dos en los extremos y una en la parte central. Las observaciones se hicieron con un microscopio Nikon modelo HFX-DX. Se calculó la colonización de la raíz como el cociente entre el número de campos con presencia de estructuras de HMA y el número total de campos observados; esto se calculó para cada estructura fúngica en particular y para el porcentaje total de colonización por HMA.
El porcentaje de colonización por HMA fue analizado mediante un análisis de varianza de tres vías, usando las especies, las estaciones y el tratamiento como factores. Los análisis se hicieron con el programa estadístico InfoStat (Infostat, 2009).,
La distribución de los datos de porcentaje de colonización (total y de cada estructura fúngica) no fue normal (pruebas de Shapiro - Wilkins y Levene). Para normalizar dicha distribución los datos se transformaron mediante la raíz cuadrada. Se realizó una prueba de Tukey para el factor estaciones.
Resultados
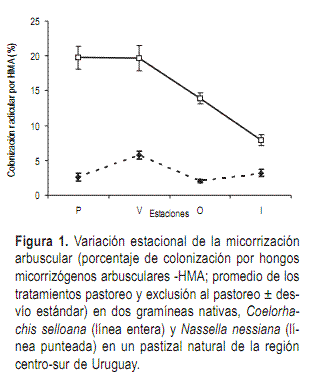
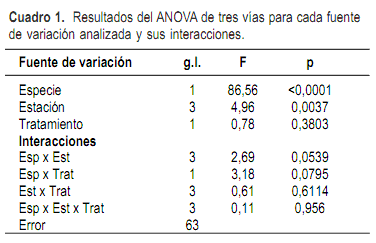
Las dos especies analizadas (N. neesiana y C. selloana) exhibieron la presencia de HMA asociados a sus raíces, siendo la especie C. selloana, de ciclo estival y metabolismo C4, la que mostró de forma significativa mayor presencia de HMA (Figura 1 y Cuadro 1).
Los porcentajes de micorrización mostraron diferencias significativas en relación a la estación del año (Figura 1, Cuadro 1). Si bien hay diferencias entre las especies, en ambos casos la micorrización fue mayor en verano. El factor especie explica un 48,7% de la variación y la estación un 8,4%.
El pastoreo (tratamiento) no tuvo efecto significativo sobre la micorrización de las especies analizadas (Cuadro 1).
Cuando se evaluaron las posibles interacciones entre las distintas variables estudiadas (tratamiento, especie y estación) se encontró que la interacción especie x estación fue marginalmente significativa (Cuadro 1). Las restantes interacciones, especie x tratamiento, estación tratamiento y especie x estación x tratamiento no fueron significativas.
Cuando se analizó el efecto de la estación para cada especie por separado, en el caso de N. neesiana este factor no fue significativo Sin embargo, esta especie mostró el mayor porcentaje de micorrización en verano (6,75% en promedio para ambos tratamientos), mientras que en primavera, otoño e invierno la micorrización fue escasa y similar en los tres casos. El efecto de la estación en C. selloana fue significativo (Cuadro 1). De acuerdo a la prueba de Tukey, la colonización fue significativamente menor en invierno en relación a primavera y verano, mientras que en otoño la colonización no difiere significativamente de las restantes estaciones.
El análisis del tratamiento (pastoreo vs. exclusión) para cada especie por separado no mostró efectos significativos en ninguno de los dos casos. Pero cabe resaltar que C. selloana mostró una tendencia a un mayor porcentaje de micorrización bajo régimen de pastoreo en todas las estaciones del año (Figura 2a). Esta especie bajo pastoreo alcanzó porcentajes de colonización de sus raíces de aproximadamente 23% en primavera y verano; dicho porcentaje disminuyó en la época fría: 15% en otoño y 8% en invierno. Bajo exclusión al pastoreo el máximo porcentaje alcanzado en C. selloana fue también en primavera y verano cercano al 15%. Contrariamente, en N. neesiana, si bien hubo muy escasa presencia de HMA, mostró un incremento en la colonización bajo exclusión al pastoreo en primavera, otoño e invierno, pero este patrón no se mantuvo durante todo el año ya que en verano la mayor colonización ocurrió bajo exclusión (Figura 2b).
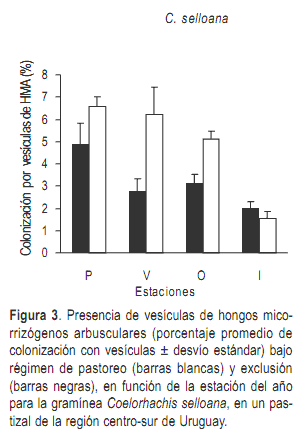
Las estructuras fúngicas que se observaron en este trabajo corresponden a hifas y vesículas, no lográndose observar otras estructuras características de los HMA como los arbúsculos. Probablemente no se haya logrado una buena tinción de las raíces para poder observar estas estructuras. La colonización con vesículas de HMA mostró un marcado predominio en las raíces de la especie C. selloana con respecto a N. neesiana (por lo cual solo se graficaron los valores para la primera), aunque en general se encontraron pocas vesículas en todas las muestras analizadas. En C. selloana si bien se registró la presencia de vesículas en todas las estaciones del año, los mayores valores se registraron en primavera y verano, y estas estructuras fueron más abundantes bajo pastoreo (Figura 3), aunque no existen diferencias significativas en ningún caso. En N. neesiana la colonización con vesículas fue muy escasa en todas las estaciones del año, tanto en situación de pastoreo como de clausura, por lo que tampoco se detectaron diferencias significativas.
Discusión
Son varios los estudios que relatan la influencia significativa que tiene la simbiosis micorrítica sobre el desempeño de las plantas y el rol que esta asociación juega en la estructuración de comunidades vegetales en los ecosistemas terrestres en general (Bethlenfalvay y Dakessian, 1984; Grime et al., 1987; van der Heijden et al., 1998, 2002; Koide y Dickie, 2002; Ferrol et al., 2004; Landis et al., 2005). Las gramíneas son el componente característico de los pastizales y se ha observado que generalmente presentan un grado importante de colonización por HMA, aunque pocos trabajos confirman efectos positivos de la micorrización sobre estas especies (Hetrick et al., 1990; Wilson y Hartnett, 1998; Hartnett y Wilson, 2002). El presente trabajo reporta los primeros resultados que demuestran la presencia de micorrizas arbusculares en gramíneas nativas características de los pastizales de Uruguay.
Los porcentajes de micorrización observados en la especie C4, C. selloana fueron mayores en relación con los observados para la especie C3, N. neesiana, lo cual estaría en concordancia con estudios previos, en los cuales el porcentaje de colonización fue mayor en especies C4 (Hetrick et al., 1988, 1990; Wilson y Hartnett, 1998; Lugo et al., 2003). Estas diferencias estarían relacionadas con ciertos atributos de las plantas, como la arquitectura radical (Fitter, 1987; Hetrick et al., 1992; Roumet et al., 2006), la fenología (Hetrick et al., 1988, 1992) y el ciclo de vida (Roumet et al., 2006). Las especies de gramíneas C3 poseen caracteres radicales que las hacen más eficientes en la exploración del suelo, como la presencia de sistemas de raíces muy ramificados y finos; en comparación con las C4, las cuales presentan raíces más gruesas y fibrosas, por lo que estas últimas dependerían más de su asociación con los HMA para suplir sus requerimientos nutricionales (Hetrick et al., 1988, 1989). Considerando que en Uruguay existen aproximadamente unas 340 especies de gramíneas nativas, de las cuales el 41% posee mecanismo fotosintético C3 y el 59% mecanismo C4 (Cayssials, 2010), la relación de las gramíneas con los HMA podría tener un papel fundamental en el proceso de estructuración de los pastizales. Sumado a esta predominancia en la abundancia de especies C4, sería interesante investigar en Uruguay el efecto de las micorrizas sobre su desempeño, considerando los antecedentes de que estas especies en general responden de forma favorable a la asociación micorrícica arbuscular (Hetrick et al., 1990; Hartnett y Wilson; 1999, 2002).
El análisis de las interacciones entre las distintas variables analizadas (especie, tratamiento, estación del año), mostró que la interacción especie x estación resultó marginalmente significativa. El análisis del porcentaje de micorrización en función de la estación del año mostró una correspondencia con el ciclo de la especie C. selloana, que presentó un incremento en la colonización en las estaciones cálidas, lo que es esperable para una gramínea de ciclo estival, ya que es cuando presenta mayor actividad fotosintética y eventualmente podría destinar mayor cantidad de carbono a los simbiontes fúngicos. Sin embargo, para la especie de ciclo invernal N. neesiana, no existe una correspondencia entre la colonización y el ciclo de vida de la especie, ya que no hay diferencias significativas en los porcentajes de colonización en las diferentes estaciones del año. La relación entre la micorrización y el ciclo de vida se observó también al considerar solamente la presencia de vesículas de los HMA en C. selloana. En esta especie la presencia de vesículas fue consistente con su ciclo de vida, observándose mayor porcentaje de colonización por parte de HMA en las estaciones cálidas. También se notó que el pastoreo tiene un efecto positivo sobre la presencia de estas estructuras evidenciada por un mayor porcentaje de vesículas de HMA bajo este régimen. Teniendo en cuenta la función que cumplen las vesículas (almacenamiento de energía) podría ser una estrategia del hongo para afrontar situaciones de estrés como el pastoreo.
Los efectos del pastoreo han sido contradictorios dependiendo de la intensidad de pastoreo y de la especie vegetal considerada. Existen estudios en donde se muestra que la herbivoría tuvo un efecto negativo sobre la colonización por HMA en un 62% de las especies de plantas que fueron estudiadas mientras que el restante 42% presentó una relación positiva o no hubo efecto (Gehring y Whitham; 1994). Por otro lado investigaciones realizadas en pastizales con intensidad moderada de herbivoría observaron que la colonización no fue afectada (Reece y Bonham, 1978; Borowicz, 1993; Busso et al., 2001; Lugo et al., 2003; Saito et al., 2004; Pietikäinen et al., 2005) o incluso aumentó (Wallace, 1981, 1987; Bayne et al., 1984; Eom et al., 2001; Kula et al., 2005; Wearn y Gange, 2007). En nuestro trabajo en donde la intensidad de pastoreo es considerada entre moderada y baja (0,5 UG/ha) no encontramos relaciones significativas que puedan determinar un patrón en la colonización por HMA en respuesta al pastoreo. Las micorrizas pueden incrementar la tolerancia de las plantas al pastoreo, ya que proveen a las plantas de nutrientes los cuales ayudan a superar los efectos de la defoliación. De forma alternativa, bajo condiciones intensas de pastoreo el follaje y los rebrotes de las plantas compiten con los HMA por la limitada disponibilidad de carbono. Bajo pastoreo C. selloana exhibió los mayores porcentajes de micorrización aunque en exclusión al pastoreo la micorrización por HMA presentada por esta especie fue considerable. Esto podría relacionarse con el hecho de que C. selloana es una especie decreciente en pastoreo, y que en esta situación podría resultarle beneficioso una mayor colonización con HMA. En el caso de la especie N. neesiana es indiferente en su respuesta al pastoreo, y esto podría relacionarse con la escasa variación presentada en la micorrización en situaciones de clausura y pastoreo.
Los resultados de nuestro estudio sugieren que la intensidad de pastoreo utilizada en este trabajo no fue suficientemente intensa como para limitar significativamente la simbiosis micorrícica. Por otro lado, la ausencia de un patrón en la colonización, en respuesta al pastoreo, puede deberse a que el número de individuos muestreados no fue suficiente como para visualizar una tendencia en la dinámica de colonización y también a que la intensidad de herbivoría no fue constante, lo que podría interferir en la asociación con HMA. También tenemos que tomar en cuenta que existe una alta variación entre individuos en la micorrización, lo que podría ser otra fuente de error al analizar las tendencias en los patrones de colonización por parte de los HMA.
La necesidad de más información sobre las interacciones planta-HMA, en particular en los pastizales resulta clave para entender cómo es la dinámica de estas interacciones y cuál es el rol que juegan los HMA en la estructuración de dichas comunidades vegetales. En el caso concreto de los pastizales de Uruguay, generalmente el nitrógeno es el principal nutriente limitante para el crecimiento de las plantas, mientras que el fósforo disponible oscila entre 3 y 5 mg kg-1 (Hernández et al., 1995). Estos valores son considerados insuficientes para la instalación de mejoramientos forrajeros por ello es común la adición de fertilizantes fosfatados. En este contexto resulta interesante conocer los efectos de dicha práctica sobre las micorrizas en nuestros pastizales, para lo cual es necesario un mayor número de estudios.
Conclusiones
C. selloana y N. neesiana son colonizadas por HMA, confirmando la presencia de micorrizas arbusculares en asociación con estas gramíneas nativas.
La especie con metabolismo C4, C. selloana, mostró mayor grado de micorrización que la especie C3, N. neesiana; esta última presentó niveles de colonización muy escasos.
El patrón de micorrización observado en C. selloana está marcando una concordancia entre el ciclo de vida de esta especie vegetal y la dinámica de colonización de los hongos (mayor presencia de estructuras fúngicas en época estival); para la especie de ciclo invernal N. neesiana no parece haber una correspondencia entre la colonización y el ciclo de vida de la especie.
Se observó una tendencia a una mayor micorrización en la especie C. selloana bajo pastoreo, aunque no se encontraron diferencias significativas entre los tratamientos pastoreo-exclusión al pastoreo sobre la colonización micorrícica de las dos especies analizadas.
Agradecimientos
A la familia Macció por brindarnos su hospitalidad en el establecimiento “El Relincho” donde llevamos a cabo este estudio. Al laboratorio de Microbiología de la Facultad de Agronomía donde procesamos las muestras. A la Dra.Claudia Rodríguez y a la MSc. Andrea Rodríguez, por sus aportes y sugerencias. Al Grupo Ecología de Pastizales (GEP) por su apoyo. Este estudio corresponde al trabajo final para obtener el título de Licenciado en Ciencias Biológicas de G. Parodi y fue financiado con la partida de Dedicación Total de F. Pezzani.
Bibliografía
Allen EB. 1989. The restoration of disturbed arid landscapes with special reference to mycorrhizal fungi. Journal of Arid Environments, 17: 279-286.
Altesor A, Oesterheld M, Leoni E, Lezama F, Rodríguez C. 2005. Effect of grazing exclosure on community structure and productivity of an Uruguayan grassland. Plant Ecology, 179: 83-91.
Auge RM. 2001. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis. Mycorrhiza 11: 3–42.
Azcon-Aguilar C, Barea JM. 1992. Interactions between mycorrhizal fungi and other rizosphere microcroorganisms. In: Allen MF (Ed.). Mycorrhizal functioning and integrative plant-fungal process. New York : Chapman and Hall. pp. 163-198.
Bayne HG, Brown MS, Bethlenfalvay GJ. 1984. Defoliation effects on mycorrhizal colonization, nitrogen fixation and photosynthesis in the Glycine-Glomus-Rhizobium symbiosis. Physiological Plantarum, 62: 576–580.
Bethlenfalvay GJ, Evans RA, Lesperance AL. 1985. Mycorrhizal colonization of crested wheatgrass as influenced by grazing. Agronomy Journal, 77: 233–236.
Bethlenfalvay GJ, Dakessian S. 1984. Grazing effects on mycorrhizal colonization and floristic composition of the vegetation on a semiarid range in northern Nevada. Journal of Range Management, 37: 312–316.
Bethlenfalvay GJ, Bayne HG, Pacovsky RS. 1983. Parasitic and mutualistic associations between mycorrhizal fungus and soybean: the effect of phosphorous on host plant-endophyte interactions. Physiological Plantarum, 57: 543-548.
Borowicz VA. 2001. Do arbuscular mycorrhizal fungi alter plant–pathogen relations? Ecology, 82: 3057–3068.
Borowicz VA. 1993. Effects of benomyl, clipping, and competition on growth of prereproductive Lotus corniculatus. Canadian Journal of Botany, 71: 1169–1175.
Brundrett MC. 2004. Diversity and classification of mycorrhizal associations. Cambridge Philosophical Society, 79: 473–495.
Brundrett MC. 2002. Coevolution of roots and mycorrhizas of land plants. New Phytologist, 154: 275-304.
Brundrett MC. 1991. Mycorrhizas in natural ecosystems. Advances in Ecological Research, 21: 171–311.
Busso CA, Briske DD, Olalde-Portugal V. 2001. Root traits associated with nutrient exploitation following defoliation in three coexisting perennial grasses in a semi-arid savanna. Oikos, 93: 332–342.
Cayssials V. 2010. Relación entre atributos de las gramíneas nativas de pastizales uruguayos y el ambiente: efectos del hábitat y del pastoreo. (Tesis de Maestría). Montevideo : Facultad de Ciencias. 70p.
Daft MJ, El-Giahmi AA. 1978. Effect of arbuscular mycorrhiza on plant growth. New Phytologist, 80: 365–372.
Eom AH, Wilson GW, Hartnett DC. 2001. Effect of ungulate grazers on arbuscular mycorrhizal symbiosis and fungal community structure on tallgrass prairie. Mycologia, 93: 233-242.
Ferrol N, Calvente R, Cano C, Barea JM, Azcón-Aguilar C. 2004. Analysing arbuscular mycorrhizal fungal diversity in shrub associated resource islands from a desertification threatened semiarid Mediterranean ecosystem. Applied Soil Ecology, 25: 123–133.
Fitter AH, 1987. An architectural approach to the comparative ecology of plant root systems. New Phytologist, 106: 61-77.
Gehring CA, Whitham TG. 2002. Mycorrhizae-herbivore interactions: population and community consequences. In: van der Heijden MG, Sanders I (Eds.). Mycorrhizal ecology. Berlín : Springer-Verlag. pp. 295–320.
Gehring CA, Whitham TG. 1994. Interactions between aboveground herbivores and the mycorrhizal mutualists of plants. Trends in Ecology and Evolution, 9: 251–255.
Govindarajulu M, Pfeffer P, Jin H, Abubaker J, Douds D, Allen J, Bücking H, Lammers P, Shachar-Hill Y. 2005. Nitrogen transfer in the arbuscular mycorrhizal symbiosis. Nature, 423: 819-823.
Grime JP, Mackey JML, Hillier SH, Read DJ. 1987. Floristic diversity in a model system using experimental microcosms. Nature, 328: 420–422.
Grogan PT, Bruns D, Chapin FS. 2000. Fire effects on ecosystem nitrogen cycling in a Californian Bishop Pine forest. Oecologia, 122: 537-544.
Harley JL. 1989. The significance of mycorrhiza. Mycological Research, 92: 129–139.
Hartnett DC, Wilson GWT. 2002. The role of mycorrhizas in plant community structure and dynamics: lessons from grasslands. Plant and Soil, 244: 319–331.
Hartnett DC, Wilson GWT. 1999. Mycorrhizal influence on plant community structure and diversity in tallgrass prairie. Ecology, 80: 1187–1195.
Hernández J, Otegui O, Zamalvide JP. 1995. Formas y contenidos de fósforo en algunos suelos del Uruguay. Boletín de Investigaciones (Facultad de Agronomía), (43) : 32p.
Hetrick BA, Wilson WT, Todd TC. 1992. Relationships of mycorrhizal symbiosis, rooting strategy, and phenology among tallgrass prairie forbs. Canadian Journal of Botany, 70: 1521-1528.
Hetrick BA, Wilson WT, Todd TC. 1990. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany, 68: 461-467.
Hetrick Bad, Kitt DG, Wilson GT. 1989. Relationship between mycorrhizal dependence and competitive ability of two tallgrass prairie grasses. Canadian Journal of Botany 67:2608-2615.
Hetrick BA, Kitt DG, Wilson GT. 1988. Mycorrhizal dependence and growth habit of warm-season and cool-season tallgrass prairie plants. Canadian Journal of Botany, 66: 1376-1380.
Jayachandran K, Shetty KG. 2003. Growth response and phosphorus uptake by arbuscular mycorrhizae of wet prairie sawgrass. Aquatic Botany, 76: 281–290.
Johnson NC, Graham JH, Smith FA. 1997. Functioning of mycorrhizal association along the mutualism-parasitism continuum. New Phytologist, 135: 575 – 585.
Klironomos JN, McCune J, Moutoglis P. 2004. Species of arbuscular mycorrhizal fungi affect mycorrhizal responses to simulated herbivory. Applied Soil Ecology, 26: 133-141.
Klironomos JN. 2003. Variation in plant response to native and exotic arbuscular mycorrhizal fungi. Ecology, 84: 2292– 2301.
Koide R, 1991. Nutrient supply, nutrient demand and plant response to mycorrhizal infection. New Phytologist, 117: 365-386.
Koide R and Dickie IA, 2002. Effects of mycorrhizal fungi on plant populations. Plant and Soil 244: 307–317.
Koide RT, Kabir Z. 2000. Extraradical hyphae of the mycorrhizal fungus Glomus intraradices can hydrolyze organic phosphate. New Phytologist, 148: 511-517.
Koske R, Gemma J. 1989. A modified procedure for staining roots to detect VA mycorrhizas. Mycological Research, 92: 486-505.
Kula AAR, Hartnett DC, Wilson GWT. 2005. Effects of mycorrhizal symbiosis on tallgrass prairie plant-herbivore interactions. Ecology Letters, 8: 61– 69.
Landis FC, Gargas A, Givnish TJ. 2005. The influence of arbuscular mycorrhizae and light on Wisconsin (USA) sand savanna understories: 1. Plant community composition. Mycorrhiza, 15: 547–553.
Lugo MA, Gonzáles Maza ME, Cabello MN. 2003. Arbuscular mycorrhizal fungi in a mountain grassland: II Seasonal variation of colonization studied, along with its relation to grazing and metabolic host type. Mycologia, 95: 407-415.
Montañez A. 2005. El estudio de las micorrizas arbusculares: limitantes y perspectivas. Agrociencia, 9: 311-315.
Newsham KK, Fitter AH, Watkinson AR. 1995. Multifunctionality and biodiversity in arbuscular mycorrhizas. Trends in Ecology and Evolution, 10: 407–411.
Pezzani F, Montaña C, Guevara R. 2006. Association between arbuscular mycorrhizal fumgi and grasses in the successional context of a two phase mosaic in the Chihuahuan Desert. Mycorrhiza, 16: 285-295.
Pietikäinen A, Kytöviita MM, Vuoti U. 2005. Mycorrhiza and seedling establishment in a subartic meadow: effects of fertilization and defoliation. Journal of Vegetation Science, 16: 175–182.
Reece PE, Bonham CD. 1978. Frequency of endomycorrhizal infection in grazed and ungrazed blue grama plants. Journal of Range Management, 31: 149–151.
Reinhardt D, Miller R. 1990. Size classes of root diameter and mycorrhizal fungal colonization in two temperate grassland communities. New Phytologist, 116: 129-136.
Rosengurtt B. 1979. Tablas de comportamiento de las especies de plantas de campos naturales en el Uruguay. Montevideo : Facultad de Agronomía. 86p.
Roumet C, Urcelay C, Días S. 2006. Suites of root traits differ between annual and perennial species growing in the field. New Phytologist, 170: 357 – 368.
Saito K, Suyama Y, Sato S, Sugawara K. 2004. Defoliation effects on the community structure of arbuscular mycorrhizal fungi based on 18S rDNA sequences. Mycorrhiza, 14: 363-373.
Sanders IR, Fitter AH. 1992. The ecology and functioning of vesicular-arbuscular mycorrhizas in co-existing grassland species: II. Nutrient uptake and growth of mycorrhizal plants in a semi-natural grassland. New Phytologist, 120: 525–533.
Sanders FE, Sheikh NA. 1983. The development of vesicular-arbuscular mycorrhizal infection in plant root systems. Plant and Soil, 71: 223–246.
Sanders FE, Tinker PB. 1971. Mechanism of absorption of phosphate from soil by Endogone mycorrhizas. Nature, 233: 278–279.
Sapp J. 2004. The dynamics of symbiosis: an historical overview. Canadian Journal of Botany, 82: 1046-1056
Schüssler A. 2010. Classification of ‘AM fungi’ [En línea]. Consultado octubre 2010. Disponible en: http://www.lrz.de/~schuessler/amphylo/.
Sikes BA, Cottenie K, Klironomos JN. 2009. Plant and fungal identity determines pathogen protection of plant roots by arbuscular mycorrhizas. Journal of Ecology, 97:1274-1280.
Smith SE, Read DJ. 2008. Mycorrhizal symbiosis. 3rd ed. London : Academic Press. 787p.
Smith SE, Smith FA, Jakobsen I. 2003. Mycorrhizal fungi can dominate phosphate supply to plants irrespective of growth responses. Plant Physiology, 133: 16-20.
Tinker PB, Jones MD, Durall DM. 1992. A functional comparison of ecto- and endomycorrhizas. In: Read DJ, Lewis DH, Fitter AH, Alexander IJ (Eds.). Mycorrhizas in Ecosystems. Wellingford : CAB International. pp. 303-310.
Trent JD, Wallace LL, Svejcar TJ, Christiansen S. 1988. Effect of grazing on growth, carbohydrate pools, and mycorrhizae in winter wheat. Canadian Journal of Plant Science, 68: 115–120.
Treseder KK, Allen MF. 2002. Direct N and P limitation of arbuscular mycorrhizal fungi: a model and field test. New Phytologist, 155: 507-515.
van der Heijden MG. 2002. Arbuscular mycorrhizal fungi as a determinant of plant diversity: in search of underlying mechanisms and general principles. In: van der Heijden MGA, Sanders IR (Ed.). Mycorrhizal Ecology. Heibelberg : Springer Verlag. pp. 243–265.
van der Heijden MGA, Klironomos JN, Ursic M, Moutoglis P, Streitwolf-Engel R, Boller T, Wiemken A, Sanders IR. 1998. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 396: 69-72.
Vogelsang KM, Reynolds HL, Bever JD. 2006. Mycorrhizal fungal identity and richness determine the diversity and productivity of a tallgrass prairie system. New Phytologist, 172: 554–562.
Wallace LL. 1987. Mycorrhizal in grasslands: interactions of ungulates, fungi an drought. New Phytologist, 105: 619-632.
Wallace LL. 1981. Growth, morphology and gas exchange of mycorrhizal and non-mycorrhizal Panicum coloratum L. a C4 grass species, under different clipping and fertilization regimes. Oceanologia, 49: 272-278.
Wang SG, Lin XG, Yin R, Hou YL. 2004. Effect of inoculation with arbuscular mycorrhizal fungi on the degredation of dehp in soil. Journal of Environmental. Science, 16: 458-461.
Wearn JA, Gange AC. 2007 Above-ground herbivory causes rapid and sustained changes in mycorrhizal colonization of grasses. Oecologia, 153: 959–971.
Wilson GWT, Hartnett DC. 1998 Interspecific variation in plant responses to mycorrhizal colonization in tallgrass prairie. American Journal of Botany, 85: 1732–1738.