Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.15 no.1 Montevideo jun. 2011
Evaluación de alternativas para el control poscosecha de aislamientos de Penicillium digitatum resistentes a imazalil
Lado Joanna1, Luque Eleana1, Blanco Oribe2, Pérez Faggiani Elena2
1Área Poscosecha. Programa Nacional de Investigación en Producción Citrícola, Instituto Nacional de Investigación Agropecuaria. Estación Experimental Salto Grande. Camino al Terrible s/n C.P. 50000. Salto.Uruguay. Correo electrónico: jlado@sg.inia.org.uy.
2Área Fitopatología. Programa Nacional de Investigación en Producción Citrícola, Instituto Nacional de Investigación Agropecuaria. Estación Experimental Salto Grande. Camino al Terrible s/n C.P. 50000. Salto.Uruguay.
Resumen
El control del moho verde producido por Penicillium digitatum en las plantas de empaque de cítricos de Uruguay se basa principalmente en el fungicida imazalil (IMZ). Esto ha incrementado las poblaciones de biotipos resistentes del patógeno. El objetivo del presente trabajo fue evaluar alternativas para el control de aislamientos de P. digitatum resistentes a IMZ (1,0 mg l-1 in vitro). Frutos de Valencia y Ellendale fueron inoculados con aislamientos de P. digitatum sensible y resistente a imazalil y tratados por inmersión 15 s con IMZ, pirimetanil (PYR) o fludioxonil (FLU) en combinación con sales: bicarbonato sódico (BCS), carbonato sódico (CS) o sorbato potásico (SP). Se contabilizó la incidencia luego de 15 días a 20 ± 2 ºC. En Ellendale, el IMZ fue el fungicida más efectivo en controlar el aislamiento sensible, alcanzando 100% de control con 500 mg l-1. La incidencia fue menor al 25% utilizando 500 µL l-1 de PYR o FLU, aunque el control fue inferior al del IMZ. Para el control del aislamiento resistente, los tratamientos PYR y FLU fueron tan efectivos como la aplicación de 1500 mg l-1 de IMZ, obteniéndose un 80% de frutos sanos. La combinación de 3% de BCS y 500 mg l-1 de IMZ fue significativamente superior al resto de los tratamientos. En naranja Valencia se obtuvieron controles superiores al 90% con IMZ 1500 mg l -1 e IMZ + PYR 750 µL l-1. Las alternativas evaluadas aportan a un manejo anti-resistencia del moho verde, potenciando el control de biotipos resistentes al IMZ.
Palabras clave: PIRIMETANIL, FLUDIOXONIL, BICARBONATO SÓDICO, CARBONATO SÓDICO, SORBATO POTÁSICO
Summary
Evaluation of alternatives for Penicillium digitatum imazalil resistant strains postharvest management
The control of Green mold caused by Penicillium digitatum in Uruguayan packinghouses is based in imazalil (IMZ) application. As a result, resistant strains appeared. The aim of this work was to evaluate different alternatives for postharvest control of IMZ resistant (1.0 mg l-1 in vitro) P. digitatum strains. Valencia and Ellendale fruit were inoculated with P. digitatum S22 (IMZ sensitive) and R20 (IMZ resistant) strains. Afterwards, they were treated by a 15 s immersion in IMZ, pyrimethanil (PYR) or fludioxonil (FLU) alone or combined with salts: sodium bicarbonate (BCS), sodium carbonate (CS) or potassium sorbate (SP). After 15 days of storage at 20 ± 2 ºC pathogen incidence was registered. For Ellendale, IMZ was the best fungicide for sensitive strain management, achieving 100% control with 500 mg l-1. Although disease incidence was lower than 25% with 500 µL l-1 PYR or FLU application, control efficacy was lower than for IMZ treatment. For resistant strain PYRand FLU were as effective as IMZ (1500 mg l-1), with 80% of healthy fruit. BCS applied at 1, 2 or 3% reduced pathogen incidence, being significantly superior in mixture with IMZ 500 mg l-1. For Valencia oranges an incidence reduction higher than 90% was obtained by IMZ 1500 mg l-1 and IMZ + PYR 750 µL l-1. These alternatives reveal that is possible to develop anti-resistance strategies for P. digitatum IMZ resistant strains management.
Key words: PYRIMETHANIL, FLUDIOXONIL, SODIUM CARBONATE, SODIUM BICARBONATE, POTASSIUM SORBATE
Introducción
Una de las principales causas de pérdida de la calidad de la fruta cítrica durante su almacenamiento y vida mostrador es provocada por hongos del género Penicillium (Plaza, et al., 2003; Kanetis y Adaskaveg, 2005). Cuando la cosecha se produce bajo condiciones de días húmedos y temperaturas templadas se favorece el desarrollo de estos patógenos, provocando más del 90% del total de las pérdidas en poscosecha (Eckert y Eaks, 1989).
A nivel mundial el control de Penicillium spp., se basa principalmente en el uso de fungicidas de síntesis. Los principios activos más utilizados son el imazalil (IMZ), Procloraz (PRO), Orto-fenil fenato de sodio (SOPP) y Tiabendazol (TBZ (Smilanick, et al., 2008). No obstante, en ambientes donde se ha hecho un uso continuo de ellos, se han observado incrementos en las poblaciones del patógeno capaces de resistir las dosis comerciales de estos fungicidas. En California, la proporción de aislamientos resistentes a IMZ, SOPP y TBZ, aumentó en plantas de empaque de un 43,1% en 1988 a 74,2% en 1994. Los biotipos detectados mostraron en ciertos casos, resistencia únicamente a uno de los productos; aunque algunos aislamientos fueron resistentes a los tres principios activos (Holmes y Eckert, 1999). En Uruguay el fungicida TBZ se utilizó en la década del 70 y 80 del siglo pasado y fue sustituido por IMZ debido a la alta incidencia de aislamientos resistentes que provocaron una pérdida en la efectividad comercial del producto. Delgado, et al. (1997) detectaron un 65-70% de aislamientos tolerantes a TBZ en Penicillium italicum, Penicillium digitatum y Penicillium ulaiense. En el caso del SOPP e IMZ, aunque se han reportado biotipos resistentes a ambos productos químicos (Lado y Pérez, 2009; Delgado, et al., 1997), a nivel comercial siguen siendo alternativas efectivas, utilizándose en todas las plantas de empaque uruguayas que procesan fruta para exportación. Sin embargo, para mantener un control adecuado del patógeno, las concentraciones de IMZ utilizadas aumentaron gradualmente desde 500 mg l-1 a 2500-3000 mg l-1. Esta situación es altamente preocupante, debido a que se ha alcanzado el límite máximo sugerido para mantener el nivel de residuo del producto en cantidades admisibles (5 mg kg-1). Actualmente no se cuenta con otras alternativas ajustadas para las condiciones particulares de Uruguay, aunque se conoce que para lograr un manejo anti-resistencia, es conveniente realizar aplicaciones conjuntas o en secuencia de productos químicos con diferente principio activo (Zhang, 2007). En California, a nivel de plantas de empaque, son comunes las aplicaciones de bicarbonato de sodio (BCS), IMZ, TBZ, pyrimetanil (PYR) y fludioxonil (FLU) para el control de los agentes causales de las principales podredumbres (P. digitatum, P. italicum y Geotrichum citri-aurantii) (Smilanick, et al., 2008).
La utilización de sales con efecto fungistático sobre Penicillium spp., es una de las alternativas más promisorias para potenciar el control de biotipos del patógenos resistentes a los fungicidas. El carbonato de sodio (CS), BCS y el sorbato de potasio (SP) han surgido como alternativas para ser aplicadas solas o en conjunto con fungicidas (Smilanick, et al., 2008). Su acción fungistática enlentece el crecimiento del patógeno, afectando la fisiología celular y por lo tanto, la germinación de esporas y producción de enzimas (Obagwu y Korsten, 2003; Smilanick, et al., 2005). Estas alternativas no han sido aún evaluadas para el control de los biotipos de P. digitatum presentes en plantas de empaque de Uruguay, resistentes a altas concentraciones del fungicida IMZ. A su vez, las interacciones del patógeno con variedades de cítricos producidas en climas diferentes también pueden hacer variar los resultados.
El objetivo del presente trabajo fue evaluar la efectividad del IMZ, PYR y FLU solos o en combinación con sales: BCS, CS o sorbato de potasio, para el control de aislamientos de Penicillium digitatum representativos de las poblaciones de Uruguay.
Materiales y métodos
Patógeno
Se utilizaron dos biotipos de P. digitatum S-22 y R-20 caracterizados en trabajos previos por su resistencia cuantitativa y cualitativa a IMZ y su alta patogenicidad en Limón, Spring Navel y Ellendale (Lado y Pérez, 2009). El aislamiento S-22 es sensible a 0,1 mg l-1 de IMZ in vitro, siendo incapaz de esporular sobre fruta tratada con 0,5 mg l-1 de IMZ, a su vez, R-22 es resistente a 3,0 mg l-1 de IMZ in vitro.
Tratamientos e inoculación
Se trabajó con frutos del Tangor Ellendale y naranja dulce Citrus sinensis var. Valencia seleccionados por calibre, color y sin lesiones aparentes. En laboratorio, la fruta fue desinfectada superficialmente, mediante inmersión por 60 s en una solución al 1% de cloro activo (pH 7,0) y enjuagada una vez en abundante agua destilada. A continuación permaneció a temperatura ambiente durante 6 h para permitir el secado, siendo inoculada con un punzón de 2 mm de profundidad y 1 mm de diámetro, con una solución de 1,0 x 106 esporas/ml del patógeno (Eckert y Brown, 1986). Posteriormente, la fruta se mantuvo a temperatura ambiente durante 18-20 h, realizándose la aplicación de los distintos tratamientos por inmersión durante 15 s. Se trabajó con una inmersión de 15 s simulando las aplicaciones comerciales que se realizan a nivel de plantas de empaque en Uruguay (5-10 s). La temperatura de las distintas soluciones se mantuvo en 20 ± 3 °C. El control para cada biotipo consistió en fruta inoculada bañada en agua. En todos los casos en que se aplicaron sales: CS (1,5%), BCS (1-3%) y SP (1-3%) (Pharma Chemical, Jiangsu, China), se evaluó la pérdida de peso con relación al control, pesando fruta no inoculada almacenada a 5 y 20 °C luego de 7 y 15 días de almacenamiento con el fin de determinar si se produce un incremento en la deshidratación por deposición de sales en la cáscara (Larrigaudieíre, et al., 2002).
Los productos fungicidas evaluados fueron: IMZ (Fungaflor 75 PS, Janssen Pharmaceutica), PYR + IMZ (Philabuster SC, Janssen Pharmaceutica) y PYR (Pyrus 300SC, Lanafil S.A.), FLU (Scholar 230SC, Syngenta S.A.). En el Cuadro 1 se detallan los tratamientos realizados en cada uno de los experimentos. La fruta inoculada fue evaluada luego de 15 d a 20 ± 2 °C y 80-90% de HR, registrándose el porcentaje de incidencia (número de frutos con pudrición/total de frutas por repetición * 100) y esporulación (número de frutos que forman conidios/total de frutos por repetición*100) del patógeno. Cada uno de los experimentos fue repetido dos veces.
Análisis estadístico
Se utilizaron 8 repeticiones de 10 frutas por tratamiento, con un diseño completamente al azar. Los datos fueron transformados para su análisis (Arcoseno raíz de la proporción-p) y analizados mediante el procedimiento GLM programa SAS (SAS Institute INc., Cary, NC.). La comparación de medias se realizó mediante el test de Tukey (p≤0,05). Se realizó un análisis de varianza (repetición del ensayo Nº 1 vs. repetición del ensayo Nº 2) que confirmó la posibilidad de presentar los datos promedios en cada ensayo.
Resultados
Ensayo 1-Ellendale
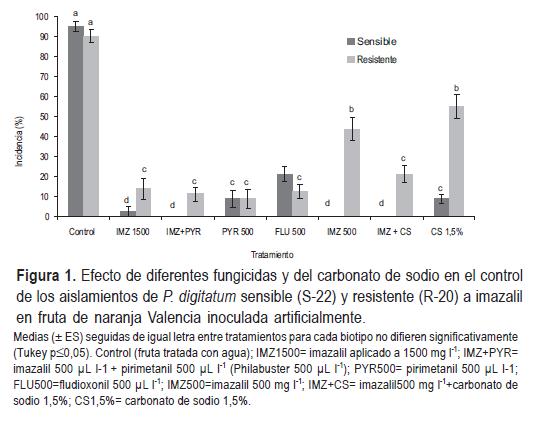
Las aplicaciones de IMZ a altas concentraciones (1500 mg l-1) redujeron significativamente la incidencia de pudriciones producidas por ambos biotipos (<15% incidencia), siendo más efectivas para minimizar el crecimiento del biotipo sensible (Figura 1). La aplicación de 500 mg l-1 de IMZ no controló efectivamente el aislamiento resistente (45% incidencia). Sin embargo, con la adición de CS se mejoró en forma significativa el control del mismo (Figura 1), reduciendo la incidencia a la mitad. La mezcla del IMZ (500 mg l-1) con la sal registró idéntico control del biotipo resistente al compararla con cualquiera de las otras alternativas evaluadas (Figura 1). El CS aplicado solo redujo la incidencia de ambos biotipos con respecto al control, con un mayor efecto sobre el biotipo sensible, no obstante, la incidencia del biotipo resistente fue de un 57%, no diferenciándose de IMZ 500 mg l-1. El nivel de control del biotipo resistente alcanzado por el CS fue de igual magnitud que la aplicación de IMZ (500 mg l-1).
El FLU y el PYR controlaron ambos biotipos, siendo más efectivos que el IMZ para el control del biotipo resistente, aplicados a la misma concentración. Sin embargo, en el caso del biotipo sensible, la eficiencia del control fue menor en ambos casos (Figura 1). El control del biotipo resistente alcanzado con 500 mg l-1 de FLU o PYR no se diferenció del control logrado por el IMZ a 1500 mg l-1 y el IMZ+CS (Figura1).
Ensayo 2-Ellendale
El BCS resultó efectivo en reducir la incidencia y el porcentaje de fruta con esporulación de Penicillium digitatum con respecto al control. No se detectaron diferencias entre las aplicaciones al 1, 2 y 3% de BCS (Cuadro 2). La aplicación de BCS logró una reducción en la incidencia del biotipo sensible de un 27 al 47% y en el caso del resistente del 34 al 37%, con respecto al control. La adición de sales de sodio al IMZ (500 mg l-1) potenció el control de la incidencia de ambos biotipos y del porcentaje de fruta con esporulación del biotipo resistente, sin registrarse ningún efecto sobre el control alcanzado en el biotipo sensible (Figura 1 y Cuadro 2).
Ensayo 3-Valencia
La mezcla de PYR e IMZ (Philabuster™) aplicado a 750 µL l-1 logró un control efectivo del patógeno en las dos variables evaluadas (Cuadro 3).
La aplicación de SP en la mayoría de los casos produjo una reducción significativa en la incidencia con respecto al testigo (Cuadro 3). Nuevamente, el efecto fue mayor en el caso del biotipo resistente para concentraciones de SP 2 y 3% (p/v), no siendo efectivo al 1% en estas condiciones. A diferencia de lo observado para el BCS, no existió potenciación en el control entre el SP y ninguna de las formulaciones evaluadas (Cuadro 3).
Pérdida de peso de la fruta
No existieron diferencias en la pérdida de peso registrada en el testigo y los tratamientos con sales, siendo la misma en promedio de 3,52% y 14,2% luego de 15 da 5 y 20° C, respectivamente (datos no presentados).
Discusión
A nivel mundial se han desarrollado diferentes estudios tendientes a la búsqueda de alternativas más inocuas para el manejo de P. digitatum. Conjuntamente con esto, el desarrollo de resistencia a los fungicidas más utilizados ha incrementado la necesidad de contar con alternativas aplicables para el control de nuevos biotipos, cumpliendo a su vez con las condiciones de calidad e inocuidad solicitadas por los distintos mercados. Es importante considerar también que la respuesta a un determinado manejo es altamente dependiente de la variedad cítrica con la que se trabaje (Montesinos-Herrero, et al., 2009), así como su interacción con los diferentes biotipos de patógenos presentes. Los biotipos de P. digitatum resistentes al IMZ poseen una capacidad de crecimiento sobre fruta cítrica más limitada (Holmes y Eckert, 1995). Estas diferencias de comportamiento entre biotipos también se observan en la respuesta obtenida en el control. En el caso del FLU, el control alcanzado fue altamente dependiente del biotipo inoculado, siendo menor la eficacia en el control del biotipo sensible, con mejores resultados para el resistente (Figura 1). En concordancia con esto, varios trabajos mencionan resultados erráticos para este principio activo. Según Smilanick, et al. (2008) el FLU aplicado por inmersión a 300 µL l-1 no controló efectivamente el desarrollo de la enfermedad en naranjas Valencia, luego de dos semanas a 20 ºC. Sin embargo, según Zhang (2007) concentraciones de entre 500 y 2000 µL l-1 han resultado efectivas para el control de P. digitatum. Este mismo autor reporta un efecto muy pobre del FLU en el control del porcentaje de fruta con esporulación en comparación con el IMZ, aplicado en idénticas condiciones. El tiempo en que la fruta permanece en contacto con la solución del fungicida es determinante del efecto del mismo, encontrándose diferencias importantes entre un tiempo de inmersión de 30 s y de 180 s para el FLU (Smilanick, et al., 2008). Schirra, et al. (2005) reportan un control altamente efectivo por parte del FLU al ser aplicado por inmersión (180 s) a 400 mg l-1 en naranjas Tarocco. Las diferencias con los resultados obtenidos en esta investigación podrían explicarse por el tiempo de contacto y/o por el tiempo entre la inoculación y la aplicación del tratamiento. Según Schirra, et al. (2005) el FLU es tan efectivo como el IMZ aplicado a la misma concentración y temperatura, aunque la sensibilidad in vitro es menor. Las aplicaciones de este principio activo son más efectivas para el control de P. digitatum cuando son realizadas dentro de las 12-15 h luego de la inoculación del patógeno (Kanetis et al., 2007). Es importante recordar que FLU es un fungicida de contacto, con mínima acción sistémica (Syngenta Crop Protection, Inc., 2006), lo cual explica los resultados poco efectivos cuando el patógeno se encuentra ya dentro de la herida. En este trabajo, no se alcanzaron niveles aceptables de control (<15% a 20° C) para fruta tratada luego de 18-20 h.
El PYR surge también como otra alternativa promisoria para el control de biotipos resistentes al IMZ, con un desempeño destacado cuando se aplica en conjunto con éste. En el presente experimento el PYR aplicado sólo a 500 µL l-1 resultó efectivo para el control de biotipos resistentes (Figura 1). Esto concuerda con trabajos realizados en California, en donde la aplicación de 500 o 1000 µL l-1 de PYR en solución acuosa mediante inmersión o drencher durante 30 s, redujo en forma muy importante la incidencia de P. digitatum, en limones y naranjas (Smilanick et al., 2006a). Según estos autores, aplicaciones de PYR (inmersión durante 60 s en 500 µL l-1 a 20 ºC) también controlaron efectivamente aislamientos sensibles y resistentes al IMZ. Este principio activo posee una importante acción curativa, siendo muy efectivo aplicado incluso 24 h luego de la inoculación, a diferencia de lo que ocurre con el FLU. Su efectividad es muy similar a 500 o 1000 µL l-1. Posee acción protectora débil, siendo incapaz de controlar infecciones posteriores a su aplicación (24 y 48 h), a diferencia de lo que ocurre con el IMZ y el TBZ (Smilanick et al., 2006a). Estos autores manifiestan que es importante considerar siempre la mezcla de IMZ + PYR, teniendo en cuenta el efecto antiesporulante del IMZ aplicado con la cera y el control de aislamientos resistentes al mismo por el PYR. De esta forma, se minimizaría el desarrollo de resistencia al PYR por parte del patógeno. De acuerdo a los resultados obtenidos en este trabajo, la aplicación de IMZ y PYR en mezcla (Philabuster™) resultó en un control efectivo de ambos biotipos del patógeno al ser aplicado a 750 µL l-1. Sin embargo, a 500 µL l-1 no se diferenció del IMZ 1500 mg l-1 (Figura 1).
Existen diversos trabajos a nivel mundial que evalúan el efecto de distintas sales en el control de diversos patógenos (Deliopoulos et al., 2010). En el caso específico de los cítricos y Penicillium, el CS, BCS y el SP han sido evaluados en distintas condiciones por investigadores de California (Smilanick et al., 2008), España (Palou et al., 2002; Montesinos-Herreros et al., 2009), Sudáfrica (Obagwu y Korsten 2003) e Italia (Dore et al., 2010) entre otros, con resultados alentadores. En este trabajo, la adición de BCS y CS al 3 y 1,5%, respectivamente, potenció en forma significativa el control del IMZ al biotipo resistente (Figura 1, Cuadro 2) lo cual no ocurrió al agregar SP al 2% en la mezcla (Cuadro 3). El efecto sinérgico del BCS no debería ser explicado por una mayor residualidad del fungicida, ya que se ha demostrado que la acción principal de las sales en el control de Penicillium se debe a un efecto fungistático (Smilanick et al., 1999) y a la inducción directa de resistencia en la fruta (Dore et al., 2010). El efecto fungistático observado es provocado principalmente por la inactivación de enzimas producidas por el patógeno (fumarasa, aspartasa y succínico-dehidrogenasa) relacionadas con su crecimiento (York y Vaughn, 1964), modificando también la permeabilidad de las membranas y la fisiología de sus células (Smilanick, et al., 2005). Por otro lado, la inducción de resistencia por parte del BCS se desarrolla mediante la estimulación de la producción de la fitoalexina scoparona en el albedo, no siendo afectada la misma por la presencia de IMZ (Dore et al., 2010). Estos autores mencionan que conjuntamente con el efecto fungistático del BCS, existe también un incremento en la toxicidad del IMZ, potenciando la absorción del mismo en frutos con heridas.
Existen reportes sobre la potenciación de los fungicidas cuando son aplicados con sales y/o agua caliente, existiendo sinergismo en el control de Penicillium spp. (Palou et al., 2000; Smilanick et al., 1999; Smilanick et al., 2005). Los resultados obtenidos coinciden con lo reportado por Smilanick et al. (2005), en donde el IMZ aplicado solo (500 mg l-1) no controló los aislamientos resistentes a dicho principio activo; sin embargo, cuando fue aplicado a la misma concentración en conjunto con BCS al 3%, controló el desarrollo de ambos aislamientos (sensibles y resistentes).
Es importante destacar que la adición de sales no modifica el nivel de residuos del fungicida en la cáscara de frutos sanos (Dore et al., 2010), evitando las dificultades en el cumplimiento de los límites máximos exigidos por los distintos mercados. El nivel de residuos en limones sumergidos durante 30 s en IMZ (500 mg l-1) o en BCS (3%) + IMZ (500 mg l-1), fue de 2,59 y 2,56 mg kg-1, respectivamente, aumentando a 3,58 y 3,02 mg kg-1 con un tiempo de inmersión de 60 s (Smilanick et al., 2005). Algunos autores (Larrigaudieíre et al., 2002) mencionan que la presencia del residuo de las sales sobre la fruta incrementa la tasa de pérdida de peso, particularmente cuando no recibe recubrimiento posterior con cera y la fruta es almacenada durante largos períodos (Smilanick et al., 2006b). Larrigaudieíre et al., (2002) han reportado una mayor pérdida de peso y firmeza durante un almacenamiento de 2 meses en clementinas tratadas con soluciones de BCS y CS al 2%, en comparación con los controles. En contraposición, en este trabajo no se detectaron diferencias en la pérdida de peso entre los testigos y la fruta que recibió sales (BCS, CS y SP).
El SP aplicado al 2 y 3% p/v provocó una reducción en la incidencia y el porcentaje de fruta con esporulación del biotipo resistente, siendo una herramienta a considerar para futuros ensayos. Su desempeño mejoró al estar mezclado con fungicidas, aunque no se detectó una potenciación del efecto de los principios activos evaluados (Cuadro 3). Esto podría explicarse por las altas concentraciones de IMZ y PYR evaluadas, ya que según Montesinos-Herreros, et al. (2009), el efecto sinérgico sí es visualizado cuando se trabaja con menores concentraciones (< a 500 mg l-1) del principio activo o cuando se logra un mayor tiempo de contacto entre la fruta y la solución. Estos autores reportan también efecto del SP en el control del patógeno cuando es aplicado por inmersión en agua caliente. En ensayos semi-comerciales se logró una reducción del 95% en la incidencia del patógeno en naranja valencia con respecto al control (77% de incidencia), mediante aplicaciones por inmersión (30 s) de SP al 1% (Montesinos-Herrero et al., 2009). A su vez, la incidencia se redujo de 95% a 10% en fruta tratada con SP (1%) a 62 °C durante 15 s, sin observarse daño en la cáscara de esta variedad (Montesinos-Herrero et al., 2009).
En contraposición con los resultados obtenidos en el presente estudio, en donde el SP no potenció el control de ambos biotipos por parte del IMZ, Smilanick et al. (2008) reportan que fruta tratada con IMZ (500 mg l-1) combinado con SP (0,50%) en agua a 50 ºC (inmersión durante 30 s), logró un control efectivo de aislamientos de P. digitatum resistentes a dicho principio activo. (Smilanick et al., 2008). Esto podría estar explicado por las diferencias en la temperatura del agua y el tiempo de inmersión, ya que ambas variables influyen directamente en el control alcanzado (Smilanick et al., 2008). Similarmente a lo que ocurre con el BCS, el mecanismo de acción de la sal no estaría explicado por un aumento en el residuo del principio activo en la fruta, ya que estos mismos autores no detectaron un aumento de residuos de los fungicidas (IMZ, PYR y FLU) luego de la aplicación de la mezcla con la sal. En este sentido también, es importante considerar que la respuesta del patógeno al tratamiento con sales no depende únicamente del tipo de aplicación, existiendo una interacción importante con la variedad. Montesinos-Herrero et al. (2009) reportaron diferencias muy importantes en la eficacia del tratamiento con SP entre Valencia y Clemenules, alcanzándose reducciones del 95% en el primer caso y un efecto muy reducido en el segundo.
A partir de los experimentos realizados detectamos que la eficacia en el control del biotipo resistente se redujo en forma significativa (aumento mayor al 100% en la incidencia del patógeno) al bajar la concentración del IMZ de 1500 a 500 mg l-1 (Cuadro 3). Para alcanzar un control efectivo de estos biotipos fue necesario aumentar la concentración del principio activo o combinarlo con distintas alternativas que potencien el control. En ausencia del IMZ, los aislamientos resistentes son menos competitivos que los no resistentes (Holmes y Eckert, 1995), siendo deseable no mantener constante dicha presión de selección, aplicando estrategias que combinen distintos principios activos con sales y/o nuevas alternativas.
Conclusiones
Existen herramientas disponibles, ya sea nuevos principios activos o su combinación con sales, para potenciar el control de biotipos de Penicillium digitatum resistentes al IMZ presentes en Uruguay. Sin embargo, en el caso del control de biotipos sensibles, el IMZ es el producto más eficiente. En condiciones experimentales es posible alcanzar un control adecuado de biotipos resistentes ya sea mediante la combinación de IMZ en conjunto con BCS o mediante la incorporación al manejo de la mezcla de IMZ y PYR. Estos resultados deberían validarse en condiciones comerciales.
Agradecimientos
A las empresas citrícolas uruguayas Citrícola Salteña, Milagro y URUD´OR por la colaboración constante con fruta y participación directa en la definición de los ensayos. A todo el equipo de trabajo de poscosecha, fitopatología y operaciones de INIA Salto Grande que hizo posible el desarrollo de estos trabajos.
Bibliografía
Delgado R.A., Pérez G. y Díaz, L. 1997. Comportamiento de Penicillium digitatum, P. italicum y P. ulaiense en poscosecha de citrus en Uruguay. En: IX Congreso Latinoamericano de Fitopatología ;12-17 octubre 1997 ; Montevideo, Uruguay.
Deliopoulos T., Kettlewell P.S. and Hare, M.C. 2010. Fungal disease suppression by inorganic salts : A review. Crop Protection, 29(10) : 1059-1075.
Dore A., Molinu M.G., Venditti T. and D´Hallewin, G. 2010. Sodium bicarbonate induces crystalline wax generation, activates host-resistance, and increases imazalil level in rind wounds of oranges, improving the control of green mold during storage. Journal of Agricultural and Food Chemistry, 58(12) : 7297-7304.
Eckert J.W. and Brown G.E. 1986 Evaluation of postharvest fungicide treatments for Citrus fruits In: Methods for evaluating pesticides for control of plant pathogens. Kenneth D. Hickey (Ed). St. Paul : APS Press. pp. 92 – 97.Lado J. y Pérez E. 2009. Hacia un manejo integrado y sustentable de Penicillium en poscosecha de cítricos. INIA (Actividades de Difusión ; N° 597).
Obagwu J. and Korsten L. 2003. Integrated control of citrus green and blue molds using Bacillus subtilis in combination with sodium carbonate or hot water. Postharvest Biology and Technology, 28 (1): 187-194.
Palou L., Smilanick J.L., Usall J. and Viñas I. 2000. Control of postharvest blue mold of oranges by sodium carbonate and sodium bicarbonate. Phytopatology, 90(S):S58.
Palou L., Usall J., Muñoz J.A., Smilanick J.L. and Viñas I. 2002. Hot water, sodium carbonate and sodium bicarbonate for the control of postharvest green and blue molds of clementine mandarins. Postharvest Biology and Technology, 24(1): 93-96.