Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.14 no.1 Montevideo ene. 2010
Micropropagación de Achyrocline flaccida (Weinm.) DC. en medios de cultivo líquidos
Ross, Silvia1 y Castillo, Alicia2
1) Departamento de Biología Vegetal, Facultad de Agronomía, Universidad de la República. Gral. E. Garzón 780. Montevideo, Uruguay. Correo electrónico: sross@fagro.edu.uy
2) Unidad de Biotecnología, Instituto Nacional de Investigación Agropecuaria, INIA Las Brujas. R. 48 km 10, Canelones, Uruguay.
Recibido: 31/7/09 Aceptado: 21/12/09
Resumen
La ‘Marcela’ (Achyrocline flaccida) es una planta nativa de Uruguay, sur de Brasil, Argentina y Paraguay, frecuente en arenales y sierras. Su interés productivo radica en el elevado contenido de quercetina que presenta, con importantes propiedades antioxidantes y citoprotectoras. Con el fin de incrementar la escala de propagación de esta especie, se evaluó su multiplicación en medio de cultivo líquido empleando biorreactoreses. Los biorreactoreses constituyen un sistema de micropropagación de plantas rápido y eficiente, evitando la manipulación intensiva y disminuyendo costos. La hiperhidricidad representa la principal limitante de estos sistemas. Los tejidos sumergidos sufren cambios que afectan la anatomía y fisiología de las plantas obtenidas y por lo tanto su sobrevivencia. El objetivo de este trabajo fue optimizar un sistema de producción de microplantas de A. flaccida, en biorreactoreses para incrementar la escala de producción. Se evaluó el efecto del floroglucinol por su acción antivitrificante como promotor de la biosíntesis de lignina, confirmándose mediante cortes histológicos de las plantas obtenidas. En todos los tratamientos realizados se logró una mayor tasa de multiplicación que cuando se emplearon medios sólidos, obteniéndose un máximo de 11 microestacas por yema en dos meses. Los porcentajes de enraizamiento y sobrevivencia ex vitro de las microestacas fueron cercanos al 100 %. Estos resultados permiten lograr una reducción efectiva de costos, ya que se requiere menos mano de obra y disminuyen los costos de insumos.
Con este trabajo se ajustó un sistema de propagación eficiente que contribuirá a incrementar el stock de plantas disponibles, de buena calidad.
Palabras clave: biorreactoreses, cultivo in vitro, hiperhidricidad, floroglucinol
Summary
Micropropagation of Achyrocline flaccida (Weinm.) DC. in liquid culture media
Achyrocline flaccida, known by the popular name of ‘Marcela’, is a plant native from Uruguay, south of Brazil, Argentina and Paraguay, frequently found in sandy and stony ground. Its productive interest lies in Marcela´s content of high levels of quercetin, a flavonoid with important antioxidant and cytoprotective properties. In order to increase the propagation scale of the species, the multiplication in liquid medium employing bioreactors was evaluated. Bioreactors represent an efficient plant micropropagation system, avoiding intensive manipulation and reducing costs. Hyperhydricity represents the main limitation of the system. Submerged tissues suffer stress, and the plants obtained show different anatomical and physiological anomalies that may affect their survival ex vitro. Our objective was to optimize a system for the production of A. flaccida microplants in bioreactors, which could allow the scaling up of production. The effect of phloroglucinol to prevent hyperhydricity promoting lignin biosynthesis was assessed, and confirmed with light microscopy.
For all treatments multiplication rate was higher than that employing solid medium, with a maximum of 11 micro cuttings per bud in two months. Rooting and survival ex vitro was close to 100 %. These results represent an effective reduction of costs as less manual labor and media components are required. An efficient system has been developed which will contribute to increase the stock of good quality plant material available.
Key words: bioreactors, hyperhydricity, in vitro culture, phloroglucinol
Introducción
La ‘Marcela’ es una planta nativa del Uruguay, sur de Brasil, Argentina y Paraguay, frecuente en arenales, cerros, sierras y campos de nuestro país. Popularmente se utiliza como estomacal, digestiva y antiespasmódica entre otras aplicaciones (Davies, 2004). Mediante estudios farmacológicos se constató la presencia de Quercetina en flores, hojas y tallos de esta especie, y su acción en la reversión o disminución de lesiones cerebrales. La quercetina es un flavonoide ampliamente distribuido en el reino vegetal. Entre sus principales virtudes se destaca la actividad antioxidante debido a su poder removedor sobre los radicales libres, ejerciendo un papel citoprotector en situaciones de peligro de daño celular. Asimismo se ha demostrado que la quercetina disminuye la incidencia de infarto de miocardio y de derrames cerebrales en personas de tercera edad. Presenta acción antiinflamatoria, antitumoral y es un potente agente antiviral entre otros efectos (Arredondo et al., 2004).
Como todos los metabolitos secundarios sintetizados por plantas se trata de moléculas producidas en muy baja cantidad, lográndose muy bajos rendimientos de extracción. Por esta razón, se han hecho importantes esfuerzos de producción por plantas in vitro o cultivos celulares, en los cuales se pueden manipular las condiciones de crecimiento y estimular así la síntesis de metabolitos específicos (Villamil y Bonnecarrére, 2005).
La propagación por semillas en este género es un método práctico para obtener una buena población de plantines para instalar un cultivo (Davies, 2004). Sin embargo, es necesario disponer de un sistema de propagación que permita clonar eficientemente posibles quimiotipos seleccionados y caracterizados por una mayor producción de antioxidantes, que surjan de los estudios farmacológicos que se realizan. Asimismo, con el fin de contar con suficiente materia prima para el estudio de las propiedades de la quercetina, obtenida a partir de los extractos vegetales, es necesario disponer de un sistema de propagación que asegure la producción de plantas a gran escala y en tiempos razonables.
El medio líquido representa una alternativa ideal para reducir los costos de producción de plántulas micropropagadas al mismo tiempo que posibilita la automatización del proceso (Ziv, 2002). Entre otras ventajas, los sistemas de cultivo líquidos proporcionan condiciones de cultivo uniformes, el medio puede ser renovado fácilmente sin necesidad de cambiar de recipiente, la limpieza del recipiente luego de un período de cultivo es más fácil y se reducen los subcultivos (Adelberg, 2004). Su uso a menudo resulta en mayores tasas de crecimiento en relación con el medio semisólido. Esto se debe a que una mayor superficie del explanto está en contacto con el medio, y cuando es aireado o agitado se reducen los gradientes de difusión entre éste y el explanto (Etienne y Berthouly, 2002). Estos dos factores combinados permiten una toma de nutrientes y reguladores de crecimiento más eficiente, de modo que en algunas especies es posible emplear medios de cultivo desprovistos de reguladores. Al mismo tiempo, los metabolitos tóxicos que pueden acumularse en la proximidad de los tejidos, son eficientemente dispersados (George, 1993).
La automatización de la micropropagación utilizando biorreactoreses ha sido citada por varios autores como una alternativa para reducir costos. La aplicación de biorreactoreses para la producción de plántulas fue citada por primera vez por Takayama (1981) para la propagación de plantas del género Begonia. Desde entonces, se han utilizado con éxito para el cultivo de numerosas especies y tipos de explanto (bulbos, microtubérculos, embriones somáticos y brotes) (Paek y Hahn, 2002). Ventajas adicionales del empleo de biorreactoreses para la micropropagación de plantas son el aumento de la tasa de multiplicación permitiendo la producción de gran número de plantas en poco tiempo, la facilidad de escalado, obtención de mayor biomasa consecuencia del estímulo de la tasa de crecimiento motivado por la aireación forzada (Curtis, 2005) y la pérdida de la dominancia apical por estar los explantos en movimiento dentro del biorreactor, lo que estimula el crecimiento de numerosas yemas que se desarrollan en propágulos (Takayama, 2002).
La principal limitante del sistema de cultivo en biorreactoreses utilizando medio líquido es el fenómeno de hiperhidricidad o vitrificación, que se manifiesta como una malformación de hojas y tallos que presentan aspecto vítreo debido a la inmersión temporal o continua en el medio (Ziv, 2002). Entre las principales malformaciones se cita cierre estomático dificultado, anormalidades en tejidos vasculares y epidérmicos, afección de fotosíntesis, lo que resulta en plantas que no se adaptan al trasplante ex vitro. La misma puede ser evitada o reducida mediante diversas medidas en función del sistema de cultivo empleado. La hiperhidricidad, entre otros trastornos, reduce la síntesis de lignina, pero este proceso puede ser reactivado agregando al medio de cultivo floricidina o alguno de sus precursores (floroglucinol y ácido p-cumárico), que tienen el efecto de incrementar la actividad de enzimas implicadas en la biosíntesis de lignina (George, 1993a; Ziv, 1991).
El objetivo de este trabajo fue optimizar un sistema de producción de plantas de ‘Marcela’, micropropagadas en medio líquido utilizando biorreactoreses, para incrementar la biomasa disponible para la extracción de flavonoides y realización de análisis posteriores. Asimismo, se evaluó el efecto del floroglucinol en el proceso de lignificación como forma de evitar la ocurrencia de hiperhidricidad en los cultivos. Por primera vez se utiliza un biorreactor para micropropagar esta especie. La elección del sistema de inmersión permanente empleado se hizo con el objetivo de no encarecer el proceso, utilizando materiales disponibles en el laboratorio para su construcción.
Materiales y métodos
Material vegetal
Los materiales de ‘Marcela’ empleados para la instalación de los ensayos corresponden a la especie Achyrocline flaccida, cultivados en la estación experimental Las Brujas (inia), en el marco del proyecto interinstitucional cotepa (Centro de Orientación Técnica y Económica de las Plantas Aromáticas). Estos materiales se encontraban creciendo en condiciones in vitro en medio de cultivo semisólido, de la misma composición que el empleado en los biorreactoreses pero con adición de agar (7 g l-1).
Se utilizaron 10 explantes por biorreactor; cada explanto consistió de un segmento nodal con tres a cuatro yemas axilares.
Medio de cultivo
El medio de cultivo empleado en la etapa de multiplicación fue MS (Murashige y Skoog, 1962) , complementado con myo-inositol glicina (100 mg l-1) y sacarosa (20 g l-1). El pH del medio fue ajustado en 5,50 unidades antes del autoclavado. Se evaluaron dos volúmenes de medio de cultivo: 0,50 y 1,00 litro. Asimismo se evaluó el efecto de adicionar floroglucinol (40 mg l-1) en el medio de cultivo.
Biorreactoreses
Los biorreactoreses de inmersión permanente empleados fueron construidos con Erlenmeyer de 2,00 litros, cerrados con tapones de goma con dos puertos para permitir la conexión de entrada y salida de aire filtrado estéril. La difusión de aire en el líquido se realizó mediante un sistema de tipo piedra porosa. Se empleó un sistema de aireación (bomba de aire) clásico utilizado en acuarios y peceras, el cual proporciona un caudal de aire de 2.000 ml min-1 y no presenta fluctuaciones a lo largo del tiempo. La figura 1 muestra los biorreactoreses empleados en los ensayos.

Los biorreactoreses fueron incubados durante 60 días en cámara de crecimiento con las siguientes condiciones: 20 ºC +/- 2 ºC de temperatura, fotoperíodo de 16 horas de luz, suministrada por tubos de luz fría con una intensidad de 30 mmol m-2 s-1 y 8 horas continuas de oscuridad.
En todos los ensayos realizados se registró semanalmente el pH del medio de cultivo, con peachímetro modelo TOA Electronics HM-30S. Para la determinación de pH se extrajo un volumen constante de 3 ml con pipeta estéril en cámara de flujo laminar, el cual fue descartado luego de la determinación.
Enraizamiento
Para el enraizamiento ex vitro de las microestacas obtenidas, de 2 cm de longitud o más, se empleó un sustrato compuesto por una mezcla de tierra, turba y perlita en partes iguales. Se utilizaron bandejas plásticas con tapa, que fueron colocadas en cámara de crecimiento con las mismas condiciones de luz y temperatura señaladas anteriormente. Las bandejas permanecieron cerradas durante quince días, y luego se fueron abriendo gradualmente, incrementando la duración a partir de una hora diaria hasta la completa eliminación de la tapa.
Cortes histológicos
Se realizaron cortes transversales con micrótomo de mano de los tallos que presentaban un diámetro promedio de 4 mm, provenientes de los biorreactoreses y de cultivo en medio semisólido que fueron usados como control. Para teñir diferencialmente la lignina de la celulosa y de la hemicelulosa se usó Azul de Toluidina (O’Brien et al., 1964).
Se tomaron fotografías de los tejidos luego de la tinción, y se consideró la intensidad de la coloración como indicadora de presencia de lignina (coloración azul intensa en tejidos lignificados).
Análisis estadístico
Los parámetros evaluados en el ensayo de multiplicación fueron la tasa de multiplicación (número de brotes obtenidos por yema) y el tamaño de la yema (mm).
En el ensayo de enraizamiento se contaron el número de explantos que emitieron raíz, y se calculó el porcentaje de enraizamiento.
El número de repeticiones fue tres para todos los experimentos.
El análisis de los datos se realizó con el programa Statistica®. Las variables evaluadas fueron analizadas mediante análisis de varianza (ANOVA) y para la comparación de medias se calculó el valor de la mínima diferencia significativa (MDS) a un nivel de significación de 0,05.
Resultados y discusión
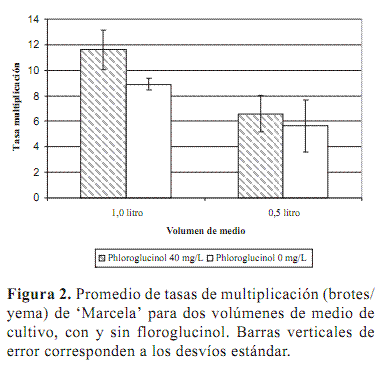
En todas las condiciones evaluadas se obtuvo multiplicación de los explantos, con tasas que variaron entre 6 y 11 brotes/yema como se muestra en la figura 2. Estas tasas de multiplicación son significativamente mayores a las que se obtienen en nuestro laboratorio en medio semisólido, de entre tres y cuatro brotes por yema.
Respecto al volumen de medio empleado, las mayores tasas de multiplicación se obtuvieron en 1 litro, independientemente de la presencia de floroglucinol en el medio (figura 2). Los explantos proliferaron rápidamente emergiendo sobre la superficie del medio, incluso antes de que se cumpliera un mes de cultivo.
En los tratamientos de medio litro se observaron explantos oxidados y vitrificados (figura 3).
Las tasas de multiplicación fueron mayores cuando se adicionó 40 mg l-1 de floroglucinol al medio de cultivo. Sin embargo, las diferencias no fueron significativas en el menor volumen, confirmando que la aireación es el primer factor determinante del comportamiento de las distintas especies y en particular de la aparición de trastornos por hiperhidricidad (figura 4). Según Saher et al. (2005), el estrés oxidativo generado por las condiciones de hipoxia es el principal factor de estrés que afecta el metabolismo de las plantas hiperhídricas.
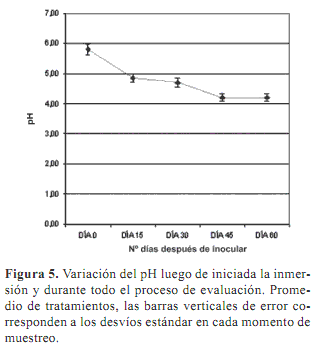
El pH mostró un comportamiento similar en todos los tratamientos, con un descenso inicial, estabilizándose en valores cercanos a 4,00 al fin de los ensayos (figura 5). Los valores de pH de los diferentes tratamientos no mostraron diferencias estadísticas. En ningún caso se observó un efecto negativo del descenso de pH que fue de aproximadamente 1,50 unidades en el primer mes de duración del ensayo, antes de estabilizarse. Es frecuente que el pH de los medios que contienen iones amonio y nitrato disminuya en las etapas iniciales de cultivo, estabilizándose o incluso incrementándose nuevamente hasta alcanzar un nuevo equilibrio (Klein y Manos, 1960). La naturaleza de las variaciones de pH difiere según la especie cultivada (Howard y Marks, 1987) y es importante monitorearlo, ya que si se producen desvíos importantes las condiciones dejan de ser favorables para el crecimiento y diferenciación de los tejidos (Nesius y Fletcher, 1973). Este aspecto adquiere particular relevancia en este ensayo con medio líquido, ya que los cultivos permanecen en el mismo medio (sin subcultivos) durante períodos de tiempo más prolongados que los habitualmente empleados cuando se trabaja con medio semi-sólido.
Los porcentajes de enraizamiento obtenidos fueron cercanos al 100 %, estadísticamente no diferentes al porcentaje de enraizamiento de material proveniente de medio semisólido de multiplicación. Los resultados de este ensayo se muestran en la figura 6. La ‘Marcela’ habitualmente no presenta dificultades de enraizamiento, observándose raíces incluso en el medio de multiplicación. Por este motivo no se consideró necesario evaluar el efecto de la auxina en el medio de enraizamiento, pero sí constatar que los explantos provenientes de los ensayos no vieran disminuida su capacidad de enraizar ex vitro, lo cual fue comprobado mediante este ensayo.
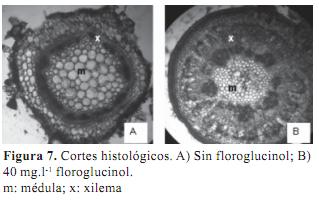
Los cortes histológicos teñidos con Azul de Toluidina mostraron que las microestacas provenientes de los tratamientos sin floroglucinol tenían un mayor diámetro de médula y menor proporción de xilema primario. Los cortes correspondientes a los tratamientos con 40 mg.l-1 de floroglucinol mostraron mayor desarrollo del xilema, asociado a una mayor lignificación y menor diámetro de médula (figura 7). Estos resultados permiten reforzar la hipótesis de que el floroglucinol actúa previniendo la ocurrencia de hipolignificación característica de brotes hiperhídricos proporcionando precursores que habitualmente en tejidos vitrificados no se sintetizan o lo hacen en muy bajas concentraciones. La hipolignificación ha sido atribuida a niveles inferiores de fenoles y a la inadecuada actividad de las enzima hidroxi-cinamin CoA- ligasa y fenilalanina-amonio-liasa (Ziv, 1991). Paralelamente la adición de floroglucinol contribuyó a incrementar la tasa de multiplicación de la especie como se mencionó anteriormente.
Conclusiones
Este trabajo constituye el primer estudio sobre la aplicación práctica del cultivo de tejidos vegetales en medio líquido para esta especie.
Mediante el empleo de biorreactoreses se logró incrementar la tasa de multiplicación respecto al sistema convencional utilizado, pasando de 4 a 11 brotes por yema. Esto significa que se puede triplicar el número de plantas obtenido en la mitad de tiempo y sin necesidad de subcultivos en la etapa de multiplicación. Sería adecuado evaluar el contenido de quercetina de las plantas obtenidas, ya que la masificación derivada del empleo de biorreactoreses puede generar variabilidad en la respuesta de crecimiento.
Estos resultados permitirán lograr una reducción efectiva de costos del proceso de micropropagación en la etapa de multiplicación, donde la mano de obra representa el mayor componente de esos costos. A esto se suma la reducción de costos de insumos, ya que el agar representa el componente más caro del medio de cultivo sólido, tampoco fue necesaria la utilización de reguladores de crecimiento en ninguna etapa del proceso, así como menores gastos operativos al reducirse considerablemente los tiempos necesarios para la obtención de plantas.
El empleo de floroglucinol como precursor de la biosíntesis de lignina fue el tratamiento que proporcionó un mejor control de la vitrificación y al mismo tiempo la mejor tasa de multiplicación, asociado a una mejor calidad de las microestacas obtenidas. Los cortes histológicos y posterior tinción mostraron un mayor desarrollo de los tejidos lignificados en estos explantos. En este sentido, el modelo experimental utilizado permitiría continuar la investigación realizando determinación de lignina, o de alguna de las enzimas involucradas en su biosíntesis para confirmar la hipótesis planteada.
Los porcentajes de enraizamiento y sobrevivencia ex vitro fueron buenos, lo cual permite afirmar que se desarrolló un sistema de multiplicación eficiente, que contribuirá a incrementar el stock de plantas disponibles de esta especie, con plantas de buena calidad y a un menor costo.
Bibliografía
Adelberg, J. 2004. The new generation bioreactors, PGR´s and plant organ development. En: Proceedings Plant Growth Regulator Society of America. pp 28-29.
Arredondo, F.; Blasina, F.; Echeverry, C.; Morquio, A.; Ferreira, M.; Abín, J.A.; Lafón, L. and Dajas, F. 2004. Cytoprotection by Achyrocline satureoides (Lam) D.C. and some of its main flavonoids against oxidative stress. Journal of Ethnopharmacology 91:13-20.
Curtis, W. 2005. Application of bioreactor design principles to plant micropropagation. Plant Cell, Tissue and Organ Culture. 81:255-264.
Davies, P. 2004. Estudios en domesticación y cultivo de especies medicinales y aromáticas nativas. Serie FPTA-INIA, Nº 11. 229 p.
Etienne, H. and Berthouly, M. 2002. Temporary immersion systems in plant micropropagation. Plant Cell, Tissue and Organ Culture. 69:215-231.
George, E. F. 1993a. Plant Propagation by Tissue Culture; Part 1: The Technology. Second Edition. Great Britain, Exegetics Ltd. 574 p.
George, E. F. 1993b. Plant Propagation by Tissue Culture; Part 2: In Practice. Second edition. Great Britain, Exegetics Ltd. 1361 p.
Howard B.H. and Marks T.R. 1987 The in vitro - in vivo interface. pp. 101-111 in Jackson M.B., Mantell S.H. and Blake J. (eds.) Advances in the Chemical Manipulation of Plant Tissue Cultures. Monograph 16, British Plant Growth Regulator Group, Bristol.
Klein R. M. and Manos G.E. 1960. Use of metal chelates for plant tissue cultures. Ann. New York Acad. Sci.88, 416-425
Murashige T. and Skoog F. 1962. A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Physiol. Plant. 15, 473-497.
Nesius K. and Fletcher J.S. 1973. Carbon dioxide and pH requirements of non-photosynthetic tissue culture cells. Physiol Plant 28:259-263.
O’Brien, T.P.; Feder, N. and McCully, M.E. 1964. Polychromatic staining of plant cell walls by toluidine blue. Protoplasma. 59:368-373.
Paek, K. and Hahn, E. 2002. Application of bioreactor system for scale up production of horticultural and medicinal plants. En: 1st Int. Symp. «Liquid Systems for in vitro Mass Propagation of Plants». As, Norway. pp 15-16.
Saher, S.; Fernández-García, N.; Piqueras, A.; Hellín, E. and Olmos, E. 2005. Reducing properties, energy efficiency and carbohydrate metabolism in hyperhydric and normal carnation shoots cultured in vitro: a hypoxia stress? Plant Physiology and Biochemistry. 43:573-582.
Takayama, S. 2002. Practical aspects of bioreactor application in mass propagation. En: 1st Int. Symp. «Liquid Systems for in vitro Mass Propagation of Plants. As, Norway. pp 60-62.
Villamil, J. and Bonnecarrére, V. 2005. Nuevos enfoques en el campo de las plantas aromáticas y medicinales: la producción de fitoterápicos. Revista INIA Nº5. pp 43-46.
Ziv, M. 2002. Simple bioreactors for mass propagation of plants. En: 1st Int. Symp. «Liquid Systems for in vitro Mass Propagation of Plants. As, Norway. pp 13-14.
Ziv, M. 1991. Quality of micropropagated plants: vitrification. In vitro Cell Dev. Biol. 27:64-69.