INTRODUCCIÓN
A la transmisión de una cepa resistente de VIH-1 a una persona que no ha sido expuesta a terapia antirretroviral (TAR), se le conoce como resistencia transmitida1. La Organización Mundial de la Salud (OMS) indicó que en 21 de 30 encuestas de farmacorresistencia del VIH, se reportó niveles de resistencia superiores al 10% a la nevirapina (NVP) o al efavirenz (EFV) antes del uso de TAR, en poblaciones que iniciaron con esquemas de primera línea2. La encuesta nacional sobre farmacorresistencia en Guatemala, en la que participaron 11 de 16 Unidades de Atención Integral del VIH, reportó una prevalencia de resistencia general del 14.1% (IC 95% 10.0-19.0%) y 12% (IC 95% 8.3-16.8%) de resistencia a la familia de los INNTR, previo al inicio de TAR3.
En base a los resultados de la encuesta de farmacorresistencia, los profesionales de la salud de las Unidades de Atención integral del VIH del país consensuaron la incorporación del inhibidor de la integrasa (INSTI) dolutegravir (DTG) en el esquema de inicio de TAR, catalogando como preferente la combinación TDF/FTC + DTG4; esquema fue adoptado paulatinamente; sin embargo, antes y aún durante esta disposición los pacientes de reciente diagnóstico de VIH-1 atendidos en las distintas Unidades de Atención Integral del VIH del país iniciaban TAR con el esquema tradicional de primera línea, 2 INTR + 1 INNTR (generalmente TDF/FTC/EFV o AZT/3TC+EFV) y en caso de fallo se combinaba 2 INTR + 1 IP (en su mayoría AZT/3TC/LPV/r); lo anterior es una consideración importante debido a la relación que existe entre el historial de ARVs disponibles en el país, la resistencia adquirida del VIH-1 a los mismos y la resistencia transmitida.
La sección de secuenciación del área de Biología Molecular del laboratorio de la Unidad de Atención Integral del VIH e Infecciones Crónicas “Dr. Carlos Rodolfo Mejía Villatoro” del Hospital Roosevelt, procesó las primeras pruebas de genotipo del VIH-1 en el año 2011, a partir del cual se tuvo acceso a la prueba de forma parcial hasta el año 2014; luego, del 2015 al 2017 se recibió el apoyo de laboratorios externos para la determinación de resistencia a los ARVs en pacientes en fallo virológico. Posteriormente, en el 2018 la Unidad retomó el procesamiento de la prueba de genotipo del VIH-1 con un abastecimiento del 100%, lo que se alineó a la norma nacional que indicó la necesidad de la prueba de resistencia a los ARVs para los pacientes en fallo virológico4.
La gestión de la Unidad en conjunto con las autoridades correspondientes del Hospital Roosevelt, hizo posible que ese mismo año se extendiera el procesamiento de la prueba a los pacientes de reciente diagnóstico del VIH-1 previo al inicio de TAR, decisión basada en los resultados de resistencia transmitida socializados a partir de estudios previos en pacientes de la Unidad y a la primera encuesta de farmacorresistencia realizada en el país3,5,6; dicha extensión que se amplió en el año 2019 a las Unidades de Atención Integral del VIH ubicadas en interior del país, para los pacientes de reciente diagnóstico del VIH-1 antes de iniciar TAR, apoyo que fue posible hasta el año 2020, período en el que se tuvo disponibilidad de la prueba de genotipo del VIH-1 de forma continua; apoyando así la óptima selección de esquemas de inicio de TAR de primera línea para lograr la supresión virológica y con ello minimizar la propagación de la farmacorresistencia. El objetivo del presente estudio fue describir los niveles de resistencia transmitida del VIH-1 en pacientes con reciente diagnóstico del VIH antes del inicio de TAR, atendidos en 9 Unidades de Atención Integral de Guatemala.
MATERIALES Y MÉTODOS
POBLACIÓN Y MUESTRA
Se realizó un estudio descriptivo de corte transversal que incluyó 185 registros de pacientes adultos positivos para VIH-1 sin exposición previa a tratamiento antirretroviral, cuyas muestras de plasma fueron referidas desde las Unidades de Atención Integral del VIH ubicadas en los departamentos de Guatemala durante el período de noviembre del 2019 a noviembre del 2020: Clínica de Atención Integral, Hospital Regional de Occidente, Clínica de Atención Integral, Hospital Escuintla, Clínica de Atención Integral, Hospital Zacapa, Clínica de Atención Integral, Hospital Jalapa, Clínica de Atención Integral, Hospital Retalhuleu, Clínica de Atención Integral, Hospital Cobán, Clínica de Atención Integral, Hospital San Benito, Petén, Clínica de Atención Integral, Hospital Malacatán y Clínica de Atención Integral, Hospital Coatepeque. El método de muestreo fue no probabilístico de casos consecutivos.
PRUEBA DE CARGA VIRAL
El valor de carga viral del VIH-1 se obtuvo del formulario de solicitud de la prueba de genotipo, que cada Unidad envió junto a la muestra referida. Algunas Unidades realizaron la determinación en un equipo GeneXpert® propio y otras a través de laboratorios de referencia, donde se realiza la medición en el sistema cobas® 4800.
GENOTIPIFICACIÓN DEL VIH-1
Las muestras de plasma fueron extraídas en las respectivas Unidades de Atención Integral del VIH de los departamentos, seguidamente centrifugadas, separadas y conservadas de acuerdo a los protocolos de manejo interno de cada Unidad, para su posterior referencia a la Unidad de Atención Integral del VIH e Infecciones Crónicas “Dr. Carlos Rodolfo Mejía Villatoro” del Hospital Roosevelt para la secuenciación de ácidos nucleicos de las regiones de la transcriptasa reversa (TR) y la proteasa (PR) del VIH-1, en el sistema de secuenciación MiniSeq™ - Illumina, utilizando el software DeepChek® v2.0. Para la clasificación de la resistencia se siguió el algoritmo de HIV Drug Resistance Database (HIVdb) Stanford University7 v9.4 (07/12/2022), se utilizó tanto la puntuación como la interpretación del mismo. Los niveles de resistencia fueron agrupados en 3 categorías para cada medicamento: Posible/bajo nivel de resistencia corresponde a Stanford score (SS) de 10-29, nivel intermedio de resistencia a SS de 30-59 y alto nivel de resistencia a SS ≥ 60. Se analizó únicamente las mutaciones internacionalmente reconocidas y en la región PR sólo se incluyó a las mutaciones mayores 7,8. Los subtipos del VIH-1 se identificaron a partir de 166 secuencias FASTA de las regiones PR/RT del gen pol, utilizando la herramienta de subtipificación REGA HIV-19 v3.0.
INSTRUMENTO DE RECOLECCIÓN DE DATOS
La base de datos fue elaborada en una hoja electrónica de Excel Office versión 2019, en función de las variables registradas en la base de datos de la sección de secuenciación del área de Biología Molecular del Laboratorio de la Unidad, la cual se adecuó para estudiar exclusivamente los datos correspondientes a pacientes adultos con reciente diagnóstico de la infección por VIH-1 sin exposición previa a antirretrovirales a quienes se les realizó la prueba de genotipo de VIH. Para la tabulación de variables, se agregaron campos que no estaban presentes en la base de datos inicial, correspondientes al valor de la carga viral del VIH-1, subtipo del VIH, niveles de resistencia y mutaciones.
PROCEDIMIENTO DE RECOLECCIÓN DE DATOS
Posterior a la adecuación de la base de datos, la información fue transcrita en el orden preestablecido de los campos. El valor de carga viral de VIH-1 se obtuvo del formulario de solicitud de la prueba de genotipo; de la base de datos de la sección de secuenciación se obtuvo las variables sexo, edad y departamento de residencia. Los perfiles de resistencia y mutaciones fueron transcritos desde la base de datos Stanford (v9.4 - 07/12/2022). Los subtipos del VIH-1 fueron registrados a partir de los resultados de la herramienta REGA HIV-1 v.3.0.
ANÁLISIS DE DATOS
Se realizó mediante el software estadístico de distribución libre Jamovi versión 2.3.21; las variables categóricas se describen a través de frecuencias y porcentajes, las cuantitativas en mediana y rango intercuartílico. Se aplicó la prueba de Chi-2 para asociaciones, con un nivel de significancia de 0.05. La prevalencia de resistencia se presenta en intervalos de confianza al 95%; los perfiles de resistencia del VIH-1 y mutaciones se presentan en porcentajes.
ASPECTOS ÉTICOS
Durante el estudio no hubo intervención a pacientes debido a que los datos fueron obtenidos del formulario de solicitud de la prueba de genotipo del VIH- 1 y de la base de datos e informes de resultados de genotipo de las muestras de plasma referidas a la sección de secuenciación del área de Biología Molecular del Laboratorio de la Unidad de Atención Integral del VIH e Infecciones Crónicas “Dr. Carlos Rodolfo Mejía Villatoro” del Hospital Roosevelt. La prueba fue indicada a cada paciente al momento de la cita médica por sospecha de resistencia, explicando la necesidad y beneficio de manera verbal; por lo que los pacientes accedieron voluntariamente a la realización de la misma. No se tomó en cuenta datos de identificación de los pacientes con el fin de garantizar la confidencialidad. El estudio fue revisado y autorizado por las correspondientes autoridades de la Unidad y el Departamento de Docencia e Investigación del mismo hospital.
RESULTADOS
De 185 casos analizados 66.5% eran hombres. La mediana de edad al momento de realizar la prueba de genotipo fue de 31 años (RIC 24, 39). El departamento con mayor referencia de muestras fue Escuintla con 53.0%.
La mediana de la carga viral de VIH-1 fue de 5.4 log cp/mL (RIC 4.8, 5.8). El subtipo B fue identificado en el 67.5% de 166 secuencias FASTA recuperadas. Los 54 casos de subtipo no B, que corresponden al 32.5%, se distribuyen en 15.1% (25/166) de subtipo B-like, 12.0% (20/166) del recombinante de B D, 3.0% (5/166) de subtipo B potencialmente recombinante, 1.2% (2/166) del subtipo C, 0.6% (1/166) y 0.6% (1/166) de recombinante 39 BF B y CRF 18 cpx, respectivamente.
Tabla 1: Características de individuos de nuevo diagnóstico de VIH-1 sin exposición previa a tratamiento antirretroviral a quienes se realizó la prueba de genotipo, provenientes de 9 Unidades de Atención Integral del VIH de Guatemala
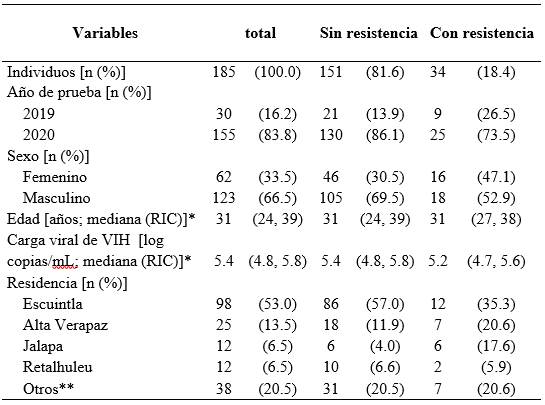
*Rango intercuartílico, **Baja Verapaz, Huehuetenango, Izabal, Jutiapa, Petén, Quetzaltenango, Quiché, Sacatepéquez, San Marcos, Santa Rosa, Suchitepéquez, Zacapa
Se encontró 18.4% (IC 95% 13.1 - 24.7%) de resistencia general a alguna de las familias de ARVs; se evidenció 2.2% (IC 95% 0.6 - 5.4%) de resistencia a la familia de INTR, 15.1% (IC 95% 10.3 - 21.1) para los INNTR y 2.7% (IC 95% 0.9 - 6.2%) a los IP; tres casos presentaron resistencia múltiple a los INTR + INNTR. Durante el período de análisis se encontraban embarazadas 11 mujeres, residentes de Alta Verapaz, Baja Verapaz, Escuintla, Jalapa, Retalhuleu y Suchitepéquez; de las cuales 4 presentaron resistencia individual a la familia de los INNTR. No se encontró relación estadísticamente significativa entre la resistencia con la edad, sexo ni residencia.
De los 34 pacientes que presentaron resistencia y representan el 18.4%, la mayor resistencia por familia individual fue de 13.5% a los INNTR, conformando 25 casos, de los cuales 18 fueron identificados en el año 2020, 15 eran de sexo masculino y 9 indicaron residir en el departamento de Escuintla. De los tres pacientes en quienes se encontró resistencia múltiple a los INTR + INNTR, dos fueron atendidos en el año 2020, dos eran de sexo femenino, indicaron vivir en Escuintla, Jalapa y Quetzaltenango.
La mayor resistencia a cualquier familia de ARVs se encontró en pacientes residentes en Escuintla con 35.3% (12/34) seguida por 20.7% (7/34) quienes indicaron residir en Alta Verapaz y 17.6% (6/34) en Jalapa. La mayor proporción de resistencia del VIH-1 a los ARVs por familia individual fue identificada en los INNTR, con 36.0% (9/25), 28.0% (7/25) y 20.0% (5/25) en pacientes residentes en Escuintla, Alta Verapaz y Jalapa, respectivamente.
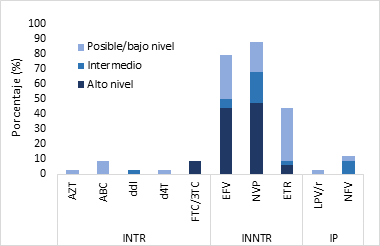
Figura 1: Niveles de resistencia transmitida de VIH-1 por familia de fármacos antirretrovirales (n=34)
La resistencia más elevada se observó en la familia de INNTR, con 47.1% (16/34) para NVP y 44.1% (15/34) para EFV, respectivamente, seguida por la familia de los INTR con 8.8% (3/34) de resistencia a FTC/3TC. De los IP, NFV presentó 8.8% (3/34) de resistencia intermedia y LPV/r 2.9% (1/34) de bajo nivel de resistencia. Se identificó a un individuo con la mutación asociada a los análogos de la timidina (TAM) T215Y y a otro con la K219Q.
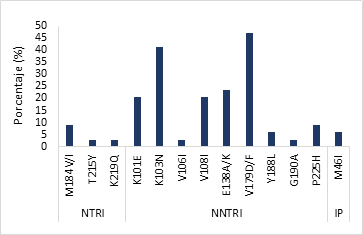
Figura 2: Mutaciones por familia de fármacos antirretrovirales detectadas en individuos con resistencia transmitida de VIH-1 (n=34)
Las mutaciones más frecuentes encontradas en la región de la TR que confieren resistencia a los INNTR fueron K103N (41.2%) y la mutación accesoria V179D/F (47.1%); M184V/I (8.8%) fue la mutación más frecuente de las que confieren resistencia a la familia de los INTR. La mutación primaria M46I asociada a resistencia en la región de la PR se identificó en 5.9%.
DISCUSIÓN
Al igual que la información obtenida en la encuesta de farmacorresistencia del país, en el presente estudio predominó el sexo masculino y la mediana de edad fue similar a la reportada previamente3; en tanto que Escuintla fue el departamento con mayor referencia de muestras (Tabla 1), directamente proporcional a su capacidad de detección de nuevos casos. Por otra parte, el 32.4% (60/185) de los pacientes incluidos en este estudio presentaron CV > 500.000 cp/mL, de ellos 11.7%(7/60) presentaron resistencia únicamente a la familia de INNTR. Estudios realizados han sugerido que valores de CV > 500.000 cp/mL previo al inicio de TAR conllevan a mayor tiempo de supresión viral10 y valores > 500 cp/mL tras 12 semanas de inicio de la terapia representan mayor riesgo de fracaso virológico11; por lo que es importante la determinación de la carga viral basal y su monitoreo dentro de los primeros 6 meses de iniciada la prescripción farmacológica, así como tener en cuenta las comorbilidades, interacciones farmacológicas, adherencia al tratamiento y la resistencia previa al TAR, para abordar de manera conjunta y efectiva las situaciones desfavorables, con la finalidad de lograr la supresión virológica. Hubo predomino del sub tipo B de VIH-1, tal como se ha reportado previamente en el país5,6, sin una tendencia especifica de sub tipos no B que pueda ser comparable con otros estudios12,13 la presencia heterogénea de sub tipos no B sugiere la importancia de realizar futuros estudios para la identificación de diferencias y/o patrones que puedan apoyar la comprensión del comportamiento del virus, así como el impacto de la fisiopatología del mismo.
Estudios llevados a cabo en pacientes de Guatemala y publicados en los años 2011, 2015 y 2017, reportaron resistencia transmitida a algún ARV de la familia de INTR, INNTR o IP entre el 7.3% y 14.1%3,5,6, siendo menor al 18.4% (IC 95% 13.1 - 24.7) encontrado en el presente análisis. Aunque existe un ascenso en la resistencia transmitida, esta continua centrándose en la familia de los INNTR (15.1% (IC 95% 10.3 - 21.1)) principalmente en NVP (47.1% (16/34)) y EFV (44.1% (15/34)) (Figura 1), ARVs que formaban parte del esquema de primera línea, actualmente sustituidos por los INSTI. Asimismo, de manera esperada, la resistencia a los INTR se expresó mayormente en FTC y 3TC, ARVs utilizados en esquemas de primera y segunda línea en el país4, siguiendo la tendencia de estudios reportados a nivel local y en la región3,14.
Si bien, la baja barrera genética de los INNTR puede ser una de las razones de que la resistencia se encuentre mayormente en esa familia de ARVs, lo que llevó al consenso de los profesionales de salud a nivel nacional de migrar a los INSTI4, también es importante tener en consideración el tema de la adherencia, que debe ser reforzado a nivel individual en los pacientes que reciben TAR para evitar resistencia a cualquier familia de ARVs y la educación para la prevención de contraer VIH, enfocada especialmente en grupos de riesgo, que por consiguiente disminuirá la probabilidad de transmisión de farmacorresistencia. Por otra parte, la transmisión de TAMs identificada en este estudio, asociadas al uso de AZT, evidencia la necesidad de seleccionar una adecuada combinación de ARVs desde el inicio de TAR, con la finalidad de evitar la acumulación de estas mutaciones, ya que pueden reducir la eficacia de toda la familia de los INTR15, que continúan siendo el eje central del TAR.
La presencia de la mutación M184V/I (8.8%) (Figura 2) es congruente con el elevado nivel de resistencia encontrado en este estudio para FTC y 3TC, así como la expresión de la K103N (41.2%) que coincide con la resistencia de alto nivel para NVP y EFV. La presencia de la mutación accesoria V179D/F (47.1%) asociada a resistencia a ETR sugiere dos posibilidades: que se haya generado, en la fuente de transmisión, por el uso de EFV y NVP en esquema de primera línea provocando resistencia cruzada, o que la fuente haya estado expuesta directamente a la ETR en un esquema de segunda línea, ya que este ARV ha sido indicado en esquemas de rescate4,16, aun así, la resistencia presente mayormente en nivel posible/bajo también puede deberse a su mayor barrera genética17.
NFV (8.8% (3/34)) y LPV/r ((2.9% (1/34)) fueron los IPs identificados con resistencia intermedia y baja, respectivamente (Figura 1), solamente hubo presencia de la mutación M46I (5.9%) (Figura 2). NFV estuvo incluido en los esquemas de TAR durante los años 2004 al 2007; sin embargo, la presencia de la mutación M46I provoca resistencia cruzada a varios ARVs de la familia de IPs8,15, como a LPV/r aún utilizado en el país.
Adicionalmente, es importante mencionar los casos de resistencia transmitida en mujeres embarazadas, de las cuales el 36.4% (4/11) presentó resistencia a los INNTR, lo cual se asocia al uso de ARVs de esa familia en los esquemas de primera línea en el país4,18 y que tenían mayor probabilidad de generar resistencia debido a su baja barrera genética. Cabe mencionar que una paciente fue detectada en Alta Verapaz y tres en Jalapa.
Este hallazgo muestra la importancia de dirigir activamente los esfuerzos de evaluación de farmacorresistencia entre las gestantes con reciente diagnóstico de VIH19, tomando como base la evaluación de riesgo, con la finalidad de realizar el abordaje a la mujer y las intervenciones necesarias en el neonato expuesto para disminuir el riesgo de transmisión vertical4.
La elevada resistencia general del VIH-1 observada en pacientes residentes en Escuintla, Alta Verapaz y Jalapa, así como a la familia de INNTR (Tabla 1), refleja que la transmisión de VIH con algún nivel de resistencia está condicionada al fallo de TAR del contacto de riesgo, lo que poblacionalmente está relacionado, entre otros, con el impacto del acceso a TAR, adherencia y cobertura de carga viral en las diferentes Unidades de Atención Integral de VIH, que según lo reportado por el Ministerio de Salud Pública y Asistencia Social en el año 2018, en general, entre el 6% y 22% de los pacientes atendidos en las Unidades del interior del país tenían CV > 1000 cp/mL y específicamente 11% (60/570), 20% (73/364) y 15% (122/823) de quienes estaban en TAR y recibían atención en las Unidades del Hospital Zacapa, Hospital de Cobán y Hospital de Escuintla, respectivamente20, lo cual aunado a la baja percepción de riesgo de contraer VIH que pueden tener algunas personas21, representa una importante brecha para la prevención de la resistencia transmitida del VIH y el control de la farmacorresistencia, cuyo abordaje debe abarcar desde la educación a nivel de población general, con énfasis en poblaciones de riesgo, hasta el abordaje integral de personas viviendo con VIH en TAR que se encuentran en fallo virológico y realizar pruebas de resistencia al VIH previo al inicio de TAR, ante la identificación de factores de riesgo, con la finalidad de seleccionar una combinación eficaz de ARVs para lograr la supresión virológica.
CONCLUSIÓN
La elevada resistencia transmitida del VIH-1 en pacientes atendidos en distintas Unidades de Atención Integral del VIH, demuestra la importancia de analizar periódicamente la tendencia de la resistencia en personas que no han estado expuestas a ARVs, lo cual a su vez es un marcador indirecto de presencia de resistencia adquirida en el país, datos que evidencian la necesidad de acciones e intervenciones prontas y efectivas dado su impacto en la salud pública.















