Introducción
En Uruguay el cáncer de próstata representa el 20% del total de cánceres en el hombre (excluyendo el cáncer de piel no melanoma); ocupa el primer lugar en incidencia y el tercer lugar en mortalidad en dicho sexo, después del cáncer de pulmón y colo-recto, se diagnostican en promedio 1473 casos nuevos al año y se registran 570 muertes cada año 1.
Gracias a la generalización de la dosificación del Antígeno Prostático Específico (PSA), la mayoría de los cánceres de próstata se diagnostican ahora en estadios precoces. Al planificar el tratamiento, es esencial considerar la historia natural de la enfermedad y el riesgo de progresión, dado que muchos de estos cánceres son biológicamente indolentes y podrían no amenazar jamás la salud o vida del paciente 2,3.
Para estos pacientes, las opciones de tratamiento estándar incluyen prostatectomía radical, radioterapia y, para aquellos cuidadosamente seleccionados con enfermedad de muy bajo riesgo, bajo riesgo o riesgo intermedio favorable, la vigilancia activa. La elección del tratamiento se basa en varios factores clave, como el riesgo de recurrencia o metástasis, la edad, la esperanza de vida, la presencia de otras enfermedades significativas y las preferencias del paciente 2,3.
Actualmente, la vigilancia activa es considerada una opción adecuada para pacientes con cáncer de próstata de muy bajo riesgo, bajo riesgo o riesgo intermedio favorable, con la posibilidad de realizar un tratamiento definitivo en el futuro si es necesario. Tabla 1 4.
Tabla 1: Esquema de estratificación de riesgos para el cáncer de próstata localizado, según la Red Nacional Integral del Cáncer (NCCN)
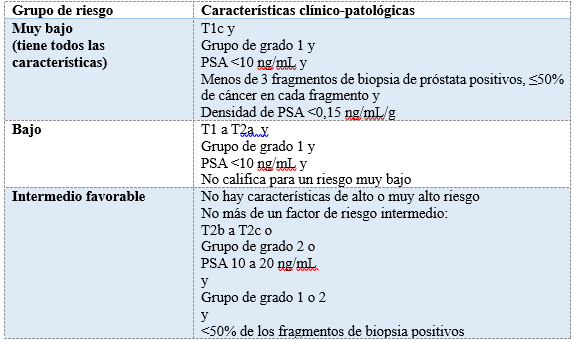
La vigilancia activa es una estrategia que permite mantener la calidad de vida del paciente mientras se retrasa el tratamiento radical, solo implementándolo si la enfermedad avanza, sin comprometer las posibilidades de curación. Esta estrategia consiste en un estricto protocolo de seguimiento con el fin de detectar a tiempo cualquier progresión de la enfermedad. Varios estudios a largo plazo respaldan este enfoque. Durante años, la vigilancia activa ha sido reconocida y adoptada como una opción estándar en distintas guías internacionales para pacientes seleccionados con cáncer de próstata de riesgos especificados anteriormente 4,5,6,7. Es crucial entender que esta estrategia requiere un compromiso activo tanto del paciente como del médico.
El propósito de este estudio es ofrecer una descripción de los resultados del seguimiento activo a mediano plazo de pacientes con cáncer de próstata de distintos niveles de riesgo tratados en el CEDA de Rivera, Cooperativa Médica de Rivera (COMERI).
Objetivo principal
Describir una población de pacientes con cáncer de próstata de muy bajo riesgo, bajo riesgo o riesgo intermedio favorable, en vigilancia activa del sanatorio de la ciudad de Rivera COMERI.
Materiales y métodos
Se trata de un estudio descriptivo, unicéntrico, observacional, retrospectivo. Se incluyeron todos los pacientes con cáncer de próstata de muy bajo riesgo, bajo riesgo o riesgo intermedio favorable (según los criterios incluidos en la tabla 1), en vigilancia activa asistidos por el equipo de Oncología Médica en COMERI entre 2010 y 2018.
Se recopilaron datos ingresados en el sistema de registro clínico electrónico denominado Historia Clínica Electrónica Oncológica (HCEO) durante ese período. Variables incluidas en el estudio: edad actual, edad al diagnóstico, antecedentes personales, fecha de primer consulta en el servicio de oncología, PSA al diagnóstico, fecha de punción biópsica prostática (PBP) inicial, resultado de anatomía patológica (AP): tipo histológico, cantidad de cilindros afectados, porcentaje de carcinoma en los cilindros correspondientes, invasión perineural, embolias linfáticas tumorales, PIN, Gleason y grupo pronóstico. Se incluyeron también datos sobre tacto rectal, PSA posteriores, imagenología correspondiente, tiempo en seguimiento activo hasta el fin del estudio.
Los datos obtenidos fueron sometidos a análisis y se compararon con información disponible de Uruguay y otros países. Se procesaron utilizando una hoja de cálculo (Microsoft Excel) y los resultados se presentan en forma de frecuencias absolutas o relativas.
El protocolo de vigilancia activa se realizó mediante controles clínicos (interrogatorio y examen físico) y determinación de PSA en el Servicio de Oncología cada 6 meses. El tacto rectal se realizó en forma anual. La PBP se realizó al diagnóstico y se repitió en los pacientes que presentaron síntomas y/o cambios en el examen físico y/o la curva de PSA.
Cabe destacar que todos los pacientes participantes otorgaron su consentimiento informado, permitiendo su participación en el estudio y autorizando el uso de la información obtenida para el mismo.
Aspectos Éticos
Se llevaron a cabo el estudio y el análisis estadístico cumpliendo con las normas éticas internacionales para investigaciones biomédicas, incluyendo las "Normas del MERCOSUR sobre regulación de los estudios clínicos" y la "Declaración de Helsinki". Además, el estudio se ajustó al reglamento de investigación aprobado por la Comisión Nacional de Ética en 2019. Se garantizó el anonimato de los pacientes en el análisis estadístico.
Resultados
Se incluyeron 33 pacientes, procedente de Rivera, asistidos en COMERI. La mediana de edad al diagnóstico fue de 74 años (rango 52-84).
Los antecedentes personales más frecuentes fueron: Diabetes Mellitus (DM), hipertensión arterial (HTA) y tabaquismo. La mediana del valor de PSA al diagnóstico fue de 6 ng/ml (rango 2.68 ng/ml - 9.57 ng/ml). Tabla 2.
Tabla 2: Características -patológicas y nivel de riesgo de los pacientes incluidos en el estudio (n=33)
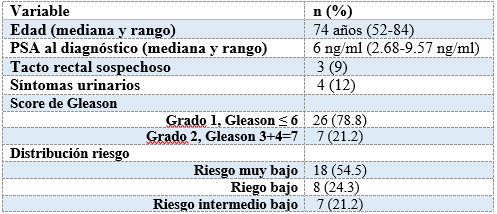
Todos los pacientes incluidos tenían adenocarcinoma de próstata. La mayoría de ellos (88%, n=29) no presentaba síntomas urinarios al momento del diagnóstico. Es importante aclarar que, en cada paciente, se obtuvieron un total de 12 cilindros de acuerdo con los protocolos estándar. Es fundamental destacar que, durante el período de inclusión de nuestro estudio (2010-2018), el número de cilindros afectados en la PBP no era un criterio utilizado para la estratificación del nivel de riesgo según las guías de la NCCN. Esta consideración se introdujo más recientemente. Del total de pacientes, el 54.5% (n=18) tenía entre 1 y 2 cilindros afectados en la PBP, el 27.3% (n=9) tenía entre 3 y 5 cilindros afectados, y el 18.2% (n=6) tenía 6 o más cilindros con adenocarcinoma. Ninguna muestra mostró la presencia de embolias linfáticas tumorales, el 91% (n=12) no presentaba PIN de alto grado y el 51.5% (n=7) no tenía invasión perineural. El resto de las características clínicas y patológicas; y los grupos de riesgo se muestran en el tabla 2.
El 91% fue estadificado con TC de abdomen y pelvis y centellograma óseo. Ninguno de los pacientes cuenta con Resonancia Magnética multiparamétrica (RNMmp) de próstata.
Todos los pacientes fueron sometidos a controles clínicos (interrogatorio y examen físico) y determinación de PSA en el Servicio de Oncología cada 3 meses. Durante el seguimiento, se observaron pocas variaciones en los valores de PSA a lo largo del tiempo. El tacto rectal se realizó en forma anual. Durante el período de vigilancia activa, el 21% (n=7) de los pacientes fue sometido a una segunda biopsia. De estos, 5 pacientes presentaron síntomas urinarios adicionales y 2 mostraron un discreto aumento del PSA. Es relevante señalar que, a pesar de la realización de una segunda biopsia, en todos estos casos el score de Gleason se mantuvo inalterado. Al momento de definir si continuar con la vigilancia activa o iniciar un tratamiento activo se tomó en consideración presencia de síntomas, cambios en el examen físico y la curva de PSA.
El tiempo mediano de vigilancia activa fue de 33 meses (rango de 5-58). Solo un paciente falleció al finalizar la recopilación de datos debido a causas cardiovasculares. Todos los pacientes vivos permanecen en la vigilancia activa, no se evidenció cambio de la evolutividad de la enfermedad ni han cambiado la preferencia personal con la conducta tomada.
Discusión
La vigilancia activa es una estrategia de manejo conservador para pacientes con cáncer de próstata de muy bajo, bajo riesgo o riesgo intermedio favorable que evita el sobretratamiento en estos pacientes, lo que puede tener beneficios significativos en términos de calidad de vida, evitando complicaciones y efectos secundarios vinculados con tratamientos más agresivos. Conocer los resultados de la vigilancia activa en nuestro medio puede ayudar a las autoridades de salud a planificar mejor los recursos necesarios para la atención de pacientes con cáncer de próstata, garantizando un manejo adecuado y oportuno de la enfermedad. Si bien se trata de un único estudio, con un bajo número de pacientes, procedentes de un solo centro, la divulgación de nuestros resultados puede proporcionar información valiosa para mejorar el manejo y atención de esta enfermedad, y para tomar decisiones informadas que beneficien a los pacientes y la comunidad en general.
Nuestro estudio, aunque se incluyó un reducido número de pacientes (n=33), se alinea con las conclusiones obtenidas tanto en los estudios PRIAS como en los PROTECT (Prostate testing for cancer and Treatment). No observamos fallecimientos ni progresiones hacia enfermedad metastásica relacionadas con el cáncer de próstata, un resultado que reafirma la seguridad oncológica de la estrategia de vigilancia activa, como lo demuestran las bajas tasas de mortalidad específica por cáncer de próstata en estos estudios. El estudio PROTECT con un seguimiento mediano de 15 años, reveló que la vigilancia activa redujo el riesgo de efectos secundarios relacionados con el tratamiento, como disfunción eréctil y problemas urinarios, sin incrementar el riesgo de mortalidad por cáncer de próstata en comparación con las intervenciones activas 8. Respecto al estudio PRIAS, su brazo Gotemburgo con un seguimiento mediano de 15 años, ha demostrado que la vigilancia activa puede ser una estrategia segura a largo plazo. Sin embargo, las rebopsias programadas son fundamentales para detectar aquellos tumores que muestran signos de progresión 9.
De acuerdo a las recomendaciones internacionales4,6,7 la evaluación inicial de la totalidad de los pacientes incluidos incluyó el interrogatorio y un examen físico con tacto rectal, la deteminación del PSA y la PBP con la determinación de la puntuación de Gleason en la biopsia inicial y el número de cilindros comprometidos.
Es importante resaltar que, aunque no es habitual incluir estudios de imagen como la tomografía computarizada (TC) y el centellograma óseo (CO) en la evaluación inicial de pacientes con riesgo muy bajo y bajo de cáncer de próstata, en este estudio, la mayoría de los pacientes sí se sometieron a dichos estudios. Esto probablemente se deba a que el equipo médico consideró que estos estudios eran necesarios para determinar la extensión de la enfermedad para planificar el tratamiento de manera adecuada.
La RNMmp se ha convertido en una herramienta esencial en la vigilancia activa del cáncer de próstata. Recientemente las guías de la Sociedad Americana de Oncología Clínica (ASCO)7, la Sociedad Americana de Oncología Radiológica (ASTRO) (6 y la Sociedad de Oncología Urológica (SUO)10 establecieron a la RNMmp como un estándar en la valoración del paciente con cáncer de próstata localizado. El estudio ASIST11 proporciona evidencia crucial sobre su importancia en esta estrategia de manejo. En dicho ensayo, los hombres con cáncer de próstata de bajo riesgo fueron aleatorizados para recibir biopsia sistemática o RNMmp con biopsias sistemáticas y dirigidas. Los resultados mostraron que el uso inicial de la RNMmp antes de la biopsia confirmatoria resultó en un 50% menos de fallos en la vigilancia activa y menos progresión al cáncer de mayor grado en un seguimiento de 2 años. Esto respalda la utilidad de la RNMmp en la identificación precisa de lesiones clínicamente significativas, reduciendo potencialmente la probabilidad de subestimar la agresividad del tumor. Sin embargo, el estudio ASIST también señaló diferencias significativas en las tasas de fallo de la vigilancia activa entre los centros en los que se realizó la RNMmp, sugiriendo que la experiencia y competencia del centro puede influir en los resultados. Esto destaca la importancia de la estandarización y la formación en la interpretación y realización de la RNMmp. Aunque los pacientes del estudio no se sometieron a la RNMmp, lo que representa una limitación en nuestro análisis debido a que este examen nos podría ofrecer una comprensión más profunda sobre la evolución de la enfermedad, es vital considerar ciertos factores al abordar este tema. Primero, el período en el que se incluyeron a los pacientes fue entre 2010 y 2018, y la RNMmp se incorporó a las guías mencionadas recientemente. Segundo que las restricciones de acceso al estudio, ya sea por pautas de cobertura de salud o por la necesidad de desplazamiento de los pacientes para su realización, también podrían haber afectado esta decisión. El papel de la RNMmp en la predicción del "upgrade" durante la vigilancia activa, como se destaca en el estudio ASIST, debe integrarse en nuestra estrategia de manejo y en la discusión con los pacientes. La decisión de continuar con la vigilancia activa versus optar por un tratamiento más agresivo debe basarse en una combinación de hallazgos clínicos, niveles de PSA, y resultados de RNMmp, garantizando así un enfoque personalizado y basado en la evidencia.
La vigilancia activa implica monitorear el crecimiento tumoral con el fin de brindar un tratamiento curativo oportuno a los pacientes que presentan progresión de la enfermedad. En este contexto debido a que estos pacientes no reciben tratamiento inmediato, en algunos casos es posible que la enfermedad progrese, lo que podría aumentar el riesgo de enfermedad metastásica. Es por esto que es necesario un seguimiento cuidadoso durante la vigilancia activa con el fin de identificar la progresión de la enfermedad y la necesidad de instaurar un tratamiento definitivo. Los protocolos de seguimiento de pacientes bajo vigilancia activa varían considerablemente entre las instituciones y han evolucionado con el tiempo debido a la naturaleza dinámica de la vigilancia y la diversidad de objetivos y enfoques para la observación del cáncer de próstata (12-14. Por lo general, esto implica un riguroso interrogatorio, un examen físico, la determinación del PSA, estudios de imagen y la repetición de la PBP a los 6 o 12 meses de la PBP inicial (debido a la PBP inicial pudo haber subestimado el riesgo) o en la evolución para descartar una progresión en la lesión. Nuestros pacientes fueron monitorizados en forma trimestral mediante el interrogatorio, examen físico y determinación del PSA. El 21% de los pacientes fue sometido a una segunda PBP ya que en el resto de los pacientes no se produjeron cambios que justificaran su solicitud. En este contexto, debemos señalar que no existe una única estrategia de monitoreo aceptada, y los protocolos de vigilancia deben adaptarse al riesgo de progresión, las preferencias individuales de cada paciente y sus comorbilidades.
Según la información disponible en la literatura, la mayoría de los hombres que abandonan la vigilancia activa lo hacen debido a la progresión de la enfermedad. Los criterios para determinar la progresión no están bien definidos y dependen del juicio del médico. Sin embargo, se ha observado que aumentos sostenidos en el PSA, especialmente un tiempo de duplicación del PSA de menos de 3 años, o el empeoramiento de las alteraciones en el tacto rectal, deben considerarse como indicadores para realizar una evaluación más detallada, como la RNMmp de próstata con biopsias específicas de regiones de interés, con o sin biopsias sistemáticas.
Finalmente, debemos destacar que ninguno de los pacientes incluidos abandonó la vigilancia activa. Si bien la mayoría de los pacientes que interrumpen la vigilancia activa lo hacen debido a la progresión de la enfermedad, siendo necesario un mayor seguimiento de los pacientes incluidos para evaluar la presencia de progresión lesional, no debemos olvidar que algunos pacientes abandonan esta estrategia muchas veces debido a la carga psicosocial de vivir con un cáncer indolente sin tratamiento y otros por mala adherencia a la estrategia 15,16. En este contexto, la ansiedad puede ser un factor importante que lleva a muchos pacientes a optar por un tratamiento activo, mientras que otros pueden abandonar la vigilancia activa debido a problemas de adherencia a esta estrategia. En este punto, el equipo médico tratante juega un papel fundamental 17,18. Los pacientes que reciben una adecuada información sobre el curso indolente del cáncer de próstata de muy bajo y bajo riesgo, así como del riesgo intermedio bajo, pueden estar mejor preparados para evitar complicaciones psicológicas asociadas con la vigilancia activa. Una buena comunicación médico-paciente permite al paciente comprender plenamente su situación médica, los riesgos y beneficios de la vigilancia activa, y las opciones de tratamiento disponibles. Además, la vigilancia activa requiere un seguimiento regular y continuo del paciente para monitorear la evolución de la enfermedad, y una comunicación clara asegurará que el paciente entienda el plan de vigilancia activa y la importancia de seguirlo correctamente, lo que ayudará a garantizar que cumpla con las recomendaciones médicas y se someta a las pruebas y exámenes necesarios 15,19,20.
En resumen, nuestros resultados refuerzan la idea de que la vigilancia activa es una opción válida y segura para muchos pacientes con cáncer de próstata de bajo riesgo. Sin embargo, es crucial que se proporcionen recursos adecuados y se mantenga una comunicación abierta para asegurar el seguimiento adecuado y abordar cualquier preocupación que puedan tener los pacientes.
Conclusiones
En este estudio, describimos los resultados de pacientes diagnosticados con adenocarcinoma de próstata de muy bajo y bajo riesgo, así como riesgo intermedio bajo, que fueron sometidos a vigilancia activa en COMERI. Aunque este estudio incluyó un número limitado de pacientes y tuvo un seguimiento corto, se observó que la vigilancia activa es una opción factible y segura en nuestro entorno. Esto puede tener beneficios significativos en términos de calidad de vida al evitar complicaciones y efectos secundarios asociados con tratamientos más agresivos.















