Introducción
El adenocarcinoma gástrico constituye 95% de todos los tumores malignos de estómago. Su incidencia en Uruguay se encuentra en descenso y en el periodo 2014 a 2018 fue 12,66, mientras que la tasa de mortalidad fue 10,55 por cada 100.000 habitantes.2 A nivel mundial la incidencia del carcinoma gástrico de células en anillo de sello (CGCAS) se encuentra en aumento y representó 35% - 45% de los nuevos casos. (3 A nivel microscópico puede ser bien diferenciado (papilar o tubular) o indiferenciado que es el caso de la variante con células en anillo de sello, cuyo rango de incidencia es amplio (3-39% en países occidentales). (1,2
Se identifican como factores de riesgo para el desarrollo de cáncer gástrico determinantes genéticos y ambientales. Dentro del primero se destaca la mutación del gen CDH1 que codifica la glicoproteína E cadherina, se asocia a diagnóstico en edades más tempranas y a un subtipo histológico indiferenciado. (4) Dentro de los ambientales la infección por H. pylori es uno de los determinantes más importantes. (5,6
Se define por la OMS como la presencia de más de 50% de células, aisladas o en grupo, con mucina intracitoplasmática, se incluye dentro del subgrupo carcinoma pobremente cohesivo. (7 La presentación clínica del CGCAS depende del tiempo de evolución, localización y extensión del tumor. En etapas iniciales suele ser asintómatico en 80% de los casos y si presenta síntomas son inespecíficos. Hasta 30% de los CGCAS debutan en estadio IV. (8,9 Esto, sumado a la escasa respuesta a la quimioterapia, la cual es inversamente proporcional al porcentaje de CAS del tumor, reviste un mal pronóstico para estos pacientes. Dentro de las compliaciones el sindrome de estenosis gastroduodenal es poco frecuente y se describe en hasta 10%. 8,9,10,11
La cirugía y quimio inmunoterapia constituyen alternativas terapéuticas válidas dependiendo de variables como la resecabilidad del tumor y el terreno del paciente, por lo que el tratamiento es individualizado e interdisciplinario. (10,11
Caso clínico
Se presenta el caso de un hombre de 42 años sin antecedentes familiares a destacar, que refería ERGE de larga data en tratamiento con omeprazol. Como antecedente quirúrgico presentaba la perforación de ulcus duodenal de cara anterior, en contexto de anemia severa (Hb 6 g/dl) sin sangrados evidentes con buena evolución en el posoperatorio mediato. Recibió tratamiento empírico para erradicación de H. pylori con cuádruple terapia por 14 días.
Dos meses luego de la cirugía, consultó con un sindrome de estenosis gastroduodenal caracterizado por epigastralgia y vómitos de retención, asociados a adelgazamiento de 10 kg. Del examen físico se destacaba repercusión general, dolor epigástrico a la palpación profunda, sin defensa, con el hallazgo de clapoteo y bazuqueo.
En este contexto se realizó una VEDA (video endoscopía digestiva alta) donde se reportó esofagitis grado B de los Ángeles. En estómago había alimentos sólidos retenidos, con un píloro edematoso que estenosaba completamente la luz, de aspecto inflamatorio, con múltiples ulceraciones, infranqueable. Fue interpretada inicialmente como estenosis posquirúrgica. La TC de abdomen contrastada informaba un engrosamiento de las paredes de la región antropilórica, sin otras lesiones asociadas.
Por la falta de respuesta al omprezol IV en altas dosis se decidió una reevaluación con VEDA, que reportó estenosis pilórica regular de 7 mm de diámetro y 3 cm de longitud y la presencia de una úlcera circunferencial localizada en el píloro cubierta de fibrina. El bulbo se encontraba deformado en relación a antecedente quirúrgico y estenosis descrita.
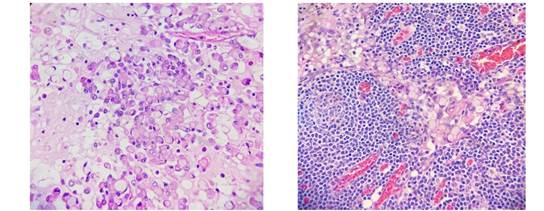
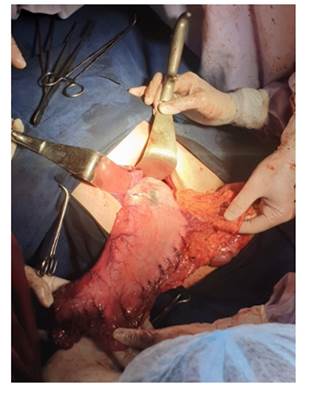
Se tomaron biopsias de la estenosis que informaron infiltración de la mucosa gástrica antral por adenocarcinoma moderada a pobremente diferenciado, ulcerado, con presencia de células en anillo de sello. Se realizó gastrectomía parcial con anastomosis Billroth II y linfadenectomía sin complicaciones (Figura 1 y 2).
La macroscopía de la pieza reportó lesión vegetante y ulcerada, estenosante, Borman III de 8 x 5 cm, que ocluía 100% de la luz y comprometía todo el espesor parietal. La microscopía reportó carcinoma pobremente diferenciado con células en anillo de sello. Se estudiaron 8 ganglios linfáticos y todos fueron positivos. Se catalogó como T3N3M0.
Discusión
Se discute el caso de un hombre con CGCAS que como atencedente presentaba ulcus duodenal perforado y a los dos meses debutó con un sindrome de estenosis gastroduodenal acompañado de repercusión general. Venturelli describió en un estudio de cohorte que hasta 90% de los tumores gástricos se encuentran en estadío avanzado al diagnóstico como en este caso. Del total de los detectados en etapas tempranas en este estudio, sólo 20% fueron CAS. (12
El cáncer gástrico tiene una mayor prevalencia en hombres pero se ha descrito que la variante CAS es ligeramente más frecuente en mujeres, con un relación 1,2:1. El CGCAS debuta a edades más tempranas, con un pico de incidencia entre los 30 y 50 años, franja en la que se encontraba el paciente. (1,2,12
Al igual que en el caso descrito, la principal localización del CGCAS es en la región antropilórica (40%).13 La estenosis gastroduodenal es una complicación descrita en hasta 10% de los CGCAS pero no existe mucha información disponible donde el diagnóstico se realice a partir de esta presentación clínica. (12,13
En este caso, el antecedente de ulcus duodenal perforado reciente llevó a que se interpretaran los síntomas del CGCAS como parte de una evolución tórpida del cuadro y no a una etiología diferente y maligna, si bien llamaba la atención el valor de hemoglobina alcanzado en ese contexto. Un abordaje mediante laparotomía de la complicación del ulcus quizá hubiese permitido el diagnóstico del cáncer gástrico en paralelo, pero es de elección la laparoscopía de urgencia por la menor morbimortalidad y además el paciente no presentaba ningún indicio previo ni factores de riesgo de cáncer gástrico. Independientemente del abordaje, no existe evidencia que indique la toma de biopsias de ulcus duodenal perforado. (14
Hasta 35% se presenta como lesiones ulceradas con crecimiento fungoide. Se ha reportado que la forma predominante de presentación es como tumores pT3 (invasión subserosa) hasta en 90%.13) La invasión ganglionar es el principal factor pronóstico en cualquier estirpe. Si bien en el paciente no impresionaban adenomegalias en la evaluación imagenológica, la linfadenectomía confirmó su invasión como es esperable para este tipo de neoplasias al debut. (15
En una serie de casos con CGCAS se evidenció que el uso de quimioterapia presentaba menor respuesta comparado con el adenocarcinoma. Probablemente esto se deba al mayor compromiso peritoneal de CAS vs NCAS. Se recomienda la neoadyuvancia basada en Fluoracil mas leucovorina, oxaliplanao y docetaxel (FLOT) en tumores rescables, localmente avanzados. (16 Además hay otras opciones que dependen del perfil molecular como trastuzumab, nivolumab, pembrolizumab o bevacizumab17,18 En el caso presentado se realizó gastrectomía parcial con anastomosis Billroth II y linfadenectomía, pero podría haberse discutido la realización de gastrectomía total. Shyn obtuvo mejores resultados con la gastrectomía total sumada a linfadenectomía extendida en los casos que fueron resecables. (19 Por otra parte, Maithan et al en un estudio retrospectivo que incluyó 17086 individuos observó que la gastrectómia parcial tuvó mejor supervivencial general versus la total en CGCAS. 20
El pronóstico de CGCAS es malo. Se ha descrito que en el estadio IIIB la supervivencia a 5 años es 5-10% a pesar de que se trate de un paciente joven sin comorbilidades. En cuanto al seguimiento endoscópico, actualmente no hay una recomendación formal ya que se ha visto que no mejora la sobrevida. El consejo genético de la búsqueda del mutaciones germinales en el gen CDH 1, que codifica la proteína E cadherina está recomendado para los familiares de primer grado en el caso de síndromes hereditarios y en pacientes menores de 40 años con cáncer gástrico difuso por lo que no se realizó en este caso. En los portadores de la mutación CDH 1, se recomienda gastrectomía profiláctica o seguimiento anual con VEDA implementando el protocolo Bethesda. 21,22).
El interés de presentar este caso, radica en difundir la presentación de un CGCAS que debuta con una complicación poco frecuente como es el sindrome de estenosis gastroduodenal.