Introducción
En Uruguay, el alcohol es la droga más consumida con 261.000 de los 3.250.000 habitantes que muestran signos de consumo problemático y otros 100.000 con signos claros de dependencia del alcohol1. Además, la incidencia del 13 % en adolescentes y mujeres menores de 18 años está aumentando en paralelo con una disminución continua en la edad de inicio del consumo de alcohol1. Curiosamente, las determinaciones de parámetros biológicos que reflejen el consumo de alcohol no son usuales y los datos relacionados con los hábitos de consumo de alcohol surgen mayoritariamente de encuestas generales nacionales, ventas de bebidas alcohólicas y análisis de espirometría realizados por las autoridades de tránsito. Para comenzar a solucionar esta falta, en la Unidad de Trastornos Relacionados con el Alcohol (UNITRA, Hospital de Clínicas, UDELAR) se ha comenzado a realizar la determinación de algunos parámetros indirectos de consumo de alcohol:
I- las enzimas hepáticas γ-glutamil-transferasa (GGT), alanína-aminostranferasa (ALT) y aspartato aminotransferasa (AST) porque se encuentran entre los indicadores más utilizados de consumo crónico de alcohol2)(3, se ordenan como parte de la paraclínica de rutina y sus determinaciones son baratas y simples;
II- volumen corpuscular medio (VCM) porque aumenta con el consumo excesivo de alcohol4)(5)(6) probablemente debido a la macrocitosis y al aumento del número de reticulocitos más grandes causados por el consumo de alcohol de larga duración3;
III-transferrina deficiente en carbohidratos (CDT) porque es propuesta como el biomarcador indirecto más específico del consumo sostenido de alcohol que además puede reflejar la abstinencia durante el tratamiento6)(7)(8) y está elevada en la mayoría de los pacientes que consumen más de 50 gramos de etanol por día durante una semana7)(9;
IV- fosfatasa alcalina (PA) como indicador de daño hepático y porque se encontraron niveles más altos en la colestasis alcohólica10.
Dado que el consumo crónico y excesivo de alcohol induce una respuesta inflamatoria en el cerebro y que la neuroinflamación se ha propuesto como desempeñando un rol esencial en el desarrollo de la adicción al alcohol11, nuestra hipótesis sostiene que los efectores de la inflamación conocidos como metaloproteinasas de matriz (MMP) 2 y 9 (también denominadas gelatinasas por su acción gelatinolítica) podrían ser biomarcadores tempranos y altamente sensibles del consumo problemático de alcohol. Estas dos enzimas en particular, han mostrado niveles elevados en una amplia gama de enfermedades humanas12)(13)(14, donde la inflamación juega un papel preponderante. Para comprobar esta hipótesis se determinó la actividad de MMP-2 y MMP-9 en las muestras provenientes de alcohólicos y donadores controles no bebedores.
Materiales y métodos
Población estudiada
El estudio fue aprobado por el Comité de Ética del Hospital de Clínicas Dr. Manuel Quintela (Facultad de Medicina, UdelaR), cuyos procedimientos siguen el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). La población analizada incluyó a los pacientes de UNITRA que cumplieron los siguientes requisitos: edad mínima de 18 años; alcohol como la única droga consumida desde al menos 1 año y ausencia de otras enfermedades. Una vez admitidos en la UNITRA, el nivel de consumo de alcohol fue establecido de acuerdo a la escala AUDIT completa (del inglés Alcohol Use Disorder Identification Test)15. Se presentó y luego invitó a participar en este estudio a cada paciente admitido en la UNITRA, solicitándole la firma de un consentimiento informado escrito que permite el uso de sus parámetros bioquímicos para fines de investigación. En total, se realizó un estudio analítico transversal en una cohorte de 100 pacientes de UNITRA AUDIT IV y en 50 donantes sanos no consumidores de alcohol que fueron invitados a participar en este estudio y posteriormente se clasificaron como nivel I de la escala AUDIT. En ambos grupos estudiados, la edad promedio fue de 45 años y varió de 26 a 70 años, con un 10-15 % de mujeres y un 85-90 % de hombres representando la distribución de género de los bebedores crónicos de alcohol en Uruguay1.
Análisis de las muestras biológicas
Se obtuvieron muestras biológicas durante el día de la primera entrevista médica de cada paciente o control que confirmó una abstinencia de 8 h. Se obtuvo un par de muestras en tubos con anticoagulantes y una tercera en tubos secos. Cada muestra se almacenó inmediatamente a 5 ºC durante 6 h, luego se dividió en alícuotas y se almacenó a -80 ºC hasta su análisis. Las determinaciones bioquímicas se realizaron en el Laboratorio Central del Hospital Maciel, donde se procesaron simultáneamente las muestras provenientes de los grupos control y alcohólicos. Los niveles de gelatinasas en suero se determinaron por zimografía en gel en las muestras obtenidas en tubos secos y fueron realizadas en el Departamento de Bioquímica Clínica de la Facultad de Química por dos personas independientes empleando el método de doble ciego. Cada determinación se realizó por duplicado o por triplicado en tres procedimientos diferentes.
Las enzimas GGT, AST, ALT y PA se midieron espectrofotométricamente en un equipo Beckman Coulter AU 480 utilizando sus respectivos métodos enzimáticos cinéticos siguiendo las sugerencias de la Federación Internacional de Química Clínica16. Brevemente, para determinar GGT se evaluó a la liberación de 5-amino-2-nitrobenzoato al catalizar la transferencia de ácido glutámico a glicilglicina a 405 nm, mientras que para determinar AST o ALT se evaluó la pérdida de absorbancia a 340 nm producida por el consumo de NADH durante la transaminación de aspartato (AST) o alanina (ALT) a α-oxoglutarato16. La actividad PA se midió determinando la tasa de conversión de p-nitrofenilfosfato en medio alcalino tamponado con 2-amino-2-metil-1-propanol a 520 nm16. Los niveles de albúmina se determinaron usando verde de bromocresol como indicador de color y de acuerdo a las indicaciones de los fabricantes.
Los valores de CDT y de transferrina total se determinaron en el Laboratorio de Inmunología del Laboratorio Clínico del Hospital de Clínicas Manuel Quintela empleando un ensayo inmunonefelométrico directo N Latex CDT mediante el uso de un kit comercial9. Todos los valores, excepto VCM y CDT se expresaron como valores relativos a proteínas totales determinadas por el método del ácido bicinconínico17.
Zimografía en gelatina
El ensayo de zimografía en gel fue realizado según Marco et al (2006)17 con pequeñas modificaciones. Brevemente, 1 % de gelatina para cultivo celular se co-polimerizó en gel de poliacrilamida al 8 %. Empleando geles de 15 carriles, se cargaron 0,5 µl de cada muestra de suero en cada carril y se sometieron a electroforesis a 100 V durante aproximadamente 3 h empleando el sistema Miniprotean II (BioRad, Reino Unido). En cada gel se sembró igual cantidad de proteínas de MMP-2 y MMP-9 recombinante. Luego de la corrida electroforética, el gel se desmontó, se lavó 2 veces a temperatura ambiente con Triton X-100 al 2,5 % durante 30 minutos, se enjuagó 3 veces en agua destilada y se incubó durante 18 h a 37 °C en un tampón Tris-HCl 50 mM, pH 7.6, suplementado con 25 mM de CaCl2, 200 mM de NaCl y 0.005 % Brij 35. Después de la incubación, el gel se tiñó con 1 % de Coomassie Brilliant Blue R-250 preparado en metanol al 40 % y ácido acético glacial al 10 %. Luego se procedió a desteñir el gel, agitando suavemente en metanol 40 % y ácido acético glacial al 10 % hasta percibir bandas claras en los lugares de degradación de la gelatina. El cálculo de las masas moleculares aparentes de las bandas gelatinolíticas se realizó por referencia a MMP-9 y -2 recombinantes empleadas como patrones. El área de cada banda se determinó con el programa Image J (NIH) y se expresó como unidades absolutas (UA).
Análisis de datos y estadística
Cada determinación bioquímica se incluyó en una tabla que contenía las muestras numeradas, sin ninguna referencia a la identidad de cada participante en el estudio. Los datos de diferentes laboratorios se agruparon después de parametrizar los valores a proteínas totales, excepto los valores de VCM que se tomaron en valores de fL y CDT que se denominaron como un porcentaje de la transferrina total como generalmente se reporta en la literatura existente7)(8)(9. Después de agrupar los datos, se analizó la estadística descriptiva en cada parámetro considerando a toda la población de controles y pacientes, luego se hicieron gráficos de cajas de cada población utilizando GraphPad Prism6 indicándose el rango (mínimo y máximo), la mediana y los cuartiles 1 y 3 de cada población. La comparación entre los valores presentes en controles y en pacientes se realizó con pruebas estadísticas del mismo software, empleándose ANOVA de una cola para comparación entre grupos.
Resultados
Los niveles de GGT y AST parametrizados a proteínas totales y la relación AST/ALT (Figura 1) mostraron aumentos significativos en los alcohólicos en comparación con los controles, (Figuras 1B, D y E, p <0.05), mientras que ALT (Figura 1C) no mostró diferencias significativas entre ambas poblaciones. VCM presentó un aumento pequeño pero significativo (p< 0.001) con una escasa dispersión de valores que fue mucho menor que la presentada por los otros parámetros analizados (Figura 1F). Los valores de CDT referidos a porcentaje de transferrina total bajaron en alcohólicos en comparación con los controles (Figura 1G) y los niveles de PA fueron similares entre ambos grupos (Figura 1H).
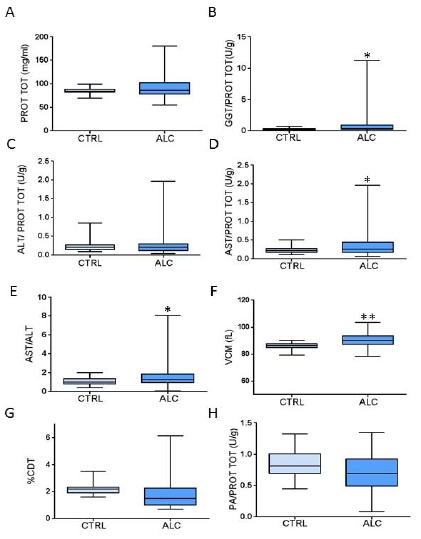
Figura 1: Valores séricos de proteínas totales (A); GGT (B); ALT (C); AST (D); relación ALT/AST (E); VCM (F); CDT (G) y AP (H) en controles y alcohólicos.
Valores séricos de proteínas totales (A); GGT (B); ALT (C); AST (D); relación ALT/AST (E); VCM (F); CDT (G) y AP (H) en controles y alcohólicos. Los valores fueron normalizados a proteínas totales (U/mg) excepto para VCM expresado como fL y CDT expresada como % de transferrina total de acuerdo a lo usualmente aceptado7)(8. Las gráficas de cajas que muestran los valores mínimos y máximos, primer y tercil cuartil y mediana, así como el análisis de datos entre grupos se realizó con GraphPad Prism6 empleando ANOVA de una cola. (*) indica p<0,05 y (**) p<0.001.
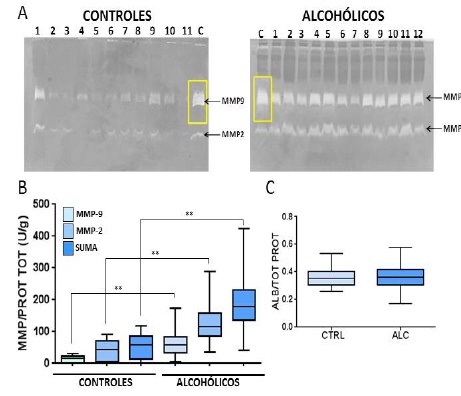
Las diferencias mayores entre alcohólicos y controles (Figura 2) se detectaron en la actividad enzimática de MMP-2, MMP-9 o la suma de ambas (Figura 2A, B), donde los alcohólicos triplicaron o cuadruplicaron los valores de los controles. Los niveles de albúmina no mostraron cambios al comparar ambos grupos (Figura 2C).
Determinación de MMP-2 y MMP-9 en sueros de controles y alcohólicos. (A) Zimogramas representativos de controles y alcohólicos, evidenciando la hidrólisis de gelatina que se observa como bandas blancas en un gel coloreado en los lugares correspondientes a los tamaños de MMP-2 y MMP-9. Los recuadros amarillos muestran los controles positivos correspondiente a MMP-2 y MMP-9 recombinante comercial. (B) Cuantificación en U/g de bandas positivas a MMP-2 y MMP-9 luego de la determinación de las áreas con el programa Image J y la parametrización de proteínas totales de cada muestra. Las gráficas muestran la mediana, el rango de valores mínimo y máximo y los cuartiles correspondientes. (C) Valores de albúmina en pacientes y controles sin diferencias entre los grupos.
Discusión
Las enzimas hepáticas, GGT y AST mostraron aumentos significativos en los alcohólicos, mientras que ALT fue similar en ambas poblaciones, confirmando la mayor sensibilidad de GGT en comparación con ALT y AST como se reportó anteriormente3. Sin embargo, aunque la relación AST/ALT fue significativamente mayor en alcohólicos que en controles, no alcanzó el valor considerado patológico (>2), probablemente porque el abuso de alcohol de larga data tiende a disminuir los valores de esas enzimas por el daño hepático producido3. Sin embargo, la ausencia de cambios en la fosfatasa alcalina sugiere que los alcohólicos no presentan daño hepático significativo18. Otra posible explicación de la falta de mayores diferencias entre alcohólicos y controles puede surgir del rango de edad extendido de la población estudiada, ya que las enzimas hepáticas como la GGT parecen aumentar en pacientes de 18 a 65 años18 y no parecen responder al consumo de alcohol en menores de 30 años3. Para dilucidar este punto, es necesario aumentar el tamaño de la muestra para permitir el análisis estadístico comparando franjas etarias menores (10 años aproximadamente)18.
En este estudio, los niveles de VCM se elevaron en pacientes alcohólicos en comparación con los controles como reporta la literatura20, aunque los valores obtenidos están dentro del rango normal3)(19.
Los resultados obtenidos con CDT no están de acuerdo con la evidencia que propone que CDT sea el biomarcador indirecto más sensible y específico para identificar el consumo de alcohol porque no se ve afectado por otras enfermedades o medicamentos para hepáticos o enfermos crónicos3)(6)(21)(22.
Dado que el resto de los parámetros determinados en los alcohólicos cumple las tendencias de valores reportados en la literatura, entendemos que la ausencia de cambios observados en CDT en esta población probablemente se deba a problemas metodológicos, lo que podría solucionarse con abordajes más sensibles como electroforesis capilar entre otros10. Otras posibles explicaciones para los valores de CDT encontrados en alcohólicos podrían relacionarse con las interferencias reportadas en la literatura, entre las que se incluyen las variantes genéticas de transferrina23, errores congénitos del metabolismo de las glicoproteínas que causan glicoproteínas deficientes en hidratos de carbono24, variaciones en el estado hormonal femenino25, niveles de hierro corporal25)(26, valores biométricos y hábitos personales22)(26)(27)(28. En principio, descartamos la influencia de las variantes genéticas y de errores congénitos ya que la metodología empleada excluye esos sesgos17)(24 y las influencias debidas a la presencia femenina ya que la relación de sexos se mantuvo en ambos grupos analizados. Entendemos que la influencia de los niveles de hierro en los valores de CDT en alcohólicos es menor, ya que las condiciones vitales de estos pacientes hacen improbable que exista una sobrecarga de hierro que es la asociada a niveles bajos de CDT26. Finalmente, pese a que en este estudio no se realizaron determinaciones de los valores biométricos de los participantes, no podemos descartar su influencia ni la del hábito de fumar en ninguno de los dos grupos. No obstante, ello podría explicar incrementos en los valores de CDT22)(25)(27)(28, no disminuciones.
Los resultados más relevantes obtenidos fueron los enormes aumentos en los niveles de gelatinasas en pacientes alcohólicos en comparación con los controles. Este es un resultado novedoso ya que la literatura reporta escasos trabajos anteriores reportando niveles aumentados de gelatinasas en alcohólicos crónicos. Si bien Sillanaukee y colegas (2002)18 mostraron elevaciones de proteína MMP-9 en alcohólicos finlandeses probablemente debido a la condición inflamatoria general crónica que sufren los alcohólicos11, los aumentos eran menores y no habían reportado cambios en MMP-2. Analizando pacientes del este de Polonia, Prystupa y colegas (2015)29 encontraron niveles aumentados de MMP-2, MMP-8 y MMP-9 solo en las etapas cirróticas en alcohólicos cirróticos hepáticos, pero no antes. En cambio, nuestros resultados no están de acuerdo con los datos obtenidos por Madro y cols.30 que muestran disminución en la actividad de MMP-2 en alcohólicos cirróticos y ausencia de cambios en la actividad de MMP-9. Hay parcial coincidencia con los reportes de Kuyvenhoven y cols.31 que muestran incrementos en los niveles de MMP-2, pero no en MMP-9, en relación directa con la progresión del daño hepático de diferente etiología, incluyendo alcoholismo.
Nuestros resultados no solo muestran aumentos mayores en MMP-9 que los reportados anteriormente18)(29)(30)(31, sino que estos aumentos aparecen antes que el daño hepático significativo según sugieren los valores obtenidos de PA en la población analizada. Por tanto, proponemos que las gelatinasas pueden actuar como biomarcadores de consumo crónico de alcohol con una sensibilidad incluso mayor que la reportada previamente. Además, como los datos encontrados en este trabajo concuerdan con los reportados en alcohólicos finlandeses y polacos, la respuesta de las gelatinasas al abuso de alcohol parece superar la debilidad de otros biomarcadores que están influenciados por múltiples factores como los hábitos alimenticios y personales que interfieren con los valores considerados normales y con las referencias de corte para identificar etapas patológicas3)(5)(21)(22 23)(24)(25)(27)(28)(28)(32. Por lo tanto sugerimos que las gelatinasas podrían ser biomarcadores sensibles y generales de consumo crónico de alcohol.
Finalmente, aunque nuestros resultados sustentan la hipótesis de niveles elevados de gelatinasas resultantes del alcoholismo crónico sostenido, el posible papel de estas enzimas en el establecimiento de la dependencia al alcohol33 debe ser considerado al momento de analizar estrategias terapéuticas.
Conclusiones
Este estudio piloto muestra claramente que GGT y VCM, pero fundamentalmente la actividad de las gelatinasas, son los biomarcadores indirectos que reflejan mejor el consumo crónico de alcohol en la cohorte de pacientes uruguayos analizada. Por otra parte, si estos biomarcadores se interpretan en el contexto de cada historial médico, permitirán un mejor conocimiento de la salud del paciente, ayudando a la conciencia sobre su condición y sobre los efectos de la dependencia del alcohol en su cuerpo.