Introducción
La megacariopoyesis es el proceso por el cual, a partir de células madre hematopoyéticas (CMH), los megacariocitos (MK) se diferencian y maduran hasta producir y liberar plaquetas. El estudio de la megacariopoyesis humana se ha visto obstaculizado por la relativa escasez de MK y unidades formadoras de colonias megacariocíticas en la médula ósea (MO). Por este motivo, en las últimas décadas se ha estudiado la megacariopoyesis y la trombopoyesis utilizando cultivos celulares1)(2)(3)(4)(5)(6)(7)(8)(9)(10. Para ello, muchos de los equipos de investigación han utilizado precursores CD34+ provenientes del cordón umbilical (CU) dado que la obtención de los mismos es menos trabajosa que la de precursores provenientes de MO. No obstante, se han descrito y demostrado diferencias cualitativas y cuantitativas entre los MK obtenidos de precursores de CU y precursores de MO11)(12)(13)(14)(15, entre las que se destacan los niveles de poliploidías superiores y la mayor producción de plaquetas en los MK derivados de progenitores de MO respecto de los derivados de CU16. Por ello, los cultivos obtenidos a partir de precursores de MO parecen reflejar mejor la fisiología de la megacariopoyesis en condiciones de funcionalidad normal.
La trombopoyetina (TPO) es el principal factor regulador de la megacariopoyesis. Actúa en todas las fases evolutivas de forma positiva, directa, sinérgica y aditiva con otros factores hematopoyéticos. Su producción tiene lugar en el hígado y puede sintetizarse asimismo en el riñón. Interviene en la fase madurativa incluyendo la poliploidización y la diferenciación terminal con formación de proplaquetas. Se la considera como el principal regulador fisiológico de la maduración megacariocítica y de la producción plaquetaria17)(18)(19)(20)(21. El primer protocolo de expansión ex vivo que tuvo un impacto clínico inequívocamente positivo se basó en un cóctel de tres citoquinas: el factor de células madre (SCF), el factor estimulador de colonias de granulocitos (G-CSF), y el factor de crecimiento y desarrollo de megacariocitos pegilados (PEG-MGDF)) en un medio sin suero22. Se han utilizado diferentes combinaciones de factores para la obtención de MK in vitro21)(23)(24)(25)(26)(27. En 2011, Duchez y cols.28 evaluaron distintas dosis de TPO como sustituto de MGDF en pacientes con mieloma múltiple obteniendo resultados positivos. Sin embargo no se encontraron reportes sobre la diferenciación de MK a partir de precursores de MO obtenidas de donadores sanos. En el presente trabajo se analiza la dosis óptima de TPO necesaria para estimular precursores CD34+ provenientes de cinco donantes alogénicos aceptados para trasplante de MO, para la obtención de una muestra enriquecida de MK.
Materiales y métodos
Obtención de muestras y consideraciones éticas
Las muestras (n=5, 25-40 años) de donantes alogénicos para trasplante de MO fueron proporcionadas por el Servicio de Medicina Transfusional de la Asociación Española Primera en Salud (AEPS). Las mismas fueron obtenidas por leucoaféresis, luego de efectuarse la movilización de precursores CD34+ hacia la periferia. El trabajo contó con la aprobación de los Comités de Ética del Instituto de Investigaciones Biológicas Clemente Estable (IIBCE) y de la AEPS, y el consentimiento informado de cada individuo. Se procesó una alícuota de 5 ml del producto de leucoaféresis de cada donante para el análisis.
Purificación de precursores CD34+
Los precursores CD34+ se purificaron por separación magnética partiendo de la alícuota del producto de leucoaféresis. Se utilizaron CD34 MicroBead Kit, LS Columns (130-042-401, Miltenyi Biotec) y un separador magnético MidiMACS Separator (130-042-302, Miltenyi Biotec) siguiendo las instrucciones del fabricante.
Previo y posterior a la purificación, se realizó un conteo y se testeó la viabilidad de las células CD34+. Se utilizó la Guía ISHAGE (“International Society of Hematotherapy and Graft Engineering”)29)(30 para el recuento de células CD34+, utilizando los AcMo antiCD34-PE (IM11420, clon Immu133 Beckman Coulter) y antiCD45-FITC (IM0782U, clon J33 Beckman Coulter). Para evaluar la viabilidad celular se utilizó 7AAD (A1310, Invitrogen). La adquisición de datos se realizó en un citómetro de flujo CyAn™ ADP (DakoCytomation).
Cultivos celulares de megacariocitos
Se efectuaron cultivos celulares de poblaciones enriquecidas de células CD34+ a una concentración de 2,5 X 105 cel/ml en placas de cultivo celular con 24 pocillos (Greiner bio-one) en el medio de cultivo StemPro-34 (10640-019, Gibco) suplementado con Nutrient Suplement (10641-025, Gibco) y HSA (A1653 Sigma) según las instrucciones del fabricante. Se le adicionó, además, penicilina (100 U/ml) y estreptomicina (125 mg/ml). La estimulación diferenciadora se realizó utilizando distintas concentraciones de TPO (PHC9514, Gibco): 5, 10, 20 y 40 ng/ml al inicio de los cultivos. Al séptimo día de cultivo se reabasteció a los cultivos con la misma cantidad de TPO. Los cultivos fueron incubados durante 14 días en un ambiente húmedo conteniendo 5 % de CO2. Alícuotas de 1 ml fueron extraídas a diario de los cultivos para realizar los análisis que serán detallados posteriormente.
Análisis de la diferenciación megacariocítica
El análisis la diferenciación megacariocítica se llevó a cabo utilizando microscopía óptica de luz (MOL), microscopía láser confocal (MLC) y citometría de flujo. Las alícuotas fueron extendidas en láminas porta objetos de vidrio, en dónde se realizaron diferentes procedimientos según las técnicas de microscopía a utilizar. Fueron examinadas alrededor de 5000 células individuales.
Adquisición de imágenes con microscopía óptica de luz (MOL)
Los extendidos fueron teñidos con el método tradicional de May Grünwald-Giemsa. Primeramente, las muestras fueron procesadas con May Grünwald (Sigma-Aldrich) durante 1 min., y luego fueron lavadas con agua destilada para posteriormente ser teñidas con Giemsa diluido en agua a una concentración de 1:9. Por último fueron lavadas y secadas al aire libre. Todo el procedimiento fue realizado a temperatura ambiente. Las imágenes fueron tomadas en un microscopio Olympus Vanox provisto con una cámara Dino-Eye AM-423X y el software proporcionado por dicha cámara. Todas las fotografías fueron adquiridas a un aumento de 100X.
Adquisición de imágenes con microscopía láser confocal (MLC)
El análisis se realizó empleando tres marcadores de superficie: CD34, CD41 y CD61, y los núcleos fueron evidenciados utilizando DAPI. CD41 (integrina alfa IIB) y CD61 (integrina beta III) son parte del complejo glicoproteico GpIIb/IIIa el cual es expresado en la membrana de los MK maduros y en las plaquetas, y son utilizados para la identificación de MK, proplquetas y plaquetas. La desaparición del antígeno de membrana CD34 y la aparición de CD41 y CD61 se asocian con la transición de una fase proliferativa a una no proliferativa, por lo cual la utilización de esta combinación de marcadores es utilizada para el seguimiento de la diferenciación megacariocítica19)(31. Se realizaron experimentos preliminares utilizando aspirados y biopsias de MO con la finalidad de optimizar las técnicas de fijación e inmunocitoquímica.
Las muestras fueron fijadas con 4 % PFA y permeabilizadas con 0,2 % de Triton X-100 durante 10 min. Luego fueron lavadas con PBS (3 x 1 min.). Posteriormente se realizó el inmunomarcado utilizando 1:100 antiCD34-PE y/o antiCD34-FITC (IM1870U, clon S81 Beckman Coulter); o 1:100 antiCD41-PE (IM1416U, clon P2 Beckman Coulter) y antiCD61-FITC (IM1758U, clon SZ21 Beckman Coulter) por 20 min. A continuación se lavaron los preparados (3 x 1 min.) con PBS, y por último los preparados fueron montados en 50 % de glicerol conteniendo 1 µg/ml de DAPI. Todo el procedimiento fue realizado a temperatura ambiente y bajo condiciones de oscuridad. Las imágenes fueron adquiridas en un microscopio confocal Olympus FV300 que posee láseres de 405, 488, 543 y 633 nm. Todas las imágenes se obtuvieron a 2048 x 2048 con gran aumento (160 o 200X) preservando los parámetros de adquisición en todas las condiciones.
Análisis de los cultivos celulares
Los cultivos celulares fueron analizados tomando alícuotas de los mismos a diario y se adquirieron imágenes utilizando MOL y MLC. La pureza de los cultivos y el conteo final de las células obtenidas fueron determinados por citometría de flujo utilizando también la Guía ISHAGE. Se realizó un inmunomarcado con los siguientes anticuerpos monoclonales: CD34-PE-Cy7 (A51077, clon S81 Beckman Coulter), CD45-PE-Texas Red (IM2710U, clone J33 Beckman Coulter), CD41-PE y CD61-FITC. Fueron adquiridos al menos 10.000 eventos de cada muestra analizada.
Análisis estadístico y procesamiento de imágenes
Dos investigadores independientes analizaron los resultados. Se contaron al menos 350 células de diferentes campos de cada donante obtenida a lo largo del experimento. Los ensayos fueron realizados por triplicado. Se utilizó el software Origin 8.5 para realizar el análisis estadístico y los gráficos. El procesamiento de imágenes se realizó con el software Photoshop CS6.
Resultados
Mediante la utilización de citometría de flujo, se evaluó la viabilidad celular y el conteo de precursores CD34+ previo y posterior a la purificación magnética (Figura 1). Para el inicio de los cultivos celulares se partió de productos purificados que contaran con una viabilidad de células CD34+ mayor o igual al 90 %. Las células muertas y los desechos celulares fueron discriminados y aislados utilizando la dispersión frontal y lateral del citómetro de flujo.
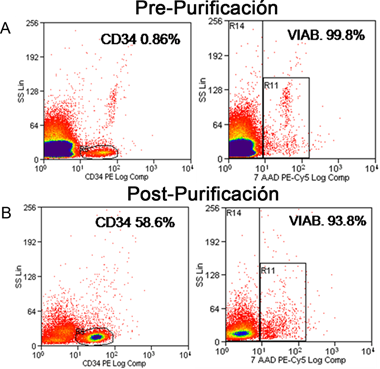
Figura 1: Purificación representativa de precursores CD34+ de donantes alogénicos humanos aceptados para trasplante de MO realizada con MACS. Diagramas de puntos de citometría de flujo mostrando el porcentaje de células CD34+ y la viabilidad celular de uno de los donantes antes y después de la purificación. Las células fueron reconocidas utilizando un anticuerpo monoclonal anti-CD34. 7-AAD indica la mortalidad celular. Los datos son expresados como porcentaje del total de células.
El análisis de la pureza y viabilidad de los cultivos de MK se llevó a cabo en el día 14 utilizando citometría de flujo (Figura 2A). Los MK fueron definidos como células CD41+, CD61+, CD34-, y fueron separados de las plaquetas utilizando la dispersión frontal del citómetro de flujo ya que el tamaño de las plaquetas es muy inferior al de los MK. Los MK CD41+/CD61+/CD34- constituyeron entre el 80 % a 85 % del total de las células, mientras que las células CD34+ oscilaron entre el 0 % y el 0,05 % en todos los cultivos realizados utilizando la concentración de TPO de 20 ng/ml. Se seleccionó esa concentración ya que la evaluación de las distintas dosis de TPO utilizadas mediante el conteo de células CD41+/CD61+/CD34- al día 14 evidenció que la riqueza era mayor cuando se utilizaban dicha concentración de TPO (Figura 2B). El análisis estadístico demostró que las medias de los grupos son significativamente diferentes (p<0,05 en todos los casos). Se realizaron, además, los recuentos de células CD34+, CD41+/CD61+, y células totales por citometría de flujo al final de los cultivos para cada concentración de TPO utilizada (Figura 2C).
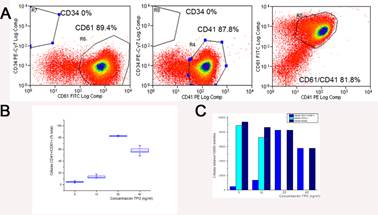
Figura 2: Evidencias inmunofenotípicas de la diferenciación megacariocítica y análisis de las diferentes dosis de TPO utilizadas. (A) Diagramas de puntos de citometría de flujo, dónde se visualiza la expresión de CD34, CD41 y CD61 en el día 14 de cultivo. Se confirma la ausencia de células CD34+ y la presencia de altos valores de células coexpresando CD41 y CD61. (B) El gráfico muestra la media y los desvíos estándar de las diferentes concentraciones de TPO utilizadas. Se evidencia que el porcentaje de células CD41+/CD61+ es mayor cuando se estimula con 20 ng/ml de TPO. Las medias de todas las concentraciones de TPO utilizadas son diferentes y estadísticamente significativas con un p<0,05 para todos los grupos. (C) El gráfico de barras expone los recuentos de células obtenidos al final de los cultivos, para cada concentración de TPO utilizada.
La caracterización de los MK obtenidos a partir de precursores movilizados de MO fue realizada a diario, lo cual permitió evaluar el estado de los cultivos durante la duración del experimento. Se utilizó la tinción de May Grünwald-Giemsa (datos no mostrados) y los marcadores específicos de MK y plaquetas CD41 y CD61 (Figura 3).
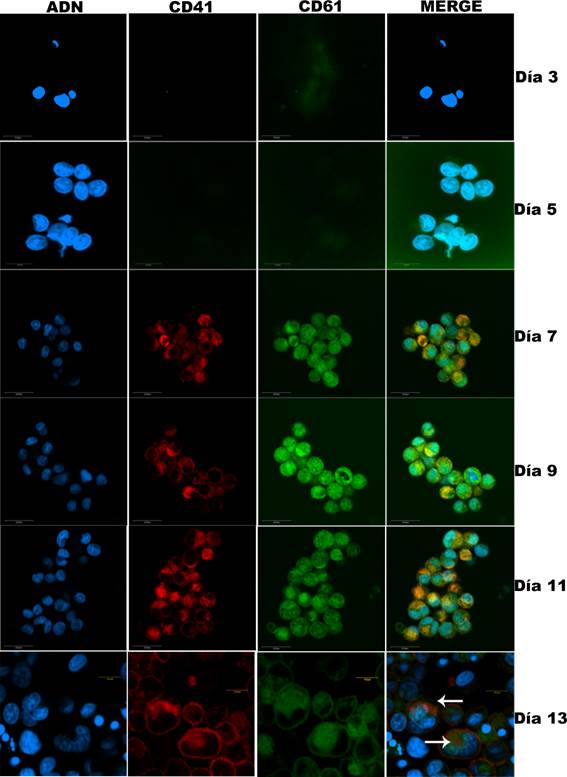
Figura 3: Coexpresión de CD41 y CD61 a lo largo de la megacariopoyesis humana in vitro. Las imágenes de MLC indican ausencia de células positivas para CD41 (rojo) y CD61 (verde) hasta el día 5 y se observan señales positivas significativas a partir del día 6 persistiendo hasta el final del experimento, confirmado la correcta diferenciación megacariocítica. Se observan células con altos niveles de ploidía en el día 13 (flechas). Los núcleos celulares fueron reconocidos con DAPI (azul).
Como control negativo de la maduración megacariocítica se utilizó CD34, el cual evidenció inmunomarcación positiva hasta el sexto día de cultivo, ya que al séptimo día no se visualizó más señal CD34+ (Figuras 4 A y B). Al contrario, no se visualizó inmunomarcación de CD41 y CD61 positiva durante los primeros días de cultivo, los cuales comenzaron a emitir señal a partir del día sexto, exponiendo el proceso de maduración de los MK desde ese día y hasta el final del experimento (Figuras 4 A y B). Estos datos evidenciaron que la diferenciación megacariocítica fue exitosa. También se realizó un análisis de ploidías (Figura 4 C), el cual reafirmó la buena diferenciación de los MK debido a los altos niveles de ploidía obtenidos.
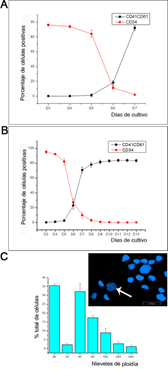
Figura 4: Análisis cuantitativo de la expresión de CD34 y de la coexpresión de CD41/CD61 durante la megacariopoyesis humana in vitro, y cuantificación de los niveles de ploidía. Porcentaje de células CD34+ y células CD41+/CD61+ con respecto al total de células (A) por recuento directo durante la primera semana de cultivo, (B) por citometría de flujo durante todo el experimento. Se visualiza que los resultados son similares por ambos métodos (C) El gráfico muestra la cuantificación de los niveles de ploidía obtenidos al final de los cultivos. Los datos están representados como porcentajes de células respecto al total. La cuantificación se llevó a cabo por conteo directo utilizando MLC.
Discusión
Debido a que es la primera vez que se realizan cultivos celulares de MK humanos en nuestro país fue necesario llevar a cabo experimentos preliminares para definir las condiciones óptimas de cultivo, definidas como tales aquellas que permitieron la expansión y diferenciación megacariocítica. También se utilizaron aspirados y biopsias de MO para la optimización de las técnicas de fijación e inmunocitoquímica.
Aunque los cultivos celulares para el estudio de la mecariopoyesis y trombopoyesis se realizan desde hace bastantes años, aún no se han establecido las condiciones óptimas para su realización. Si bien en la bibliografía científica se reportan diversos protocolos, se carece de un protocolo estándar con el cual se puedan hacer comparaciones. Por otra parte, la necesidad en el abastecimiento de plaquetas en los Bancos de Sangre hace imperiosa la realización de nuevos ajustes en los sistemas in vitro para obtener plaquetas, y así poder suplir las necesidades de la población afectada. Si bien es de suma relevancia entender los mecanismos de formación y liberación de plaquetas, en la actualidad se sabe muy poco acerca de lo que inicia y regula el proceso de formación de proplaquetas. Esto lleva a que no exista un control directo sobre el proceso de formación de plaquetas en los sistemas in vitro. En el 2007, Junt et al.32 realizaron estudios microscópicos intravitales en ratones, dónde se mostró que las fuerzas de corte del flujo sanguíneo en los sinusoides probablemente ayudaban a la liberación de las plaquetas. También se han creado biorreactores que simulan el entorno medular y muestran un aumento al doble en los rendimientos de plaquetas comparada con las condiciones estáticas, pero aún falta mucho por investigar y afinar en este campo33)(34)(35)(36)(37
En el presente trabajo se evaluaron las condiciones de estimulación óptima para obtener una alta riqueza de MK que permita tanto el estudio de la megacariopoyesis así como la obtención de proplaquetas y plaquetas. Se han evaluado distintas condiciones de estimulación con TPO, evidenciando que se necesita una dosis de TPO inicial (20 ng/ml) y un reabastecimiento de la misma cantidad de TPO al séptimo día para la obtención de un buen número y proporción de MK. Los resultados obtenidos son acordes con los obtenidos en la bibliografía científica específica21)(23)24)(25)(26)(27. Los valores de TPO utilizados en nuestro trabajo son un poco menor a la mayoría de los trabajos citados (30 a 50 ng/ml), aunque se mantiene dentro de los rangos utilizados (10 a 100 ng/ml). Esta diferencia puede ser debida a que en la mayoría de los mencionados trabajos se utilizan células patológicas, mientras que en este trabajo se utilizan células de individuos normales. Ello podría sugerir que en condiciones patológicas el umbral en el cual los precursores responden al estímulo de TPO es mayor que en condiciones fisiológicas como las que se reporta en este trabajo.
Conclusiones
Se estableció un nuevo protocolo para la obtención de una muestra altamente enriquecida de MK a partir de productos de leucoaféresis provenientes de la movilización de precursores CD34+ de donantes alogénicos aceptados para trasplante de MO. La concentración óptima de TPO hallada bajo las condiciones de cultivo establecidas fue de 20 ng/ml al principio de los cultivos y a los 7 días de transcurrido el mismo.














