Introducción
Los esteroides anabólicos androgénicos (EAA) fueron desarrollados con fines terapéuticos para el tratamiento del hipogonadismo masculino, la pubertad tardía en varones y, posteriormente, se les encontró utilidad para el cáncer de mama, la osteoporosis y la anemia aplásica1. El uso ilícito de EAA sin prescripción médica, a dosis hiperbólicas y combinaciones múltiples, resulta cada vez más frecuente en un denominador común que incluye a hombres jóvenes, con un buen estado físico, deportistas aficionados o fisicoculturistas. Su consumo puede devenir en hepatotoxicidad, insuficiencia renal, hipogonadismo, hipertrofia miocárdica y depresión.
Los EAA son derivados sintéticos de la testosterona y se denominan así por sus acciones androgénicas (el desarrollo del fenotipo masculino) y anabolizantes (síntesis proteica, acción miotrófica y crecimiento de huesos largos) imposibles de disociar porque existe un único receptor de andrógenos. Cuentan con absorción mantenida o retardada y con un metabolismo hepático disminuido con respecto a la testosterona original. De acuerdo a su estructura química y función se diferencian en tres grupos: testosterona y derivados (propionato, metiltestosterona, metandrostenolona); dihidrotestosterona y derivados (estanozolol, drostanolona, oximetolona, metenolona, oxandrolona, entre otros) y nandrolona y derivados (noretandrolona, etilestrenol, entre otros). La alquilación C-17 se asocia a injuria hepática y ha extendido el consumo por habilitar la vía oral y mayores dosis por toma1.
A nivel hepático la presentación hepatocelular es más frecuente, pero la colestásica es más grave y puede asociarse a falla renal. Se ha descrito peliosis y el hallazgo de adenoma o carcinoma hepatocelular con el consumo prolongado2. La prevalencia de hepatotoxicidad es difícil de estimar ya que el diagnóstico de certeza es complejo y la notificación de reacciones adversas a fármacos, por parte de los profesionales sanitarios, es escasa. Se cree que el uso ilícito de EAA supera lo prescripto para uso terapéutico, por lo que este problema de infranotificación es aún mayor3
Caso 1
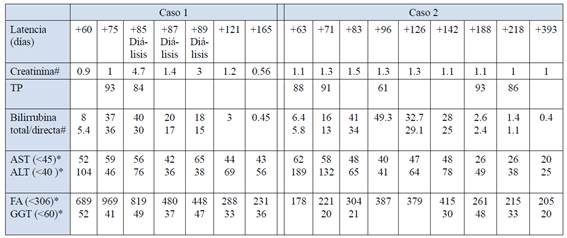
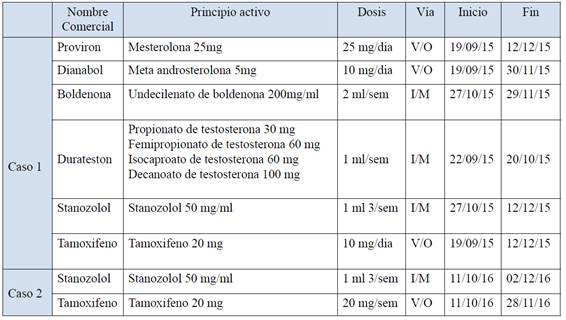
Hombre de 36 años, sin enfermedad hepática previa diagnosticada ni antecedente de alcoholismo, consultó por malestar abdominal inespecífico de 10 días de evolución, prurito, coluria e ictericia, sin fiebre, rash u otra sintomatología acompañante. Al examen físico solo destacaba la ictericia y lesiones de rascado. La ecografía abdominal al ingreso describía una vesícula con microlitiasis, de paredes finas, sin dilatación de la vía biliar, sin alteraciones de la morfología hepática y el bazo era de tamaño normal. El laboratorio inicial y los posteriores se detallan en la Tabla 1. En la evolución se destaca un ascenso progresivo de bilirrubina hasta 41 mg/dL, agregando alteración de la función renal con requerimiento de 3 sesiones de hemodiálisis. Fue con la gravedad del cuadro que el paciente reconoció el consumo de EAA y otros fármacos durante los 3 meses previos a la consulta y los discontinuó 16 días antes (Tabla 2). La serología viral (VHA, VHB, VHC, CMV) y los marcadores de autoinmunidad (ANA, ASMA, AMA, Anti LKM-1) fueron negativos. A 5 meses del debut se observó la normalización de las alteraciones hepáticas y renales.
Caso 2
Hombre de 26 años, celíaco, que cumplía dieta libre de gluten, sin enfermedad hepática previa diagnosticada ni antecedente de alcoholismo, consultó por ictericia, sin fiebre, dolor, rash u otra sintomatología acompañante. Ante la insistencia en la consulta el paciente reconoció el consumo de EAA y otros fármacos sin indicación médica durante los 2 meses previos a la consulta y los discontinuó 11 días antes (Tabla 2). La ecografía abdominal al ingreso fue normal. El laboratorio inicial y evolutivo se detalla en la Tabla 1. En la evolución presentó un ascenso (hasta 49 mg/dL) y desarrolló intenso prurito. La alteración leve y estable de la creatininemia no requirió hemodiálisis. La serología viral (VHA, VHB, VHC, VIH, CMV, VEB) y los marcadores de autoinmunidad (ANA, ASMA, AMA, Anti LKM-1) fueron negativos.
Discusión
El uso de los EAA sin prescripción médica es ilegal en la mayoría de los países, sin embargo, el consumo por parte de fisicoculturistas y atletas jóvenes está creciendo. En Estados Unidos se estima entre 1 y 3 millones de consumidores de EAA, 3-31% en usuarios de gimnasios y entre el 16-50% en culturistas1. En el registro español se evidenció un aumento significativo del 1 al 8% del número de casos de DILI reportados en los últimos 4 años por esta causa2.
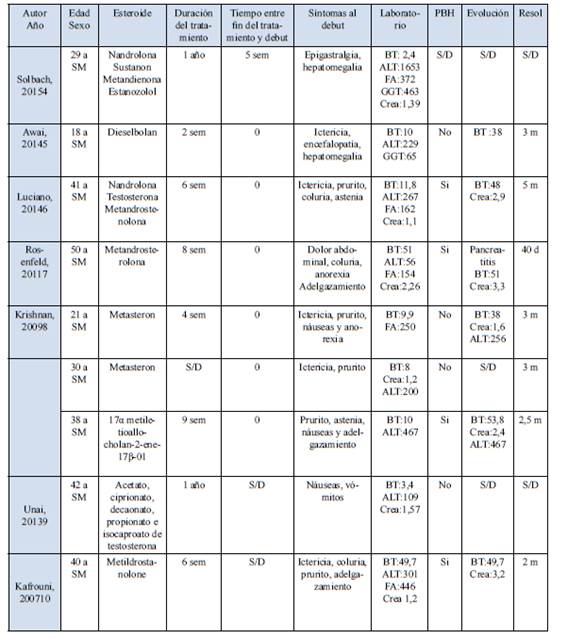
El espectro clínico de la lesión hepática es variable y debido al uso ilícito de estas drogas, la mayoría de la información disponible proviene del reporte de casos aislados o series pequeñas. Lo habitual es que en un mismo paciente haya una asociación de distintos fármacos, como en los casos presentados. Al fármaco que con mayor frecuencia se atribuye la toxicidad es al estanozolol, ya sea en forma aislada o asociada con otros EAA. El denominador común es la elevación de la bilirrubina, y la necesidad de hospitalización es frecuente4)(5)(6)(7)(8)(9)(10. En la Tabla 3 se resumen los datos más significativos de los casos publicados. El perfil hepatocelular es el más descrito y el colestásico el más severo y menos frecuente, también está descrito en la literatura el desarrollo de adenomas, hepatocarcinoma y peliosis11. A pesar de que el fenotipo predominante es la combinación de daño hepatocelular con bilirrubina elevada, los pacientes en general no desarrollan falla hepática fulminante. Este resultado favorable contradice el paradigma de la Ley de Hy, que establece que los pacientes con lesión hepatocelular asociada a ictericia tienen mayor riesgo de falla hepática2
El daño hepático generalmente se desarrolla en un período de hasta 4 meses luego de iniciada la terapia (como se comprueba en los casos expuestos), pero puede presentarse incluso luego de 24 meses. La presentación colestásica generalmente es insidiosa con desarrollo de náuseas, fatiga y prurito, seguida de coluria e ictericia. La ictericia y el prurito se pueden prolongar tras discontinuar la medicación. Por lo general la elevación de las enzimas séricas es modesta, con niveles de ALT y FA de 2 a 3 veces el valor normal a pesar de la ictericia. Cursan con GGT normal, por lo que es importante considerar como diagnósticos diferenciales el consumo de anticonceptivos orales, la colestasis gravídica y algunas formas de colestasis familiares. La biopsia hepática muestra típicamente una colestasis blanda, con mínima inflamación y necrosis hepatocelular. El daño de los conductos biliares es leve o está ausente12)(13.
El paciente del caso 1 tuvo una evolución a la falla renal aguda con requerimiento de hemodiálisis y por ende quedó catalogado como un caso severo de DILI14. Existe una estrecha relación, dependiente del tiempo, entre el nivel de bilirrubina y la función renal, lo que sugiere un rol de la bilirrubina en el daño renal de estos pacientes. Se estima que el mejor punto de corte del valor de bilirrubina para predecir el riesgo de disfunción renal es 21,5 mg/dL2. No se sabe claramente el mecanismo de injuria pero se ha propuesto como mecanismo la necrosis tubular aguda secundaria a la colestasis severa y el incremento de la excreción renal de bilirrubina7.
La aplicación de la escala de CIOMS permitió categorizar la causalidad como probable para ambos caso (scores de 8 y 6 respectivamente)15.
Con respecto al manejo de la hepatotoxicidad por EAA, ningún tratamiento está establecido, salvo la retirada del fármaco. La recuperación es lenta y en general se logra luego de 3 a 6 meses de la suspensión, como se observa en los casos expuestos. Existen casos publicados que reportan el éxito del tratamiento de la ictericia progresiva por EAA con ácido ursodeoxicólico aunque su rol está en revisión1. El uso de corticoides es inefectivo por lo que debe ser evitado13.
La prevalencia de hepatotoxicidad por EAA parece estar aumentando, probablemente por un aumento del consumo ilícito. La dificultad para reglamentar y controlar la distribución de estos productos supone un problema de salud pública y es responsabilidad de los médicos concientizar a la población sobre los riesgos de estos fármacos.