Introducción
En la patogenia de la EII se han identificado diferentes mecanismos inmunológicos implicados en su desarrollo. El TNF-α es una de las citoquinas principales en la patogénesis de la EII, y agentes que bloquean selectivamente el TNF-α han demostrado ser eficaces1, pero asocian un incremento de desarrollo de TB.
El Mycobacterium tuberculosis se transmite habitualmente por vía aerógena, alcanzando los alveolos donde desencadena una serie de respuestas tisulares e inmunológicas conocidas como primo infección tuberculosa. Los linfocitos activadores de los macrófagos, las células epiteloides y las gigantes se sitúan concéntricamente para rodear e intentar destruir a los bacilos dando lugar al característico granuloma tuberculoso. Las micobacterias persisten latentes, capaces de resistir ocultas en el interior de algunas células o en pequeños focos caseosos y frente a alteraciones de la inmunidad, se altera este equilibrio2.
Los fármacos anti TNF-α interfieren con la respuesta innata y adaptativa que es esencial para contener la infección en los granulomas, observándose un aumento de desarrollo de TB activa. Con el tratamiento de la ITBL el número de personas que desarrollan TB activa ha disminuido significativamente. Por lo tanto, la detección de ITBL antes de la iniciación de los anti TNF-α es obligatoria y el tratamiento de la misma es parte integral del control de la TB3)(4)(5.
La ITBL se define por la presencia de prueba de tuberculina o ensayo de liberación de interferón gamma -IGRAs- (QuantiFERON TB) positivos en un paciente asintomático con radiografía de tórax (RxTx) normal6.
En estos casos la isoniazida es el tratamiento de elección para prevenir la progresión de la infección, aun cuando la misma puede asociar reacciones adversas, siendo la más frecuente la hepatotoxicidad, menos frecuentemente se observan lesiones de piel6)(7)(8.
Se discute el caso de una paciente con diagnóstico de Enfermedad de Crohn, que durante tratamiento con Infliximab (IFX) presenta ITBL, presentando reacción adversa a isoniazida.
Caso Clínico
Paciente de 21 años, sexo femenino, mal medio socioeconómico. Fumadora esporádica hasta los 18 años, sin noción de contacto con TB. Inicia a los 16 años con vómitos reiterados, acompañado de gran repercusión general, diagnosticándose enfermedad de Crohn con compromiso gastroduodenal que implicaba dificultad en la alimentación. En la evolución agrega compromiso ileal, colónico y perianal. Se inicia corticoides presentando corticodependencia y en diciembre 2014 se inicia infliximab (IFX) concomitantemente con azatioprina (AZA). Se realiza dosis de inducción de IFX a dosis de 5mg/kg y luego cada 8 semanas, previo a la realización de RxTx normal y QuantiFERON-TB negativo. Buena respuesta inicial pero luego de cuarta dosis de mantenimiento reinstala vómitos, descenso de peso, anemia y aumento de proteína C reactiva, por lo que se disminuye el intervalo de infusión de IFX a 4 semanas. En diciembre 2015 presentando niveles de IFX en rango (7,6 ug/ml) reinstala síntomas.
En marzo 2016 se constata QuantiFERON-TB positivo. La paciente niega haber estado expuesta a factores de riesgo para TB. No presenta síntomas respiratorios, sin fiebre y con RxTx normal. Se plantea ITBL y bajo seguimiento con neumólogo se inicia quimioprofilaxis con isoniazida a 300 mg/día en junio 2016. Dada la escasa respuesta al tratamiento y la complicación con ITBL, se suspende IFX y AZA. Al mes del tratamiento con isoniazida se inicia metrotexate (MTX) a dosis de 25mg vía oral semanal más ácido fólico.
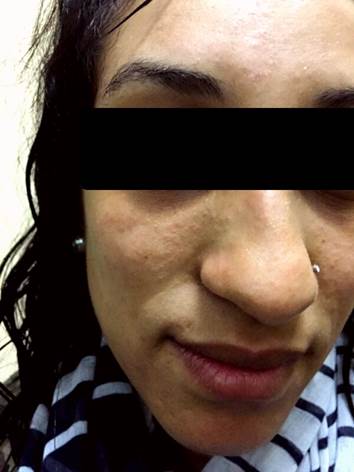
A los 4 meses consulta por lesiones eritematosas sobreelevadas de 2-3cm de diámetro, periorbitarias, acompañado de edema y erupción cutánea facial, con posterior descamación, acompañado de adenomegalias retroauriculares (Figura 1).
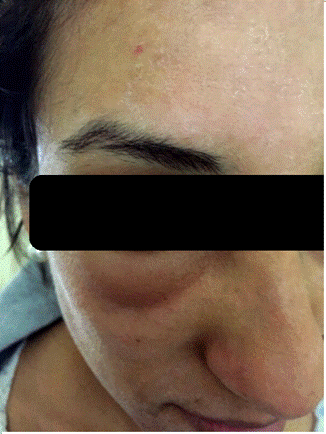
Figura 1: lesiones eritematosas sobreelevadas, periorbitarias, acompañado de edema, erupción y descamación cutánea facial, luego de la exposición a isoniazida
Se realiza radiografía de senos faciales y tomografía de tórax normales, tomografía de abdomen y pelvis sin cambios, hemograma y hepatograma normales, serología para toxoplasmosis, Chagas, virus de Epstein Bar, citomegalovirus y hepatitis A, B y C negativas.
Se plantea reacción adversa cutánea secundaria a MTX, suspendiéndose la misma. Concomitantemente la paciente abandona por cuenta propia isoniazida. A los 10 días presenta regresión total de las lesiones de piel y adenopatías. Al mes se reinstala isoniazida en monoterapia, presentando nuevamente a los 4 meses la misma reacción (Figura 2), por lo que se suspende, habiendo cumplido 8 meses de isoniazida.
Actualmente, a los 5 meses de suspendido la isoniazida paciente no ha reinstalado lesiones cutáneas.
Discusión
Con el advenimiento de la terapia anti TNF-α se ha observado un aumento del desarrollo de TB con distintas formas clínicas de presentación. El IFX es el agente anti TNF-α que se asocia con mayor riesgo de TB activa, debido probablemente a que produce un bloqueo completo del TNF. Se encontró para el IFX una tasa de incidencia media de TB activa de 284.5 por 100.000 personas año y para el adalimumab 203 por 100.000 personas año. En estos pacientes son más frecuentes las formas extrapulmonares (hasta en el 65% vs 17.5% en la población general), viéndose formas diseminadas hasta en el 25% de los pacientes9)(10.
El riesgo de TB activa depende, además, de otros factores de riesgo individuales y epidemiológicos como son: edad (adultos mayores), malnutrición, ser procedente de un país con incidencia media-alta como lo es nuestro país con 25,2 casos por 100.000 habitantes en el año 20149)(10)(11.
La identificación y tratamiento de la ITBL puede reducir sustancialmente el riesgo de desarrollar una enfermedad activa. Sin embargo, no hay un estudio patrón oro para el diagnóstico de la ITBL. Dos test están disponibles para la identificación de la misma: prueba de tuberculina intradérmica (PPD) con booster o QuantiFERON-TB. La evidencia sugiere que ambos test son aceptables pero tienen sus limitaciones12.
Si bien se conoce que hay dificultad en la interpretación de los resultados de estos test, la detección de ITBL antes de iniciar los fármacos anti TNF-α es obligatoria por el riesgo de TB activa que conlleva y una vez iniciado dicho tratamiento, en aquellos que fueron negativos para los test de detección de TB, se recomienda repetir PPD o QuantiFERON-TB anual4)(6)(13.
El tamizaje se realiza con una historia clínica completa dirigida a valorar signos y síntomas de TB actual y/o riesgo de presentar contacto con pacientes infectados con TB, RxTx, prueba de tuberculina intradérmica (PPD) con booster o QuantiFERON-TB. El PPD se considera positivo a una reacción igual o mayor a 5 mm en estos pacientes. Si es menor a 5 mm no descarta ITBL dado que la propia enfermedad puede determinar anergia y además de posibles resultados falsos negativos por anergia relacionada con tratamiento con esteroides e inmunosupresores (hasta 83%). Cuando es negativa se debe realizar el booster, que es otra prueba de tuberculina a la semana o dos semanas, o preferentemente realizar QuantiFERON-TB. El mismo mide la liberación de interferón gamma luego de la exposición al antígeno de TB. Es más específico que la prueba de tuberculina13.
Planteamos que nuestra paciente adquirió la infección durante el tratamiento con IFX, dado que previo al inicio del mismo las pruebas para detección de TB dieron negativas y si se iniciara el anti TNF-α cursando una ITBL, la enfermedad activa se produce en los 2- 5 meses de iniciado el tratamiento14.Nuestra paciente positiviza el QuantiFERON-TB luego de 15 meses de tratamiento sin síntomas de infección de TB, con RxTx normal y sin evidencia de infección extrapulmonar. Si bien no se puede confirmar que exista una ITBL, frente al riesgo en una paciente inmunodeprimida y evolucionar a TB activa bajo tratamiento con anti TNF- α, se decide tomar el nuevo valor del test de QuantiFERON-TB como conversión y realizar tratamiento preventivo.
Cuando se detecta ITBL se debe iniciar quimioprofilaxis con isoniazida 300 mg día durante 6 a 9 meses o rifampicina por 4 meses4)(13. Los pacientes con ITBL deben comenzar el tratamiento con isoniazida 1 mes antes del inicio de la primera aplicación del anti TNF-α. En los pacientes que ya están recibiendo terapia inmunomoduladora, si desarrollan ITBL como fue el caso de nuestra paciente se aconseja suspensión de la terapia biológica por un mes e inicio de isoniazida. En caso de presentarse una TB activa, el anti TNF-α debe suspenderse4)(10.
Los efectos adversos más frecuentes de la isoniazida son hepatitis y la neuritis periférica, pero hay que tener presente, si bien la incidencia es baja <0,001%, las reacciones adversas cutáneas7)(8.
Nuestra paciente presentó una reacción adversa de piel localizada a nivel facial con lesiones eritematosas, sobreelevadas, periorbitarias, acompañado de edema y erupción cutánea facial, con posterior descamación. La secuencia temporal razonable entre la administración del fármaco y la reacción adversa, la exclusión de causas alternativas, la buena evolución tras la retirada, y principalmente la reaparición de la reacción frente a la reexposición establecen la relación causal entre la isoniazida y las lesiones cutáneas. La reexposición se realizó con el planteo de que la reacción adversa era secundario a MTX15.
Se podría no haber re-expuesto a la paciente y haber utilizado en su lugar a la rifampicina como tratamiento antituberculoso de haberse relacionado las lesiones de piel a la isoniazida4)(13).
Una de las complicaciones del tratamiento con anti TNF-α es el desarrollo de TB. La identificación y tratamiento de la ITBL puede reducir sustancialmente el riesgo de desarrollar una enfermedad activa. Sin embargo, no hay un estudio patrón oro para el diagnóstico de la ITBL ni algoritmos nacionales a seguir en estos pacientes. El diagnóstico de ITBL obliga el tratamiento de esta infección con otras drogas que no están libres de efectos adversos.
Crear pautas nacionales para detección de TB en estos pacientes y el diagnóstico precoz de los efectos adversos durante el tratamiento preventivo, con el retiro de la droga sospechosa, evitando la re-exposición con la utilización de otra opción terapéutica como lo es la rifampicina es fundamental para un manejo adecuado.