Introducción
El estudio de las estrategias neurales para la organización del comportamiento en vertebrados es uno de los mayores desafíos para la Neurociencia. El avance del conocimiento en este campo depende de manera crítica de la utilización de modelos experimentales adecuados que admitan múltiples niveles de análisis (p.ej: comportamental, circuital, celular, sináptico, molecular) así como del uso de técnicas variadas, corrientemente utilizadas en diversas disciplinas. En este sentido, por la relativa sencillez de su sistema nervioso y la robustez de algunos de los comportamientos que despliegan, los invertebrados se han constituido en modelos experimentales valiosos para el estudio de las bases neurales del comportamiento 1. En contraste con el avance en el conocimiento de las bases neurales del comportamiento en invertebrados y vertebrados inferiores (ver p.ej. ref. 2)(3)(4)(5), los niveles circuital, celular y sináptico de organización de comportamientos relativamente complejos en mamíferos, organizados a niveles intermedios de integración neural han sido poco explorados. La dificultad en la identificación de los circuitos neurales responsables de estos comportamientos, la complejidad inherente a los mecanismos implicados y la ausencia de modelos experimentales adecuados para su estudio, constituyen algunos de los obstáculos más significativos para el progreso en la comprensión de sus bases neurales.
El estudio del ciclo de sueño y vigilia ha concitado el interés de la comunidad científica no solo por su proyección neurobiológica general sino, además, por su impacto sobre el neurodesarrollo, el aprendizaje y la memoria, la regulación de funciones metabólicas y, más recientemente, por su vinculación a ciertos estados patológicos en seres humanos (ver para revisión ref.6)(7). Pese a tratarse de estados comportamentales complejos, particularmente el sueño de movimientos oculares rápidos también llamado activo o paradójico (en lo que sigue, sueño REM, de "rapid eye movements", S-REM) emerge como un modelo de estado comportamental, relativamente bien definido y robusto en el que, aún cuando su expresión involucra amplios sectores del SNC, los mecanismos responsables de su generación parecen operar en una región relativamente acotada del tronco encefálico. En efecto, un cúmulo de evidencias obtenidas fundamentalmente de preparaciones in vivo, han permitido postular que un área restringida del puente rostral, ventral y medial al locus coeruleus, localizada en o en la vecindad del PnO -de acuerdo a la terminología utilizada para describir los agrupamientos neuronales de la formación reticulada pontina8- contiene la red neural responsable de la generación y de la organización del S-REM6)(7)(9)(10)(11)(12)(13). Existe consenso en que los núcleos tegmentales laterodorsal y pedunculopontino (LDT-PPT) y su proyección colinérgica a las neuronas de la FRP, promotora de S-REM, constituyen elementos críticos de esta red (sin embargo, ver más adelante). Las neuronas de la FRP son blanco además de influencias moduladoras mediadas por serotonina (5-HT) y noradrenalina cuyos efectos asocian la supresión de S-REM y promueven un estado comportamental con las características básicas de la vigilia. Si bien persiste el debate en este sentido, se acepta que el PnO de la formación reticulada pontina oficiaría de conmutador principal o de "conexión nodal" (traducción de "nodal link"; ver ref.14) para la generación, organización y mantenimiento del S-REM. Se han elaborado varios modelos con valor heurístico tendientes a explicar tanto la fenomenología del S-REM como su regulación6)(13)(15)(16)(17)(18)(19)(20. En general, estos modelos suponen el control dual y antagónico. Ver modelos propuestos en:6)(14)(17)(21)(22)(23)(24 sobre la red mesopontina responsable del S-REM, particularmente de la zona ejecutiva de la FRP, y de alguna manera sugieren la existencia de una red de propósito único cuyo nivel de activación determinaría la probabilidad de aparición de S-REM. En efecto, el concepto que subyace a estos modelos establece que la aparición del S-REM, con sus diversos componentes, resulta de la activación de neuronas glutamatérgicas REM-on localizadas en la FRP. Revisado en22 sugiriendo un mecanismo basado en la existencia de una red dedicada para la generación y control de este estado comportamental.
Sin perjuicio de lo anterior, los modelos cualitativos referidos más arriba no incorporan la modulación de la eficacia de los contactos sinápticos de la red, particularmente los que reciben las células ejecutivas para el S-REM de la FRP, como factor determinante de la operativa del circuito mesopontino y, en consecuencia, como mecanismo contribuyente a la generación, mantenimiento y control del S-REM. La participación de este tipo de fenómenos plásticos a nivel de la red mesopontina ha sido poco explorada25)(26 y su papel en el control del S-REM y otros estados comportamentales queda aún por determinarse.
En el curso de experimentos electrofisiológicos en rodajas del tronco encefálico de la rata orientados al estudio de los efectos de las neurotrofinas sobre las propiedades electrofisiológicas intrínsecas de las neuronas de la formación reticulada pontina27 uno de nosotros (J Yamuy) detectó la potencialidad del uso de una rodaja de tronco encefálico -como la utilizada en el presente trabajo- para el estudio de los mecanismos celulares y sinápticos que operan en la red mesopontina responsables de la generación y mantenimiento del S-REM y el control de la vigilia 28. Para ello, esta rodaja debería contener las estructuras clave implicadas en la regulación del S-REM y de la vigilia, cuyas interconexiones se encuentren conservadas y permanezcan operativas in vitro y, finalmente, elementos neurales capaces de expresar signos característicos del S-REM, equivalentes de la atonía muscular. Somos conscientes que no es posible reproducir in vitro la completitud fenomenológica de estados comportamentales complejos. Sin embargo, un abordaje reduccionista adecuado a los requerimientos del modelo experimental expresados más arriba, permitiría acceder a los mecanismos neuronales y sinápticos que operan en estructuras centrales para la organización y regulación de algunos componentes cardinales de estos estados comportamentales, particularmente del S-REM.
En el presente trabajo, como un paso inicial en el desarrollo de un proyecto de largo aliento orientado al estudio de las estrategias neurales para la organización y regulación de estados comportamentales como el sueño y la vigilia, llevamos adelante la caracterización de una preparación reducida de SNC de la rata in vitro. Utilizando múltiples abordajes experimentales y técnicas, demostramos que las estructuras críticas para el control del S-REM están presentes y son operativas en la rodaja mesopontina. Más aún, la inclusión del núcleo motor del trigémino en esta rodaja permitió detectar modificaciones de la excitabilidad de las motoneuronas provocadas por manipulaciones farmacológicas del PnO representativas de las observadas en modelos in vivo ante similares maniobras experimentales29)(30)(31. La utilización de este modelo in vitro de S-REM, contribuirá a la dilucidación de las estrategias neurales que operan en niveles intermedios de organización del SN en mamíferos para la generación y regulación de un estado comportamental.
Materiales y métodos
Obtención de la rodaja
Los animales se obtuvieron de la Unidad de Reactivos y Biomodelos Experimentación (U.R.B.E.) de la Facultad de Medicina, UdelaR y los procedimientos utilizados fueron aprobados por la Comisión Honoraria de Experimentación animal y la Comisión de Experimentación Animal de Facultad de Medicina (Exp. Nº 071140-000654-10).
Se utilizaron ratas de cepa Wistar entre P7 y P15. En esta etapa de la vida post-natal la mielinización no ha alcanzado el desarrollo del adulto, aspecto que fue relevante a la hora de optimizar las condiciones de visualización de las neuronas a registrar.
Las ratas fueron decapitadas y se realizó una craneotomía ampliada para acceder y remover rápidamente el tronco encefálico. Durante la disección, el SNC se bañó continuamente con solución de líquido cefalorraquídeo artificial (LCRA) modificado: Sacarosa 213 mM, KCl 2.7 mM, KH2PO4 1.25 mM, MgSO4∙7H2O 2 mM, NaHCO3 26 mM, glucosa 10 mM, CaCl2 2 mM a 4ºC. La sustitución equimolar del ion sodio por sacarosa se utilizó para reducir la actividad neuronal y la actividad sináptica minimizando los procesos de excitotoxicidad y muerte neuronal32.
La pieza obtenida se fijó a la platina de un vibrátomo (Vibratome 1000plus, Vibratome) sumergiéndola en LCRA modificado a 4ºC. Se realizaron cortes transversales al eje mayor del tronco encefálico obteniendo rodajas de 350-450 µm de espesor. Las rodajas de la unión ponto-mesencefálica se mantuvieron en una mezcla (50%-50%) de solución de LCRA normal NaCl 126 mM, KCl 5 mM, glucosa 10 mM, NaHCOla pieaza obtenida 26 mM, HEPES 2 mM, MgCl2 6H2O 2mM, CaCl2 2 mM y LCRA modificado a temperatura ambiente (20 a 22ºC). La mezcla de LCRA se remplazó paulatinamente (en 1 hora) hasta alcanzar el 100% de solución LCRA normal. La rodaja de trabajo fue transferida luego a la cámara de registro (cámara de inmersión), y se perfundió con solución LCRA normal a temperatura ambiente (1-3 ml/min). El LCRA fue burbujeado continuamente con carbógeno (95% O2-5% CO2) a los efectos de estabilizar el pH (7.4) y promover la oxigenación. Para conservar en una misma rodaja las estructuras clave de la red mesopontina implicada en el control del S-REM (ver más adelante), las secciones del tronco encefálico se obtuvieron de manera tal que el plano de corte formó un ángulo de 4-6º con respecto a los cortes coronales. La cámara de registro se dispuso en la platina de un microscopio (Nikon, Eclipse FN1) dotado de iluminación infra-roja y óptica para contraste de interferencia diferencial (DIC-IR) con objetivos X4 y X40 (inmersión en agua). Una cámara digital (319CU 3.2M CMOS, Micrometrics) conectada a un ordenador permitió la exploración de la rodaja, la visualización de las neuronas, la colocación de los electrodos de estimulación y registro y de las micropipetas para aplicación local de sustancias.
Estímulo eléctrico
Para la estimulación eléctrica del área del LDT-PPT, del PnO o la raíz del NM V (según el objetivo específico del experimento) se utilizó un electrodo metálico bipolar (nichrome, 75 micras) conectado a un estimulador GRASS S88 (Grass Medical Instruments, Quincy Mass USA) a través de una SIU (GRASS SIU5) o mediante la utilización de una SIU controlada por una señal de tipo TTL (2620 Stimulus Isolator, Tektronik Beaverton Oregon, USA) por medio de la salida digital de la tarjeta de conversión (Digidata 1322). En este caso, los parámetros de estimulación fueron controlados por el software (Clampex 8, paquete pClamp, Axon Instruments). A los efectos de activar neuronas del LDT-PPT y obtener resultados comparables entre experimentos, el electrodo de estimulación sistemáticamente se colocó en una relación topográfica precisa con el extremo medial del pedúnculo cerebeloso superior (p.c.s., Figura 1B). Para cada experimento se ajustó la intensidad del estímulo hasta obtener una respuesta de amplitud y latencia estable con valores similares a los observados en otros experimentos de modo de trabajar con una población relativamente homogénea de respuestas postsinápticas. Ocasionalmente se utilizaron pares de estímulos a intervalos variados (5 a 150 ms) de acuerdo al objetivo del experimento y a la estructura en análisis.
Registro intracelular
Para el registro intracelular se utilizaron electrodos de patch (resistencia 4-8 MOhm) fabricados con un estirador de pipetas (P-87 Sutter Instruments Co.) en su configuración de célula entera (o de whole cell). Se emplearon medios intracelulares con diferentes composiciones con el fin de controlar el potencial electroquímico de ciertos iones de interés, y la optimización la relación señal-ruido de los registros bioeléctricos. Así, para el estudio de la acción GABAérgica, se utilizó una solución con alta concentración de Cl- (150 mM, potencial de equilibrio electroquímico calculado ~ 3 mV) (MgCl2 4.6mM, HEPES 10mM, EGTA 1 mM, CaCl2 0.1 mM, ATP-Na 4 mM, GTP-Na 0.3 mM) de tal manera que en el potencial de reposo (potencial de mantenimiento, Vh -70 mV) la corriente sináptica GABAérgica fue de entrada y fácilmente detectable. En aquellos experimentos en los que se analizaron corrientes sinápticas glutamatérgicas se empleó un medio intracelular basado en gluconato de K+ (Gluconato de K+ 144mM, EGTA 0,2mM, MgCl2 3mM, HEPES 10mM, NaGTP 0,3mM, Na2ATP 4mM). Ocasionalmente los registros se realizaron con electrodos afilados (50 a 70 MOhm) conteniendo Acetato de K+, 4 M.
Los electrodos de registro se posicionaron mediante un micromanipulador hidráulico (Narishige MHW-13), se conectaron a un amplificador Axoclamp 2B (Axon Instruments) y se obtuvieron registros en la modalidad de fijación de corriente y/o de voltaje según las necesidades específicas del experimento. Se compensó la resistencia del electrodo (al 100% en condiciones de fijación de corriente) o la resistencia en serie (hasta un 50%) para el registro en condiciones de fijación de voltaje. Los protocolos específicos en ambas modalidades de registro fueron aplicados utilizando el software CLAMPEX 8.0 (pClamp, Axon Instruments). Las señales registradas se digitizaron (Digidata 1322A, Axon Instruments) para su almacenamiento en un ordenador y su posterior análisis.
A nivel del PnO, una vez seleccionada la neurona a registrar, de manera sistemática se consignó tanto el tamaño de su soma (dimensiones aproximadas en µm) como su forma. Para la obtención del registro de patch se procedió de manera estándar 33 en condiciones de fijación de voltaje. Una vez establecido el sello (> 1GOhm) entre la pipeta y la membrana neuronal (configuración cell attached), se aplicó una leve presión negativa perforando el parche de membrana, ganando acceso eléctrico al medio intracelular (configuración whole cell). En estas condiciones se llevó a cabo la caracterización electrofisiológica de la neurona y se buscó correlacionar estas propiedades con las características del soma neuronal consignadas previamente. Una vez estabilizado el registro y compensada la resistencia del electrodo se procedió a consignar el valor del potencial de membrana (Vm) y a aplicar protocolos específicos para estimar la resistencia de entrada de la neurona (Ren). De manera rutinaria, la Ren se evaluó mediante una serie de pulsos de corriente hiperpolarizantes y despolarizantes (fijación de corriente, ver para ejemplos (Figura 2A, 3A). En Clampfit (pClamp 8) se midieron Im (corriente inyectada) y el cambio del Vm resultante para cada pulso, mediante cursores colocados en el instante correspondiente al máximo de respuesta para el pulso máximo hiperpolarizante (típicamente a 50-70 ms del inicio del pulso). Los valores obtenidos se graficaron y la Ren se estimó por ajuste de una recta a los puntos del sector lineal del gráfico (típicamente entre 0 y -60 mV). En otras ocasiones, en condiciones de fijación de voltaje, se empleó una rampa de voltaje (520 ms, -90 a -50 mV) y se midió la corriente durante la rampa. En estos casos, el gráfico (I vs V) se obtuvo representando el trazado de corriente contra el correspondiente trazado de voltaje durante la aplicación de la rampa, se ajustó una recta a los puntos representados y se estimó la Ren según los parámetros de la recta ajustada (1/pendiente). Se analizaron las propiedades electrofisiológicas activas utilizando protocolos específicamente diseñados tanto en condiciones de fijación de corriente como de voltaje. Se analizó particularmente la presencia de corrientes de potasio transitorias (de tipo IA), corrientes catiónicas activadas por hiperpolarización (de tipo Ih), corrientes de calcio transitorias (IT), identificadas en estudios previos como representativas del fenotipo electrofisiológico de las neuronas de este sector de la FRP25)(26)(34)(35)(36)(37)(38)(39. Los registros se analizaron utilizando el programa Clampfit 9, parte del paquete de software de pClamp (Axon Instruments, Inc.). Las características específicas de los protocolos utilizados para poner de manifiesto cada tipo de corriente de membrana se describen con la presentación de los resultados correspondientes.
En los experimentos orientados al análisis de la modulación de la excitabilidad de las motoneuronas por aplicación de agentes colinérgicos y GABAérgicos en el PnO, estas células fueron caracterizadas mediante la aplicación de familias de pulsos de corriente hiper y despolarizantes y la resistencia de entrada se monitorizó mediante la inyección de pulsos de corriente hiperpolarizante (típicamente 1 nA) o la aplicación de rampas lentas de baja amplitud (-0.3 a 0.3 nA en 1s).
Marcaje intracelular
En una serie experimental se procedió al marcaje intracelular de las neuronas registradas con vistas al establecimiento de su citomorfología general (soma y prolongaciones) y su correlación con los hallazgos electrofisiológicos. Para ello, los electrodos de patch utilizados para los registros intracelulares se llenaron con solución intracelular basada en gluconato conteniendo neurobiotina (2%) lo que permitió la caracterización electrofisiológica de la neurona y demás maniobras experimentales durante la difusión del colorante en el medio intracelular40. Una vez finalizado el experimento se retiró el electrodo de registro a la vez que se ejerció una leve presión positiva. La rodaja permaneció en la cámara por un período no menor a 4 horas esperando una adecuada difusión del colorante en la célula marcada y luego se fijó durante la noche (~8 horas) en paraformaldehído al 4% en buffer fosfato (0.1 M). Finalizada la fijación se pasó a una solución de buffer fosfato (PBS, pH 7,3) hasta el posterior procesamiento para observación. En cada rodaja se marcó únicamente una neurona del PnO, para facilitar su identificación y la adecuada correlación con los hallazgos electrofisiológicos.
Para el revelado, se utilizó Vectastain ABC System (Vector Laboratories, Burlingame, CA, USA) empleando el procedimiento descrito originalmente por Kita y Armstrong (1991)41. Después de varios lavados con PBS, la rodaja fue tratada con Triton-X100 (0,4% en PBS) durante 1 a 2 horas y después se incubó en VECTASTAIN® ABC reactivo en PBS durante 2 horas. Después de varios lavados con PBS, se hicieron reaccionar con diaminobencidina (DAB 0,05%) y H2O2 (0,003%) en PBS.
Las preparaciones histológicas se observaron con microscopia de luz (Nikon Optiphot), documentando mediante fotografía digital (Kodak MDS120). Las neuronas marcadas se fotografiaron y dado que ocuparon más de un plano focal se procedió a su reconstrucción mediante el uso de un dispositivo de cámara clara acoplado a un microscopio Olympus BX60.
Marcaje retrógrado e inmunohistoquímica
La presencia de neuronas del LDT-PPT conectadas con elementos neurales del PnO en la rodaja mesopontina se exploró mediante la aplicación por iontoforesis de marcador retrógrado en el PnO. Para ello, una pipeta conteniendo solución de neurobiotina al 2%42 en acetato de potasio (4 M) se posicionó en el centro aproximado del núcleo y se aplicaron pulsos de corriente de polaridad alternante de hasta 5 µA de amplitud y 500 ms de duración a una frecuencia ~ 0.8 Hz durante 30 min. Finalizada la inyección de neurobiotina se aguardó un mínimo de 4 horas (usualmente cerca de 8 hs) antes de proceder a la fijación de la preparación. El revelado se realizó con un protocolo similar al utilizado para la inyección intracelular excepto cuando el marcaje se combinó con inmunohistoquímica para colina acetiltransferasa (ChAT) (ver luego). En estos casos las rodajas se crioprotegieron y se obtuvieron cortes de 30 µm con criostato (Reichert-Jung, Leica, Deerfield, IL, EEUU).
En los casos que se realizó una doble inmunotinción, las secciones fueron procesadas sucesivamente para ChAT y para neurobiotina. Los cortes se lavaron varias veces en PBST (0,1 M PBS con 0,3% Triton X-100) y se incubaron con anticuerpo contra ChAT (Chemicon, CA; dilución 1: 2000) en solución PBST durante la noche. Al siguiente día, las secciones se lavaron en PBST durante 30 minutos; luego se incubaron 90 min en PBST que contenía anti-IgG de conejo biotinilado (Vector Laboratories, Burlingame, CA; diluido a 1: 300) seguido por incubación en el complejo ABC (Vector Laboratories, Burlingame, CA; diluido a 1: 200) durante 90 min. La reacción de color se llevó a cabo incubando las secciones en 50 mM de tampón Tris (pH 7,5) que contiene 0,02% 3,3V-diaminobenzidina (DAB) y 0,015% de H2O2 durante 15 -30 min. Después de la reacción con DAB, las secciones se lavaron en PBS varias veces y se montaron para su observación en microscopio.
Para la doble detección para ChAT y neurobiotina por métodos de inmunofluorescencia, luego de la exposición al anticuerpo primario para ChAT, las secciones se incubaron en Alexa Fluor 488 burro IgG anti-cabra (Molecular Probes) 1:200. Para neurobiotina se incubaron durante 1,5 h con estreptavidina-Alexa Fluor 568 (Jackson Immunoresearch Laboratories Inc., West Grove, PA, EE.UU.) diluido 1: 2000.
Las secciones fueron examinadas usando un microscopio Olympus BX60 (Olympus Optical, Tokio, Japón). Las fotomicrografías se obtuvieron por medio de una cámara digital conectada al microscopio, se adquirieron en una computadora y se procesaron con el software Photoshop (Adobe Systems, San Jose, CA). Cortes seleccionados, particularmente aquellos en los que se realizó doble inmunomarcaje para neurobiotina y ChAT, se inspeccionaron utilizando un microscopio de barrido láser confocal (Leica TCS). En estos casos, se obtuvieron imágenes de dos colores que fueron combinadas digitalmente (Adobe Photoshop Software) para indagar acerca de la colocalización de ambos marcadores a nivel de las neuronas del LDT-PPT.
Soluciones
Para la aplicación local de soluciones de agonistas para diversos tipos de receptores se utilizó un sistema de inyección de microvolúmenes por presión (picospritzer III, Parker Instrumentation). Usualmente los volúmenes inyectados no excedieron los 30 pl. El volumen se estimó midiendo bajo microscopio el diámetro de la gota en el aire ante pulsos de presión de entre 50 - 150 ms de duración y presiones inferiores a los 30 psi. Se utilizaron pipetas de patch conteniendo las soluciones de agonistas disueltas en solución salina; NaCl 0.9%. Bajo control visual las pipetas se posicionaron en las estructuras de interés. Las concentraciones de agonista utilizadas en la solución de llenado de la pipeta se ajustaron de tal manera de lograr concentraciones de 3 a 5 veces el EC50 del agonista. La estimación de estas concentraciones se realizó según las ecuaciones de difusión simple corregidas según las características del tejido nervioso y de la sustancia aplicada 43. Se utilizaron soluciones de ACh (1 mM), carbamilcolina (Carbacol, CCh 1 mM), Glutamato (Glu., 10 mM) y Muscimol (100 μM) (concentraciones en la pipeta de inyección).
En todos los casos, los antagonistas para diversos tipos de receptores se aplicaron en la solución de perfusión en las siguientes concentraciones: para receptores glutamatérgicos ionotrópicos, ácido quinurénico 5 mM; para receptores de tipo GABAérgicos, picrotoxina (100 μM) para GABA-A; para receptores colinérgicos muscarínicos atropina (1μM).
Tratamiento estadístico de los datos
Salvo que se indique específicamente, los valores se presentan como la media ± error estándar (SE) de la media. La significación estadística de las diferencias en las propiedades analizadas o en las modificaciones provocadas por una determinada maniobra experimental o manipulación se evaluaron con el test de t pareado (p <0.05). En los casos en que los datos a comprar no se ajustaron a una distribución normal se empleó la prueba de la suma de rangos con signo de Wilcoxon (prueba de U de Mann-Whitney), test no paramétrico que compara la mediana de dos muestras o el de Kolmogórov-Smirnov (test K-S), test no paramétrico que evalúa la diferencia entre dos muestras independientes comparando las distribuciones de probabilidad de cada una de ellas.
Resultados
Todos los experimentos se llevaron a cabo en una preparación reducida del tronco conteniendo la red neural considerada como necesaria y suficiente para el inicio y mantenimiento del S-REM y el control de otros estados comportamentales6)(8)(44)(45.
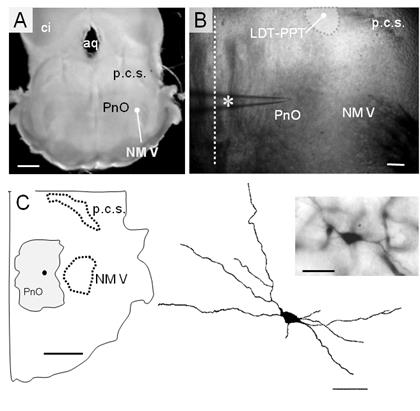
Figura 1: Características estructurales de la rodaja mesopontina. A. Imagen panorámica de la rodaja mesopontina por transiluminación. Se distinguen el núcleo motor del V par craneano (NM V), el pedúnculo cerebeloso superior (p.c.s.), la porción rostral de la formación reticulada pontina (PnO). Se señalan además el colículo inferior (ci) y el acueducto (aq). Calibración: 200 µm. B. Fotografía de la preparación en el microscopio con DIC-IR (objetivo 4x). Se distinguen las estructuras clave (PnO, NM V y el pcs) y una pipeta (asterisco) para el registro de neuronas del PnO. Se señala la línea media para referencia (línea recta punteada). Calibración 200 µm. C. Esquema del cuadrante ventrolateral de la rodaja mesopontina indicando las estructuras clave y el sitio aproximado de una neurona del PnO (circulo negro) marcada con neurobiotina. La neurona identificada electrofisiológicamente como de tipo LTS, fue fotografiada (inserto arriba derecha, calibración 20 µm) y reconstruida en el dibujo de cámara clara (inserto abajo derecha, calibración 20 µm).
Como se ilustra en la (Figura 1), la rodaja contiene un sector de la formación reticulada pontina (FRP) rostral -consignado como PnO en Paxinos y Watson (1998)46, corte a -8.72 mm del Bregma- situado ventralmente al pedúnculo cerebeloso superior (p.c.s.), medial al sector más rostral del NM V. El plano de corte utilizado y la presencia del p.c.s. sugiere la presencia de neuronas de los núcleos tegmental laterodorsal (LDT) y pedúnculo pontino (PPT) en la vecindad de su polo medial, aspecto que se confirmó con la aplicación de técnicas de inmunohistoquímica (Figura 4).
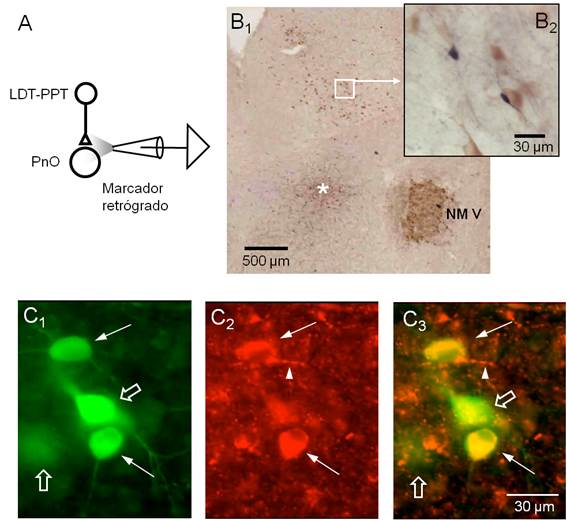
Figura 4: Neuronas colinérgicas y no colinérgicas del LDT-PPT inervan al PnO en la rodaja mesopontina.
Figura 4. Neuronas colinérgicas y no colinérgicas del LDT-PPT inervan al PnO en la rodaja mesopontina. A. Esquema del diseño experimental empleado para el marcaje retrógrado de las neuronas que proyectan al PnO. B1. Fotografía panorámica de una sección representativa de la rodaja procesada para neurobiotina y ChAT sin contratinción. El sitio de la aplicación iontoforética de neurobiotina se indica con el asterisco. Note la intensa expresión de ChAT a nivel del NM V. Algunas neuronas del complejo LDT-PPT se hacen evidentes con este nivel de magnificación. El área del complejo LDT-PPT comprendida en el recuadro blanco se ilustra, a mayor magnificación, en el inserto en B2. A este nivel, neuronas ChAT+ (citoplasma marrón claro) se presentaron junto a neuronas marcadas con neurobiotina (somas de color negro). El procesamiento utilizado no permitió distinguir el fenotipo para neurotransmisor de las neuronas marcadas retrógradamente. C. Detalle de un área del LDT-PPT procesada con anticuerpos contra neurobiotina y ChAT conjugados con fluoróforos con emisión en diferentes longitudes de onda: Alexa 488 para ChAT (rojo) y Alexa 568 para neurobiotina (verde). C1. Neuronas del LDT-PPT marcadas retrógradamente. Las flechas señalan aquellas neuronas que además resultaron ChAT+ (C2) en tanto que las indicadas con la flecha vacía no mostraron inmunomarcaje para ChAT (superposición de imágenes en C3). Note la presencia de finas prolongaciones ChAT positivas de aspecto arrosariado (punta de flecha en C2 y C3) próximas a las neuronas marcadas retrógradamente.
Debido a la inclinación del plano de corte utilizado (Figura 1A) para conservar estas estructuras y su conectividad, el sector dorsal de la rodaja (~ - 8.30 mm del Bregma46) fue relativamente más rostral que su sector ventral (~ - 8.72 mm del Bregma). Estructuras clave como el NM V y el p.c.s., utilizadas junto con las características de la cavidad ventricular como referencias anatómicas para la selección de la rodaja mesopontina, se identificaron fácilmente en DIC-IR (Figura 1B). De manera característica, las neuronas del PnO, se registraron en el área de la formación reticulada ubicada a una distancia > 250 µm de la línea media (línea punteada en la Figura 1B) y a > 250 µm por dentro del límite medial del NM V, a la altura del centro de este núcleo motor ((1250 µm del límite ventral de la rodaja). La Figura 1C (dcha.) muestra un ejemplo de las neuronas del PnO (microfotografía y reconstrucción en cámara clara) registradas en este trabajo, que fuera marcada por aplicación intracelular de neurobiotina. El esquema del cuadrante ventral de la rodaja incluido a la izquierda muestra la localización aproximada de esta neurona en el área del PnO.
Caracterización electrofisiológica de las neuronas del PnO
Se seleccionaron para este estudio aquellas neuronas del PnO con Vm más negativos de -55 mV, que mostraron respuestas monosinápticas ante la estimulación eléctrica del LDT-PPT (n=45) ajustándose a los criterios de Rose & Metherate (2005) 47 adaptados a nuestro diseño experimental: reducida variabilidad de la latencia con intensidades de estimulación submáximas ≤ 1 ms, modificación menor a 1ms con incrementos de la intensidad de estimulación y estabilidad de la latencia para frecuencias de estimulación relativamente elevadas (15Hz)48)(49).
En conjunto, las neuronas registradas presentaron Ren de 292.17 ± 22.41 MOhm y en su mayoría (42 en 45) no mostraron descarga espontánea de potenciales de acción. Otros estudios in vitro25)(26)(34)(39)(50)(51)(52)(53)(54)(55 describen neuronas de la FRP con similares características. Los potenciales de acción provocados por pulsos despolarizantes de escasa amplitud (apenas superiores a la reobase) mostraron una amplitud media (± desvío estándar) -medida desde el nivel de Vm alcanzado inmediatamente antes de la espiga- de 78.9 mV (± 6.4 mV) y una duración a la mitad de la espiga de 2.1 ms (± 0.8 ms). La caracterización del fenotipo electrofisiológico se realizó en condiciones de fijación de corriente e incluyó la aplicación de protocolos específicamente diseñados para detectar la presencia de espigas de bajo umbral (LTS, de Low Threshold Spike). Los resultados obtenidos mediante este tipo protocolos (ver más adelante) permitió categorizar las neuronas registradas en dos grupos LTS (Figura 2) y No-LTS (sin espiga de bajo umbral, (Figura 3). Se indagó asimismo acerca de otras propiedades electrofisiológicas activas de las neuronas registradas compatibles con la expresión de conductancias de tipo IA e Ih (37).
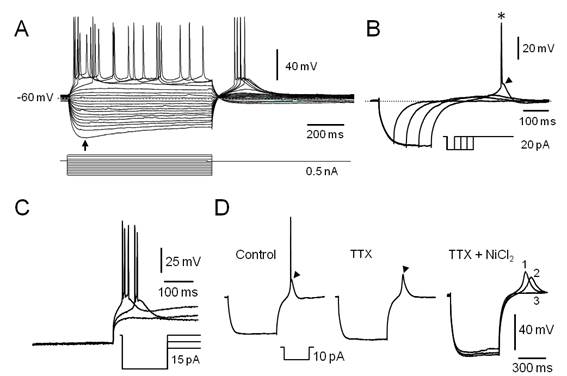
Figura 2. Características electrofisiológicas de las neuronas LTS del PnO. A. Familia de respuestas provocadas por la aplicación de pulsos de corriente de 800 ms de duración (esquematizados en la parte inferior). La flecha señala el comienzo de la rectificación de entrada (sag). Note a la salida de la hiperpolarización, la ocurrencia de respuestas despolarizantes lentas en cuya fase de ascenso se desencadenan potenciales de acción de Na+. B. La aplicación del protocolo de corrientes ilustrado en el inserto (parte inferior), es capaz de desencadenar respuestas despolarizantes con características de LTS (punta de flecha) a la salida de la hiperpolarización. El asterisco señala un potencial de acción de Na+. C. La LTS muestra un comportamiento todo o nada. La hiperpolarización creciente del Vm (protocolo esquematizado en el inserto) retrasa y finalmente bloquea la respuesta de tipo LTS sin afectar su amplitud. D. Respuesta de tipo LTS a la salida de la hiperpolarización (punta de flecha) provocada por el pulso ilustrado en el inserto sobre la que se produce una espiga rápida de Na+ (izq. Control). En tanto la perfusión de TTX 1µM (TTX), no afecta a la LTS (punta de flecha) esta se bloquea si se añade NiCl2200 µM a la solución de perfusión (derecha, TTX + NiCl2). Los trazados 1, 2 y 3 corresponden a los obtenidos tras 15, 20 y 30 minutos de iniciada la perfusión con NiCl2 respectivamente. A y B misma neurona. C y D corresponden a neuronas diferentes.
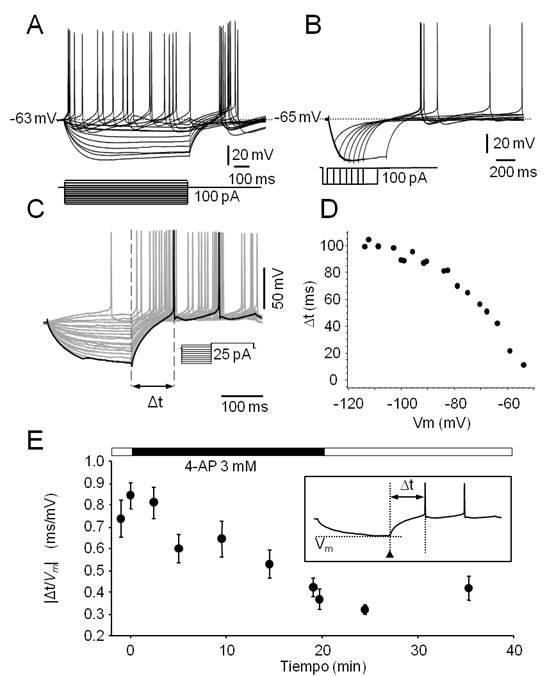
Figura 3. Características electrofisiológicas de las neuronas No-LTS del PnO. A. Familia de respuestas provocadas por la aplicación de pulsos de corriente de 800 ms de duración (esquematizados en la parte inferior). Note la ausencia de respuestas con características de LTS a la salida de la hiperpolarización. B. Este tipo de neuronas carece de respuestas de tipo LTS a la salida de la hiperpolarización provocada por la aplicación de protocolos como el ilustrado en el inserto y usualmente utilizados para generar LTS (compare con Fig. 2B). C. La latencia a la primera espiga (Δt, medida entre las líneas entrecortadas verticales) provocada por un pulso despolarizante, varía con el valor máximo de Vm alcanzado durante la aplicación de prepulsos hiper y despolarizantes (protocolo en el inserto). D. Gráfico de la latencia a la primera espiga y el valor de Vm alcanzado durante los prepulsos que sugiere la participación de corrientes de K+ de tipo IA. E. Valor absoluto del cociente 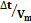 (estimación de la magnitud de la corriente de tipo IA) vs tiempo para un prepulso de amplitud constante (-15 pA), calculado antes, durante y después de la perfusión de 4-AP 3 mM (el curso del experimento se ilustra en la barra horizontal sobre el gráfico). En el inserto, esquema de una respuesta típica en la que se indican la latencia a la primera espiga (Δt) y el instante en el que se mide Vm al final del prepulso (cabeza de flecha). Cada punto representa el valor medio ± s.d. (N=20) de este cociente obtenido en 20 trazados sucesivos a intervalos regulares.
(estimación de la magnitud de la corriente de tipo IA) vs tiempo para un prepulso de amplitud constante (-15 pA), calculado antes, durante y después de la perfusión de 4-AP 3 mM (el curso del experimento se ilustra en la barra horizontal sobre el gráfico). En el inserto, esquema de una respuesta típica en la que se indican la latencia a la primera espiga (Δt) y el instante en el que se mide Vm al final del prepulso (cabeza de flecha). Cada punto representa el valor medio ± s.d. (N=20) de este cociente obtenido en 20 trazados sucesivos a intervalos regulares.
En la formación reticulada pontina (FRP), varios estudios electrofisiológicos (ver p.ej. ref.34)(35)(36)(37) señalan la presencia de neuronas de tipo LTS. La espiga de bajo umbral ha sido descrita en neuronas de varias estructuras del SNC e involucra la participación de una corriente de calcio transitoria (IT)56)(57)(58. La LTS constituye un fenómeno todo o nada que muestra un umbral usualmente 10 a 15 mV más hiperpolarizado que el del potencial de acción de sodio. La corriente de calcio de tipo T que subyace a esta respuesta, se activa por despolarización con voltajes medios de activación relativamente hiperpolarizados (( -65 mV) respecto de otras corrientes de entrada y se encuentra parcial o totalmente inactivada en el reposo (Vm ( -60 mV). Su desinactivación (también llamado proceso de recuperación) ocurre a potenciales hiperpolarizados y es un proceso voltaje y tiempo dependiente. En el curso de nuestros experimentos, el 47% (21/45) de las neuronas registradas en condiciones de fijación de corriente mostraron LTS, sea durante la aplicación de protocolos para determinar la Ren (Figura 2A) o por la aplicación de protocolos específicamente diseñados para su estudio (Figura 2B, Figura 2C). En todos los casos la ocurrencia de la LTS requiere de la hiperpolarización previa del Vm cuya magnitud y duración deben ser adecuadas para promover el proceso de desinactivación de la IT. La amplitud de la LTS suele ser suficiente para desencadenar uno o varios potenciales de acción de sodio (Figura 2). En nuestro estudio, las neuronas LTS presentaron Ren de 294.14 ± 35.78 MOhm y respondieron a pulsos despolarizantes descargando repetitivamente mostrando adaptación de frecuencia (Figura 2A). Debido al proceso de inactivación que caracteriza a la corriente de calcio de tipo IT, la ocurrencia de la LTS al final del pulso de corriente hiperpolarizante requiere de que el pulso inyectado mantenga el Vm en un rango de valores específico (relativamente hiperpolarizado) y durante un tiempo suficientemente prolongado. En nuestro caso, con la aplicación de protocolos específicos como el ilustrado en la Figura 2B, determinamos que la generación de la LTS requiere de hipeprolarizaciones previas que mantengan el Vm en el rango de -80 a -110 mV durante un tiempo no menor a 400 ms, valores similares a los descritos para otras células del SNC58. A la salida de hiperpolarizaciones de menor amplitud o duración pueden observarse potenciales despolarizantes lentos, relativamente más tardíos y de amplitud variable (graduada con la hiperpolarización previa), probablemente debidos a la corriente Ih presente en estas células (ver más adelante y Figura1S-D. El carácter todo o nada de la LTS se analizó combinando el pulso hiperpolarizante de desinactivación con un segundo pulso hiperpolarizante (aplicado inmediatamente después del pulso precedente, postpulso), de amplitud creciente con la ejecución del protocolo (típicamente de 0 a -0.1 nA en 12 a 20 barridos) lo que provocó su retraso y luego su fallo sin modificación de su amplitud (Figura 2 C). La trayectoria del Vm luego del pulso hiperpolarizante precediendo a la LTS, sugiere la participación de una corriente de K+ de tipo IA (ver más adelante) (Figura 1S-D). De manera característica (n=3) la LTS no se modificó en presencia de TTX 1 µM (Figura 2 D) (trazado medio) y se bloqueó con la ulterior perfusión de NiCl2 (200 µM) (Figura 2D), TTX + NiCl2, trazados a la dcha.) indicando la participación de canales de tipo T en la generación de esta espiga.
En el 53% restante de las neuronas registradas (24/45), la aplicación de los protocolos habituales para desencadenar LTS no fueron capaces de generar este tipo de respuestas independientemente de la magnitud y duración de la hiperpolarización aplicadas (Figura 3B) y fueron categorizadas como neuronas No-LTS. Un ejemplo representativo de este tipo de neuronas se ilustra en la Figura 3. En conjunto estas neuronas presentaron una Ren de 270.07 ± 28.20 MOhm, valor que no mostró diferencia estadísticamente significativa con la Ren promedio de las neuronas LTS (Mann-Whitney U test, p=0.78). La descarga repetitiva provocada por los pulsos despolarizantes mostró adaptación de frecuencia, comportamiento similar al observado en las neuronas LTS (Figura 3A).
Tanto las neuronas de tipo LTS como No-LTS presentaron comportamientos electrofisiológicos compatibles con la participación de una corriente de potasio de tipo IA. Estas corrientes de potasio, son corrientes transitorias activadas por despolarización que presentan inactivación 59. Reportes previos (ver p.ej. ref.37) describen la presencia de este tipo de corrientes en neuronas de la FRP. En general las corrientes de tipo IA se encuentran parcialmente inactivadas en el reposo y los protocolos utilizados para poner de manifiesto la participación de este tipo de corrientes en las respuestas neuronales, consisten en pulsos de corriente hiperpolarizante de amplitud y duración adecuadas (típicamente -0.1 a -0.5 nA y 200 ms) para su desinactivación seguidos de un pulso despolarizante de amplitud levemente superior a la reobase (Figura 3C). La despolarización provoca uno o pocos potenciales de acción y la latencia de la primera espiga está determinada en parte por la activación de este tipo de corrientes. Debido a la expresión de este tipo de corrientes de potasio, la magnitud de esta latencia guarda relación inversa con el valor del Vm alcanzado durante el prepulso hiperpolarizante (Figura 3D). Respuestas neuronales compatibles con la presencia de este tipo de corrientes de potasio se consignaron en el 74.04 % de las neuronas independientemente de su naturaleza LTS o No-LTS. En efecto, el ejemplo de la (Figura 3C, Figura 3D) corresponde a una neurona No-LTS en tanto que los registros de las (Figura 2C y 1S-D) sugieren que neuronas LTS también presentan respuestas -trayectorias del Vm a la salida de la hiperpolarización- compatibles con la activación de una corriente de tipo IA. Este tipo de corrientes se bloquea en presencia de 4-aminopiridina (4-AP, 3 mM). En experimentos seleccionados (n=3) se ensayó el efecto de este bloqueante sobre el comportamiento neuronal provocado por la participación de este tipo de conductancias de membrana. Un ejemplo de los resultados de este tipo de experimentos se ilustra en la figura 3E. La dependencia de la latencia a la primera espiga (Δt) del Vm alcanzado durante el prepulso hiperpolarizante (Δt/Vm) se redujo sustancialmente (de 0.84 ± 0.06 a 0.38 ± 0.04) y de manera reversible en presencia de 4-AP. La reducción del cociente Δt/Vm ilustrada en la figura alcanzó significación estadística (Mann-Whitney U test, p<0.001).
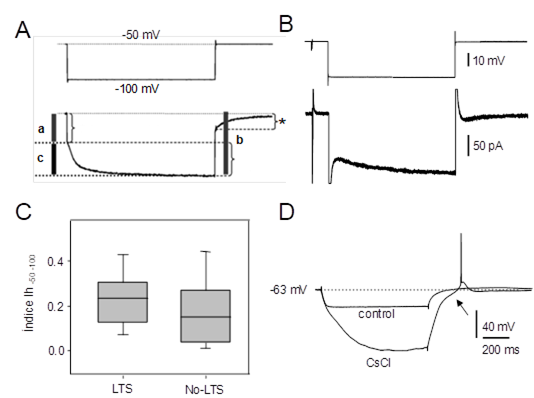
La presencia de Ih, corriente catiónica que se abre por hiperpolarización60 (revisado recientemente en61), se evaluó aplicando una serie de pulsos de corriente hiperpolarizante de amplitud creciente (800 ms de duración) en condiciones de fijación de corriente, explorando la eventual participación de esta corriente en las respuestas observadas en un rango del Vm de entre -70 y -110 mV. Típicamente, para valores de Vm alcanzados durante el pulso hiperpolarizante más negativos que -90 mV, la presencia de Ih se manifestó por la presencia del llamado "sag", relajación del Vm hacia valores relativamente despolarizados (Figura 2A, Figura 3A, Figura B), y la existencia de rebote despolarizante post-hiperpolarización fácilmente distinguible de la LTS por tratarse de un cambio de Vm relativamente lento y graduado con la magnitud de la hiperpolarización previa. En condiciones de fijación de voltaje, se buscó cuantificar la expresión funcional de esta corriente a través del cálculo del índice Ih-50-100 (Figura 1S). Este índice permite obtener la magnitud de la corriente Ih normalizada al valor la conductancia de entrada y por tanto, al tamaño de la neurona. En términos generales, en las neuronas LTS registradas (n=20), el índice Ih-50-100 mostró una media de 0.25 ± 0.03. Por su parte las neuronas No-LTS (n=23) presentaron un índice de 0.18 ± 0.03. Si bien las neuronas de tipo LTS mostraron un índice ligeramente superior al de las neuronas No-LTS la diferencia en el índice entre ambos grupos no alcanzó significación estadística (test K-S, p=0.13). La rectificación para pulsos hiperpolarizantes se eliminó en presencia de CsCl (3 mM) (Figura 1S-D) o de ZD-7288, bloqueantes específicos de Ih.
Se buscó establecer una relación entre el fenotipo electrofisiológico y la citomorfología de las dos categorías de neuronas: LTS y No-LTS. En todos los casos, previamente a su caracterización electrofisiológica, se consignó la forma y tamaño de los somas neuronales a la inspección bajo DIC-IR. Pese a numerosos intentos de ajuste del protocolo de inyección intracelular de neurobiotina y del procedimiento de revelado, sólo se obtuvo marcaje intracelular completo en dos neuronas (una de cada tipo). En los restantes casos (n=12) solo se pudo observar prolongaciones dendríticas marcadas en el área de la neurona inyectada sin poder detectar la presencia del soma neuronal. Las neuronas que a posteriori fueron categorizadas como LTS (n=21) presentaron predominantemente somas ovoides (diám. mayor: 21.12 ± 3.86 µm y diám. menor: 15.36 ± 3.99 µm). El marcaje intracelular con neurobiotina permitió identificar el soma así como las principales prolongaciones de este tipo de neuronas. Un ejemplo representativo de las neuronas LTS se ilustra en la Figura 1C. Las dendritas (2 troncos principales) se originan en polos opuestos del soma neuronal, extendiéndose en sentido medial o lateral. La mayoría de las neuronas No-LTS (n=23), en cambio, presentaron somas de aspecto variado, predominantemente redondeado (diám: 26.39 ± 4.79 µm), con dimensiones algo superiores a las de las neuronas LTS (Mann-Whitney U test, n=14, p=0.006). En estas neuronas, mayoritariamente multipolares, las dendritas se ramificaron en el plano de corte sin una orientación dominante (no mostrado).
Las evidencias electrofisiológicas y morfológicas aportadas muestran que las neuronas registradas en el área de la FRP seleccionada para este estudio guardan razonable similitud, particularmente en lo que refiere a su fenotipo electrofisiológico, con las características de las neuronas de los sectores de la formación reticulada de presumiblemente implicados en el control del S-REM y descritos por otros autores25)(26)(34)(35)(36)(37)(38)(39. Esto sugiere la adecuación de los criterios utilizados en este trabajo para la identificación del PnO como sector de la reticulada del tronco encefálico integrante del circuito mesopontino implicado en el control del S-REM.
Neuronas del LDT-PPT inervan neuronas LTS y No-LTS del PnO
Las aferencias a las neuronas del PnO procedentes del complejo LDT-PPT son elementos constitutivos esenciales de la red mesopontina implicada en el control del S-REM a nivel del tronco encefálico (ver para revisión ref.6)(7)(13). Con el propósito de determinar si este componente de la red mesopontina está presente y es funcional en la rodaja de la unión ponto-mesencefálica, se desarrollaron dos series experimentales tendientes a obtener evidencias, morfológicas y funcionales, que apoyaran la indemnidad de esta conexión.
En 6 rodajas se inyectó iontoforéticamente neurobiotina como marcador retrógrado a nivel de la FRP precisamente en el área tomada como referencia en este trabajo y de la que proceden las neuronas cuyas características electrofisiológicas se incluyeron en la sección anterior (Figura 4A). En algunos casos, de forma complementaria, se aplicaron técnicas inmunohistoquímicas para identificación del neurotransmisor de las neuronas marcadas retrógradamente. La inspección del área efectiva de inyección reveló que en todos los casos la inyección del marcador quedó circunscripta al sector dorsal del polo rostral de la formación reticulada pontina (PnO) (Figura 4B1). El revelado del marcador retrógrado permitió identificar algunos somas neuronales en el LDT-PPT ipsilateral (Figura 4B1 y B2). La combinación del marcaje retrógrado con la detección inmunohistoquímica para ChAT, buscó identificar las neuronas colinérgicas dentro del grupo de neuronas del LDT-PPT marcadas retrógradamente. Estos núcleos del tegmento pontino son considerados el principal origen de la inervación colinérgica del SNC en general y del PnO en particular62)(63)(64)(65. La utilización del procedimiento estándar para la inmunodetección para ChAT mostró marcaje evidente en las motoneuronas del NM V así como en neuronas del LDT-PPT que no mostraron marcaje retrógrado (Figura 4B1 y B2). Desafortunadamente, este procedimiento no permitió distinguir la expresión de ChAT en las neuronas marcadas retrógradamente. Para ello, 3 rodajas fueron procesadas para la inmunodetección de neurobiotina y ChAT utilizando anticuerpos conjugados con fluoróforos diferentes. Un ejemplo de los resultados obtenidos con este abordaje se ilustra en las (Figura 4C1, Figura C2 , Figura C3). Neuronas del LDT-PPT positivas para neurobiotina (Fig. 4C1) también mostraron positividad para ChAT (Figura 4C2) como se observa en la superposición de imágenes en la Figura 4C3. Se destaca que este abordaje también mostró neuronas positivas para neurobiotina pero negativas para ChAT (flechas vacías en la Figura 4C1 y C3) sugiriendo que neuronas no colinérgicas, presumiblemente glutamatérgicas o GABAérgicas, inervan el PnO y están presentes en la rodaja de la unión ponto-mesencefálica. Evidencias en este sentido han sido aportadas por otros autores65)(66)(67 aún cuando el origen de la inervación no-colinérgica del PnO ha sido poco estudiada 13. Coincidiendo con nuestros hallazgos, se ha reportado que el número de neuronas no colinérgicas del LDT-PPT que proyectan a la PnO es relativamente bajo en relación a la población de neuronas de este complejo.
Con vistas a la obtención de evidencias adicionales a favor de la conexión entre neuronas del LDT-PPT y de la FRP en la rodaja de la unión ponto-mesencefálica, se procedió a 1.- la estimulación eléctrica del LDT-PPT y registro de respuestas sinápticas en neuronas del PnO, 2.- la estimulación farmacológica del LDT-PPT con agonistas glutamatérgicos y colinérgicos y registro de respuestas sinápticas en neuronas del PnO, y 3.- la estimulación eléctrica del PnO y registro de neuronas del LDT-PPT, diseño experimental que buscó detectar potenciales de acción antidrómicos en las neuronas del LDT-PPT, producto de la estimulación eléctrica de sus axones a nivel del PnO.
Para la primera serie de experimentos, las respuestas de las neuronas del PnO a la estimulación eléctrica del LDT-PPT se registraron, inicialmente, en condiciones de fijación de corriente (Vm -57.30 ± 1.70 mV) con electrodos de patch con medio intracelular basado en gluconato de potasio (ver Materiales y Métodos) siguiendo el diseño experimental de la (Figura 5) Figura 5A.
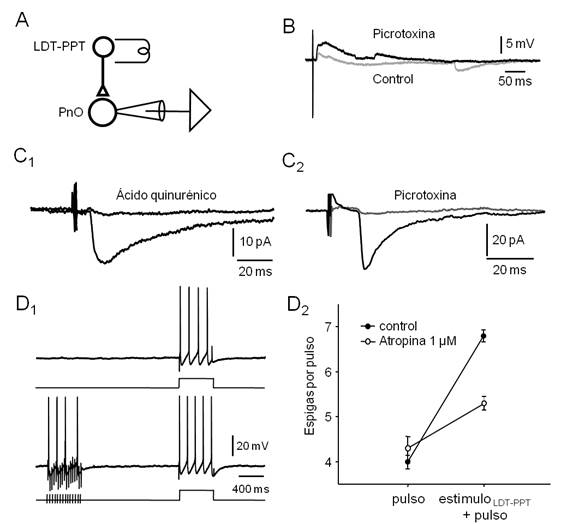
Figura 5. La estimulación eléctrica del LDT-PPT provoca respuestas sinápticas en neuronas del PnO. A. Esquema del diseño experimental utilizado. B. Respuestas sinápticas a estímulos eléctricos del LDT-PPT (repetidos a 0.3 Hz) obtenidas en la modalidad fijación de corriente (medio intracelular basado en Gluconato de K+, Vm aprox. -70 mV) en situación control (trazado gris) y en presencia de Picrotoxina (PTX, 100 µM, trazado negro). Note la ocurrencia de IPSPs espontáneos en la situación control. C 1 . EPSC (promedio de 20 respuestas sucesivas a 0.3 Hz, Vh= -60 mV, medio intracelular basado en gluconato de potasio) obtenido en presencia de PTX 100 µM antes (negro) y durante (gris) la perfusión de ácido quinurénico (5 mM). C 2 . En otra neurona, en presencia de ácido quinurénico (5 mM), IPSC representativo (promedio de 20 barridos sucesivos a 0.3 Hz, Vh=-70 mV, medio intracelular basado en KCl) obtenido antes (negro) y durante (gris) la perfusión de PTX (100 µM). D. La estimulación del LDT-PPT con trenes de estímulos de alta frecuencia (50 Hz, 500 ms) provoca cambios de la excitabilidad de la neurona del PnO compatibles con un efecto colinérgico muscarínico. D 1. Respuesta de la neurona a la aplicación de un pulso de corriente despolarizante (500 ms, 0.3 nA, protocolo esquematizado a abajo) aislado (arriba) o precedido (intervalo de 1.5 s) de un tren de estímulos en el LDT-PPT (30 Hz, 500 ms, abajo) D 2 . Gráfico del número de espigas provocadas por el pulso de corriente despolarizante aislado (pulso) y precedido del estímulo sináptico condicionante (estímulo LDT-PPT + pulso) obtenido en situación control (●) y en presencia de atropina (1 µM, ◌). Cada punto corresponde a la media de 20 barridos sucesivos (± SE.).
De manera característica, e independientemente del fenotipo electrofisiológico de la neurona registrada, estímulos eléctricos únicos del LDT-PPT (0.3-3.0 µA, 0.2 a 0.6 ms, 0.16 Hz) provocaron potenciales postsinápticos despolarizantes de corta latencia (9.74 ± 0.45 ms, n=45) de amplitud variable (3.35 ± 0.59 mV). Un ejemplo representativo se ilustra en la Figura 5B (control). En estas condiciones fue posible observar además potenciales postsinápticos hiperpolarizantes espontáneos. En presencia de picrotoxina (100 µM, Figura 5B, picrotoxina), bloqueante de los receptores GABAérgicos de tipo A, esta actividad espontánea hiperpolarizante fue suprimida y sustituida por un bombardeo sináptico despolarizante -probablemente debido a un incremento general de la excitabilidad del preparado provocado por el bloqueo de la transmisión GABAérgica-, al tiempo que la amplitud de la respuesta sináptica provocada aumentó ligeramente (4.17 ± 0.77 mV). Estos resultados sugieren que la estimulación eléctrica del LDT-PPT es capaz de provocar respuestas postsinápticas mixtas excitadora (presumiblemente glutamatérgica) e inhibidora (GABAérgica) en las neuronas del PnO.
Para estudiar aisladamente la actividad sináptica glutamatérgica o GABAérgica provocada por estimulación eléctrica del LDT-PPT, estas respuestas se obtuvieron en presencia de picrotoxina (100 µM) (Figura 5C1), para el estudio de la sinapsis glutamatérgica o en presencia de ácido quinurénico (5mM) (Figura 5C2) - bloqueante de receptores ionotrópicos para Glu.- para el análisis de los contactos GABAérgicos. Las respuestas se registraron en condiciones de fijación de voltaje (corrientes sinápticas) optimizando en cada caso las condiciones de registro (potencial de mantenimiento y medio intracelular) para el estudio de uno u otro tipo de acción sináptica. Las corrientes sinápticas excitadoras (EPSCs) aisladas farmacológicamente se registraron utilizando un potencial de mantenimiento (Vh) de -60 o -70 mV y medio intracelular basado en Gluconato de potasio. La estimulación del LDT-PPT provocó corrientes sinápticas de entrada de una amplitud media (± SE) de 26.38 ± 2.39 pA (n=11). Dicha respuesta fue bloqueada por la perfusión de ácido quinurénico (5 mM) (Figura 5C1). Por su parte, las corrientes sinápticas inhibidoras (IPSCs) provocadas por la estimulación del LDT-PPT se obtuvieron utilizando un Vh de -70 mV y medio intracelular basado en KCl (150 mM, Veq. Cl- ≈ -3 mV). En estas condiciones los IPSCs se registraron como corrientes sinápticas de entrada que alcanzaron una amplitud media (± SE.) de 95.91 ± 21.56 pA (n=54); un ejemplo se ilustra en la Figura 5C2. Los IPSCs se bloquearon completamente por la perfusión de picrotoxina 50-100 µM indicando su naturaleza GABAérgica y la participación de receptores de tipo GABA-A. La latencia de los EPSCs (10.09 ± 2.77 ms) fue similar a la de los IPSCs (9.53 ± 2.76 ms) no existiendo entre ellos diferencias estadísticamente significativas (Test de t, p=0.51). En ningún caso, las respuestas postsinápticas a estímulos únicos del LDT-PPT se modificaron por la perfusión de atropina (1 µM) sugiriendo la ausencia de un componente postsináptico dependiente de la activación de aferentes colinérgicas. La activación de este tipo de aferentes sólo se logró mediante trenes de estímulos similares a los utilizados en el hipocampo de la rata in vitro68. En efecto, como se muestra en el ejemplo de la Figura 5D1, la aplicación de trenes breves de estímulos a alta frecuencia (30 Hz, 500 ms) a nivel del LDT-PPT, provocó un incremento de la excitabilidad neuronal compatible con un efecto muscarínico a nivel postsináptico que se bloqueó parcialmente con la perfusión de atropina 1 µM (Figura 5D2). Efectos similares de la estimulación con trenes breves del LDT-PPT sobre la excitabilidad de las neuronas del PnO se observó en 3 de las 5 neuronas en las que se ensayó este protocolo (no efecto en las restantes). En estos casos, el número de espigas por pulso se incrementó en un 65.0 ± 12.4% respecto del control (ausencia de tren) cuando fue precedido por el tren de estímulos en el LDT-PPT, efecto consistente aún cuando la diferencia en el número de espigas por pulso en ausencia vs en presencia de estímulo sináptico previo no alcanzó significación estadística (K-S, p=0.16).
Dado que la estimulación eléctrica con electrodos convencionales aplicada en el tejido nervioso es capaz de activar tanto somas neuronales propios del área estimulada así como fibras de pasaje procedentes de otras estructuras, se analizaron las respuestas provocadas en neuronas del PnO por la aplicación local de agonistas glutamatérgicos y colinérgicos en el LDT-PPT. Aún cuando este método no permite el estudio sistemático de potenciales postsinápticos individuales en las neuronas del PnO -como ocurre con la estimulación eléctrica-, es posible analizar las respuestas postinápticas globales provocadas por la activación presumiblemente asincrónica de neuronas del LDT-PPT que contactan a las neuronas del PnO. En estas condiciones, se asume que el efecto neto a nivel postsináptico (PnO) resultará de la activación de un grupo de neuronas presinápticas (del LDT-PPT) que convergen sobre la neurona en estudio.
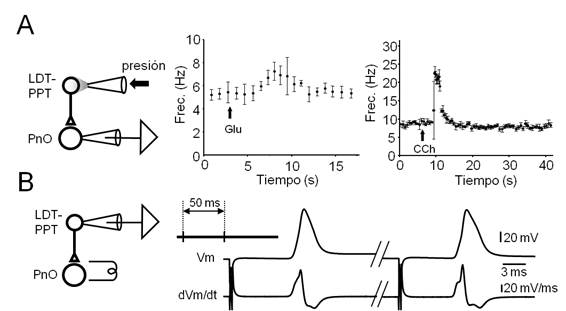
Figura 6: Axones de neuronas del LDT-PPT alcanzan al PnO y establecen contactos funcionales con neuronas de este sector de la FRP
Figura 6. Axones de neuronas del LDT-PPT alcanzan al PnO y establecen contactos funcionales con neuronas de este sector de la FRP. A. Respuestas de neuronas del PnO a la estimulación farmacológica de neuronas del LDT-PPT. Izquierda. Diseño experimental para el estudio de las respuestas de neuronas del PnO a la estimulación farmacológica de neuronas del LDT-PPT. Se indica el sitio de registro así como el método y sitio de inyección de agonistas glutamatérgicos y colinérgicos. Centro. Gráfico de frecuencia instantánea de la descarga espontánea de espigas en función del tiempo en una neurona del PnO, observada antes, durante y después de la aplicación de un microvolúmen de glutamato (Glu, 10 mM, 100 ms, 20 psi, flecha) a nivel del LDT-PPT. Cada punto representa la media (± SE.) de la frecuencia instantánea en un intervalo de un minuto. Derecha. En otra neurona, gráfico de frecuencia instantánea de la descarga espontánea en función del tiempo, antes, durante y después de la aplicación de CCh (1 mM, 50 ms, 15 psi, flecha) en el LDT-PPT. Cada punto representa la media (± SE.) de 5 eventos sucesivos. B. Activación antidrómica de neuronas del LDT-PPT. Izquierda. Diseño experimental utilizado para el estudio de las respuestas de neuronas del LDT-PPT a la estimulación eléctrica del PnO. Derecha. Registros en condiciones de fijación de corriente de la primera (izq.) y la segunda (dcha.) respuestas provocadas por un par de estímulos del PnO (50 ms de intervalo, ver esquema del protocolo arriba a la izq.) y sus correspondientes trazados dVm/dt (abajo).
La estimulación farmacológica (diseño experimental en Figura 6A izq.) (Figura 6) se ensayó en 14 neuronas realizando microinyecciones por presión (20 ms, 20 psi) de soluciones de CCh 1 mM (n=5) o Glu. 10 mM (n=9) en el LDT-PPT. CCh, al tiempo que provoca la despolarización de la mayoría de los tipos neuronales del LDT-PPT genera hiperpolarización en las neuronas colinérgicas 69. Glutamato, en cambio, se ha reportado que promueve la activación tanto de las neuronas colinérgicas como no colinérgicas del LDT-PPT 70. Para estos experimentos, las neuronas del PnO se registraron utilizando medio intracelular en base de Gluconato a los efectos de evaluar adecuadamente las respuestas sinápticas excitadoras e inhibidoras provocadas por la estimulación farmacológica del LDT-PPT. Usualmente, las pipetas de inyección se colocaron por dentro del polo medial del p.c.s. a una distancia superior a 1000 µm del área de registro en el PnO. En la mayoría de los experimentos, para facilitar la detección de los efectos sinápticos provocados por la estimulación farmacológica del LDT-PPT, se modificó el potencial de equilibrio del ion K+ ((K+)e = 9 mM), de forma de provocar la despolarización de las neuronas del PnO con la consiguiente descarga espontánea de PAs. Se buscó que el bombardeo sináptico asincrónico sobre estas neuronas provocado por la estimulación farmacológica del LDT-PPT, se expresara como la modificación del régimen de descarga de PAs. En la Figura 6A se ilustran resultados representativos obtenidos por la aplicación de Glu. (Figura 6A centro) y de CCh (Figura 6A dcha.). Como se ilustra en la figura, ambos agonistas fueron capaces de provocar incrementos transitorios en la frecuencia de descarga de potenciales de acción en las neuronas del PnO. La respuesta a Glu. presentó una latencia en el rango de 3-5 s en tanto que la respuesta a CCh presentó una latencia levemente superior (6 - 8 s). El incremento en la frecuencia de descarga de las neuronas del PnO ante la aplicación de Glu. fue de 2-3 Hz. Por su parte, CCh generó una modificación de hasta 15 Hz en la descarga de las neuronas del PnO. En estos casos la hiperpolarización de las neuronas registradas por inyección de corriente (típicamente -0.01 a -0.05 nA) capaz de detener la descarga espontánea de potenciales de acción de las neuronas registradas, no permitió detectar claramente la existencia de un bombardeo sináptico como posible causa del incremento de la frecuencia de descarga observada en la situación control. Resultados similares pudieron ser detectados solamente en 5 de las 14 inyecciones (2 de CCh y 3 de Glu.). En las restantes inyecciones no fue posible obtener respuestas claras ni en el Vm ni en la frecuencia de descarga de potenciales de acción en las neuronas del PnO. En algunos experimentos se ensayó el registro de neuronas del LDT-PPT a los efectos de confirmar su activación por los agonistas inyectados; para el caso del Glu., la aplicación yuxtacelular de microvolúmenes de solución (10 ms, 20 psi) provocó despolarizaciones transitorias (típicamente 1 a 1.7 s) supraumbrales capaces de inducir la descarga en ráfaga de potenciales de acción (datos no mostrados).
Finalmente, se registraron neuronas del LDT-PPT (n=33) al tiempo que se estimuló eléctricamente el PnO con estímulos únicos o pareados con el propósito de estimular el axón de las neuronas del LDT-PPT que proyectan a este núcleo (Figura 6B). El fenotipo electrofisiológico de las neuronas registradas presentó características similares (Ih, presencia o ausencia de LTS entre otras) a las descritas por diversos grupos de investigación69)(71)(72. En 2 neuronas de las 33 registradas, a intensidades de estimulación (típicamente 3 µA, 0.2 ms, 0.3 Hz) inferiores a las requeridas para la activación ortodrómica de estas neuronas 73, los estímulos provocaron potenciales de acción cuya morfología sugiere su naturaleza antidrómica (Figura 6B, dcha). La latencia de la respuesta a la estimulación del PnO fue de 7.87 ± 0.29 ms. Modificando levemente la intensidad del estímulo aplicado se constató el comportamiento todo o nada de la espiga registrada así como la invariabilidad de la respuesta durante la aplicación de estímulos supramáximos repetidos a frecuencias relativamente elevadas (50 Hz). Ambos resultados, sugieren el carácter antidrómico de la respuesta registrada. En este mismo sentido apunta la morfología del potencial de acción registrado. En efecto, la espiga se origina abruptamente desde el Vm de reposo exhibiendo cambios abruptos de la trayectoria del Vm en la fase de ascenso y de repolarización que sugieren la presencia de varios componentes. Estos cambios se apreciaron más claramente en el trazado de dVm/dt en función del tiempo como se ilustra en el trazado inferior de la figura 6B (derecha). En este trazado es posible distinguir tres componentes que podrían representar la descarga de diferentes compartimientos neuronales 74. El primer componente podría corresponder a la espiga del segmento inicial del axón, el segundo -de mayor amplitud- a la invasión del soma neuronal y el tercero podría resultar de la invasión tardía del árbol dendrítico. Estos componentes se hacen más evidentes si se utilizan pares de estímulos (protocolo en el inserto) a intervalos tales que los cambios de excitabilidad provocados por la respuesta al primer estímulo afecten la propagación de la respuesta al segundo, i.e.: la reducción de la excitabilidad provocada por la respuesta al primer estímulo (período refractario) dificultó la invasión del soma y las dendritas del potencial de acción antidrómico provocado por el segundo estímulo.
Manipulaciones farmacológicas del PnO promueven modificaciones de la excitabilidad de las neuronas del NM V
A los efectos de obtener evidencia adicional en favor de la indemnidad anatómica y funcional de la red mesopontina implicada en el control del S-REM en nuestra rodaja de trabajo, nos propusimos analizar las modificaciones de la excitabilidad de las motoneuronas del NM V provocadas por la aplicación local de agonistas colinérgicos (4 rodajas, 6 inyecciones) y GABAérgicos (3 rodajas, 4 inyecciones) en el PnO, maniobras experimentales similares a las realizadas in vivo (ver p.ej:29). Apoyados en un importante cúmulo de evidencias (recopiladas y revisadas p.ej. en:6)(7)(13) la aplicación de colinomiméticos en el PnO debería ser capaz de promover una reducción de la excitabilidad de las motoneuronas -equivalente de la supresión motora observada in vivo75)(76)(77)(78- en tanto que la aplicación de agonistas GABAérgicos debería tener el efecto opuesto30)(31)(79. Rutinariamente, las pipetas para la aplicación local de agonistas se colocaron cerca del centro del PnO a una distancia superior a las 600 µm del límite medial del NM V (disposición similar a la ilustrada en la Figura 1B).
Neuronas del NM V (centrales al núcleo) se seleccionaron bajo control visual y se registraron utilizando la técnica de patch (medio intracelular basado en Gluconato de K+) en condiciones de fijación de corriente (Figura7) (Figura 8) (Figura 7A, Figura 8A).
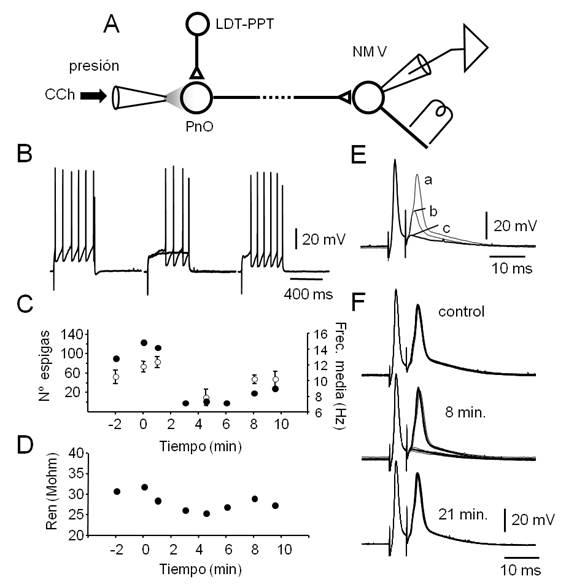
Figura 7: La aplicación de CCh en el PnO reduce transitoriamente la excitabilidad de las neuronas del NM V. A.
Figura 7. La aplicación de CCh en el PnO reduce transitoriamente la excitabilidad de las neuronas del NM V. A. Esquema del diseño experimental que incluye el circuito hipotético que subyace a la modulación de la excitabilidad de las motoneuronas del NM V provocada por la manipulación farmacológica del PnO. La conexión del PnO con motoneuronas del NM V no ha sido aún caracterizada y se asume indirecta (línea punteada). B. Respuestas a pulsos despolarizantes (500 ms, 0.7 nA) de una motoneurona representativa obtenidos antes (izq.) 5 min. (centro, superposición de dos trazados) y 15 min. después de la aplicación de un microvolúmen de CCh (30 psi, 100 ms) en el PnO. C. Curso temporal del número total de espigas por protocolo (20 pulsos de corriente, ●) y de la frecuencia media (± s.d., por protocolo, ◌) antes y después de la aplicación de CCh (en el 0 min.). D. Gráfico de la resistencia de entrada neuronal (Ren, media para n=3) en función del tiempo (CCh se aplicó en el 0 min.). E. Espigas antidrómicas provocadas por pares de estímulos separados por 5.3 ms. Para facilitar la comparación, se superponen trazados obtenidos a tres Vm diferentes: a -68 mV (a), a -85 mV (b, inyección de corriente -1 nA) y a -95 mV (c, -1.5 nA). F. Modificaciones de la segunda espiga antidrómica, provocadas por la aplicación de CCh en el PnO. El agonista colinérgico impide la invasión somato-dendrítica del potencial de acción antidrómico. El efecto es máximo a los 8 min. (falla de la invasión en el 50% de los casos sin cambios en el Vm) y ya no se observa a los 21 min.
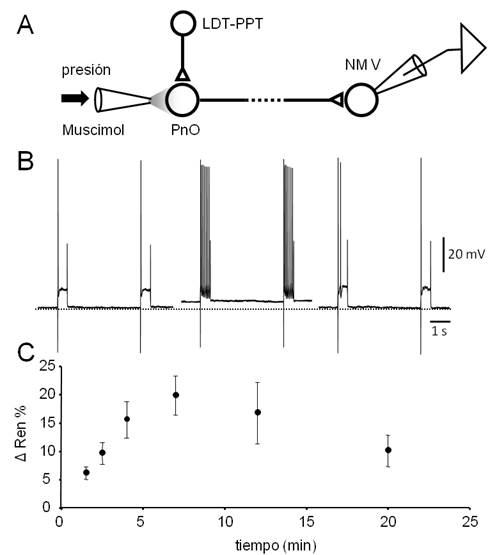
Figura 8: La aplicación de agonistas GABAérgicos en el PnO desencadena un incremento transitorio de la excitabilidad de las neuronas del NM V. A.
Figura 8. La aplicación de agonistas GABAérgicos en el PnO desencadena un incremento transitorio de la excitabilidad de las neuronas del NM V. A. El diseño experimental utilizado es similar al de la serie experimental ilustrado en la Fig. 7 excepto en que no se utilizó el estímulo eléctrico del axón de las motoneuronas. B. Respuestas de una motoneurona a pulsos despolarizantes (600 ms, 0.5 nA) aplicados cada 6 s. Se representan dos respuestas sucesivas obtenidas antes (izq.), 7 min. (centro) y 15 minutos después de la aplicación de un microvolúmen de Muscimol (10µM) por presión (20 psi, 100 ms) en el PnO. Note el incremento de la respuesta neuronal acompañado de despolarización, observado a los 7 min. de la inyección. C. Gráfico del cambio de la resistencia de entrada (ΔRen, media ± s.d., N=3) en función del tiempo provocado por la aplicación de Muscimol (en 0 min.). La evaluación de la Ren se realizó manteniendo manualmente el Vm mediante la inyección de corriente.
Luego de la caracterización electrofisiológica básica de las neuronas registradas con la aplicación de protocolos específicos (ver Materiales y Métodos), la excitabilidad y/o la Ren se determinaron a intervalos regulares, antes y después de la aplicación de microvolúmenes de CCh (agonista colinérgico, 1 mM, Figura 7) y de Muscimol (agonista GABAérgico, 10 µM, (Figura 8). En conjunto, previamente a la manipulación farmacológica del PnO, las motoneuronas mostraron Vm relativamente hiperpolarizados (( -69 mV) y Ren de 26.3 ± 8.5 Mohm (n=10). Pulsos despolarizantes prolongados (500 ms, ver Figura 7B) de amplitud suficiente (típicamente 0.7 a 1 nA) provocaron la descarga repetitiva de potenciales de acción sin clara adaptación de frecuencia.
De manera sistemática (4 de 6 inyecciones), la estimulación colinérgica del PnO provocó la reducción del número de espigas provocadas por pulsos despolarizantes prolongados y de la frecuencia media de la descarga repetitiva (Figura 7B, Figura C). La reducción de la excitabilidad se acompañó de la disminución transitoria de la Ren (al 87% del control, n=3, (Figura 7 D) de las motoneuronas del NM V estimada a través de la inyección de rampas de corriente (ver Materiales y Métodos). En dos experimentos, se analizó además el efecto de la estimulación colinérgica del PnO sobre la invasión somatodendrítica del potencial de acción antidrómico (Figura 7E, Figura 7F) provocado por la estimulación eléctrica de la raíz del V par (Figura 7a)(para el diseño experimental). Se utilizó un protocolo de estimulación similar al ensayado para la activación antidrómica de las neuronas del LDT-PPT (Figura 6B) pero el intervalo de los estímulos del par fue de 5.3 ms. Como se ilustra en el ejemplo de la Figura 7E, la hiperpolarización somática por inyección de corriente continua, provocó el bloqueo de la generación del componente somatodenrítico de la espiga (Figura 7E, Figura 7b) desenmascarando el componente del segmento inicial. Ulteriores incrementos de la corriente inyectada bloquearon la generación de este componente (Figura 7E) (Figura 7C) revelando un componente de escasa amplitud posiblemente resultado de la descarga de un potencial de acción en el primer nodo de Ranvier74. Acompañando la reducción de la Ren provocada por la inyección de CCh en el PnO, y probablemente como consecuencia de ello, se redujo la excitabilidad de la motoneurona lo que impidió la invasión somatodendrítica y del segmento inicial del potencial de acción antidrómico de manera reversible (Figura 7F), bloqueándose ambos componentes en un 55% de las respuestas (para el segundo potencial de acción del par) a los 8 min. luego de la inyección.
Es razonable postular que CCh haya promovido, directa o indirectamente, la activación de neuronas de la FRP integrantes de la red mesopontina de control del S-REM (REM-on) capaces de promover la reducción de la excitabilidad de las neuronas del NM V, efecto equivalente de la supresión motora observada in vivo (recientemente revisado en13)(80)(81). El efecto de los colinomiméticos sobre neuronas del PnO se analizó en una serie experimental utilizando indicadores de calcio (ver material suplementario). La aplicación de microvolúmenes de agonistas colinérgicos en el PnO (Figura S2, material complementario) provocó incrementos transitorios de la concentración de calcio citosólico en una población de neuronas presumiblemente colinoceptivas. Aún cuando no se utilizaron técnicas electrofisiológicas para confirmar la descarga de potenciales de acción de estas neuronas como consecuencia de la estimulación colinérgica, la señal de calcio observada sugiere su activación a través de receptores muscarínicos usualmente implicados en los efectos excitadores de los colinomiméticos82)(83 y cuya expresión en estas células ha sido demostrada12)(78. Recientemente, Weng et al., (2014)26 sugieren que la facilitación presináptica, mediada por ACh, de las terminales glutamatérgicas que contactan las neuronas de la FRP podría contribuir a la activación de estas neuronas en respuesta a la aplicación de colinomiméticos.
En línea con lo observado in vivo, la aplicación de Muscimol en el PnO, tuvo el efecto opuesto al obtenido por aplicación de CCh sobre la excitabilidad de las motoneuronas del V par (Figura 8). En efecto, siguiendo el diseño experimental esquematizado en la. Figura 8A, se constató que la inhibición de las neuronas del PnO por aplicación local del agonista GABA-A provocó la despolarización de las neuronas del NM V (( 4 mV a los 7-9 min. de la inyección) y el incremento de su respuesta (número de espigas/pulso, incremento del 131.4 ± 37.2 %) ante la aplicación de pulsos despolarizantes prolongados (Figura 8B). Estas modificaciones se acompañaron de un incremento de la Ren (de hasta un 19.8 ± 3.5 %, (Figura 8C), efectos que en conjunto revirtieron -al menos parcialmente- a los 20 minutos de la inyección. Este incremento transitorio de la Ren pudo haber contribuido al notable aumento de la excitabilidad (además del provocado por la despolarización) de las neuronas del NM V.
Discusión
Los datos aportados en el presente trabajo sugieren que la rodaja de tronco encefálico de la unión ponto mesencefálica de la rata constituye un modelo experimental adecuado para avanzar en la comprensión de los mecanismos celulares y sinápticos implicados en la generación del S-REM y el control de otros estados comportamentales. En efecto mostramos que esta rodaja contiene las estructuras consideradas clave para la regulación del S-REM6)(13)(80 i.e.: el sector rostral de la FRP, zona considerada ejecutiva para los componentes cardinales del S-REM, y el LDT-PPT, complejo neural implicado en el inicio y, probablemente, en el mantenimiento de este estado comportamental, así como de la vigilia. Más aún, nuestros datos indican que los contactos entre estas estructuras se encuentran conservados y son funcionales in vitro. El NM V ha sido específicamente incluido en la rodaja como referencia topográfica del nivel de corte. La presencia del polo rostral de este núcleo en la rodaja permitió indagar, asimismo, acerca del estado funcional de la red mesopontina en su conjunto, a través del análisis de los cambios de la excitabilidad de las motoneuronas trigeminales provocados por manipulaciones farmacológicas del PnO, similares a las realizadas in vivo (ver p.ej.29)(30)(31).
Somos conscientes de la imposibilidad de reproducir in vitro la completitud fenomenológica de estados comportamentales complejos. Sin embargo entendemos que el abordaje reduccionista que ofrece este modelo in vitro, permitirá acceder a los mecanismos neuronales y sinápticos que operan en estructuras centrales para la organización y regulación de algunos componentes cardinales de estos estados comportamentales, particularmente del S-REM, mecanismos neurales poco conocidos y aún objeto de intensa investigación13)(81.
La rodaja mesopontina contiene las estructuras clave para el control del S-REM
Aún cuando el atlas estereotáxico utilizado como referencia 46 aplica a las características anatómicas de adultos jóvenes (270-290 g de peso), la morfología general de la rodaja obtenida de ratas de P7 a P14 como la utilizada en este estudio (Figura 1), guarda razonable correspondencia con los cortes 53 a 55 (bregma -8.30 a -8.80 mm) de dicho atlas. Debido a la inclinación con la que se obtuvo la rodaja, el sector más ventral parece contener las estructuras delineadas en el corte mas caudal (bregma ∼ -8.80 mm) en tanto que el sector dorsal, colicular, se asemeja al ilustrado en el corte más cefálico (bregma ∼ -8.30 mm). El perfil de la cavidad ventricular y las estructuras de la zona subventricular corresponderían a las ilustradas en el corte intermedio (bregma -8.72 mm).
Como se mencionara, para este trabajo se adoptó el polo rostral del núcleo motor del V par como referencia topográfica a los efectos de lograr cierta homogeneidad y consistencia, experimento a experimento, en relación al sector de la reticulada del tronco seleccionada para nuestro estudio. Este sector de la FRP correspondería al PnO en su porción más caudal, área respecto de la cual numerosos autores sostienen su papel como zona ejecutiva para varios componentes del S-REM8)(14)(65 y probablemente integrada al sector más ventral y medial del SLD (de "Sublaterodorsal nucleus", 22) sector de la FRP ubicado ventralmente respecto del Locus Coeruleus (LC). La denominación y localización precisa de este sector de la formación reticulada, considerada como ejecutiva para los componentes comportamentales esenciales del S-REM varía según el atlas estereotáxico utilizado, la especie en la que se hayan obtenido las evidencias experimentales y es aún objeto de debate entre los diversos grupos de investigación (ver para revisión6)(13)(45). Con fundamento en evidencia farmacológica, electrofisiológica y de anatomía funcional en el gato, este sector de la reticulada ha sido denominado como subcoeruleus (o SubC). Esta área contendría subsectores asociados a la generación de diversos componentes del S-REM (peri-LCalfa,10; área parabraquial,84). Según otros, estos sectores estarían bajo el control de una región más rostral y ventral de la formación reticulada (reticularis pontis oralis ventral, vRPO) que actuaría como un verdadero punto nodal en la organización del S-REM14. En roedores, probablemente debido a dificultades metodológicas derivadas de las reducidas dimensiones de las estructuras del tronco encefálico, los datos no son tan claros. Aun cuando persiste controversia en cuanto a la localización precisa del sitio específico implicado en el control de los diversos componentes del S-REM, existe acuerdo en el papel central de la formación reticulada pontina rostral65. Evidencias farmacológicas y electrofisiológicas indican que las neuronas (particularmente aquellas implicadas en la atonía muscular) parecen localizarse rostralmente respecto del SubC, ventralmente al agrupamiento colinérgico del LDT-PPT. Esta región ha sido denominada como área sublaterodorsal (SLD)22, y se le asigna un papel crítico en el control del S-REM en roedores (ver más adelante) como estructura cuya activación es necesaria y suficiente para la generación de la atonía característica de este estado comportamental. La utilización de esta denominación para el área de la FRP considerada ejecutiva para los componentes cardinales del S-REM se ha ido consolidando en la última década aunque su localización precisa, características y propiedades funcionales son aún objeto de debate y de intensa investigación 13.
Los registros intracelulares de las neuronas del PnO presentaron, de manera característica, dos fenotipos electrofisiológicos signados por la presencia o ausencia de espiga de bajo umbral (LTS) lo que permitió categorizarlas como LTS y No-LTS (Figura 2) (Figura 3). Ambos tipos neuronales presentaron respuestas del Vm a diversos protocolos de corriente compatibles con la presencia de Ih e IA. Neuronas del PnO con similares fenotipos electrofisiológicos han sido descritas por otros autores (ver p.ej.:34)(37)(38) así como en otros sectores de la formación reticulada 55. Desafortunadamente, probablemente por problemas inherentes a la técnica de marcaje intracelular con electrodos de patch, no pudimos establecer una correspondencia entre la citomorfología de las neuronas registradas en el presente estudio y las descritas por otros autores (ver p.ej. 37). Aún cuando estos autores categorizaron las neuronas registradas en tipo I y tipo II de acuerdo a la ausencia (tipo I) o presencia de rectificación mediada por Ih ( tipo II), la proporción de neuronas LTS y No-LTS reportada por estos autores (14% y 86% de LTS y No-LTS) difiere de la encontrada en nuestro estudio (47.7% y 52.3%, respectivamente). Esta divergencia probablemente obedezca al hecho de que en el estudio de Núñez et al. (1997) 37 el registro intracelular se obtuvo mediante electrodos afilados convencionales lo cual pudo haber sesgado el muestreo hacia las neuronas que mostraron diámetros somáticos relativamente mayores (neuronas carentes de LTS) y limitado el control del Vm en la célula registrada. Un factor adicional que podría dar cuenta de esta divergencia es que nuestro estudio se ha limitado a analizar el fenotipo electrofisiológico de las neuronas del PnO en las que la estimulación eléctrica a nivel del LDT-PPT provoca respuestas sinápticas muy probablemente por activación de neuronas que proyectan directamente sobre estas neuronas (respuestas monosinápticas).
La presencia del LDT-PPT en la rodaja de la unión ponto-mesencefálica se apoya en evidencias topográficas (Figura 1), inmunohistoquímicas (Figura 4) y electrofisiológicas. En efecto, de acuerdo con la rodaja seleccionada para nuestro estudio y según el atlas de Paxinos y Watson (1998)46, las neuronas del tegmento mesopontino próximas al polo medial del pedúnculo cerebeloso superior (ver imagen bregma -8.72 mm) muy probablemente correspondan a neuronas del LDT-PPT. Más aún, la detección de neuronas ChAT+ en este sector (Figura 8) es considerado un elemento confirmatorio (ver p.ej.,85)(86). Finalmente, la breve caracterización electrofisiológica realizada en el curso de los experimentos dedicados al análisis de la activación antidrómica de las neuronas del LDT-PPT por estimulación eléctrica del PnO así como en los experimentos de estimulación farmacológica de estas neuronas (Figura 6) permitió constatar que las neuronas registradas exhibieron fenotipos electrofisiológicos (datos no mostrados) similares a los reportados en estudios electrofisiológicos previos (ver p.ej. 69).
La presencia de neuronas colinérgicas y no-colinérgicas del LDT-PPT marcadas retrógradamente por la aplicación de neurobiotina en el PnO (Figura 4) sugiere la existencia de terminales de neuronas del tegmento mesopontino a nivel del sitio de inyección. La activación antidrómica de las neuronas del LDT-PPT por estimulación del PnO (Figura 6) apunta en este mismo sentido. Datos adicionales en favor de la existencia de una conexión funcional entre neuronas del tegmento mesopontino y neuronas del PnO en la rodaja de la unión ponto-mesencefálica provienen de los experimentos de activación farmacológica del LDT-PPT (Figura 6), así como de los experimentos de estimulación eléctrica de este complejo (Figura 5). La aplicación de microvolúmenes de agonistas glutamatérgicos y colinérgicos a nivel del LDT-PPT provocó incrementos en la frecuencia de descarga de potenciales de acción en neuronas del PnO. A diferencia de la estimulación eléctrica convencional (ver más adelante) que puede reclutar tanto somas neuronales como fibras de pasaje, este tipo de estímulo sería capaz de activar sectores somato-dendríticos de neuronas que expresan receptores funcionales para los agonistas utilizados. En este sentido, en tanto la inyección de Glu. pudo haber activado los diversos tipos celulares presentes en el LDT-PPT (colinérgicas, glutamatérgicas y GABAérgicas,49)(70)(86), CCh pudo haber provocado la activación de neuronas glutamatérgicas y GABAérgicas y la inhibición de las neuronas colinérgicas 69. Ambos agonistas son capaces de activar receptores tanto ionotrópicos como metabotrópicos. Un aspecto llamativo de estas respuestas refiere a su prolongada latencia (( 3-8 s), que contrasta con la de las respuestas sinápticas provocadas por estímulo eléctrico (( 10 ms). La forma de evaluar las respuestas de las neuronas del PnO (frecuencia de descarga de PAs) probablemente impida determinar específicamente la latencia de las respuestas sinápticas provocadas por el estímulo farmacológico. En efecto, el cambio de la frecuencia de descarga de potenciales de acción, se estima que refleja el efecto neto sobre la excitabilidad de la célula postsináptica de múltiples entradas asincrónicas de diversa naturaleza (excitadoras e inhibidoras), de escasa amplitud (ver luego) que convergen sobre la neurona registrada. Un incremento de la frecuencia de descarga de las neuronas del PnO, como el observado en nuestros experimentos, sería el resultado de un efecto excitador neto sobre estas neuronas. Con menor latencia y precediendo a este efecto excitador neto, la estimulación farmacológica del LDT-PPT pudo haber provocado la coactivación de neuronas glutamatérgicas y GABAérgicas (menos duradera) sin efecto neto detectable en las neuronas del PnO. El curso temporal de las respuestas de las neuronas del LDT-PPT a la aplicación de agonistas (> 1s, ver Resultados) y la cinética de la difusión del agonista aplicado provocando el reclutamiento progresivo de neuronas a este nivel 43 pudo haber contribuido además al establecimiento del peculiar curso temporal de las respuestas analizadas.
La estimulación eléctrica del LDT-PPT con trenes de estímulos (Figura 5D) provocó respuestas postsinápticas en las neuronas del PnO compatibles con la activación de receptores muscarínicos en estas células sugiriendo la indemnidad de la entrada colinérgica originada en estos núcleos tegmentales. La inervación colinérgica de las neuronas de la FRP generadoras de S-REM procedente del LDT-PPT ha sido bien caracterizada (ver para revisión:13)(87), sin embargo no fue posible detectar un componente colinérgico en las respuestas postsinápticas provocadas por estímulos únicos. Probablemente la liberación de ACh por parte de estas aferentes requiera de patrones de estimulación como los utilizados en el hipocampo de la rata in vitro68 lo cual apunta a que la inervación colinérgica (conjuntamente con la monoaminérgica) ejerce un efecto esencialmente modulador como ha sido propuesto recientemente (13, 81). En este sentido es destacable que neuronas colinérgicas del LDT-PPT categorizadas como REM-on registradas in vivo 49 descargan repetitivamente a frecuencias relativamente elevadas (~ 15-20 Hz) antes y durante los episodios de S-REM. De manera característica el estímulo único del LDT-PPT provocó respuestas mixtas glutamatérgicas y GABAérgicas (Figura 5B) (Figura 5C). Aún cuando las aferencias glutamatérgicas y particularmente GABAérgicas a las neuronas de la FRP generadoras de S-REM hayan sido recientemente destacadas como determinantes en el control de este estado13)(22)(26)(30)(31)(88, el LDT-PPT no ha sido específicamente considerado como origen de este tipo de inervación (a excepción de la mención realizada de los contactos GABAérgicos en los estudios de Semba y Fibigier, 1992 64 y de Boissard et al., 2003 88). Sin perjuicio de ello, en este trabajo presentamos evidencias morfológicas (Figura 4) y electrofisiológicas (Figura 5) (Figura 6) que sustentan la existencia de contactos sinápticos directos entre neuronas no colinérgicas del LDT-PPT y neuronas del PnO. Las respuestas glutamatérgicas y GABAérgicas provocadas por estimulación del LDT-PPT, se obtuvieron aisladamente por perfusión del antagonista correspondiente (Fig. 5). La estabilidad de la latencia de las respuestas en diversas condiciones de estimulación 47 conjuntamente con la obtención de IPSCs aislados farmacológicamente por bloqueo de la transmisión glutamatérgica, sugieren que la inervación no colinérgica del PnO originada en el LDT-PPT ipsilateral, involucra contactos sinápticos directos sobre neuronas del PnO. En virtud de la sensibilidad de las respuestas provocadas a los bloqueantes utilizados y coherentemente con hallazgos previos en la FRP de la rata25)(26, los EPSCs involucran la activación de receptores ionotrópicos de glutamato (NMDA y AMPA) en tanto que los IPSCs, receptores de tipo GABAA. Tomando en cuenta la latencia de las respuestas postsinápticas en las neuronas del PnO provocadas por el estímulo eléctrico del LDT-PPT (( 9.8 ms) y la distancia (lineal) medida desde el sitio de estímulo hasta la zona de registro en el PnO (( 1.5 mm), estimando un retardo sináptico ( 1 ms, la velocidad de conducción de los axones de las neuronas activadas por el estímulo sería cercana a los 0.17 m/s. Llamativamente, la velocidad de conducción de los axones de neuronas del LDT-PPT por estímulo en el PnO (activación antidrómica) estimada sería similar ( 0.19 m/s (latencia ( 7.9 ms y similar distancia). Esto sugiere, en línea con observaciones realizadas por otros autores en hipocampo (ver p.ej.: 89), que las neuronas del LDT-PPT que proyectan al PnO presentan axones amielínicos relativamente finos.
En la actualidad se acepta que el circuito mesopontino de control del S-REM incluye los componentes colinérgico -dependiente mayormente de la activación de neuronas colinérgicas del LDT-PPT- y monoaminérgico -noradrenérgico procedente del Locus Coeruleus y serotoninérgicas del núcleo del rafe dorsal- que inervan el sector rostral de la FRP y asumen un papel esencialmente modulador (revisado en:6)(7)(22). Recientemente, además de la activación de grupos neuronales específicos, la modulación específica dependiente del estado comportamental -colinérgica o monoaminérgica- de los contactos sinápticos de la red mesopontina ha comenzado a formar parte de los mecanismos implicados en la regulación del S-REM (25, 26). En virtud de la variedad de efectos de los colinomiméticos en las sinapsis glutamatérgicas y GABAérgicas en el SNC en general 90 y en el PnO en particular25)(26 de acuerdo al tipo de contacto analizado, acotar el estudio de esta eventual modulación a un grupo funcional y anatómicamente homogéneo de entradas sinápticas, como el activado por el estímulo eléctrico en nuestra rodaja, puede construir un requisito importante para avanzar en la comprensión de los mecanismos responsables del S-REM que operan en la red mesopontina.
Mecanismos colinérgico y GABAérgico del PnO controlan la excitabilidad de las motoneuronas trigeminales en la rodaja mesopontina
Como ya se mencionara, la estimulación colinérgica de sitios específicos de la FRP es capaz de inducir un estado indistinguible del S-REM fisiológico incluyendo la atonía propia de este estado comportamental75)76)(77)(78. Por su parte la aplicación de agonistas GABAérgicos al mismo nivel, suprime el S-REM fisiológico promoviendo la irrupción de vigilia y es capaz de eliminar la atonía muscular provocada por la aplicación de colinomiméticos30)(31)(79).
Sólida evidencia indica que las neuronas glutamatérgicas de la FRP promotoras de la supresión motora característica del S-REM, controlarían la descarga de neuronas premotoras glicinérgicas y probablemente GABAérgicas, localizadas en la formación reticulada bulbar (ventromedial) próximas a la oliva inferior67)(91)(92. La estimulación colinérgica de las neuronas de las áreas de la FRP ejecutivas para el S-REM, provocarían la activación de estas neuronas bulbares inhibiendo las motoneuronas espinales con la consiguiente atonía característica de este estado comportamental13)(22)(93)(94. Aún cuando se discute si este constituye el único mecanismo responsable de la inhibición durante el S-REM de algunas motoneuronas craneales (en las respiratorias se sumaría la inhibición directa mediada por ACh) nuestros resultados sugieren que un mecanismo similar podría estar operando en la rodaja mesopontina. La estimulación colinérgica de las neuronas del PnO, se estima similar a la ilustrada en la Fig. 2S, provocó reducciones de la Ren de las motoneuronas trigeminales como base de la reducción de la respuesta neuronal a la aplicación de pulsos despolarizantes y el bloqueo de la invasión antidrómica de potenciales de acción (Figura 7). A diferencia de los cambios observados en motoneuronas durante la atonía provocada por la aplicación de CCh en la FRP en gatos76)(77, no fuimos capaces de detectar cambios significativos del Vm. Al margen de eventuales diferencias interespecíficas, o debidas al tipo de motoneurona registrada (craneal vs espinal), valores relativamente hiperpolarizados del Vm (-69 mV) y cercanos al Veq. del cloro (-75.3 mV, calculado según la relación de las concentraciones intra y extracelulares), pueden razonablemente explicar la escasa magnitud de los efectos observados. En este sentido, pudieron haber contribuido además una población reducida de neuronas de la FRP (las contenidas en la rodaja) y volúmenes relativamente pequeños (< 30 pl) de CCh inyectados a ese nivel. Sin perjuicio de lo anterior, la reducción de la excitabilidad de las motoneuronas acompañada de la disminución de la Ren y bloqueo de la invasión antidrómica del compartimiento somatodendrítico (similares a los observados por Chase y Morales, 1983 95), fueron hallazgos sistemáticos. Cabe consignar que el mecanismo responsable de la reducción de la excitabilidad de las motoneuronas característica del S-REM, continua siendo objeto de debate. El bombardeo sináptico glicinérgico-GABAérgico, capaz de reducir sustancialmente la Ren, conjuntamente con la remoción del efecto excitador de la aferencia monoaminérgica procedente de los núcleos del tronco encefálico, inhibidos durante los episodios de S-REM (neuronas REM-off del Locus Coeruleus y del núcleo del rafe dorsal,13)(96)(97)(98), han sido propuestos como los mecanismos esenciales. El eventual aporte de la disminución de la aferencia monoaminérgica a las motoneuronas trigeminales, ya madura en los especímenes utilizados (P7 a P14, 99), podría explicar, al menos en parte, la reducción de la excitabilidad observada sin que esta se acompañe de hiperpolarización. El registro de las motoneuronas del NM V durante la reducción de la excitabilidad provocada por la aplicación de CCh en el PnO en condiciones de fijación de voltaje a potenciales de comando alejados del potencial de Veq. del cloro, podría aportar evidencia relevante en relación a la participación del bombardeo glicinérgico/ GABAérgico (y su peso relativo) en el mecanismo de la inhibición de las motoneuronas craneales durante el S-REM.
La aplicación local de Muscimol, agonista GABAérgico (GABAA), en el PnO provocó sistemáticamente un aumento transitorio de la excitabilidad de las motoneuronas trigeminales acompañado de un incremento de la Ren (Figura 8), efectos opuestos a los provocados por la aplicación de CCh. Resultados similares han sido obtenidos in vivo29)(30)(31)(100 en los que la aplicación de Muscimol en la FRP fue capaz de suprimir el S-REM (fisiológico o el provocado por CCh), induciendo un estado de vigilia y un incremento de la actividad motora. Aún cuando los mecanismos implicados no han sido específicamente explorados, se ha postulado que los cambios de la excitabilidad de las motoneuronas provocado por la aplicación de agonistas GABAérgicos en la FRP resultarían de la inhibición de las neuronas implicadas en la generación de S-REM y de la supresión motora propia de este estado comportamental. Como consecuencia de ello, el incremento de la excitabilidad de las motoneuronas observado, podría obedecer a una reducción del bombardeo glicinérgico-GABAérgico, y a la activación de la aferencia monoaminérgica13)(97.
Aún cuando un efecto directo de CCh y Muscimol sobre las neuronas el NM V no puede ser definitivamente descartado, es poco probable que se haya producido la difusión pasiva de ambos agonistas desde el sitio de inyección debido a los bajos volúmenes aplicados (<30 pl), las bajas concentraciones de agonistas utilizadas y la distancia del sitio de inyección a las motoneuronas registradas 43. Más aún, los resultados obtenidos por Muscimol son opuestos a los efectos esperados por acción directa del agonista sobre las motoneuronas: inhibición y reducción de la Ren.
Conclusiones
En virtud de las características anatómicas y funcionales de la rodaja mesopontina caracterizada en el presente trabajo, esta preparación reducida del tronco encefálico de la rata emerge como un modelo experimental in vitro de elección para el estudio de los mecanismos celulares y sinápticos que operan en los circuitos centrales de control del S-REM y de otros estados comportamentales. La utilización de este modelo experimental permitirá avanzar en el conocimiento de los mecanismos que operan a niveles intermedios de integración para la organización de estados comportamentales, entre ellos, la interacción entre las inervaciones GABAérgica y colinérgica del PnO, postulada como crítica en el control del ciclo sueño-vigilia (ver para revisión6)(7)(13)(81). En este sentido es de particular interés determinar la existencia de fenómenos plásticos de los contactos sinápticos sobre las neuronas del PnO (particularmente GABAérgicos), dependientes de la inervación colinérgica y monaminérgica que convergen en el área ejecutiva del S-REM 65, que podrían ser categorizados como fenómenos plásticos dependientes del estado comportamental. Esta preparación in vitro ofrece asimismo una oportunidad de privilegio para profundizar en los mecanismos implicados en el control de la excitabilidad de las motoneuronas craneales por parte de la FRP, posiblemente implicados en la supresión motora característica del S-REM.