Introducción
El problema del cáncer es claramente uno de los desafíos sanitarios más relevantes de nuestra época. Como consecuencia del control de las enfermedades infecciosas, fruto del progreso médico en su prevención y tratamiento, así como también de las mejoras generales en la calidad de vida; la expectativa de vida tuvo, a lo largo del siglo pasado, un aumento sustantivo. Esto dio lugar a que, sobre la segunda mitad del siglo XX, emergiera un nuevo perfil epidemiológico en el cual las enfermedades crónicas y degenerativas, especialmente la patología cardiovascular y el cáncer, se constituyeron en las primeras causas de muerte1.
Este fenómeno, la transición demográfico-epidemiológica, comenzó más tempranamente en los países desarrollados, y en el contexto regional también en nuestro país1)(5. De acuerdo con los expertos en demografía, esta transición, aún en curso en el Uruguay, proyecta un escenario complejo para las próximas décadas. El aumento del envejecimiento de la población es un "potente indicador de desarrollo" y seguirá impactando en el perfil epidemiológico; "la población en edades activas caerá", lo cual tendrá consecuencias socio-económicas relevantes en los recursos disponibles para financiar las políticas sanitarias emergentes6.
Con distintas dinámicas, en las últimas décadas, los países menos desarrollados están atravesando progresivamente esta transición. Este hecho en combinación con la adquisición de hábitos de vida occidentales por parte de estas poblaciones, permite proyectar un impacto dramático del cáncer en las próximas décadas. Se estima que el número de casos nuevos de cáncer pasará de alrededor de 14 en 2012 a más de 20 millones en 2030, y que casi dos tercios de esos casos ocurrirán en los países menos desarrollados7.
Como consecuencia se proyecta entonces un cambio sustantivo tanto en la escala (magnitud) como en el perfil epidemiológico del problema, los países menos desarrollados aumentan aquellos cánceres que hasta ahora eran más frecuentes en los países más desarrollados (mama, próstata, pulmón, colo-recto) a la vez que van disminuyendo otros (cérvix, estómago) generalmente asociados a infecciones y a indicadores de calidad de vida.
Esto último requiere especial atención en tanto que los países menos desarrollados no cuentan con recursos similares a aquellos de los países desarrollados para enfrentar la enfermedad, lo cual plantea un desafío dramático.
Tal como lo plantea el Dr. Christopher Wild, actual director de la IARC: "...el futuro de los pacientes con cáncer depende en gran parte del lugar en donde viven. En los países económicamente menos desarrollados, el cáncer se diagnostica habitualmente en etapas más avanzadas, y el acceso a tratamientos efectivos es limitado o inaccesible, así como también los cuidados paliativos. Aún dentro de los países económicamente más desarrollados, existen disparidades en el acceso a la atención médica en diferentes comunidades. Las experiencias vividas por cada paciente con cáncer, reflejan con demasiada frecuencia la peor de las desigualdades globales"7.
En virtud del amplio y variado espectro de cánceres y la imposibilidad de abarcarlos a todos en este artículo, hemos decidido focalizarnos en los cuatro más frecuentes: el cáncer de mama femenino, el de próstata, el de pulmón y el de colo-recto, con énfasis en los aspectos descriptivos de la epidemiología. Estos constituyeron casi la mitad (49%) del total de los tumores malignos registrados en el período 2009-2013 en el Uruguay8. Además de los antes mencionados hemos decidido incluir el cáncer de cuello de útero y el cáncer de esófago por las siguientes razones: 1. ambos contribuyen a darle al perfil oncológico uruguayo, el cual es muy similar al de los países desarrollados, un carácter mixto, en tanto que son tumores malignos más frecuentes en países con menores grados de desarrollo (el cáncer de estómago constituye también, especialmente en el sexo masculino un rasgo similar), y 2. presentan en Uruguay características epidemiológicas particulares que merecen ser destacadas.
El cáncer en la infancia, así como la patología hemato-oncológica no serán abordados en este artículo. Se trata de áreas que merecen un tratamiento particular y requerirían seguramente del concurso de especialistas en esas respectivas áreas.
De acuerdo con la definición establecida por la American Cancer Society9, el cáncer es un grupo de enfermedades caracterizado por el crecimiento descontrolado y propagación de células anormales. Si este proceso no es controlado, puede resultar en la muerte del paciente. El cáncer es habitualmente causado tanto por factores externos (tabaco, agentes químicos, radiaciones, e infecciones) como por factores internos (mutaciones heredadas, hormonas, condiciones inmunológicas, y mutaciones que pueden ocurrir como consecuencia del propio metabolismo).
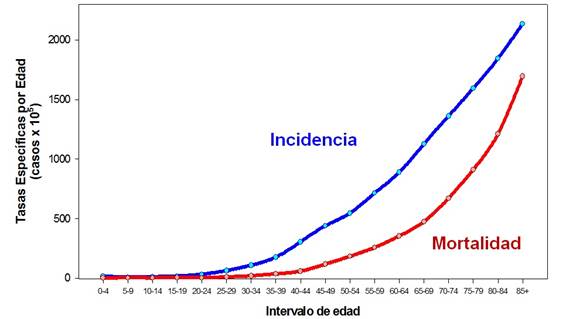
El desarrollo de la mayor parte de los cánceres requiere varias etapas que pueden ocurrir a lo largo de muchos años. En términos generales el riesgo de padecer o morir por cáncer depende dramáticamente de la edad (Figura 1).
Esta relación entre la edad y el riesgo de padecer cáncer ha sido una de las bases sobre la cual se desarrolló la teoría multi-etápica del cáncer (multi-stage theory)10. De acuerdo con esta teoría se necesita que ocurra una secuencia de cambios en la información genética, particularmente de aquellos genes involucrados en el control y la regulación de la replicación celular, para que se de lugar a la transformación maligna. Siempre de acuerdo con el enunciado original de la teoría, estos eventos o cambios son independientes en probabilidad pero tales probabilidades son dependientes del tiempo así como de la "dosis" de exposición a aquellos agentes (físicos, químicos o biológicos) potencialmente carcinogénicos.
Aunque hubo antecedentes previos, es interesante conocer que esta teoría fue formalmente enunciada por Armitage y Doll a principios de los 50’, analizando simplemente las curvas de la incidencia y mortalidad por cáncer en función de la edad. Como comentara Sir Richard Doll, cuando se cumplió medio siglo de la comunicación de la teoría, la concepción preponderante entre los médicos de la época era (especialmente producto de la influencia de los patólogos alemanes) que el cáncer se originaba en células embrionarias presentes en el organismo y no de células somáticas. A su turno, este fundamental aporte estuvo basado en la información producida por los primeros registros de cáncer de base poblacional (denominados registros centrales en el Reino Unido y EEUU) que habían sido fundados algunos años antes11.
1 El cáncer en el mundo
Las últimas estimaciones mundiales realizadas por la Agencia Internacional de Investigación en Cáncer (IARC)12 han mostrado que en 2012 se diagnosticaron más de 14 millones de nuevos casos de cáncer (en estas cifras se excluye al cáncer de piel distinto al melanoma), más de 8 millones de personas han muerto por esta causa y existían en ese año unos 32 millones de pacientes con esta enfermedad (una estimación conservadora de la prevalencia ya que se consideran solamente aquellos pacientes que tienen como máximo 5 años de diagnosticada la enfermedad).
El cáncer afecta a todos los seres humanos, pero existen marcadas diferencias en los patrones epidemiológicos a nivel internacional, regional e incluso dentro de los propios países o áreas de menor tamaño.
Es importante señalar que los datos epidemiológicos sobre la incidencia y la mortalidad por cáncer varían enormemente respecto de su cobertura y calidad a nivel internacional, desde países con registros de base poblacional que cubren toda una nación con alta calidad de datos, a zonas donde existen apenas datos limitados de base hospitalaria o incluso zonas donde no existen datos simplemente. En este sentido las estimaciones globales realizadas por la IARC son importantes para comparar regiones o países, pero por las razones señaladas, pueden tener en algunos casos limitaciones importantes13. Un complemento más fiable de esta información es aquella proporcionada por la publicación quinquenal de la misma agencia denominada Cancer Incidence in Five Continents, que publica los datos de los registros de base poblacional que satisfacen ciertos criterios de calidad14.
Los registros de cáncer de base poblacional (RCBP) cuyo desarrollo comenzó hace 70 años, tienen la función de identificar todos aquellos casos de cáncer que ocurren en una población definida. A diferencia de los registros de base hospitalaria el número de variables que registra es más modesto. La función principal de estos sistemas de información es caracterizar el perfil epidemiológico de la región implicada (medir la incidencia de los distintos tipos de cáncer, características histopatológicas, estadios al momento del diagnóstico, ubicación espacial, grandes líneas de tratamientos y analizar la supervivencia), es básicamente una tarea de vigilancia epidemiológica y de esta forma "alimentar" de información a las autoridades sanitarias, investigadores, profesionales, y especialmente a los propios habitantes15. Se consideran el sistema nervioso "sensorial" de los programas de control de cáncer en tanto que su información es vital para plantear, programar, implementar y también evaluar las intervenciones sanitarias que sean necesarias en esta materia. Lamentablemente la cobertura de los RCBP es aún muy pobre, especialmente en los países con menos grado de desarrollo, donde serán críticamente necesarios en el futuro inmediato dada la dinámica global de la enfermedad. En América Central y América del Sur los RCBP con calidad fiable como para su aceptación en la publicación Cancer Incidence of Five Continents (IARC) cubrían apenas el 8% de la población16.
En aquellas regiones con mayores Índices de Desarrollo Humano (IDH)17, los cánceres de mama (femenino), de pulmón, colo-recto y próstata dan cuenta de aproximadamente la mitad de los casos nuevos de esta enfermedad, mientras que en las regiones de IDH medio, los cánceres de esófago, estómago e hígado, figuran también entre los más frecuentes. Estos 7 tipos de tumores malignos representan el 62% del total de los casos de cáncer en las regiones de IDH medio o alto18)(19.
Las cifras sugieren que la existencia de transiciones rápidas en términos sociales y económicos en muchos países, llevan a la reducción de aquellos tumores vinculados a factores infecciosos, dando lugar al creciente número de casos de cánceres asociados a factores reproductivos dietarios u hormonales19.
2 El cáncer en el Uruguay
En el Uruguay se registran anualmente unos 15000 casos nuevos de cáncer y más de 8000 muertes son causadas por esta enfermedad20)(21. El cáncer es la segunda causa de muerte en Uruguay desde hace décadas, dando cuenta de un cuarto (24,7% en 2015) del total de las defunciones registradas22.
El cáncer de piel distinto al melanoma (en adelante cáncer de piel no melanoma) es por lejos el cáncer más frecuente pero de acuerdo a los estándares internacionales este cáncer suele excluirse de las estadísticas oficiales por las dificultades que ofrece su registro23. Siguiendo también los estándares internacionales, tampoco se incluyen en estas estadísticas los cánceres in situ, y solo se consideran los invasores. Si descartamos el cáncer de piel distinto al melanoma, entonces la cifra de diagnósticos de nuevos casos de cáncer en Uruguay (incidencia) es de unos 13000 al año.
El cáncer más frecuente en Uruguay en cifras absolutas en ambos sexos reunidos es el cáncer de mama (unos 1860 casos anuales, de los cuales 1840 son en mujeres) seguido de cerca por el cáncer colo-rectal cuando se cuentan los casos de ambos sexos reunidos (unos 1830 casos anuales) Les siguen el cáncer de próstata (1450 casos anuales) y el de pulmón (1400 casos anuales)8.
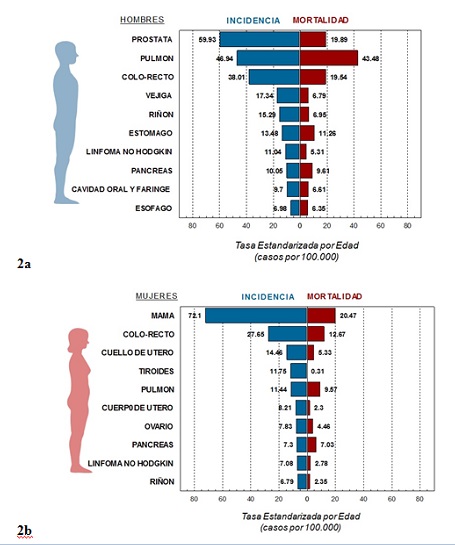
Cuando se consideran los sitios por sexo, en el hombre el cáncer de próstata es el tumor maligno más frecuente (Figura 2a) (Figura 3), seguido por el cáncer de pulmón (unos 1100 casos anuales), siendo este último, por lejos, el más letal.
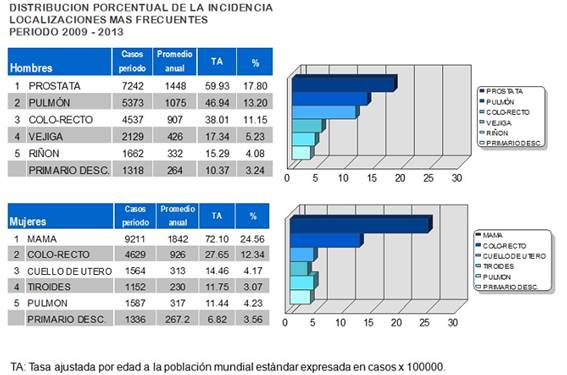
Figura 3: Número de casos y tasas ajustadas de incidencia de los cánceres más frecuentes en Uruguay período 2009-2013
El CCR ocupa el tercer lugar en hombres con unos 910 casos anuales. En mujeres el cáncer de mama es por mucho el más frecuente, seguido por el CCR (unos 920 casos anuales, ver más adelante en este artículo). En el tercer lugar, lamentablemente, aún figura el cáncer de cuello de útero con unos 330 casos nuevos cada año.
Para ubicar la importancia de las cifras de incidencia del cáncer en Uruguay en el contexto internacional digamos que la tasa estandarizada de todos los sitios reunidos (exceptuando al cáncer de piel no melanoma) considerando ambos sexos reunidos es de 298 casos por 100000 personas-año,(Figura 4a) (Figura 4b) mayor pero muy próximo al valor que las estimaciones de la IARC12. arrojan para el conjunto de los países más desarrollados (267 casos por 100000). De modo que tanto en el perfil epidemiológico como en la escala de sus cifras el Uruguay parece muy próximo al conjunto de los países más desarrollados, con la excepción del cáncer de cuello de útero en la mujer, un tumor ligado a inequidades socio-económicas y cuyas herramientas de control parecen accesibles.
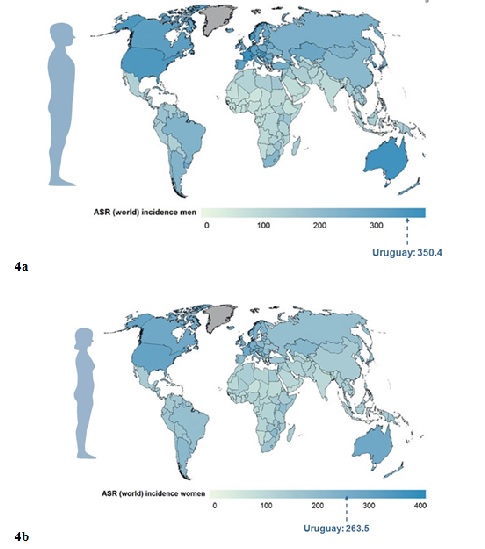
Figura 4: Distribución de las tasas de incidencia del cáncer alrededor del mundo de acuerdo a Globocan 2012 (ver texto). Las cifras señaladas para Uruguay corresponden al RNC-CHLCC, periodo 2009-2013. 4a. Hombres. 4b. Mujeres
Debemos decir también que aparecen diferencias importantes en relación a los países desarrollados cuando se examinan las tasas de mortalidad. En términos generales puede decirse que en algunos sitios relevantes las cifras de mortalidad de Uruguay son mayores que las de los países desarrollados. Si bien las tasas estimadas de mortalidad por cáncer que ha difundido la IARC12 son superiores a las que efectivamente mide el RNC, las diferencias (aunque más leves) persisten.
La razón entre la tasa estandarizada por edad de mortalidad y aquella de incidencia (cociente M/I) permite una primera aproximación (aunque grosera y con fines comparativos) de cuán importante es la mortalidad cuando la población está sometida a un cierto riesgo expresado por la tasa de incidencia. Está claro que la gran mayoría de los pacientes que mueren en un cierto año fueron diagnosticados en años anteriores, mientras que la incidencia refiere a los casos estrictamente diagnosticados en ese año, no obstante las dinámicas epidemiológicas del cáncer transcurren en períodos de muchos años, de modo que este cociente es válido con fines comparativos. Claro está, no es posible indagar más detalladamente con esta sola expresión, respecto de los factores que explican cocientes favorables o desfavorables.
También es posible mostrar que la cantidad 1-(M/I) es una buena aproximación en una gran cantidad de sitios a la tasa de sobrevida relativa a los 5 años (ver más adelante)24. Igualmente, siempre es preferible una medida precisa de la sobrevida a través del seguimiento de las cohortes de pacientes, esta es una tarea propia de los registros de cáncer de base poblacional (ver más adelante).
Cuando se examinan las cifras de estos cocientes en el contexto internacional, puede verse que Uruguay alcanza valores próximos a sus vecinos (Argentina y Brasil) en los sitios más importantes pero mayores que el conjunto de los países desarrollados (Figura 5) mostrando así resultados más pobres en el control de la enfermedad.
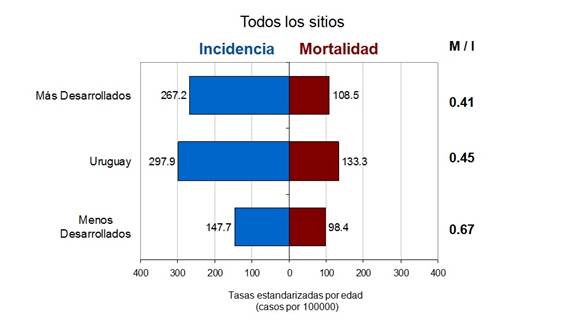
Figura 5: Diagrama de barras comparativo de las tasas estandarizadas por edad de incidencia y mortalidad en el Uruguay (cifras del RNC-CHLCC) para todos los sitios de cáncer reunidos (ambos sexos) en relación al conjunto de países más y menos desarrollados. A la derecha las razones M/I.
Es posible que tales diferencias se expliquen tanto por mayores valores en el denominador (Incidencia) debido tal vez a un número mayor de diagnósticos por los programas de tamizaje (screenings) o a mejores registros, como a valores más bajos del numerador (Mortalidad). El lector interesado podrá observar en las tablas del Globocan 2012, que la calificación de la información de incidencia es de nivel A (el máximo) y de nivel 2 para la mortalidad en el caso de Uruguay, pero que ambas calificaciones varían hacia menores niveles de calidad en el contexto regional, lo cual limita la fiabilidad de estas comparaciones.
Sin considerar que los países desarrollados poseen potencialmente y en términos generales, ventajas comparativas en relación a los recursos asistenciales, solo por ser más eficientes en su detección temprana obtendrán mejores resultados en el control global de la enfermedad. El RNC de Uruguay posee información limitada de la distribución de estadios en la mayoría de los sitios, por lo cual a pesar de que la información disponible no revela mayores diferencias en estas distribuciones con los países desarrollados, no es posible descartar la importancia de este factor en su impacto sobre las razones M/I locales.
Respecto a las tendencias de esta situación, las tasas de mortalidad por cáncer (todos los sitios reunidos) exhiben un monótono decrecimiento en Uruguay desde hace décadas (Figura 7)
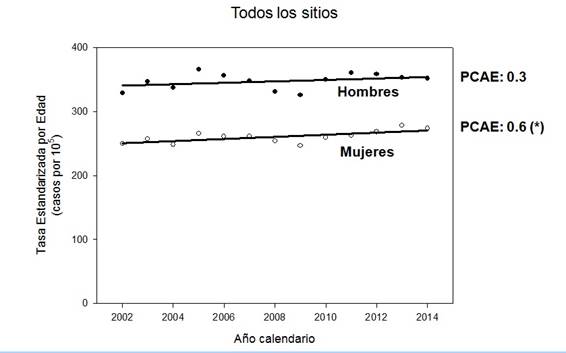
Figura 6: Tendencias recientes de la incidencia, todos los sitios, período 2002-2014. Ajustes de regresión Joinpoint con los valores del Porcentaje Anual de Cambio Estimado (PCAE). (*): p<0.05.
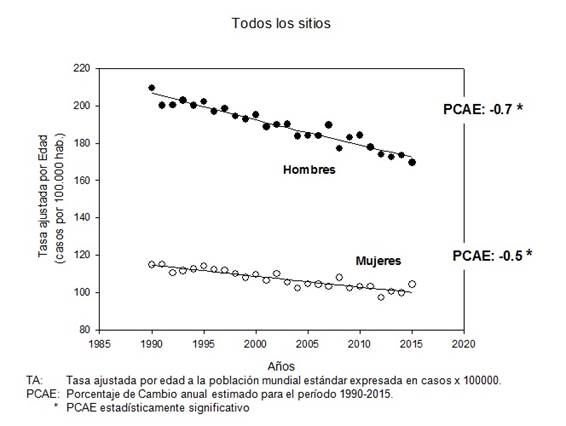
Figura 7: Tendencias de la mortalidad por cáncer. Todos los sitios. Uruguay. Período 1990-2015. Ajustes de regresión Joinpoint con los valores del Porcentaje Anual de Cambio Estimado. (*): p<0.05.
En el período 1990-2015, estas tasas decrecieron con un PCAE de - 0.7% en hombres y -0.5% en mujeres. La caída en los hombres se explica en gran medida por el descenso de la mortalidad por cáncer de pulmón. En el caso de las mujeres, la dinámica es más compleja puesto que hay ciertos cánceres relevantes que han mostrado descenso (como el cáncer de mama y el cáncer de útero - todos los tumores de los distintos subsitios de este órgano reunidos), mientras que otros (notoriamente el cáncer de pulmón) muestran aumentos significativos. En contraste con estas tendencias decrecientes en la mortalidad, las tendencias de las tasas estandarizadas de incidencia (Figura 6) muestran un curso estable en el período 2002-2014, aunque en el caso de las mujeres el PCAE es muy levemente creciente (PCAE: 0.6, p<0.05).
3 Cáncer de pulmón
El cáncer de pulmón continúa siendo el tipo de cáncer más frecuente en el mundo, en 2012 se estimaba que anualmente se registraban 1.8 millones de casos (dando cuenta del 13% del total de casos incidentes a nivel global) y 1.6 millones de muertes debidas a esta causa (20% del total de muertes por cáncer). Más de un tercio del total de estos casos fueron diagnosticados en China12)(25.
El cáncer de pulmón es la principal causa de muerte por cáncer en 87 países en el caso de los hombres y es ya, también, la principal causa de muerte por cáncer en mujeres en 26 países. Las tasas más elevadas se registran en Norte América, Europa y en el Este de Asia, así como son relativamente bajas en África y algunos países asiáticos2) (23.
Debido a la elevada y estable letalidad de este tumor, los patrones espaciales y las tendencias de la mortalidad son similares a aquellos correspondientes a la incidencia25.
En Uruguay, el cáncer de pulmón es el segundo tipo de cáncer más frecuente en hombres, pero continúa siendo la primera causa de muerte por cáncer en este sexo. En mujeres, es actualmente el cuarto cáncer más frecuente (luego del cáncer de mama, colo-recto y cérvix ), pero desde hace algunos años ya ocupa la tercera causa de mortalidad por cáncer21. Se registran unos 1400 casos nuevos de cáncer de pulmón cada año, aproximadamente unos 1100 en hombres y unos 300 en mujeres20. En el diagrama de la (Figura 8a) se muestra la relación entre las tasas de incidencia y de mortalidad para el Uruguay en comparación con aquellas cifras del conjunto de países más y menos desarrollados.
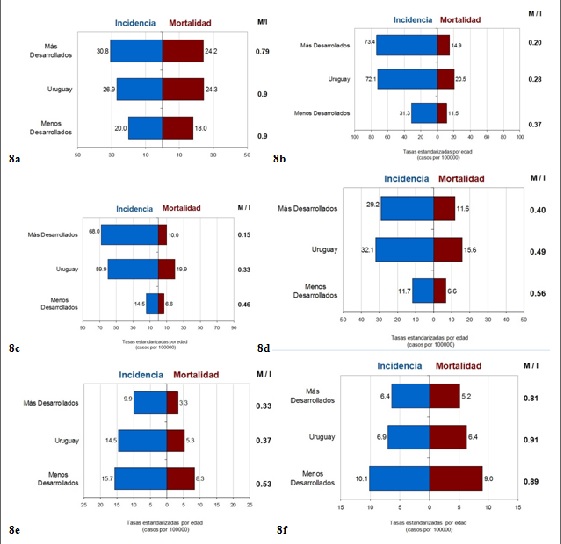
Figura 8: 8a. Pulmón. Ambos sexos. Diagramas de barras comparativos de las tasas estandarizadas por edad de incidencia y mortalidad en el Uruguay (cifras del Registro Nacional de Cáncer. CHLCC) en relación al conjunto de países más y menos desarrollados A la derecha las razones M/I. Para los sitios seleccionados. 8b. Mama. Mujeres.8c: Próstata. 8d: colo-recto. Ambos sexos. 8e: Cuello de útero. 8f: esófago. Hombres
Aquí puede observarse que las tasas de incidencia son próximas a aquellas de los países más desarrollados y las tasas de la mortalidad son casi idénticas a las de esos países. No obstante esto se expresa en una razón M/I más desfavorable y similar a aquella de los países menos desarrollados.
Las tendencias de la mortalidad que como se ha explicado más arriba reflejan bien aquellas de la incidencia debido a la elevada letalidad, han mostrado una gran dinámica en las últimas décadas con notorias diferencias entre ambos sexos. Mientras que en hombres, las tasas de mortalidad estandarizadas por edad han declinado monótonamente desde mediados de los 80´, a un promedio del 1.2 % anual, en las mujeres estas tasas aumentan dramáticamente a un promedio de 3.5% anual desde mediados de la década de los 90´ (período 1990-2015) (Figura 10a)26)(27.
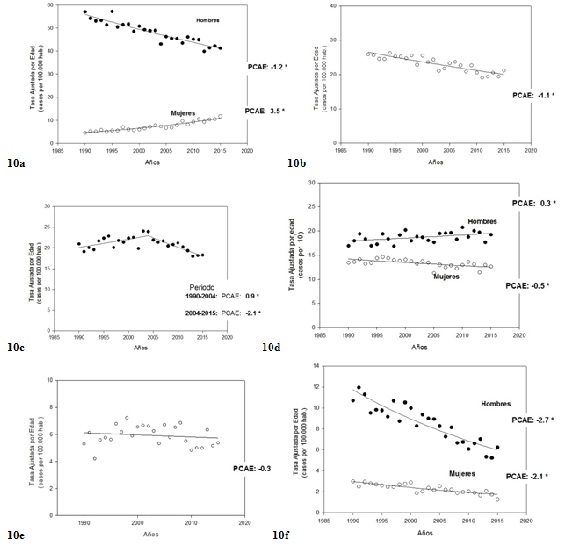
Figura 10: 10a. Cáncer de pulmón (C33-C34). Tendencias de mortalidad, sitios seleccionados, período 1990-2015. Ajustes de regresión Joinpoint con los valores del Porcentaje Anual de Cambio Estimado (PCAE). (*): p<0.05. 10b. Cáncer de mama (C50). 10c. cáncer de próstata (C61). 10d. colo-recto. 10e. cáncer de Cérvix (C53). 10f. cáncer de esófago (C15).
A principios de la década de 1990, el número de muertes por cáncer de pulmón en mujeres apenas superaba los 110 casos anuales, como se ha establecido más arriba, esta cifra se ha triplicado en este lapso. Dada la importancia en las cifras absolutas de este cáncer, esta dinámica impacta sensiblemente en las tendencias de la incidencia y la mortalidad por cáncer en el país.
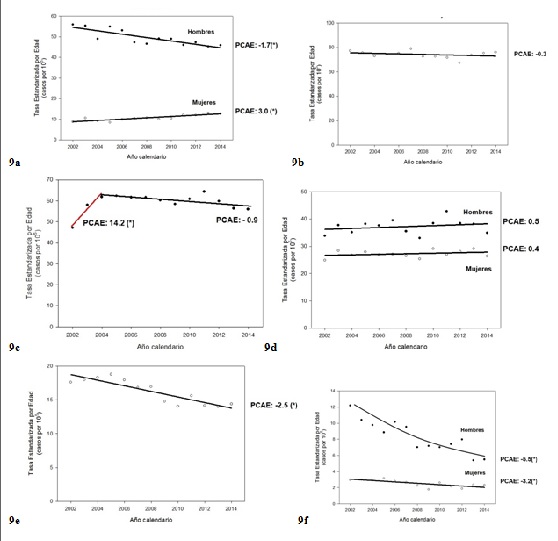
Figura 9: 9a. Pulmón. Tendencias recientes de la incidencia. Sitios seleccionados. Período 2002-2014. Ajustes de regresión Joinpoint con los valores del Porcentaje Anual de Cambio Estimado (PCAE) (*): p<0.05. 9b. Mama. Mujeres. 9c. próstata. 9d: colo-recto. 9e. cuello de útero. 9f: esófago.
En la (Figura 9a) se muestran las tendencias de las tasas de incidencia estandarizadas por edad para el período 2002-2014.
La causa más importante del cáncer de pulmón es el consumo de tabaco. El estudio del tabaquismo como factor de riesgo en cáncer es histórico y por lejos el más extensamente estudiado entre todos los carcinógenos28)(29.
Está claro entonces que el cáncer de pulmón constituye un problema relevante de salud pública y que los esfuerzos en su control, particularmente aquellos orientados a la prevención primaria (tabaquismo) están plenamente justificados y han ubicado a nuestro país entre aquellos que están en la vanguardia en materia de control anti-tabáquico30.
La tasa de incidencia del cáncer de pulmón es proporcional a la cuarta potencia de la edad en no fumadores (riesgo basal), y el exceso de riesgo (expresión técnica para calificar el aumento del mismo) en fumadores es proporcional a la cuarta potencia de la duración del consumo multiplicada por el número de cigarrillos por día. Esto es, el riesgo basal se multiplica en función de la duración y la intensidad del hábito, alcanzando en este caso Riesgos Relativos enormes31. El consumo de tabaco de "segunda mano" (fumadores pasivos) es también un factor de riesgo y constituye también otro fundamento sólido para el conjunto de medidas anti-tabaco32)(33.
Aunque se estima que el tabaquismo da cuenta de aproximadamente el 90% de los cánceres de pulmón en los países desarrollados, un amplio espectro de agentes físicos y químicos pueden ser la causa de este cáncer (arsénico, ciertos metales, fibras como el asbesto, etc), algunos de ellos involucran ciertamente riesgos ocupacionales (pintores, trabajadores expuestos a emisiones de motores diesel)34)(35. Las emisiones de Radón (especialmente desde ciertos suelos) están identificadas como un factor de riesgo para el cáncer de pulmón36.
Es conocido que las tendencias de las tasas del cáncer de pulmón están primariamente determinadas por la epidemia de tabaco. En grandes números el incremento en las muertes debidas a esta causa ocurre aproximadamente tres décadas después de la difusión generalizada del hábito de fumar.
También es un fenómeno conocido que en el caso de los hombres, la difusión del hábito del tabaquismo comenzó tempranamente en los países desarrollados a principios del siglo XX, y el cáncer de pulmón tuvo a mediados de ese siglo el pico y posterior declinación debido a las advertencias sobre la fuerte asociación entre el hábito de fumar y el cáncer de pulmón, medidas que siguieron a las históricas contribuciones de Doll y Hill en la década de 195028.
En Uruguay ese pico fue alcanzado en la primera mitad de la década de los 80'. Debido a razones principalmente vinculadas a la aceptación social del hábito en mujeres, la epidemia del cáncer de pulmón comenzó unas cuantas décadas más tarde. En el caso de EEUU, por ejemplo, donde las mujeres comenzaron a fumar más tempranamente el cáncer de pulmón es, desde hace décadas la primera causa de muerte por cáncer, delante del cáncer de mama.
Una de las herramientas matemáticas para analizar las tendencias en cáncer son los modelos edad-período-cohorte, que tratan de precisar cuál o cuáles de esos tres componentes clave en la explicación de estos fenómenos han operado y en qué magnitud. En el caso del cáncer de pulmón esto se ha analizado en diversos países18 y también en el nuestro26, correspondiendo claramente a un fenómeno de cohortes. Esto es, las cohortes (generaciones) de hombres o mujeres expuestas al tabaco, van progresivamente contribuyendo al aumento de las tasas de cáncer de pulmón con décadas de retraso, debido a la latencia en la expresión clínica y el desenlace de la enfermedad. Puede observarse que el descenso en las tasas específicas de las mujeres más jóvenes permite anticipar una amortiguación en la "epidemia", esto se ha observado especialmente en países que han alcanzado el pico de los valores de las tasas de incidencia y mortalidad.
En Uruguay, también se observa una moderación de las tendencias en las mujeres más jóvenes, producto del abandono más reciente del hábito, lo cual permite ser razonablemente optimistas en una consecuente y futura amortiguación de la tasa global tanto de la incidencia como de la mortalidad. Por otra parte, las cifras más recientes de incidencia disponibles en Uruguay corresponden a 2013, menos de una década después de instaladas las relevantes medidas de intervención en el control del tabaquismo. Por ello es aún temprano notar modificaciones en las tendencias, no obstante, es muy probable que estas medidas impacten en las tasas en los próximos años. Los resultados recientes de la encuesta GATS muestran alentadores descensos en la proporción de fumadores entre jóvenes37.
Una particularidad, que hemos notado en nuestro país, respecto del cáncer de pulmón, es su inhomogénea distribución geográfica. Simplemente observando los mapas de distribución de la enfermedad en el territorio nacional (Figura 11a) (Figura 11b) en sucesivos quinquenios desde 1989, puede verse que los departamentos del litoral poseen tasas más bajas que el resto, y que este fenómeno es estable en el período 1990-2013.
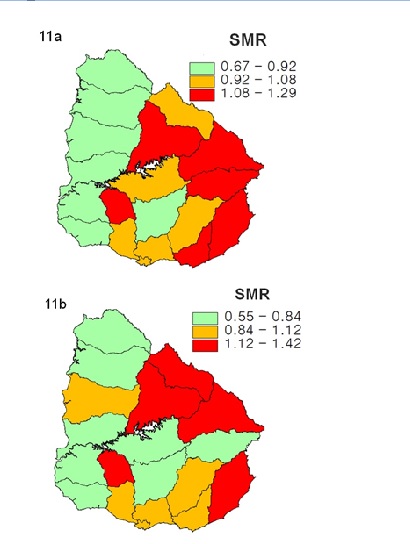
Figura 11: Razón estandarizada de mortalidad (SMR) por cáncer de pulmón para los departamentos del Uruguay. Período 2004-2008. 11a. Hombres. 11b. Mujeres.
Diferentes métodos y modelos estadísticos han mostrado la significación de estas inhomogeneidades38 y la existencia de un patrón de autocorrelación espacial39, que define una zona de menor riesgo (razón estandarizada de mortalidad) en el litoral en relación a la zona este-noreste del territorio con riesgos mayores (involucrando los departamentos de Treinta y Tres y Rocha especialmente). Este fenómeno es de mayor importancia en hombres, aunque se observa también en el sexo femenino. El análisis regional de las tendencias permite observar una cierta "resistencia" en estos departamentos a disminuir las tasas de mortalidad por cáncer de pulmón en hombres, tal como ocurre en el resto del país y especialmente en aquellos del litoral26. Las razones de estas diferencias muy probablemente debidas a la prevalencia de los factores de riesgo, notoriamente el tabaquismo, no han podido aún ser demostradas. Entre otras cosas por la falta de información desagregada geográficamente del consumo de tabaco, al menos a nivel departamental.
En resumen, el cáncer de pulmón constituye un problema mayor de salud pública en el mundo y en nuestro país, que sigue con cierto desfase las dinámicas observadas en varios países desarrollados. Pero además exhibiendo interesantes heterogeneidades geográficas que constituyen a la vez un problema epidemiológico no resuelto pero también un aporte para la orientación de medidas de intervención sanitaria. Es apropiado señalar además, dada la advertencia señalada por la IARC40 en relación a las emisiones Diesel y otros contaminantes atmosféricos, la necesidad imperiosa de controlar y vigilar la calidad del aire, especialmente en la capital donde la densidad de vehículos pesados y de transporte colectivo utilizan en su enorme mayoría estos motores.
4 Cáncer de mama
Nos referiremos exclusivamente al cáncer de mama femenino, si bien existe en el hombre, su incidencia es baja y puede considerarse como un tumor raro en el espectro de los cánceres masculinos. El cáncer de mama, como se ha dicho más arriba es por lejos el cáncer más frecuente en la mujer de acuerdo con las últimas estimaciones mundiales12 y en un conjunto grande de países es la causa más frecuente de muerte por cáncer.
Se estima en 1.7 millones los casos nuevos anuales de esta enfermedad en el mundo que constituye casi un cuarto de los tumores malignos de la mujer, dando cuenta del 15% de las muertes por cáncer en este sexo12)(41.
Las tasas estandarizadas por edad más elevadas se observan en Europa occidental, Escandinavia y América del Norte, así como las más bajas en Asia oriental. En términos generales la tasa de incidencia es más elevada en aquellos países con mejores niveles de vida (tomando como indicador el IDH, por ejemplo). Entre aquellos países con alto o muy alto IDH la incidencia duplica a aquella de los países en la categoría de bajo IDH.
Las tasas de mortalidad varían notablemente alrededor del mundo, pero claramente la letalidad de la enfermedad es más alta en los países menos desarrollados.
Mientras que la incidencia se aumenta en la mayor parte de los países del mundo, en los países de mayor desarrollo (o más alto IDH) las tasas parecen haber alcanzado un pico y comienzan a decrecer, aunque lo profundizaremos más adelante, este último caso parece ser el de Uruguay.
En los países más desarrollados, hace décadas (entre finales de los 80' y principios de los 90') que las tasas de mortalidad comenzaron a descender como consecuencia de los progresos terapéuticos y de diagnósticos más tempranos (producto de las campañas de tamizaje). Históricamente, esta reducción fue advertida por primera vez por Richard Peto en una comunicación a la revista Lancet en mayo del 2000, en la cual señalaba un descenso reciente de las tasas de mortalidad por cáncer de mama en EEUU y el Reino Unido, especialmente en mujeres de entre 50 y 69 años (Lancet, vol. 355,pp.1822).
Una situación similar se ha observado en Uruguay, dónde el descenso de la tasa estandarizada de mortalidad comenzó a mediados de los 90'.
La etiología del cáncer de mama es multifactorial estando involucrados un conjunto de factores endócrinos y reproductivos incluyendo la nuliparidad, la edad del primer hijo luego de los 30 años, la historia hormonal, así como factores exógenos tales como el consumo de alcohol, el uso de ciertos contraceptivos orales y las terapias de remplazo hormonal. La exposición a las radiaciones ionizantes, y estilos de vida "occidentales" con dietas hipercalóricas y hábitos sedentarios, son también factores de riesgo conocidos 41)( 42.
En los países industrializados donde estos estilos de vida tienen varias décadas, las tasas estandarizadas por edad de incidencia varían entre 70 y 90 casos por 100000. La existencia de programas organizados de tamizaje tiene notoriamente un impacto en estas cifras.
De acuerdo a un estudio de tipo caso-control llevado a cabo en Alemania43 el riesgo atribuible poblacional para los factores no modificables (edad de la menarca, edad de la menopausia, paridad, antecedentes de patología mamaria benigna, así como historia familiar de cáncer de mama) fue del orden de 37% (IC 95% 27.1-47.2) considerando en este estudio, todos los tipos de cáncer de mama invasor.
Respecto a los factores de riesgo modificables, los dos que tuvieron mayor impacto fueron el antecedente de terapia de remplazo hormonal y la inactividad física con un riesgo atribuible de 19.4% (IC 95%: 15.9, 23.2) y 12 % respectivamente.
Una proporción pequeña de los tumores de mama se debe a una predisposición familiar y a la existencia de dos genes de alta penetrancia (BRCA1 y BRCA2) cuyas mutaciones están ligadas a un riesgo notoriamente aumentado de padecer cáncer de mama. También se han identificado un conjunto variado de otros genes de penetrancia más baja.
La caracterización de los subtipos de cáncer de mama ha cambiado sustantivamente en los últimos años debido al progreso del conocimiento del rol pronóstico de diferentes marcadores y más allá de los tipos histopatológicos. Una combinación entre el índice Ki-67 (una proteína nuclear asociada al potencial de proliferación celular) y su involucramiento con los ganglios axilares, la expresión o no del receptor-2 del factor de crecimiento epidérmico (HER2), de los receptores de estrógenos y progestágenos en los tumores ha permitido establecer al menos 4 clases de tumores con pronósticos significativamente diferentes, y ha conducido en consecuencia a la elaboración de sendas estrategias terapéuticas. Estas clases son: luminal A, luminal B, tipo Basal - HER+, y el tipo triple negativo (receptores de estrógenos y progesterona, así como HER2, negativos), los lectores interesados podrán encontrar en la literatura citada más información44.
El cáncer de mama es desde mediados del siglo pasado la primera causa de muerte por cáncer en la mujer en nuestro país y el cáncer más frecuente en el sexo femenino (exceptuando al cáncer de piel no melanoma)45.
Cada año se registran unos 1800 casos nuevos de esta enfermedad y unas 650 mujeres mueren por esta causa. La tasa de incidencia estandarizada por edad es de unos 70 casos por 100000 mujeres (14,20,21) y se ubica en el quintil superior del espectro de los valores observados en el mundo12. De acuerdo a las citadas estimaciones de la IARC, el conjunto de los países más desarrollados exhibe una tasa estandarizada de incidencia de 73.4 muy próxima a los valores de Uruguay (72.1 caos por 100.000 en el período 2009-2013).
En América Latina: Argentina, Cuba y Uruguay exhiben las tasas de incidencia más elevadas. En una enfermedad cuyo riesgo depende dramáticamente de la edad, la anterior observación no debería resultar sorprendente en tanto que son tres de los países con pirámides de población con mayores componentes de edades avanzadas y consecuentemente mayores expectativas de vida en la región.
La tasa estandarizada de mortalidad por cáncer de mama ha caído monótonamente desde mediados de los años 90' (Figura 10b) a un 1.1% por año en promedio en el período 1990-2015. Sin embargo, la tasa cruda ha permanecido estable o declinado muy levemente, lo cual puede explicarse por un aumento en la edad de estos decesos. La tasa cruda tuvo un pico en 2006 con un valor de 42.3 para luego declinar levemente y con fluctuaciones hasta 39 en 2015. Las tasas de incidencia estandarizadas se han mostrado estables en el período 2002-2014
Esto podría ser al menos parcialmente explicado por un desplazamiento de la mortalidad a edades avanzadas como consecuencia tal vez de mejoras en las tasas de supervivencia. Las muertes en edades avanzadas “pesan” menos en las tasas estandarizadas (se "penalizan" las tasas específicas de intervalos etarios más jóvenes para intentar discriminar los riesgos subyacentes de aquellos vinculados a la edad).
No obstante este progreso, las tasas de mortalidad por cáncer de mama son relativamente elevadas tanto en el contexto global como cuando se analizan a través de las razones entre las tasas estandarizadas de mortalidad y de incidencia (ratio M/I)
Esto muestra que a “intensidades” de riesgo similares a aquellas de los países desarrollados, en Uruguay se obtienen resultados más pobres en relación a la mortalidad. Esto puede ser adjudicado a diversas causas: diagnóstico en etapas más avanzadas y limitaciones en el sistema de salud para procesar apropiadamente los tiempos de diagnóstico y tratamientos, así como la eficacia de estos últimos, entre otros. Es importante establecer que Uruguay posee un acceso universal al tratamiento oncológico, aunque la heterogeneidad geográfica de los cocientes M/I deja dudas sobre la homogeneidad en el acceso y proceso del sistema de salud globalmente considerado para enfrentar este problema8)(48.
El perfil de estadios de presentación del cáncer de mama en Uruguay ha progresado en las últimas décadas debido a la intensificación y generalización de las políticas de detección precoz y naturalmente del progreso de los procedimientos diagnósticos (Figura 12a).
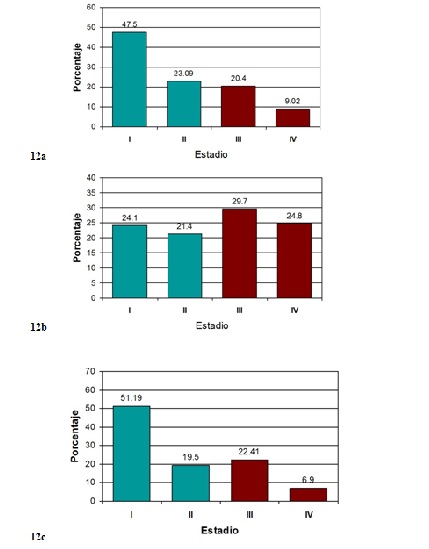
Figura 12: 12a. Mama. Mujeres. Distribución por estadios de los casos incidentes de cáncer de mama, colorrecto y cérvix . Uruguay. Período 2009-2013 12b. colo-recto - 12c. cuello de útero
Si bien la información fiable y exhaustiva sobre los estadios de presentación son un problema para el RNC y en términos generales para la mayoría de los registros de base poblacional en el mundo, en el caso del cáncer de mama ha sido posible obtener en nuestro medio este dato en más de la mitad de los casos registrados, los cual si no existen sesgos de base, resulta en una estimación razonable del espectro de estadios al momento del diagnóstico. Aproximadamente dos tercios de los casos caen en estadios tempranos (in situ, I, y II). Esto es relevante, en tanto que las determinaciones de la conducta terapéutica y especialmente del pronóstico de la enfermedad están asociados a estos estadios, y naturalmente este espectro establece información de altísimo valor para la planificación, implementación y evaluación de las políticas de intervención en materia de detección precoz, especialmente la mamografía. El lector interesado podrá encontrar en la guía del Ministerio de Salud los lineamientos establecidos en relación a las pautas de prevención49.
Como se ha dicho más arriba, la expresión de los receptores hormonales y el HER2, así como el Ki-67, son críticos al momento de categorizar un cáncer de mama, la información disponible en nuestro país a nivel nacional es limitada. En el período 2009-2013, de un total de 8669 casos de cáncer de mama, se disponía de información acerca de los receptores hormonales en 3528 casos y del Her2 en 897 casos. El 85% de los cánceres de mama en los que se disponía de información eran positivos para receptores hormonales (estrógenos o progesterona) y el 27% eran positivos para Her2. Un estudio en mujeres menores de 40 años, de las que se disponía de información, el 73% eran positivas para receptores hormonales y 33% eran positivos para Her2. En el 26% de los casos en los que se disponía de información completa resultaron triple negativos50.
En Uruguay, la tasa de sobrevida relativa a los 5 años (ver apéndice) para el cáncer de mama está en el orden del 85%, un poco inferior pero comparable en términos generales a aquellos valores obtenidos en los países desarrollados, algunos de los cuales superan el 90%51)(52)(53.
En resumen, Uruguay muestra tasas de incidencia elevadas desde hace tiempo y comparables al promedio de los países desarrollados, pero con tasas de mortalidad más elevadas. La tasa de mortalidad estandarizada por edad ha decrecido lenta pero significativamente en los últimos 25 años. El cáncer de mama femenino es claramente uno de los principales problemas en el espectro oncológico mundial y nacional, justificando los esfuerzos realizados en su prevención primaria y secundaria (esta última especialmente a través de la mamografía), así como en materia de la atención global de las pacientes afectadas. De acuerdo a nuestras estimaciones, en Uruguay el riesgo de padecer este cáncer a lo largo de la vida es de una cada 11 mujeres.
5 Cáncer de próstata
A menudo percibida como una enfermedad indolente y propia del envejecimiento, crónicamente evolutiva, lo cual es notoriamente cierto, el cáncer de próstata (CPr) es una de las causas más frecuentes de muerte en los hombres54. Su impacto actual en el mundo y su proyección, especialmente atendiendo a los cambios demográficos en curso lo ubican como un problema sanitario de primera relevancia.
El CPr es el segundo cáncer más frecuente en los hombres luego del cáncer de pulmón, en el mundo12)(18. Se estima que en 2012 se diagnosticaron 1.1 millones de casos, dando cuenta del 15% del total de los cánceres diagnosticados en el hombre. En ese año el CPr fue el responsable de unas 307000 muertes, siendo la quinta causa de muerte por cáncer en hombres (un 6.6% del total).
Casi el 70% de estos casos son diagnosticados en los países desarrollados12. La variabilidad de las tasas de incidencia observadas alrededor del mundo es notable, del orden de 25 veces. Las tasas más altas se han registrado en Australia y Nueva Zelanda (111.6 siempre expresados en casos por 100000 hombres), Norteamérica (97.2), Europa Occidental y Europa del Norte (85 y 85.8 respectivamente, notoriamente debido a la generalización de dosificación del Antígeno Prostático Específico (PSA). Debido al mayor riesgo encontrado en las poblaciones afrodescendientes, se encuentran tasas elevadas también en el Caribe y el África Subsahariana, y América del Sur. La incidencia es notablemente más baja en las poblaciones asiáticas. Debido a que la dosificación del PSA tiene notoriamente mayores consecuencias sobre la incidencia que en la mortalidad, la variabilidad de la mortalidad es también mucho menor. La región del Caribe (29.9) y del África Subsahariana (24) muestran los valores más altos.
El CPr es en la gran mayoría de los casos un adenocarcinoma acinar, una neoplasia glandular. Los sarcomas primarios y otros tipos de tumores de la próstata son bastante más raros55.
El riesgo de padecer CPr está fuertemente asociado a la edad, la historia familiar y a la etnia. La edad es por lejos el factor de riesgo más importante, clínicamente el carcinoma de la próstata se diagnostica mayoritariamente en hombres mayores de 60 años. La probabilidad del diagnóstico de un CPr es 40 veces mayor en hombres mayores de 65 que menores a esa edad, y solamente el 1% de estos tumores ocurren en hombres menores a 50. El CPr es raro en niños y suelen ser rabdomiosarcomas55.
Un hombre con una historia familiar de CPr tiene riesgos significativamente más altos de padecerlo, aproximadamente un 25% de los hombres diagnosticados con CPr tienen antecedentes familiares de la enfermedad56. El nivel de riesgo está asociado a familiares de más estrecho grado de parentesco (primer grado) y a la edad con la cual fue diagnosticado el CPr en los familiares afectados, y es tanto mayor el riesgo cuanto más jóvenes hayan sido diagnosticados esos familiares. Aquellos hombres con un padre o un hermano afectados, tienen entre 2 y 3 veces más riesgo de adquirir la enfermedad, pero el valor más alto de riesgo (11 veces mayor) es cuando un padre o un hermano fueron diagnosticados con CPr antes de los 40 años.
Los factores genéticos están obviamente detrás de la susceptibilidad del CPr y los progresos en su conocimiento serán claves en la comprensión y control de esta enfermedad. La importancia de esta carga genética ha sido remarcada en un estudio de cohorte de gemelos que indican en un 42% de los casos de CPr existen riesgos heredados57.
Diversos marcadores genéticos están siendo explorados, ciertas mutaciones en los genes de los receptores de andrógenos son las más frecuentemente observadas (PTEN, AKT1, y TP53), usualmente en etapas avanzadas de la enfermedad55. La literatura es enormemente dinámica y abundante en esta área, y sus detalles están fuera del área de esta revisión.
La relevancia de los factores étnicos en el riesgo del CPr ha sido extensamente estudiada, por su importancia respecto de la etiología de este cáncer. En EEUU el riesgo en la población afrodescendiente es 1.6 veces mayor que aquel de la población caucásica58.
Otros factores que pueden modificar el riesgo de padecer CPr: como las hormonas, el consumo de vitamina E, ácido fólico y la dieta (especialmente el Calcio) son de menor nivel de evidencia y pueden ser estudiados con mayor detalle en diversas referencias59.
El grado histológico de Gleason, el nivel sérico del PSA, el estadio clínico, y la extensión del cáncer en la biopsia (core needle biopsy) son factores relevantes para establecer el pronóstico, el tratamiento y manejo clínico de la enfermedad55.
Un hecho de extrema relevancia es que el CPr puede ser un hallazgo en la autopsia de hombres que fallecen por otras causas y que no registraban ese diagnóstico antes de morir. A veces se trata de pequeños nidos de células neoplásicas, que no se comportaron de manera invasiva y no tuvieron en consecuencia, manifestaciones clínicas. La frecuencia de este hallazgo en las autopsias también está fuertemente asociada a la edad60)(61, para hombres mayores a 60 años la probabilidad de encontrar en una autopsia un cáncer indolente va desde el 30 al 70%62. Estos estudios han sido de enorme valor para el análisis del sobrediagnóstico de la enfermedad y sus consecuencias, a partir de la masiva utilización de la dosificación del PSA como herramienta de tamizaje a nivel poblacional. Entendiendo por sobrediagnóstico, el diagnóstico de aquellos cánceres que de no haber sido detectados no se hubiesen expresado clínicamente ni conducido a la muerte a su hospedero. El sobrediagnóstico no debe ser confundido con el falso positivo, instancia que termina concluyendo que el individuo no posee el tumor, por el contrario, el cáncer sobrediagnosticado reúne los criterios establecidos para el diagnóstico de cáncer58)(62.
Desde hace unos 15 años el cáncer de próstata es el cáncer más frecuente entre los hombres en Uruguay superando desde entonces al cáncer de pulmón; y el tercero más frecuente cuando se reúnen ambos sexos, luego del cáncer de mama femenino y el cáncer colo-rectal. Representó el 21% de los tumores malignos de los hombres en el período 2009-2013 y el 13.7% del total de muertes por cáncer en ese sexo constituyéndose en la segunda causa de muerte por cáncer. En ese período se registraron en Uruguay un promedio anual de 1450 casos nuevos y 610 muertes por CPr. El 75% de los casos registrados tenían 65 años o más, y entre los fallecidos por esta causa el 84% eran mayores de 70 años.
En el espectro internacional de tasas de incidencia (Globocan 2012), Uruguay ocupa el segundo quintil superior, definido entre 32.4 y 67.1 casos por 100000. No obstante ocupa el primer quintil en el espectro de las tasas de mortalidad por CPr aun cuando su valor cae en el borde inferior de este quintil (y caería en el límite superior del segundo quintil si se tomara la cifra registrada por el RNC: 19.9). En el diagrama de la (Figura 8c) puede verse que Uruguay posee tasas de incidencia próximas al grupo de países más desarrollados pero tasas de mortalidad considerablemente mayores, esto arroja un cociente M/I más desfavorable y más próximo a aquel del grupo de países menos desarrollados.
A nivel regional y como se ha dicho antes, los países del Caribe y Brasil en América del Sur superan los valores de Uruguay en las tasas de incidencia del CPr. Sin embargo, también en esta comparación, Uruguay exhibe las tasas de mortalidad más altas en América del Sur, aunque inferiores en general a los valores de los países del Caribe. Comparando con la situación del Brasil, país que posee la tasa más alta de Sudamérica (76.2), la tasa de mortalidad en este país es de 16.6, bastante más baja que la de Uruguay, pero también más baja que la de Paraguay, Costa Rica o Venezuela. Al momento de valorar estas comparaciones es importante tener en cuenta la calidad de los datos: mientras Uruguay tiene un registro de incidencia A (datos de cobertura nacional y de alta calidad), la información de incidencia de Brasil proviene de registros B (datos regionales de alta calidad que abarcan un 10 a un 50% del territorio), ambos con información de mortalidad 2 (proveniente de registro vital completo de mediana calidad). Argentina exhibe valores inferiores en las tasas de incidencia (44.1) y de mortalidad (15.7) pero las estimaciones de incidencia provienen de registros de nivel B y las de mortalidad de registros de nivel 3 (registro vital completo pero de baja calidad)63 El Ministerio de Salud y el RNC trabajan armónicamente para mejorar la calidad de la información de mortalidad, pero realizan medidas independientes, y en el caso de CPr, éstas no difieren significativamente, de modo que si existe alguna razón para pensar en un sobreregistro de la mortalidad por CPr, habría que buscarla en la confianza que merece este diagnóstico en las causas de muerte que figuran en el certificado de defunción.
Aún en presencia de estas relativizaciones, es notorio que Uruguay posee una incidencia elevada pero menor en el contexto internacional y regional que la observada en las tasas de mortalidad.
Las tasas de incidencia aumentaron dramáticamente en EEUU y Canadá en la década de los 80’ con la difusión de la dosificación del PSA. Patrones similares se observaron en casi todos los países desarrollados en la década de los 90’, pero también en otros países menos desarrollados (Europa del Este, China, Colombia). En algunos de estos países, como EEUU, los niveles se estabilizaron hace unos años a mediados los 90’ e incluso han comenzado a descender, en otros países desarrollados el crecimiento continúa aunque con dinámicas más moderadas55)(58)(59. Aunque es un hecho constatable por la correlación temporal, es difícil cuantificar el impacto real de la difusión del uso del PSA en este aumento generalizado de la incidencia del CPr en el mundo64.
En general en aquellos países en los cuales se utilizó el PSA como instrumento de tamizaje, lo que se observa es un pico de incidencia en el momento de la introducción del método, que luego cae hasta retomar el aumento secular que venía observándose desde años antes de la aparición del PSA, para posteriormente estabilizarse o decrecer levemente.
En Uruguay la tasa estandarizada de incidencia del CPr creció continuamente desde valores de 35.2 en 199165 hasta superar los 60 casos por 100000 en el quinquenio 2007-201120, acompañando aunque moderadamente los aumentos observados en los países desarrollados y seguramente explicado por las mismas causas. En la (Figura 9c) se muestran las tendencias recientes de la incidencia en Uruguay del CPr, observándose un incremento significativo (14% anual) hasta 2004 para luego estabilizarse o decrecer muy levemente.
La tasa estandarizada por edad de mortalidad creció muy leve pero significativamente a casi 1% anual entre 1990 y 2004 (Figura 10c), a partir de entonces se observa un decrecimiento significativo de más del 2% anual. Con cierto retraso entonces, se han observado en Uruguay tendencias de la mortalidad en el CPr similares a aquellas registradas en varios países desarrollados.
Como se ha dicho antes el rol del PSA en estas tendencias observadas internacionalmente en el CPr, tanto en la incidencia como en la mortalidad es motivo de debate y en términos generales ha cuestionado la utilización de esta técnica como herramienta de tamizaje. El punto central del cuestionamiento es si efectivamente ha sido la introducción del PSA la causa del descenso de la mortalidad por CPr. En particular la magnitud del sobrediagnóstico que implica este procedimiento con la carga de morbilidad y de afectación seria de la calidad de vida, así como de relevantes consecuencias también económicas.
El aumento brusco en la incidencia que puede observarse en los 90' en las curvas de las tendencias de EEUU, se interpreta como una anticipación de diagnósticos que hubiesen sido establecidos posteriormente. Se observa como luego la curva retoma una cierta estabilidad para comenzar a descender a comienzos de este siglo. El punto central es si esta anticipación de casos (independientemente del impacto en términos de sobrediagnóstico) ha sido principal responsable del descenso de la mortalidad.
Otras explicaciones se han propuesto para dar cuenta de este descenso, asignando relevancia relativa a la introducción del PSA58)(66. Recientes trabajos muestran que el descenso en la tasa de mortalidad por cáncer de próstata comenzó antes de la difusión del uso del PSA y es mayor en magnitud al esperado por el impacto del screening67 Estos análisis sugieren que las recientes reducciones en la mortalidad por CPr (al menos en Canadá - donde este estudio fue realizado) debería buscarse en otros factores tales como los cambios seculares en las prácticas terapéuticas y cambios sistemáticos en la codificación de la causa de muerte (el progreso en los métodos diagnósticos ha permitido precisar mejor esta causa y disminuir el número de casos que equivocadamente se atribuían al cáncer de próstata anteriormente)67.
Si bien en Uruguay se han observado los cambios ocurridos en los países más desarrollados, estos han sido más tardíos y más moderados. En el caso de la incidencia, posiblemente por una difusión más lentamente progresiva del uso del PSA. En lo relativo a la mortalidad es más difícil de interpretar esta diferencia, pero deberían considerarse tanto los aspectos diagnósticos (no solamente el PSA) como terapéuticos y la accesibilidad general a los sistemas de salud. En atención a la estabilidad de los criterios de codificación de la causa de muerte en nuestros registros, la contribución relativa del error en la codificación de la causa de muerte no parece estar entre los factores más determinantes del descenso observado.
En suma, el CPr es un problema mayor de salud pública en Uruguay, siendo el cáncer más frecuente en hombres, generando una gran carga de morbi-mortalidad así como impactos socio-económicos relevantes.
6 Cáncer colo-rectal (CCR)
Los cánceres del colon, recto-sigmoides y recto (CCR) suelen agruparse en las estadísticas internacionales por dos razones fundamentales: la patología y la epidemiología de estos dos segmentos del intestino es similar en muchos aspectos, en particular por involucrar, en su gran mayoría, los mismos factores de riesgo, asimismo porque muchas veces al momento del diagnóstico es imposible saber con certidumbre dónde comenzó un tumor que se extendió a segmentos vecinos. Si bien existen CCR de naturaleza hereditaria (poliposis familiares, por ejemplo), la enorme mayoría son cánceres denominados esporádicos en los cuales, si bien pueden influir vulnerabilidades genéticas, el rol de los factores de riesgo “exógenos” y en su gran mayoría modificables, es relevante68.
El cáncer de ano suele incluirse a veces en este grupo (ICD 10: 21), siendo su inclusión controvertida tanto debido a aspectos epidemiológicos, como patológicos y clínicos. Este es el caso de la definición del CCR en la publicación de la IARC que hemos tomado como referencia para las cifras internacionales (involucrando los códigos de ICD 10: 18-21). En cualquier caso, el número de tumores de ano es muy bajo en relación a los cánceres colo-rectales (ICD 10: 18-20) y no modifica de manera significativa las cifras, tendencias y consideraciones abajo expresadas.
El CCR es uno de los cánceres más comunes tanto en el hombre como en la mujer, representando casi el 10% del total de los cánceres en el mundo. Es el tercer cáncer más frecuente entre los hombres (luego de los cánceres de próstata y pulmón) y el segundo más frecuente en mujeres. De acuerdo a las estimaciones de la IARC12, se diagnosticaron en 2012 unos 746000 casos nuevos en el sexo masculino y unos 614000 en las mujeres. Es la cuarta causa de muerte por cáncer cuando se consideran ambos sexos reunidos, habiendo dado cuenta en 2012 de casi 700000 muertes, esto es, un 13% del total de los fallecimientos por cáncer69.
Es importante destacar que casi dos tercios de los casos (65%) ocurren en países con alto o muy alto IDH12)(69, esto puede explicarse por razones demográficas (el riesgo del CCR depende fuertemente de la edad), y por la elevada prevalencia desde hace mucho tiempo de factores de riesgo conocidos para esta enfermedad: tabaquismo, sedentarismo, obesidad, consumo de alcohol, tipo de dieta (carne roja procesada, embutidos)70, entre otros. Factores generalmente vinculados a estándares de vida más altos. El lector interesado en profundizar sobre estos factores, que están por su extensión, fuera del alcance de este artículo podrá consultar las referencias citadas69)(71. Esta asociación es tan relevante que el impacto del CCR en el perfil epidemiológico de un país (y su dinámica) suele considerarse un marcador clave de las transiciones del desarrollo humano72. En términos generales puede decirse que las tasas de incidencia están aumentando en países menos desarrollados a medida que progresan en sus transiciones demográfico-epidemiológicas, así como estabilizándose o descendiendo en aquellos países con IDH alto o muy alto, más abajo analizamos estos tipos de patrones en las tendencias del CCR69.
De acuerdo a un reciente artículo llevado a cabo por investigadores de la IARC, podrían definirse al menos tres patrones en la dinámica del CCR en el mundo, en atención a las tendencias de la incidencia y la mortalidad72. Según estos autores, estos patrones establecerían los siguientes grupos: 1. Grupo A: las tasas de incidencia y mortalidad continúan aumentando, esto ocurre en países que están en etapas menos avanzadas de la transición demográfico-epidemiológica y son en general países de ingresos medios o bajos. Integran este grupo, por ejemplo: países de Europa del Este, así como diversos países de América Latina (Brasil, Colombia y Costa Rica, por ejemplo) y Asia. 2. Grupo B: en este grupo las tasas de incidencia continúan en aumento mientras que las tasas de mortalidad declinan. Esto se ha observado en diversos países, tales como: Dinamarca, Finlandia, Irlanda Italia, Eslovenia, y Canadá, entre otros. 3. Grupo C: tanto las tasas de incidencia como de mortalidad decaen. En este grupo figuran únicamente países de muy alto desarrollo HDI (Estados Unidos, Austria, Nueva Zelanda, Islandia, Francia, Japón, Australia, Israel, y República Checa). El descenso en las tasas de incidencia en estos países está muy probablemente ligado a eficaces programas organizados de tamizaje, comenzados tempranamente y sostenidos, lo que permite detectar y resolver un número importante de lesiones precancerosas, y también al descenso de la exposición a factores de riesgo, notoriamente el tabaquismo (aunque otras exposiciones no están igualmente moderadas, especialmente aquellas ligadas a factores dietarios)18)(73. Veremos más adelante que el caso de nuestro país es difícilmente ubicable en esta clasificación.
En Uruguay se registran más de 1830 cánceres invasores (como se ha explicado antes, en las estadísticas mundiales se excluye el cáncer in situ) y más de 1000 pacientes mueren por esta enfermedad cada año (Tabla 1).
Tabla 1: Incidencia y mortalidad por cáncer de colon y recto según localización (códigos ICD-O3). Datos del Registro Nacional de Cáncer. Período 2009-2013.
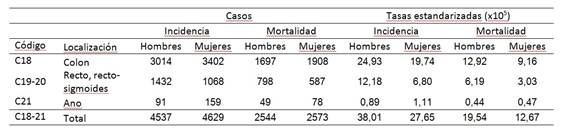
Cuando se consideran ambos sexos reunidos, el CCR es el segundo tipo de cáncer más frecuente en nuestro país, dando cuenta de casi el 14% del total de los tumores malignos en el período 2009-2013 (como se ha explicado antes, en este cálculo se excluye del total al cáncer de piel distinto al melanoma)8)(20)(21.
Las cifras más recientes disponibles (Figura 2a) (Figura 2b) muestran que la tasa de incidencia estandarizada por edad en hombres es de 38.0 y en mujeres de 27.7 (casos por 100000). De acuerdo a las estimaciones de la IARC citadas más arriba, existe una enorme variabilidad en las tasas de incidencia del CCR a nivel internacional. En ese espectro mundial, Uruguay posee tasas de incidencia y mortalidad notoriamente elevadas, ocupando el quintil superior (aquel de los países con mayores tasas). Sus tasas coinciden casi exactamente con aquellas correspondientes al conjunto de los países de muy alto IDH, cuyos valores son de 37.9 en hombres y de 24.4 en mujeres12. En Norteamérica, particularmente Canadá posee una tasa de incidencia en hombres de 42 casos por 100000, valores elevados, más elevados que los de Uruguay pueden también encontrarse en Australia y Nueva Zelanda, así como en varios países europeos.
La situación de Uruguay contrasta notoriamente con las cifras del conjunto de los países de América Latina y el Caribe, y solo Argentina se le acerca con cifras un tanto menores (tasa estandarizada por edad menor a 30 en hombres). Latinoamérica (exceptuando a Argentina y Uruguay) exhibe junto con la mayoría de los países asiáticos, valores bajos en el espectro mundial73.
Cuando compara la razón M/I de Uruguay (0.47) (Figura 8d) con otros países puede observarse que es relativamente cercano a aquel del conjunto de los países desarrollados (0.40), y muy próximo al de Argentina (0.45), no obstante, cuando se compara con países o regiones desarrollados con valores similares o superiores de incidencia las cifras muestran resultados más pobres en el control de la mortalidad.
Obsérvese que Norteamérica (EEUU y Canadá reunidos) tiene un valor de 0.36, Europa Occidental de 0.34, Australia y Nueva Zelanda de 0.26.
Nuestras estimaciones de la sobrevida relativa a los 5 años del CCR en Uruguay están en el orden del 52%, que está próxima a la estimación a través del valor complementario de la razón entre la mortalidad y la incidencia (1-M/I, que es 53%)52.
Observando el período 2002-2014 puede verse (Figura 9d) (Figura 10d) que tanto las tasas de incidencia y mortalidad, con fluctuaciones anuales menores, se han mantenido estables en hombres y en mujeres74. De acuerdo con esto, Uruguay no entraría estrictamente en ninguno de los grupos establecidos más arriba.
En el más largo plazo (1990-2015), las tasas de mortalidad estandarizadas por edad exhiben pendientes muy leves, pero significativamente distintas de cero, y divergentes para hombres y mujeres (Figura 10d). En hombres se observa un APC de 0.3 y en mujeres de -0.5. Si estas tendencias en la mortalidad se consolidaran en los próximos años, con estabilidad de las tasas de incidencia, habría que pensar en las razones por las cuales en el sexo femenino el control de la mortalidad está mejorando a diferencia de lo que ocurre en los hombres.
Estos resultados, como se ha explicado son el producto global de cómo el sistema sanitario absorbe el impacto tanto en términos de accesibilidad, diagnósticos tempranos, tratamientos, etc. En muchos tipos de cáncer, pero particularmente en el CCR, la detección temprana juega un rol determinante en el control de la enfermedad 75.
Para el caso del CCR, la distribución de estadios se ha obtenido de manera fiable en un 45.3% de los casos registrados en el período 2009-2013. Sobre la hipótesis de que no hubo sesgos importantes en la captura del estadio, y de acuerdo al diagrama de la (Figura 12b), del total de aquellos casos con estadio conocido, más de la mitad (54.5%) pertenecen a estadios avanzados (III y IV). Este resulta entonces un problema mayor de salud pública y así lo ha jerarquizado el Ministerio de Salud a través del Programa Nacional de Control de Cáncer (PRONACCAN) en la definición de sus objetivos sanitarios para el quinquenio (2015-2020)76
En términos generales, para la población de riesgo promedio, las guías de prevención basadas en evidencia sólida, recomiendan comenzar con el tamizaje a través de la detección de sangre oculta en las heces a partir de los 50 años y hasta los 74-75 años, cada dos años77)(78. En caso de ser positivo este test se realiza una fibrocolonoscopía. Para la población de riesgo alto (personas con antecedentes personales o familiares de cáncer colorrectal o portadoras de riesgo genético o de enfermedad intestinal inflamatoria crónica como la colitis ulcerosa crónica y la enfermedad de Crohn), el tamizaje debe realizarse comenzar antes de los 50 años y se realiza mediante colonoscopía Estos son apenas los dos puntos principales de un algoritmo de prevención y detección precoz.
Un fenómeno de interés es el aumento de las tasas en adultos menores de 50 años en algunos países, notoriamente EEUU y Australia. Se trata de edades en las cuales el tamizaje no está recomendado. Este hecho que carece aún de una explicación sólidamente fundada73 parece esbozarse en nuestras estadísticas.
En resumen, el CCR es un grave problema en el espectro sanitario del Uruguay, las tasas de incidencia están entre las más altas del mundo y los resultados expresados por las tasas de mortalidad muestran un control más limitado de la enfermedad que aquellos obtenidos en países más desarrollados. Por otra parte, aunque con las limitaciones en el registro de los estadios, el perfil de presentación es también, como se ha visto más arriba, preocupante. Toda esta situación, justifica notoriamente la atención y las medidas de intervención y de detección precoz del CCR propuestas por las autoridades sanitarias.
7 Cáncer cérvico-uterino (CCU)
El cáncer de cuello de útero o cérvix (CCU) es el cuarto cáncer más frecuente en el mundo, estimándose que en 2012 se diagnosticaron casi 530000 casos nuevos cada año. Es también la cuarta causa de muerte por cáncer en el mundo, dando cuenta de unas 270000 muertes anuales (7.5% del total de muertes por cáncer en la mujer). El número de mujeres que padecen este cáncer en el mundo se estimaba en 2012 en más de 1.5 millones12.
Vinculado a su etiología de base infecciosa (Virus del Papiloma Humano) y a variables asociadas a esta infección es uno de los cánceres más fuertemente ligado a la inequidad socio-económica. La enfermedad afecta principalmente a poblaciones de bajos recursos (países de ingresos medios y bajos, pero también subpoblaciones pobres de países ricos). Casi el 70% de los casos se registran en países con valores bajos o medios del IDH y más de un quinto de los nuevos casos diagnosticados cada año ocurre en la India79.
Las tasas de incidencia y de mortalidad varían notablemente alrededor del globo, siendo aún el cáncer más frecuente en mujeres en 39 de 184 países incluidos en las estimaciones de la IARC, y en 45 de esos países es aún, la primera causa de muerte por cáncer en mujeres. Estos países se ubican principalmente en el África subsahariana, Asia y algunos países de Centro y Sudamérica. Las tasas más bajas se registran en Europa occidental, América del Norte, Australia y Nueva Zelanda, así como en los países entorno al Mediterráneo oriental12.
En los países desarrollados hace ya más de medio siglo que las tasas del CCU han declinado sustantivamente debido a programas exitosos de tamizaje basados en la colpocitología, pero también en una constelación de factores socioeconómicos ligados al progreso en los estándares de vida que experimentaron estos países. No obstante, en los últimos 30 años, también las tasas de CCU han declinado consistentemente en muchos países de menores recursos que han mejorado sus condiciones generales de vida alcanzando mejores niveles de IDH79.
El CCU se origina en la unión entre el epitelio columnar del endocérvix con el epitelio escamoso del exocérvix , una zona de cambio metaplásico constante, especialmente luego de la pubertad y del primer embarazo hasta la menopausia. El enorme avance realizado en la epidemiología del CCU es haber demostrado su vínculo etiológico con la infección por el virus del Papiloma Humano (HPV). La infección persistente a nivel epitelial a través de uno o más de los subtipos oncogénicos del HPV pueden conducir eventualmente al desarrollo de una lesión precancerosa y una pequeña proporción de ellas progresará al cáncer invasor en un período de 10 a 20 años80.
La infección por HPV es la más frecuentemente transmitida por vía sexual en el mundo, y la mayoría de los individuos sexualmente activos de ambos sexos, adquieren la enfermedad en algún momento de la vida. Se estima que más del 90% de las primeras infecciones por HPV adquiridas a cualquier edad, regresan en un período de entre 6 y 18 meses81.
La prevalencia mundial en mujeres de esta infección es del orden del 10%, aunque en mujeres jóvenes, menores de 25 años, es del orden 16.9%82. La prevalencia de la infección se correlaciona notoriamente con las tasas de incidencia del CCU, en los países de nuestra región la prevalencia es elevada así como el riesgo de padecer la enfermedad, reflejado a través de las altas tasas de incidencia79.
Si bien Uruguay ocupa un lugar en el tercer quintil en el ranking internacional de tasas de incidencia por este cáncer en el mundo, es el tercer tumor maligno más frecuente después del cáncer de mama y el colo-rectal, registrándose 313 casos nuevos anuales en promedio en el período 2009-2013. Este es un rasgo que muestra inequívocamente que el perfil epidemiológico del Uruguay muestra aún características propias de los países menos desarrollados. En los países desarrollados hace décadas que el cáncer de cérvix ocupa lugares muy inferiores siendo el cáncer de endometrio el cáncer del aparato reproductivo de la mujer más frecuente.
Unas 130 mujeres mueren cada año por esta causa en nuestro país, siendo la cuarta causa de muerte por cáncer en mujeres. A nivel regional, Uruguay y Chile poseen las tasas más bajas, pero son notoriamente superiores a las de Norteamérica o Europa occidental, por ejemplo12.
En el diagrama de la (Figura 8d) se comparan las tasas de incidencia y mortalidad del CCU en Uruguay con aquellas cifras observadas en el conjunto de países menos desarrollados y en el de los más desarrollados.
Puede verse que las cifras de incidencia de Uruguay están próximas a aquellas del conjunto de los países menos desarrollados (14.5 vs. 15.7), pero las tasas estandarizadas de mortalidad están en un valor intermedio y en todo caso más próximas a aquellos valores de los países más desarrollados. Esto es, ante riesgos de enfermar elevados (alta incidencia) y comparables a los países menos desarrollados, Uruguay parece controlar mejor el impacto sobre la mortalidad. Esto se expresa a través de una relación M/I para Uruguay (0.37) que aunque menos favorable se parece más a aquella de los países más desarrollados (0.33) que al conjunto de los menos desarrollados (0.53) (Figura 8e).
Esto resulta muy probablemente de los esfuerzos que viene realizando nuestro país en materia de detección precoz de la enfermedad desde hace décadas, especialmente a través de la introducción y difusión temprana del PAP, así como de la implementación de programas específicos (Programa de Prevención del CCU-CHLCC, programas del MSP, acciones a nivel municipal, entre otros). Estos esfuerzos se expresan más recientemente en el establecimiento de marcos legales para garantizar la ejecución de las políticas sanitarias (ver más adelante). De acuerdo a los datos del RNC-CHLCC, en el conjunto de los pacientes donde consta la información del estadio (49%, lo cual revela una vez más la dificultad para registrarla), más del 70% corresponden a estadios precoces (I-II) (Figura 12c).
Respecto del curso de las cifras en el tiempo (tendencias), la tasa de incidencia de CCU estandarizada por edad ha descendido en un 11% aproximadamente en Uruguay en las últimas 2 décadas (Figura 9e).
En el quinquenio 2002-2006 fue de 17.6 y de 15.7 casos por 100000 mujeres en 2007-201120)(83. No obstante la mortalidad sostiene, a pesar de importantes fluctuaciones, una tendencia estable en los últimos 25 años27. El valor estimado del porcentaje de cambio anual para el período 1990-2015 es de 0.3 (no significativamente distinto de cero), cuando esta tendencia se analiza a través del método de regresión por segmentos denominado Joinpoint.(ver apéndice)(Figura 10e).
Sin embargo, el análisis de la dinámica de las tasas de mortalidad por CCU es más complejo cuando se considera, además, la tendencia de la mortalidad por cáncer de Útero NOS ("not otherwise specified": con subsitio indefinido, ICD-O-3: C55). Una proporción desconocida, aunque estimable de esos fallecimientos corresponden a pacientes que fallecieron de CCU pero en el certificado de defunción no ha podido ser identificado si el tumor era de cérvix o de cuerpo de útero. Los métodos de estimación, utilizados por la IARC en Globocan, hacen énfasis en la distribución de las tasas específicas por edad, asignándose a cáncer de cérvix particularmente aquellas muertes por cáncer de útero NOS de mujeres menores a 50 años84.
En cualquier caso, la tendencia de la mortalidad por este subsitio indefinido del útero ha decrecido significativamente en estos últimos 25 años, aportando una cantidad difícil de estimar al conjunto de muertes por CCU. En el gráfico (Figura 13) pueden verse las tendencias de la mortalidad en los tres sitios: cuerpo de útero, cérvix y útero sin especificar.
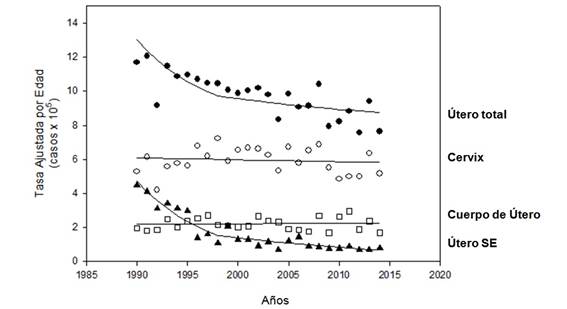
Figura 13: tendencias de las tasas de mortalidad estandarizadas por edad de los diferentes subsitios en los que se registra el Cáncer de Útero (período 1990-2014): Cérvix , Cuerpo y Útero SE (sin especificar subsitio), así como del cáncer de Útero total (todos los subsitios reunidos). Las líneas corresponden a los análisis de regresión Joinpoint.
Es razonable explicar que gran parte de esta resistencia a descender pueda deberse al descenso continuado de la mortalidad en el subsitio "Utero sin especificar". Este descenso, debido a una mejor definición de la causa de muerte en el certificado de defunción ha sido significativo en el mismo período.
Existen fundadas expectativas para ser optimistas en relación al futuro de esta enfermedad, particularmente en nuestro país. El desarrollo y optimización de los programas de detección precoz a través de la colpocitología (PAP test)85, así como de los programas de vacunación con cobertura aún modesta, y probablemente la mejora en las condiciones generales de vida (disminución de los niveles de pobreza) deberían mejorar las cifras en los próximos años.
Una medida del impacto de los programas de detección precoz a través de la colpocitología ha sido un estudio llevado a cabo por el Registro Nacional de Cáncer y el Programa de Prevención del Cáncer Cervico Uterino de la CHLCC en 2012. En primer lugar, que se observa un incremento significativo de la razón cáncer in situ / invasor, esto es una mejora en la anticipación del diagnóstico debido a la mejor cobertura de la población abarcada a través del PAP (obligatorio como control desde 2006, Decreto 001-1847/2006). Por otro lado, la comunicación establece claramente que este progreso no es homogéneo geográficamente y que aquellas zonas donde el progreso ha sido más limitado se correlacionan fuertemente con zonas de mayor nivel de pobreza. Esto podría estar indicando que en algunas zonas de mayor vulnerabilidad socio-económica (especialmente la zona norte y noreste del territorio nacional), las cuales estarían asociadas a mayores riesgos de padecer la enfermedad, son de acuerdo a nuestros resultados donde los programas de detección precoz parecen ser menos eficaces (medido a través de valores más modestos del cociente in situ / invasor). Pero señala a la vez, dónde es preciso aumentar la intensidad de estos programas86.
Estudios recientes en nuestro país respecto de las características propias del perfil de genotipos de HPV presentes en casi mil muestras tomadas a mujeres que participaban de un programa de detección precoz muestran algunas diferencias interesantes. La prevalencia global de la infección por cepas de alto riesgo (HPV 16 y 18) fue del 20.8%, pero de más del 93 % en mujeres con lesiones de alto grado (HSIL). Los 5 genotipos más frecuentes encontrados fueron los siguientes: 16, 31, 51, 56, y 39. En conjunto HPV 16 y/o 18 fueron el 6.3 % del total de las muestras, El HPV 16 fue el genotipo más frecuente (3.6%). Los autores concluyen que estos datos son de relevancia en relación a la cobertura de las vacunas87.
Un artículo previo al anterior exploró el perfil de genotipos en tumores invasores de CCU, encontrando la infección por HPV en casi el 93% de las muestras, siendo el perfil de genotipos más frecuentes los siguientes: HPV 16 (67.6%), 18 (6.8%), 45 (6.8%) y 33 (3.4%), incluyendo infecciones de un único genotipo o mixtas. Los genotipos más agresivos (16, 18 y 45) fueron encontrados preferentemente en mujeres menores de 60 años88.
En resumen, el CCU en Uruguay presenta aun y a pesar de los progresos realizados, tasas de incidencia y mortalidad considerablemente más elevadas que aquellas observadas en los países más desarrollados, razón por la cual los esfuerzos en materia de prevención primaria y secundaria implementados por las autoridades sanitarias, están absolutamente justificados. La identificación de algunas áreas geográficas (o subpoblaciones) con niveles socio-económicos desfavorables que a su turno exhiben peores relaciones entre el cáncer in situ y el invasor constituyen indicaciones interesantes para dirigir apropiadamente el énfasis de los programas de control.
8 Cáncer de esófago
El cáncer de esófago (CE) es el octavo cáncer más frecuentemente diagnosticado en el mundo, constituyendo el 3% del total de los tumores malignos y la sexta causa de muerte por cáncer12)(89. El CE es un cáncer de alta letalidad, en general con malos resultados en los tiempos de supervivencia90. Se estima que en 2012 fueron diagnosticados unos 456000 nuevos casos y más de 400000 pacientes murieron por esta causa. Más del 80% (370000 nuevos casos y 329000 muertes) fueron registrados en el conjunto de países menos desarrollados. Aproximadamente el 4% de los casos fueron diagnosticados en América Central y América del Sur12)(91 .
La variabilidad de las tasas de incidencia y mortalidad por CE registradas alrededor del mundo es enorme y los valores son notoriamente más altos para hombres que para mujeres. La razón entre hombres y mujeres (H:M) varía según las regiones entre 1.2 y 9 en las tasas de incidencia y entre 2.3 y 13 para las de mortalidad.
Las tasas más altas se observan en Irán, algunas regiones de la China y Zimbawe, áreas de riesgo intermedio son África oriental, América del Sur y el Caribe, regiones de China, Asia Central, norte de la India y Europa del sur. Mientras que las tasas más bajas se registran en Norteamérica, Europa del norte y África occidental12)(89. Estas distribuciones están notoriamente asociadas a la prevalencia de los principales factores de riesgo.
Los tipos anatomo-patológicos más frecuentes son los carcinomas de células escamosas (SC) y los adenocarcinomas (AC). Otros tipos histológicos (tumores con diferenciación neuroendócrina, carcinoma adenoide cístico, carcinoma adenoescamoso, sarcomas, melanomas, etc) son más raros y por consiguiente nos focalizaremos en los dos primeros (SC y AC). Ambos presentan no solamente diferentes rasgos histopatológicos sino que tienen también diferentes etiologías y características en sus aspectos clínico-patológicos89)(92)(93.
Para el caso del SC los factores de riesgo más importantes son el consumo de tabaco y alcohol, así como el daño térmico causado por el consumo de bebidas calientes (principalmente infusiones), en tanto que para el caso del AC los factores de riesgo son el consumo de tabaco (también), el sobrepeso y la obesidad, así como la presencia de reflujo gastro-esofágico89)(92)(94)(95. Cuando se presta atención a la distribución y a las tendencias de estos dos tipos de CE, se encuentran diferencias importantes. Ambos subtipos son más frecuentes en hombres que en mujeres, sin embargo, el SC ocurre generalmente en individuos más jóvenes y en países de menores grado de desarrollo (contextos socio-económicos más pobres), mientras que el AC ocurre preponderantemente en poblaciones de altos niveles de ingreso89.
Las estimaciones más recientes indican que el impacto mayor del SC se da en 2 regiones: Asia (sudeste y central) dando cuenta del 79% de los casos y Latinoamérica (4% de los casos)96.
A nivel regional, las tasas más altas de incidencia se observan en Brasil, Uruguay, y Cuba, tanto en la incidencia como en la mortalidad. Las tasas de SC son considerablemente mayores a las del AC (salvo en Cuenca - Ecuador). La relación entre hombres y mujeres es también alta (de 2 a 6 veces), salvo en algunas regiones de Chile (Antofagasta), Colombia (Manizales) y Ecuador (Cuenca). Aunque la validez de estas excepciones está en revisión, su ocurrencia es motivo de investigación91.
Como se ha dicho antes el consumo de tabaco y de alcohol son por lejos los factores de riesgo más importantes y su combinación tiene un efecto sinérgico sobre el riesgo, en particular en el SC97.
No obstante, el daño térmico causado por bebidas calientes ha sido propuesto como un factor también relevante. Por ejemplo, en Irán, la elevada incidencia y mortalidad por CE se ha atribuido al consumo de té a muy altas temperaturas86. El mate, una tradicional infusión en base a Ilex paraguariensis, cuyo consumo es muy difundido en Argentina, el sur de Brasil, Uruguay y Paraguay (aunque también en menor medida en otros países) ha sido señalado también como un factor de riesgo para el cáncer de esófago, así como para otros tumores malignos, especialmente del tracto aero-digestivo superior aunque también para los cánceres de vejiga y riñón98)(99)(100)(101. Excepto en Paraguay donde se consume frío (Tereré), en el resto de los países señalados antes, suele consumirse a elevadas temperaturas. Diversos estudios, mayoritariamente de tipo caso-control han mostrado riesgos significativamente elevados en aquellos consumidores intensos99)(101. Se han propuesto dos factores en el posible mecanismo de la carcinogénesis por este agente: el daño térmico por la exposición de las mucosas a elevadas temperaturas, y la presencia en la infusión de Hidrocarburos Policíclicos Aromáticos (PAH), en particular el Benzopireno. Este problema ha sido y es actualmente intensamente estudiado, particularmente en nuestro medio tanto a nivel experimental como epidemiológico99)(102)(103.
En 1991 la IARC, en su monografía sobre el posible efecto carcinogénico de las xantinas (café, té, mate, metilxantinas) había descartado el efecto carcinogénico del mate en sí (ubicándolo en el Grupo 3: no clasificable en relación a su carcinogenicidad en humanos) y clasificó al mate bebido caliente (hot mate) en el grupo 2A: “probablemente carcinogénico en humanos”99. Un comité de expertos de la IARC ha revisado recientemente97 la nueva evidencia disponible y en consecuencia la calificación del mate como agente carcinogénico, en este informe se enfatiza el rol del daño térmico y se profundiza sobre los mecanismos patológicos y moleculares involucrados. No obstante, la IARC no modificó su clasificación como carcinógeno. En el informe de 2014 se señala que el conocimiento de los aspectos mecanísticos del efecto carcinogénico del mate caliente es limitado y sugiere que el fenómeno involucra un proceso de inflamación crónica. Adicionalmente señala que el análisis de ciertas mutaciones en TP53, en aquellos SC de pacientes de regiones de alto consumo de mate presentan alta frecuencia de G:C>A:T en los sitios CpG. Este tipo de mutaciones es frecuentemente encontrado en tumores que se originan en tejidos con una historia de inflamación crónica. El poco avance que muestra esta reconsideración del problema por parte de la IARC respecto de su clasificación de 1991 ante el análisis de la evidencia reciente, coincide en cierto modo con una revisión previa106 en la cual se concluye la existencia de diversos problemas metodológicos, particularmente en algunos estudios caso-control (sesgos potenciales en la fiabilidad de la medida del consumo - "recall bias", limitaciones en la exclusión de efectos de confusión potenciales con otros agentes como el tabaco y el alcohol). Finalmente, la IARC se limitó a recomendar que el consumo de mate se realizara a temperaturas inferiores a 65°C. Esta no parece ser una conclusión menor para el Uruguay, país en el cual la primera encuesta STEPS llevada a cabo por el MSP en coordinación con la OPS en 2006107 mostró que la bebida es consumida en diversos grados por el 85% de la población. Un dato interesante es que el consumo medido a través de una variable proxy como es la importación de yerba mate, ha aumentado significativamente desde 1990108 en tanto que la incidencia y mortalidad de este cáncer, especialmente el SC han decrecido monótona y significativamente en el mismo período.
Otros factores de riesgo involucrados, son el daño químico por la ingestión de sustancias cáusticas, ciertos hábitos dietéticos como la ingesta elevada de carnes asadas (barbecues) y vegetales conservados con altas concentraciones de nitrosaminas (pickled vegetables), el consumo de opio, la mala higiene dental y una nutrición pobre. El síndrome de Plummer-Vinson, la enfermedad celíaca y la acalasia, también se mencionan como condiciones predisponentes. Los aspectos genéticos involucrados están siendo intensamente estudiados, el lector interesado en profundizar estos aspectos encontrará en la literatura citada, abundante información89.
El CE en Uruguay está entre los 10 cánceres más frecuentes en los hombres. Considerando ambos sexos el promedio anual de casos en el quinquenio 2009-2013 fue de 248 casos (168 en hombres y 80 en mujeres), representando un 1.9% del total de casos de cáncer en el período (exceptuando siempre en el total el cáncer de piel no melanoma). De modo que la razón H:M es de 2:1 aproximadamente. La tasa de incidencia estandarizada por edad es de 6.9 en hombres y de 2.1 en mujeres (casos por 100000). De acuerdo con su elevada letalidad el impacto es considerablemente mayor en la mortalidad, el promedio anual de muertes fue de 231 (154 en hombres y 77 en mujeres) para el mismo período. Esto representa una proporción de casi el 3% de total de las muertes por cáncer en Uruguay, considerando ambos sexos. La tasa de mortalidad estandarizada por edad fue de 6.4 y 1.9 en hombres y mujeres respectivamente. Más del 80% de los casos son diagnosticados en personas de 80 o más años, lo cual revela, también en este cáncer una estrecha relación con la edad8)(21. Como se ha dicho más arriba, Brasil, Uruguay y Cuba (en ese orden) muestran las tasas de incidencia más altas Latinoamérica1)(5).
En el diagrama de la (Figura 8f) se muestran las relaciones entre las tasas estandarizadas de incidencia y de mortalidad para el sexo masculino, así como los cocientes M/I, comparativamente con el conjunto de países más y menos desarrollados. Las cifras son tomadas del Globocan 2012, las tasas de Uruguay corresponden al período 2009-2013. En esta figura puede advertirse que la incidencia del CE en hombres es elevada pero comparable a aquella de los países más desarrollados, mientras que la mortalidad es muy superior a los valores de los países desarrollados, pero también a aquellos valores de los países menos desarrollados. Aun teniendo en cuenta los problemas inherentes a la calidad de la información de mortalidad, como ha sido comentado antes, es bastante evidente que el control de la mortalidad es bastante pobre. Las razones deberían buscarse probablemente en el estadio al momento del diagnóstico y en la accesibilidad global del sistema de salud en tanto que este tumor afecta preponderantemente a sectores socio-económicos menos favorecidos.
El conocimiento del perfil de estadios en el CE es muy limitado en Uruguay, sólo disponemos de información fiable en un tercio de los casos. En aquellos casos con estadio conocido, el 65% corresponden a estadios avanzados (III y IV). Aunque está claro que con tales limitaciones las conclusiones no pueden ser definitivas, es muy probable que al menos una parte importante de la explicación de los altos valores de la mortalidad se deba a diagnósticos en etapas avanzadas de la enfermedad.
Un rasgo epidemiológico que observamos desde hace décadas es el marcado patrón geográfico de las tasas de incidencia y mortalidad por CE en nuestro país. De manera estable y desde que tenemos información desagregada al menos a nivel departamental de esas tasas109 se observa un gradiente orientado desde el noreste hacia el sureste, mostrando tasas elevadas en los departamentos fronterizos con el Brasil y considerablemente más bajas en los departamentos del sur, particularmente los del suroeste. Se ha demostrado que esto configura un claro patrón de autocorrelación espacial110)(111.
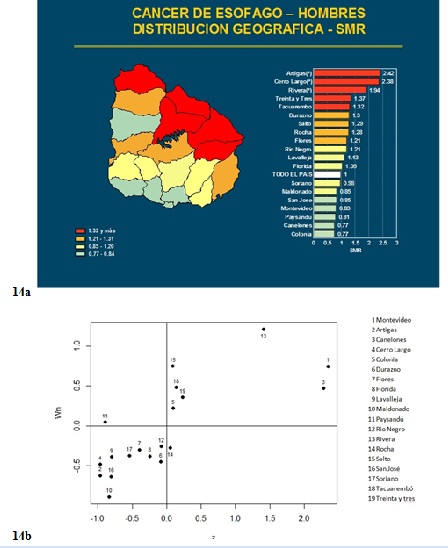
Figura 14: Mortalidad por cáncer de esófago (período 1994-2003, ver texto): 14a. distribución espacial según SMR. 14b. Gráfico de Moran.
En la (Figura 14a) se muestra el mapa del Uruguay que representa la distribución de riesgos de morir por CE a través de la Razón Estandarizada de Mortalidad (SMR por sus siglas en Inglés: que mide el riesgo del departamento involucrado en relación al riesgo del país en su conjunto). Los departamentos se dividen en cuatro cuartiles de acuerdo al SMR. Los departamentos con SMR que caen en el cuartil superior se colorean de rojo, y los del cuartil inferior en verde. Los intermedios en naranja y amarillo. Observando el mapa puede advertirse claramente el gradiente de riesgos arriba expresado.
Este mapa se completa con el plot de Moran y el cálculo de su Índice (Figura 14b).
Cada punto representa un departamento. En el eje de abcisas se expresa una medida del riesgo (departamentos a la derecha del cero tendrán altos SMRs) y en ordenadas el grado de vecindad. Aquellos departamentos con riesgos altos y que son vecinos se agruparán en el cuadrante superior derecho, mientras que aquellos departamentos con riesgos bajos y que son a la vez vecinos se agruparán en el cuadrante inferior izquierdo. Si hay diferentes riesgos pero no son vecinos, esto es, no hay un patrón, la ubicación se desplazaría hacia los cuadrantes superior izquierdo e inferior derecho. Pero en este caso parece evidente que los departamentos se agrupan de tal forma que señalan un patrón de autocorrelación y la pendiente de la recta ajustada a los puntos expresa gráficamente el coeficiente de autocorrelación espacial. Estudios brasileros muestran que un gradiente especular se da en el sur del estado de Rio Grande, con riesgos decrecientes desde la frontera con Uruguay hacia el norte del Estado112.
La explicación de este hecho está seguramente en la distribución de la prevalencia de los factores de riesgo más importantes, tales como el consumo de tabaco y alcohol, sin descartar aspectos de la dieta entre otros hábitos. No obstante, no hay estudios que permitan concluir apropiadamente en esta explicación.
Una distribución geográfica relativamente similar se ha encontrado para el cáncer de estómago, aunque con valores menores del índice de Moran. Los departamentos al norte del Rio Negro tienen en general valores superiores y estables de las tasas de incidencia y mortalidad106.
Las tendencias de las tasas de incidencia y mortalidad muestran también una importante variabilidad y como se ha dicho antes refleja la dinámica de la prevalencia de los diferentes factores de riesgo. Una importante caída de las tasas de incidencia se ha observado en EEUU a partir de la segunda mitad de los 80', pero también en países con menor grado de desarrollo como China e India, particulamente en hombres. En EEUU (también en Uruguay como veremos más adelante) el descenso es a expensas del SC, simultáneo en gran medida a los descensos en la incidencia del cáncer de pulmón y atribuido al mismo factor, el descenso en el consumo de tabaco89. Descensos más tardíos y menos importantes se observaron en Europa, aunque tal vez partiendo de valores más bajos. La diferente dinámica de los dos tipos histopatológicos más importantes, el SC y el AC, pueden expresarse en tendencias variables cuando se observa el CE en su conjunto. Por ejemplo, en algunos países de altos ingresos (Europa Occidental) se ha observado un incremento importante de la incidencia del CE113)(114)(115)(116. Este incremento se ha debido al aumento del tipo AC, fenómeno también observado en EEUU a pesar de que el descenso del SC lo enmascara cuando se observa el CE globalmente. Se ha vinculado este aumento a la prevalencia del RGE y a la epidemia de la obesidad115)(116)(117)(118)(119. Sin embargo, se considera que las razones de este aumento en la incidencia del AC están aún pobremente comprendidas96.
En Uruguay las tasas de mortalidad (estandarizadas y crudas) decrecieron significativamente y de manera monótona desde mediados del siglo pasado45. En el período 1990-2015, las tasas estandarizadas de mortalidad del CE decrecieron a más del 2% anual (PCAE; -2.7 en hombres y -2.1 en mujeres (Figura 10f).8 Como puede verse en las tendencias de largo plazo, especialmente en hombres45 el descenso comienza antes de la declinación de la mortalidad por cáncer de pulmón (que comenzó en Uruguay en la segunda década de los 80'), por lo cual debería pensarse en la influencia de otro factor de riesgo.
En lo que respecta a las tasas de incidencia (estandarizadas por edad), éstas decrecieron significativamente en el período 2002-2014 (PCAE: -5.5 en hombres y -3.2 en mujeres) (Figura 9f).
Como previamente se ha adelantado, el descenso ha sido notoriamente por la caída del SC. Debido a que la calidad del registro del cáncer ha mejorado a lo largo de las últimas décadas, especialmente en la exhaustividad de la información histopatológica es difícil evaluar las tendencias, no obstante y de acuerdo a análisis recientes, la relación SC: AC ha tendido a aumentar en hombres y a decrecer en mujeres, por lo cual se infiere un posible aumento de la incidencia del AC en el sexo femenino. Lo cual a su turno sugeriría un aumento diferencial en mujeres de la prevalencia de los factores de riesgo del AC120.
En suma, el cáncer de esófago aun mantiene importancia en el perfil oncológico del Uruguay, especialmente en los hombres, aunque se han observado descensos significativos tanto de la incidencia como de la mortalidad, notablemente a expensas del tipo SC. Aunque es difícil cuantificarlo fiablemente, el consumo de mate, que aumentó considerablemente en las últimas décadas no parece haber influido en estas tendencias.