Introducción
Cuando se presentan lesiones periapicales (LPA) el objetivo del tratamiento endodóntico es lograr las condiciones para que se produzca la neoformación de los tejidos. La regeneración implica un proceso de renovación de tejidos con células que tienen características similares a las que se perdieron. (1)
La regeneración apical, por lo tanto, es un proceso que implica mecanismos de remodelado óseo (reabsorción/formación de tejido óseo), que involucra la participación de los osteoclastos, osteoblastos y osteocitos. Es importante tener en cuenta que el metabolismo de estas células es afectado tanto por condiciones locales como por factores sistémicos. (1)
La diabetes mellitus (DM) es una patología altamente prevalente en nuestro país. La 2da. encuesta nacional de factores de riesgo de enfermedades no transmisibles (2) realizada por el Ministerio de Salud Pública en el año 2013 revela que la prevalencia de diabetes se ubica en el orden del 7,6% para la población de 25 a 64 años. Además, la prevalencia se incrementa con la edad. Se destaca que para la franja etaria entre 55 a 64 años la estimación es de 16,8%; no registrándose diferencias significativas entre hombres y mujeres.
En un estudio descriptivo transversal realizado en el Servicio de Registro de la Facultad de Odontología (Udelar) entre agosto del 2015 y mayo del 2016 se detectó una prevalencia de 15,6% de pacientes diabéticos, cifra que se eleva al 30,3% si se consideran pacientes mayores de 65 años. (3)
La integridad del sistema inmunológico, el remodelado tisular y la regulación en la diferenciación y actividad osteoclástica podrían verse alterados en los pacientes diabéticos (4), condicionando la susceptibilidad a las LPA.
En el año 2014 la Sociedad Europea de Endodoncia (ESE, por su sigla en inglés) realizó un simposio, denominado “Relación entre periodontitis apical y salud general”. Las conclusiones determinaron que el nivel de evidencia en relación a este tema es bajo. (5)
Desde la década de 1990 y con más fuerza a partir del año 2000, se ha desarrollado la “Medicina periodontal” como un área enfocada en la relación entre la enfermedad periodontal (EP) y las enfermedades sistémicas. Varios estudios epidemiológicos han encontrado asociación entre la EP y la DM.(6,7) Debido a que la EP y los procesos inflamatorios crónicos apicales comparten una serie de características (ambas son infecciones orales polimicrobianas que comparten microbiota con predominancia de bacterias anaerobias gramnegativas que desencadenan procesos inflamatorios) se podría asumir que las LPA también podrían relacionarse con enfermedades sistémicas.(8,9)
De forma semejante, entonces, surge el concepto de “Medicina endodóntica” (8) Este término se refiere a la relación bidireccional entre las infecciones endodónticas y las enfermedades sistémicas y se sustenta en evidencia que demuestra que las enfermedades sistémicas influyen en la patogénesis de la infección endodóntica, así como ésta última puede causar alteraciones a nivel de la salud general (10)
Objetivos
Este trabajo de revisión tiene como objetivo analizar la asociación entre la diabetes mellitus y las lesiones periapicales y establecer si los pacientes diabéticos tienen mayor prevalencia y severidad de LPA comparado con pacientes sin DM.
Método
Se realizó una revisión amplia de la literatura disponible, de tipo narrativa, para identificar trabajos que abordan la relación entre la DM como enfermedad sistémica asociada a las LPA, en lo referente a la prevalencia y severidad. Se consultaron las bases de datos PubMed (Medline) y SciELO y los recursos Timbó y Google Scholar.
La estrategia de búsqueda fue:
("periapical periodontitis"(MeSH Terms)OR ("periapical"(All Fields)AND "periodontitis"(All Fields) OR "periapical periodontitis"(All Fields)OR ("apical"(All Fields)AND "periodontitis"(All Fields) OR "apical periodontitis"(All Fields) AND ("diabetes mellitus"(MeSH Terms)OR ("diabetes"(All Fields)AND "mellitus"(All Fields) OR "diabetes mellitus"(All Fields)
Los criterios de exclusión fueron: trabajos anteriores al año 2010 y reportes de caso.
Se recuperaron 37 artículos de los cuales 25 fueron documentos primarios (artículos originales) y 12 secundarios (revisiones sistemáticas, metaanálisis, umbrella review).
Se completó la búsqueda con lectura y rastreo de bibliografía referenciada en esos artículos, reuniendo un total de 46 documentos publicados desde el año 1986 al 2020. Se incluyeron artículos anteriores a la fecha de exclusión por considerarse relevantes para el trabajo.
Desarrollo
Las LPA son procesos inflamatorios alrededor del ápice de la raíz dentaria, principalmente como secuela de una Infección microbiana a nivel pulpar. Esta inflamación conlleva la reabsorción de las estructuras mineralizadas de la zona perirradicular (dentina, cemento y tejido óseo), lo que se evidencia como áreas radiolúcidas en las imágenes radiográficas. (8)
El proceso inflamatorio es un mecanismo defensivo del huésped en el que se sintetizan citoquinas que desencadenan la respuesta inmune para controlar la infección pero que, simultáneamente, genera efectos adversos, como dolor, pérdida de soporte óseo o incluso la pérdida del diente (10).
En las investigaciones, tanto en animales como en estudios en humanos, se utilizan comúnmente las imágenes radiográficas como forma de determinar la presencia de LPA, así como para monitorear la evolución de las mismas luego de los tratamientos endodónticos. (9,11-20)
En el año 1986 Orstarvik (21) presenta, simplificando el método de interpretación radiográfica propuesto por Brynolf, un sistema de puntuación para la valoración radiográfica de las LPA. Este sistema denominado Índice periapical (PAI por su sigla en inglés) propone una escala ordinal de 5 puntos, desde el 1 (sano) al 5 (destrucción ósea periapical definida).
La Asociación Americana de Diabetes postuló, en el año 2010, que la DM es un grupo de enfermedades metabólicas, caracterizado por hiperglucemia, que resulta de defectos en la secreción de insulina, acción de la insulina o ambos (22)
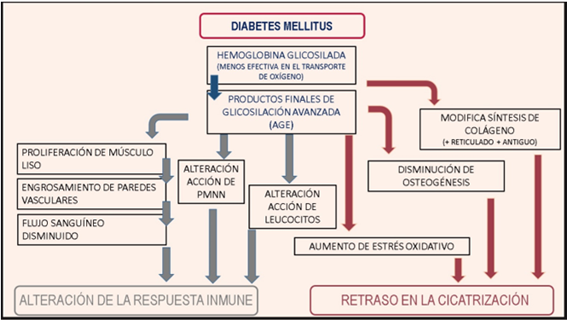
La DM afecta varias funciones del sistema inmune, alterando la respuesta celular y retrasando la cicatrización. (FIGURA 1) Esta situación predispone a la inflamación crónica y a la progresiva destrucción tisular (23)
El estado de hiperglucemia que genera la DM afecta la circulación y produce diversos cambios en la pulpa y los tejidos PA. (FIGURA 2) La DM perjudica la función bactericida de los neutrófilos, afectando seriamente la respuesta inmune. (24)
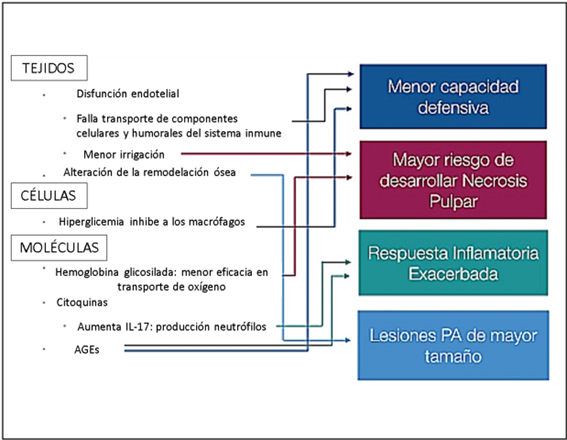
FIGURA 2: Esquema de las alteraciones producidas a partir del aumento de la glicemia y su posible consecuencia a nivel endodóntico
Según un estudio publicado en el año 2020 los pacientes con DM tipo 2 (fundamentalmente pacientes con varios años de diabetes) presentan un elevado recuento de Cándida albicans, en las infecciones primarias del sistema de conductos, con mayor frecuencia que los pacientes sanos, y esto podría explicar la mayor prevalencia de procesos perirradiculares en estos pacientes. (23)
Este hallazgo permitiría formular una hipótesis acerca de determinados patógenos endodónticos virulentos en conductos radiculares de pacientes diabéticos y que la prevalencia tan alta de estos microorganismos puede ser una de las posibles razones por las que las LPA son más severas en diabéticos que en no diabéticos. (13,26)
Discusión
Varios estudios realizados en animales han demostrado que el desarrollo de periodontitis apical y su progresión puede verse acelerada en presencia de diabetes. En comparación con las ratas de control, las ratas diabéticas exhibieron inflamación más severa del ligamento periodontal, mayor reabsorción radicular y mayor reabsorción ósea. Las LPA en ratas diabéticas fueron significativamente más grandes que las de las ratas de control, lo que sugiere una intensa respuesta inflamatoria en condiciones de hiperglicemia. (13,22,27-30)
El impacto de la DM en la prevalencia y severidad de las LPA también fue evaluada en humanos a partir de estudios observacionales y ensayos clínicos. (9,15,19,20,31-35)
-Segura-Egea y col. llevaron adelante un estudio retrospectivo en la Facultad de Odontología de la Universidad de Sevilla en el que encontraron que la diabetes tipo 2 está significativamente asociada a un aumento en la prevalencia de LPA (35)
-La prevalencia radiográfica de LPA y de dientes endodónticamente tratados (DET) fueron evaluados en pacientes con DM tipo 2 y pacientes sanos en un estudio transversal realizado en una población de Cataluña, España. (9) Los resultados mostraron que, en pacientes adultos, la DM tipo 2 se asocia significativamente con una mayor prevalencia de LPA y tratamientos de endodoncia.
-Marotta y col. publicaron en el año 2012 otro estudio transversal considernado los mismos parámetros (prevalencia de LPA y DET en pacientes con DM tipo 2) pero esta vez en una población de Brasil. (19) Las LPA fueron significativamente más prevalentes en personas diabéticas en relación a los controles no diabéticos
-Otro estudio transversal publicado en 2015 investigó la asociación entre la prevalencia de DET y LPA, y algunas condiciones sistémicas o hábitos en una población portuguesa adulta. (15) Se observó una correlación positiva entre DET y DM, pero los datos no fueron estadísticamente significativos.
Algunos estudios toman en consideración, dentro de su metodología, aspectos relativos a la evolución de la DM o a los niveles de hemoglobina glicosilada (HbA1c).(20,31-34)
-En un estudio realizado en el año 2014 se investigó la frecuencia de lesiones perirradiculares en pacientes con diabetes de larga evolución (> 48 meses) y corta evolución (<48 meses), y se demostró que es mayor en pacientes con DM de larga evolución. (34)
-En el mismo año otro estudio transversal (20) analizó radiografías de 83 pacientes con DM tipo 2, utilizando el PAI. Los pacientes fueron divididos en dos grupos según el nivel de control de la enfermedad: pacientes con buen control (HbA1c <6,5%) y pacientes con DM pobremente controlada (HbA1c >6,5%) Los resultados del modelo de regresión logística final revelan una prevalencia significativamente mayor de LPA en pacientes diabéticos tipo 2, con niveles de HbA1c ≥ 6.5%, es decir con DM pobremente controlada.
-La tomografía computada fue utilizada en un estudio transversal en el que se evaluó una posible asociación entre DM tipo 2 y LPA y se observó una mayor prevalencia de LPA y destrucción ósea severa en pacientes con DM en comparación con pacientes no diabéticos. Sin embargo, no hubo diferencias significativas entre los subgrupos con DM, bien y mal controlada. (31)
-Otro resultado arrojó un estudio transversal publicado en 2020 en el que se examinaron radiografías de 216 pacientes con diabetes tipo 2. Los resultados no mostraron asociación entre el control glucémico y la prevalencia de LPA o tratamiento endodóntico en pacientes diabéticos tipo 2..(32)
Los resultados reportados en estos estudios no son concluyentes, pero muestran algunas diferencias en la historia natural de las LPA en el paciente diabético que sugiere una asociación entre la DM y las LPA. (9)
El estudio de la severidad y la prevalencia de LPA en pacientes diabéticos ha sido objeto de múltiples revisiones y metaanálisis en la literatura. (4,8,10,25,36-44)
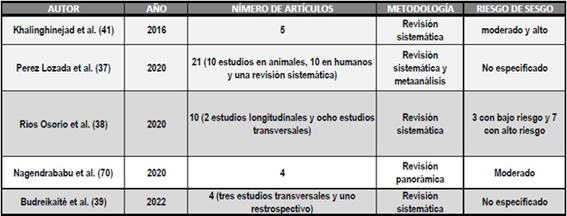
En la Tabla 1 se especifican los aspectos metodológicos de revisiones sistemáticas y metaanálisis.
TABLA 1: Artículos de revisión sistemática y metaanálisis que analizan la prevalencia y severidad de LPA en pacientes con DM.
-Para algunos autores (39,41,43) la evidencia actual no es concluyente y es insuficiente para sugerir una asociación entre DM y aumento de prevalencia y severidad de LPA..
-Para Fouad (39) la información disponible en relación a la patogénesis, la progresión y la reparación de lesiones PA en pacientes diabéticos continúa siendo insuficiente.
Varios autores remarcan la importancia de las consideraciones que requieren los pacientes diabéticos (4,38,42,43) y plantean el riesgo de exacerbaciones y dificultad en la reparación apical en estos pacientes y el conocimiento de la patología diabética para actuar de forma consciente, segura y eficaz.
-Para Lima (4) el control inadecuado de la DM puede predisponer a estos pacientes a infecciones bucales, incluida la infección de la pulpa dental. Además, la presencia de periodontitis apical tiene correlación con pacientes con DM no controlada. Esta relación demuestra una susceptibilidad cruzada entre ambas enfermedades.
-Para Perez-Losada y col. (36) la evidencia científica sugiere que podría haber un factor fisiopatológico común entre periodontitis apical y DM, pero se necesitan más estudios prospectivos para investigar la asociación entre estas dos enfermedades.
-Quezada (25) afirma que existe una mayor prevalencia de LPA en pacientes diabéticos y que se ha visto una asociación estadísticamente significativa entre la DM y la presencia de LPA en DET, demostrando la importancia de la atención integral del paciente.
-Para Cintra y col. (10) los estudios sugieren fuertemente una relación bidireccional entre la infección endodóntica y la diabetes.
-Ríos-Osorio y col. (37) concluyen que los resultados demuestran que existen bases biológicas para sugerir que la DM tipo 2 puede actuar como un factor de riesgo para desarrollar patología endodóntica.
-Segura-Egea y col. de la Universidad de Sevilla, España, han publicado una serie de revisiones en las que estudian la asociación entre la DM y las LPA. (8,40,44) Los autores establecen que los resultados de los estudios no son concluyentes, pero sugieren una asociación entre DM y LPA, asegurando que hay datos suficientes en la literatura para relacionar la DM con una mayor prevalencia de LPA, mayor tamaño de las lesiones osteolíticas, mayor probabilidad de infecciones asintomáticas y peor pronóstico para los DET. También concluyen que no hay evidencia científica que demuestre un efecto causal de la inflamación periapical en el control metabólico del paciente diabético. (8) En el año 2019 publicaron un estudio cuyo objetivo fue analizar la diferencia entre asociación y causalidad, aplicando el criterio de causalidad al caso específico de la asociación de la enfermedad endodóntica y la DM.
-Budreikaitė y col. (38) encontraron una asociación estadísticamente significativa entre pacientes con diabetes tipo 2 y la presencia de periodontitis apical, con procesos de reparación post tratamiento enlentecidos.
A pesar de que varios estudios demuestran una asociación entre la prevalencia de LPA, DET y DET perdidos con enfermedades sistémicas como la DM, esto no prueba la existencia de una relación de causa-efecto.(44)
Es importante, además, considerar que la mayoría de los estudios recuperados son de naturaleza transversal, lo que condiciona el análisis de los resultados, ya que las variables se obtienen en un mismo momento y, por lo tanto, no se puede establecer una relación causa/ efecto. (33).
En el caso específico de la asociación entre las LPA y la DM, los estudios transversales desconocen la situación previa de los dientes evaluados, y por lo tanto no es posible saber si las imágenes que se observan en los estudios paraclínicos podrían, eventualmente, corresponder a lesiones en proceso de curación. La curación del tejido PA depende del tiempo y, por lo tanto, es un proceso difícil de evaluar a través de un estudio transversal. (27) Este dato es particularmente importante en el tema de este trabajo, ya que la mayor prevalencia de LPA en pacientes diabéticos podría significar mayor incidencia de infección, pero también un retraso en el proceso de reparación. (44) Diversos estudios utilizan las imágenes radiolúcidas de la región PA, sin considerar, además, si se trata de procesos en reparación. Este aspecto es trascendente ya que es posible que se clasifique una imagen paraclínica como “fracaso endodóntico” desconociendo el diagnóstico previo al tratamiento. Sería interesante incorporar el concepto de “tolerancia al tratamiento endoóntico” como una categorización para aquellos casos en los que algunos aspectos, como la persistencia de imágenes radiolúcidas, torna inconveniente la inclusión en la categoría de “éxito” pero, al mismo tiempo, la pieza permanece funcional y asintomática.
Es muchas veces complejo controlar y evaluar todas las variables involucradas en el resultado del tratamiento endodóntico, las que actúan como factores de confusión. (31) Pese a que la asociación entre la DM y la enfermedad periodontal está comprobada, en los estudios clínicos no se evalúa la profundidad de sondaje ni se considera la enfermedad periodontal como causa de pérdida de DET en pacientes diabéticos.
En la mayoría de los estudios la determinación del grupo de pacientes diabéticos se realiza por anamnesis, sin medición de la glicemia ni diferenciación entre DM tipo 1 y tipo 2, ni pacientes bien y mal controlados.
Nagendrababu (45) recomienda realizar estudios con tamaños de muestra representativos y suficientes, en los que se analice a los pacientes en función del tipo de diabetes, cuyo status glicémico se obtenga mediante estudios de laboratorio y en los que se controlen factores de confusión como enfermedad periodontal, edad, género, idoneidad del examinador, calidad del tratamiento y las restauraciones, etc.
Conclusiones
Los estudios que relacionan la DM con la prevalencia y la severidad de las LPA, tanto en animales de laboratorio como estudios clínicos transversales y longitudinales en humanos, continúan siendo contradictorios e insuficientes. Sin embargo, la evidencia muestra una asociación entre la DM y la mayor prevalencia y severidad de las LPA. Esto revela que los pacientes diabéticos pueden presentar periodontitis apical con mayor frecuencia, con un curso más severo y retrasando la reparación luego del tratamiento endodóntico.(4,25,35,37,38)
Un seguimiento adecuado de los DET, así como el control periódico de la glucemia es imprescindible para mejorar el pronóstico endodóntico. (43) Debido a la elevada prevalencia de biofilm resistente detectado en los pacientes diabéticos el profesional debe ser riguroso al intentar controlar microorganismos como la C. albicans dentro del sistema de conductos radicular. (23)
Los pacientes con diabetes requieren seguimientos más rigurosos, terapia intervencionista más activa en lugar de actitud expectante, comunicación con los médicos y mayores medidas preventivas. (46)
En virtud de que la reparación apical puede verse retrasada luego del tratamiento endodóntico, las consultas de control deberían prolongarse, de ser necesario, por más de 4 años.(38)











 texto en
texto en