Introducción
La enfermedad periodontal es una enfermedad infecciosa, inflamatoria, inmunológica y crónica que responde a los antígenos periodontopáticos y de naturaleza multifactorial. Resulta de la interacción compleja entre los microorganismos y los mecanismos de defensa del hospedero y su desarrollo puede ser modificado por la presencia de factores ambientales (tabaco), condiciones adquiridas (enfermedades sistémicas) y factores genéticos 1.
Las características clínicas primarias de la periodontitis incluyen: pérdida de inserción clínica (PIC), reabsorción ósea (RO), formación de bolsas periodontales (BP) e inflamación gingival. Además puede darse aumento o recesión gingival, sangrado al sondaje, aumento de la movilidad, migración o exfoliación dentaria (2.
El objetivo de este artículo es revisar la evidencia disponible actualmente sobre el rol de las proteínas RANK, RANKL y OPG en la patogenia de la enfermedad periodontal, el esclarecimiento del rol de las mismas podría eventualmente permitir el desarrollo de nuevas terapéuticas que contribuyan al diagnóstico precoz y un mejor tratamiento y mantenimiento de los pacientes con esta patología.
Metodología
Se realizó una búsqueda bibliográfica que abarcó desde 1977 hasta el 2021 en bases de datos Pubmed, Scielo, Medline, utilizando descriptores como RANK, receptor del activador nuclear κappa-β, RANKL, ligando del receptor del activador nuclear κappa-β, OPG, osteoprotegerina, enfermedades periodontales, periodontitis, reabsorción ósea.
Desarrollo
La respuesta inicial a la infección bacteriana es la reacción inflamatoria que activa el sistema inmunitario innato, la amplificación de esta respuesta resulta en la liberación de una cascada de citoquinas y otros mediadores y la propagación de la inflamación hacia los tejidos subyacentes 3,4. La falla en encapsular este frente inflamatorio a nivel gingival puede resultar en la expansión de la respuesta hacia el hueso alveolar 3, el proceso inflamatorio lleva a la destrucción del tejido conectivo y hueso alveolar, el cual es el signo cardinal de la periodontitis 5.
Dentro de los avances en el conocimiento de esta enfermedad, los mecanismos intrínsecos de destrucción titular y los factores genéticos que tornan a un individuo susceptible siguen siendo grandes incógnitas.
La acción de RANKL puede ser bloqueada por su antagonista, la Osteoprotegerina (OPG), la cual es miembro de la superfamilia del FNT, con estructura homóloga a RANK 6. Al unirse a RANKL, la OPG previene su interacción con RANK y por lo tanto la cascada de eventos moleculares que llevan a la diferenciación de osteoclastos y reabsorción ósea. Las concentraciones de estas proteínas están reguladas por una variedad de factores, en ausencia de inflamación, el balance está a favor de la OPG. En presencia de inflamación, los mediadores químicos tornan el balance a favor de la reabsorción. En la periodontitis: PGE2, IL-1B, FNT-alfa e IL-6 han sido los mediadores más relacionados a la reabsorción ósea 7.
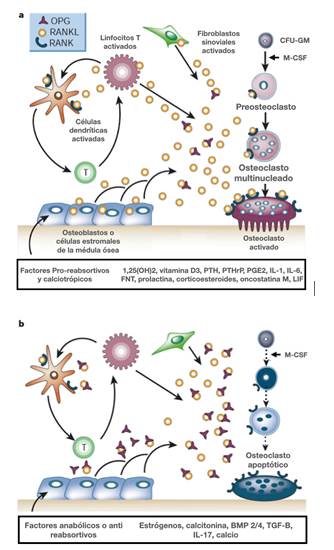
La Figura 1 es la representación esquemática del mecanismo de acción a- factores pro-reabsortivos y b-factores antirresortivos. La expresión de RANKL es inducida en osteoblastos, células T activadas, fibroblastos sinoviales, células de la médula ósea y subsecuentemente se une a su receptor RANK, desencadenando una cascada de eventos que promueve la diferenciación, activación y supervivencia de osteoclastos. Inversamente, la expresión de OPG es inducida por factores que bloquean el catabolismo óseo y promueven los efectos anabólicos. OPG se une a RANKL y lo neutraliza, llevando a un bloqueo en la osteoclastogénesis y disminución de la supervivencia de los osteoclastos pre-existentes
RANK, además de ser expresado en células precursoras de osteoclastos, se ha encontrado en células de la médula ósea, el bazo, intestino, timo, riñón, cerebro y pulmón 9 megacariocitos 10, monocitos 11, células dendríticas, células T CD4+ , fibroblastos del prepucio y ciertos linfomas de Hodgkin 12.
La función de esta proteína, además de la vinculada con la diferenciación de osteoclastos, incluye supervivencia de células endoteliales, maduración y función de células dendríticas, quimiotaxis y refuerzo de la respuesta de las células T 13.
Utilizando inmunohistoquímica, Giannopolou et al. en 2012 estudiaron la positividad de RANK, RANKL y OPG en tejidos periodontales de pacientes con periodontitis. En el epitelio de la bolsa la expresión de RANK fue significativamente más alta que OPG. En el 100% de los casos, más del 60% de las células mostraban tinción para RANK y sólo 42% para OPG (p= 0.004). En el infiltrado celular inflamatorio la expresión de RANK y RANKL mostró diferencias significativas en comparación con la expresión de OPG (p=0.001 y 0.006 respectivamente). Siendo la tinción de OPG positiva (30-59%) en 2/14 casos y menos de 29% en 7/14 casos, mientras que 9/14 casos para RANK y 8/14 casos para RANKL tenían una marcación de células de más del 60%. No se encontró un efecto significativo de tabaco en la expresión de RANK, RANKL y OPG 14.
Aún en la actualidad, las fuentes de RANKL durante la remodelación ósea fisiológica no han sido esclarecidas, pero la evidencia sugiere que la fuente cambia a lo largo del desarrollo de manera que los condrocitos hipertróficos proporcionan RANKL para la remoción trabecular durante la osificación endocondral y los osteocitos trabeculares proporcionan gran parte del RANKL necesario para la remodelación ósea en respuesta al estrés mecánico 15,16. Hace más de 30 años, con la observación de que los receptores de las hormonas osteoclastogénicas, como la hormona paratiroidea (PTH), están presentes en las células con características osteoblásticas pero no en los progenitores de osteoclastos, se desarrolló la teoría de que los osteoblastos controlan la función y diferenciación de osteoclastos 17. Trabajos posteriores mostraron que las líneas celulares con características osteoblásticas o las preparaciones celulares ricas en progenitores de osteoblastos apoyan la formación de osteoclastos en co-cultivos con progenitores de osteoclastos 18,19. El Factor Estimulante de Colonias Macrofágicas o M-CSF (macrophage colony-stimulating factor) y RANKL son considerados factores producidos por las células de soporte que son esenciales para la diferenciación de osteoclastos in vivo, explicando la necesidad de células osteoblásticas para la formación de osteoclastos 20,21.
Los osteocitos también serían una fuente esencial del RANKL que controla la formación de osteoclastos durante la remodelación del hueso esponjoso 22. Estos se forman en diferentes sitios esqueléticos para diferentes propósitos y requieren diferentes células de soporte en cada caso. RANKL derivado de los osteocitos no es necesario para la erupción dental o la reabsorción de cartílago calcificado durante la osificación endocondral, lo cual permitió concluir que otros tipos de células deben suministrar el RANKL requerido para la formación de osteoclastos en estos procesos 23. Por lo tanto, el papel del RANKL derivado de los osteocitos puede estar limitado a la remodelación ósea fisiológica.
Varios estudios indicaron que tanto los linfocitos T como los B expresan RANKL 24,25,26. En la reabsorción ósea inflamatoria, los linfocitos T serían las células que median la reabsorción ósea excesiva mediante la producción de RANKL. Esta es una proteína unida a membrana en los osteoblastos, pero su expresión unida a membrana en linfocitos T sería limitada y la mayoría de la proteína en estas células podría ser activa de manera soluble 27.
Teng 28 encontró expresión de RANKL en linfocitos T de pacientes con periodontitis agresiva infectados con A. actinomycetemcomitans. De hecho, los linfocitos T aislados de la lesión de periodontitis expresaron RANKL (27,29. Autores como Han, Kawai y Vernal 30,31,32, especificaron que aquellas células que funcionan como fuente principal de RANKL en las enfermedades periodontales son los linfocitos Th1, Th17 y los linfocitos B. Además, todas las células residentes mesenquimales pueden también expresar esta proteína bajo desafío bacteriano 33,34. Llamativamente, las células T-reguladoras pueden atenuar su expresión por otras células T activadas 35.
Un estudio de Belibasakis et al. 2011 demostró que la exposición de células T a P. gingivalis in vitro indujo la producción de RANKL, pero no de OPG. Además, también estimuló la producción del mediador inflamatorio clave PGE2. Esto indica que P. gingivalis regula la función de las células T de manera que favorece la osteoclastogénesis y la reabsorción ósea 36.
Liu 2003 examinó la expresión de ARNm para RANKL a nivel celular usando hibridación in situ y encontró que el mismo estaba presente en células inflamatorias, principalmente linfocitos y macrófagos 26. Además, el epitelio proliferante en la vecindad de las células inflamatorias expresó altos niveles de ARNm para RANKL 26. Análisis con microscopio confocal mostró que ambas células B y T, pero no monocitos ni fibroblastos, son la principal fuente celular de RANKL en la lesión ósea de enfermedad periodontal 31. Sin embargo, otras células también pueden ser una fuente importante en este proceso, porque regulan su expresión indirectamente mediante la producción de citoquinas proinflamatorias 37.
Las células B activadas producen IgG como protección al hospedador pero también podrían contribuir a la destrucción de hueso por su producción de RANKL porque este tipo de linfocito es abundante en tejidos periodontales inflamados 38,39; ya que existe una respuesta excesiva por parte de las células B representada por el anticuerpo IgG a abundantes antígenos bacterianos 40,41,42 que puede contribuir al desarrollo de reabsorción ósea periodontal mediada por el sistema inmune 43,44; además de expresar altas cantidades de RANKL en tejido gingival con periodontitis 25. Se encontró en animales inyectados con A. actinomycetemcomitans, una fuerte expresión de RANKL por parte de los Linfocitos B. La administración de OPG-Fc a este modelo disminuyó la pérdida ósea 30 sugiriendo que la reabsorción por estimulación de linfocitos B es dependiente de RANKL 30,45.
En muestras de tejido gingival, tomadas de pacientes con periodontitis, Crotti et al. 2003 encontró que aproximadamente 30% de los linfocitos T CD3 ubicados en el infiltrado inflamatorio expresaron RANKL, que los macrófagos positivos a CD68 expresaron RANKL aproximadamente en un 50% y que pocos números de linfocitos B CD 22 fueron ubicados dentro de la lesión inflamatoria y en los últimos no se encontró positividad para RANKL 46.
En tejido gingival de pacientes con periodontitis, sometido a inmunohistoquímica, la inflamación (moderada o severa) estuvo asociada con una mayor expresión de RANK y RANKL en las células inflamatorias (p= 0.07 y 0.08 respectivamente). De hecho, 9 de 14 casos (64.3%) y 8 de 14 casos (57.1%) mostraron más de 60% de células teñidas en el área de la bolsa periodontal para RANK y RANKL, respectivamente. La expresión de OPG no estuvo relacionada con el grado de inflamación 14.También mediante inmunohistoquímica, Dereka et al. en el 2009 47 comparó la expresión de RANKL en tejidos de pacientes enfermos y sanos luego de realizada la terapia periodontal no quirúrgica y encontró, en aquellas muestras sanas aproximadamente un 50% de positividad en el infiltrado y menos en el epitelio, en aquellos enfermos un 75% en el epitelio y 87% en el infiltrado inflamatorio.
Estos resultados sugieren que el aumento de la producción de RANKL puede estar asociado con la reabsorción ósea y los linfocitos son una de las fuentes principales de RANKL en el tejido con periodontitis. La expresión de RANKL y OPG de células fibroblásticas, incluyendo osteoblastos, fibroblastos del ligamento periodontal y gingivales, son principalmente examinados en cultivos celulares in vitro 48.
A nivel general, se ha detectado la expresión de OPG en células de la piel, huesos, arterias y tracto gastrointestinal 34, células endoteliales de la macro y microvasculatura , así como en células del músculo liso 49,50,51. Existe evidencia del papel de OPG en el sistema vascular , con expresión observada en el corazón, arterias y venas 52. En las células del músculo liso vascular, varios factores de crecimiento y citoquinas son capaces de aumentar la expresión de OPG, incluyendo FNT-a, IL-1B, factor de crecimiento fibroblástico, factor de crecimiento derivado de plaquetas y angiotensina II 53,51. Varias de estas citoquinas anteriormente nombradas, juegan un papel importante en la patogénesis de la enfermedad periodontal 3.
OPG ha sido localizada en gránulos secretorios específicos conocidos como cuerpos de Weibel-Palade (CWP) de células endoteliales, que también contienen la glicoproteína Factor de Von Willebrand (vWF) y la molécula de adhesión P-selectina 50. Dentro de los CWP, OPG es asociada con vWF, pero no con P-selectina y bajo la estimulación de células endoteliales por citoquinas FNT-a e IL-1b in vitro este complejo es secretado al medio circundante. Por otra parte, existe evidencia de que OPG es capaz de promover la adhesión leucocitaria a las células endoteliales y esto puede estar mediado por las interacciones del OPG con la superficie de la célula endotelial 54.
El tejido conectivo en sí, podría ser una fuente de OPG en el tejido gingival, Nagasawa et al 29. demostraron que los fibroblastos gingivales producen OPG en respuesta a la estimulación por LPS. La inducción de los fibroblastos gingivales puede ser un mecanismo de defensa para inhibir la destrucción de hueso alveolar durante la inflamación periodontal.
Las bacterias patógenas periodontales afectan el relación RANKL/OPG en los fibroblastos del ligamento periodontal de manera diferente a los fibroblastos gingivales, ambos RANKL y OPG pueden ser producidos por fibroblastos del ligamento periodontal, frente a la estimulación de los patógenos periodontales, aumentando el ratio entre ellos y los fibroblastos gingivales producen OPG, pero no RANKL, frente a la estimulación de patógenos periodontales disminuyendo el ratio RANKL/OPG 34. Sakata et al. detectó mediante RT-PCR la presencia de ARNm de OPG en fibroblastos gingivales, fibroblastos del ligamento periodontal y células de la pulpa dental en humanos, pero no en queratinocitos gingivales humanos 55. IL-1 a y factor de necrosis tumoral-a aumentó la cantidad de ARNm de OPG en los fibroblastos del ligamento periodontal, pero la IL-6 y factor de necrosis tumoral-b tuvieron escaso efecto en sus niveles 55. Lu et al. encontraron baja expresión de OPG en la zona del infiltrado inflamatorio en el tejido gingival de pacientes con periodontitis 56. Estas proteínas, están asociadas además a distintas enfermedades sistémicas, tales como osteoporosis 57 y artritis reumatoide 58.(entre otros), que a su vez, están asociadas a la enfermedad periodontal 59,60.
Discusión
Niveles de RANK, RANKL y OPG en salud y enfermedad
Comparando la expresión de RANKL y OPG en pacientes sanos y con periodontitis Lu et al. encontraron que el análisis inmunohistoquímico no mostró diferencias en la distribución de células positivas a OPG en el tejido conectivo del grupo sano y enfermo. Las células positivas a OPG estaban irregularmente distribuidas en la zona inflamatoria difusa del tejido conectivo gingival de las muestras con enfermedad. Sin embargo, las células positivas a RANKL estaban ampliamente distribuidas en el tejido conectivo de los pacientes con periodontitis crónica (media periodontitis (media ± desviación estándar (SD), 53.70% ± 15.48%)). El test Mann-Whitney U Test mostró una diferencia significativa p < 0.01 entre el porcentaje de células positivas a RANKL entre los tejidos de los individuos con salud y con enfermedad, no así para los niveles de OPG 56. En este estudio las muestras fueron tomadas de pacientes con periodontitis que no habían sido sometidos a ningún tipo de tratamiento periodontal en los 3 meses previos al estudio. Los autores no brindaron información sobre si los pacientes habían recibido tratamiento de raspado y alisado previo a la terapia quirúrgica 56.
RANKL se encontró asociada a linfocitos y macrófagos mediante inmunohistoquímica, expresándose en niveles significativamente más altos en tejido proveniente de pacientes con periodontitis 61. De lo contrario, en tejido gingival sano, muy pocas células que expresan RANKL estuvieron presentes 31,62. Más del 50% de las células T y el 90% de las células B expresaron RANKL en tejido con periodontitis, mientras que menos del 20% de las células B o T mostraron expresión de RANKL en tejido gingival sano. Las concentraciones de RANKL, pero no OPG, fueron significativamente más altas en el tejido con periodontitis en comparación con el tejido sano 31. Las muestras fueron tomadas durante procedimientos quirúrgicos, los autores no especificaron si anterior a este procedimiento, los participantes recibieron algún tipo de terapia periodontal.
El análisis de inmunohistoquímica de tejido conectivo de ratas sometidas a un proceso de periodontitis experimental mediante ligadura, reveló un mayor número de células positivas para RANK y RANKL en el grupo de animales que tenía una evolución de periodontitis de 60 días, comparado con mismo grupo al inicio del estudio y a los 15 días (0 y 15 días de evolución respectivamente) (p<0.05). En términos de número de células positivas para OPG, no hubo diferencias significativas entre los tres grupos. El desarrollo de la periodontitis fue asociado con niveles aumentados de células que son marcadores positivos para reabsorción ósea (RANK y RANKL) y la disminución de OPG, posiblemente haya sido debido al aumento linfocitario observado en el infiltrado durante el período de experimentación 63.
RANKL fue expresada de manera importante en leucocitos que formaban grandes infiltrados celulares en el tejido de granulación de lesiones de periodontitis. Tinción leve fue también vista en el tejido extracelular, que puede indicar que RANKL puede estar asociada con el tejido conectivo. La expresión de RANKL fue menos obvia en los tejidos sin periodontitis 46.
La tinción para OPG demostró que estaba asociada con células que cubrían los vasos sanguíneos en ambos tipos de tejido, sin embargo, la tinción fue mucho más fuerte en los tejidos sin periodontitis. Se realizó doble tinción utilizando marcadores específicos para RANKL y para células T (CD3), B (CD22) y macrófagos (CD68). Muchas células T (CD3) fueron vistas en los agregados celulares en los tejidos con periodontitis. Aproximadamente 30% de las estas expresaron RANKL y así como muchas células no-CD3 también lo hicieron. Menor cantidad de células CD3 fueron identificadas en los tejidos obtenidos de pacientes sin periodontitis 46.
Doble tinción para RANKL y CD68 mostró positividad en macrófagos de los tejidos con periodontitis, siendo estos menos abundantes que las células CD3. Aproximadamente la mitad de las células expresando CD68 también expresaron RANKL. En contraste, menos células expresando CD68 fueron identificadas en los tejidos sin periodontitis. Números menores de CD22 fueron identificados en los tejidos con periodontitis, pero RANKL no fue expresado en ninguna de estas células. Anticuerpos para el Factor VIII fueron utilizados para verificar que las células expresando OPG en los vasos sanguíneos eran células endoteliales. Sólo expresión débil de OPG fue asociada con F VIII en células de los tejidos con periodontitis, mientras que en el grupo sano se observó una fuerte expresión por células que expresaban Factor VIII 46. En este estudio, las muestras fueron tomadas durante un procedimiento quirúrgico, los autores no especificaron si los participantes recibieron algún tratamiento previo.
Otras técnicas han sido utilizadas para estudiar el comportamiento de estas proteínas en la enfermedad periodontal. Para determinar las diferencias en la expresión genética de RANKL y OPG en diferentes formas clínicas de enfermedades periodontales, Bostanci et al. 64 estudió mediante PCR cuantitativa a tiempo real, tejidos gingivales de 9 pacientes sanos y 41 pacientes con periodontitis. RANKL no fue detectado en ninguna muestra de tejido sano, pero fue detectado en 25% de muestras de tejidos de pacientes con gingivitis, en 54% de tejidos de pacientes con periodontitis crónica, en 75% de las muestras de tejidos de periodontitis agresiva generalizada y 60% de las muestras de tejidos de pacientes con periodontitis crónica que recibían terapia inmunosupresora. En contraste, todas las muestras de tejidos expresaron niveles detectables de OPG. En comparación con los tejidos sanos, la expresión de RANKL fue significativamente mayor (p < 0.05) en todos los grupos de periodontitis pero no en el grupo con gingivitis. Además, los niveles de RANKL en la periodontitis agresiva generalizada fueron significativamente más altos que en el de periodontitis crónica. Comparado con tejidos sanos, la expresión de OPG fue menor en todos los grupos de tejidos enfermos pero esto fue solo significativamente menor en el grupo de periodontitis crónica. Aún más, los niveles de OPG en periodontitis crónica fueron 16 veces menores que en el grupo de periodontitis agresiva generalizada. Las muestras de tejido sano fueron tomadas en procedimientos de extracción y alargamiento coronario y en el tejido enfermo, previo a la terapia periodontal no quirúrgica 64.
El nivel de ARNm RANKL en periodontitis avanzada fue más alto que en etapas moderadas de la enfermedad o en sitios sanos (Kruskal-Wallis test, p<0.042). Interesantemente, parece que el nivel de ARNm RANKL en periodontitis moderada fue relativamente más bajo que en sitios sanos. Es posible que esto pueda reflejar inflamación moderada en los tejidos gingivales normales obtenidos de sujetos en sitios sanos. Los resultados mostraron que los sitios sanos expresaron mayores niveles de ARNm OPG que en la periodontitis avanzada. El nivel de ARNm OPG en periodontitis moderada fue significativamente menor en comparación con otros grupos. Diferencias significativas fueron encontradas (p<0.05) entre todos los grupos. RANKL es altamente expresado en áreas inflamatorias y está asociado con el aumento del ratio RANKL/OPG comparado con sujetos sanos. Las muestras de tejido obtenidas de individuos enfermos fueron tomadas durante procedimientos de cirugía periodontal, los autores no especificaron si los participantes recibieron otro tipo de terapia periodontal previa 26.
Conclusiones
RANK, RANKL y OPG pueden tener un papel importante en la patogenia de la enfermedad periodontal, así como ha sido demostrado para otras enfermedades que afectan el metabolismo óseo, aún así. Por factores principalmente relacionados a la metodología de las investigaciones encontradas, tales como el momento oportuno de la toma de la muestra, se puede concluir que hace falta más evidencia y con metodología comparable para establecer una relación clara entre estas proteínas y la reabsorción ósea asociada a la periodontitis.











 texto em
texto em