Introducción
La cavidad bucal sirve como ruta de entrada natural de bacterias tanto a los tractos respiratorio y digestivo como al torrente sanguíneo;1 el ser humano presenta hábitat oral microbiano en superficies blandas y superficies duras que ofrecen varias posibilidades para la colonización microbiana; estas superficies presentarán variabilidad dependiendo de las características anatómicas, la disponibilidad de nutrientes, la temperatura, la concentración de oxígeno y la exposición a factores inmunológicos.2 Algunos estudios indican que la pérdida del equilibrio en la simbiosis entre el microbioma bucal y el huésped puede ser vinculada a ciertas enfermedades como: la osteítis alveolar, la amigdalitis, abscesos cerebrales, endocarditis, abscesos hepáticos, neumonía, diabetes y parto prematuro.1,3,4
Las bacterias que componen el biofilm bucal tienen una función decisoria en el desarrollo de las enfermedades bucales de mayor prevalencia como la caries dental y la enfermedad periodontal.1,3,5,6 Los Streptococcus ocupan una amplia gama de hábitats bucales que incluye sitios sin presencia de placa donde se encuentran en mayor abundancia; tienen la capacidad para ser colonizadores eficientes a nivel de múltiples superficies bucales.2,7Streptococcus mitis, Streptococcus sanguinis y Streptococcus gordonii son consideradas bacterias de colonización temprana que dan originen a la formación de biofilm en la superficie de los dientes, esta es seguida por la colonización tardía de bacterias patógenas como Streptococcus mutans, Veillonella spp. y Fusobacteria spp.7
Streptococcus sanguinis es una bacteria comensal de tipo anaerobio facultativo Gram positivo que abunda en el biofilm bucal y se asocia particularmente con una biopelícula de placa sana.3,5,8 Es un colonizador primario del biofilm bucal que favorece la unión de organismos sucesivos;4,6) siendo los 9 meses la edad media de colonización por S. sanguinis en el niño.3,9 Para dar inicio a la formación de biopelículas se adhiere a través de fimbrias a múltiples componentes salivales entre ellos la α-amilasa salival,3,8 la adhesión de los componentes salivales como la α-amilasa salival puede ayudar a que S. sanguinis se adhiera a la hidroxiapatita presente en las superficies de los dientes e inicie la formación de biopelículas en la cavidad bucal.3 Para sobrevivir es capaz de emplear una amplia gama de fuentes de hidratos de carbono.3 A nivel sistémico, el ingreso de Streptococcus sanguinis al torrente sanguíneo puede actuar como un patógeno oportunista y si logra colonizar una válvula cardíaca dañada puede conducir a una endocarditis infecciosa.10
Xilitol es un alcohol de azúcar natural, que deriva principalmente del abedul y otros árboles de madera dura.11 Está presente en algunas frutas y vegetales cuyo consumo en la dieta como substituto del azúcar es aprobado en muchos países y actualmente es añadido como edulcorante en varios productos comerciales tales como: las gomas de mascar, los caramelos, los cosméticos, los productos de higiene oral.12 Además, tiene las peculiaridades de: ser bajo en calorías, no es metabolizado por la mayoría de las bacterias orales y posee propiedades anticariogénicas.11,13 A pesar que se conoce poco sobre el mecanismo de acción del xilitol sobre las bacterias patógenas, existe evidencia que afirman su acción preventiva en varias enfermedades sobre todo en la caries dental.11,12 La dosis diaria tolerable de xilitol es hasta 200 g en adultos y 45 g en niños; mientras que la dosis diaria empleada en la prevención de la caries dental es de 4 a 20 g.14 También, su consumo a corto plazo se asocia con una disminución del Streptococcus mutans en la saliva, en el biofilm y en su transmisión de madres a hijos.11
En este estudio se evaluó in vitro los efectos del xilitol en el crecimiento bacteriano frente a Streptococcus sanguinis.
Métodos
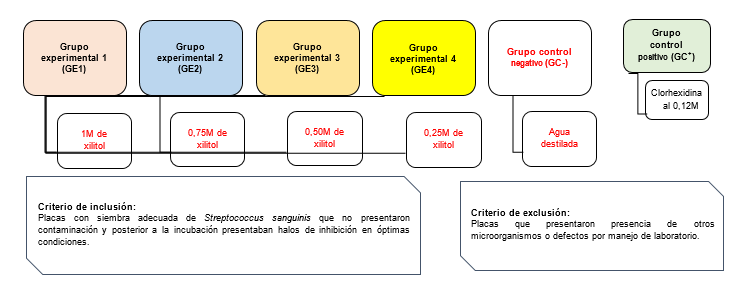
Este estudio fue de tipo longitudinal, prospectivo; con diseño cuasiexperimental. El marco muestral estuvo conformado por 105 repeticiones de inoculaciones de cepas de Streptococcus sanguinis contenidas en 15 placas Petri con 21 repeticiones en cada grupo (Gráfico 1).
El microorganismo Streptococcus sanguinis (ATCC 10556) se obtuvo del laboratorio Gen Lab del Perú S.A.C. Durante el desarrollo de este estudio se actuó con ética y se siguieron fielmente las precisiones contenidas en el Certificado de análisis: especificaciones y rendimiento de microorganismos liofilizados otorgados por el laboratorio proveedor, así como, en todo momento se puso en práctica las medidas de bioseguridad pertinentes para evitar una contaminación bacteriana.
En la preparación, se disolvió 1M (152,15 g) de xilitol en 100 mL de agua destilada; posteriormente, se obtuvieron diferentes volúmenes que fueron colocadas en tubos de prueba estériles rotuladas para cada grupo experimental. Para el GE1 se tomó 10 mL de la disolución (1M/100mL); para el GE2 se tomó 7,50 mL de la disolución (1M/100mL) y se agregó 2,50 mL de agua destilada; para el GE3 se tomó 5 mL de la disolución (1M/100mL) y se agregó 5 mL de agua destilada y; para el GE4 se tomó 2,50 mL de la disolución (1M/100mL) y se agregó 7,50 mL de agua destilada.
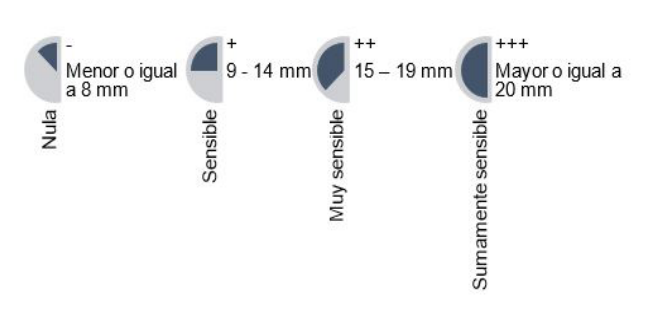
Para la activación y siembra del Streptococcus sanguinis se preparó el medio de cultivo de agar Mitis salivarius (Difco Agar Mitis Salivarius). En la siembra se empleó el método de estrías por agotamiento y para la Prueba de Susceptibilidad Microbiana se empleó el Método de Difusión en Agar Según Kirby Bauer.15 Una vez posicionados los discos de papel filtro se suministró a cada grupo experimental 10 µL de las disoluciones de 1M; 0,75M; 0,50M y 0,25M de xilitol respectivamente. Mientras que, en el grupo control negativo se suministró 10 µL de agua destilada y en el grupo control positivo se suministró 10 µL de clorhexidina al 0,12M. Una vez selladas y rotuladas las placas Petri fueron llevadas a la incubadora a una temperatura de 37°C por 24 y 48 horas antes del análisis. La determinación del efecto inhibitorio se hizo mediante la Escala de Duraffourd13 (Gráfico 2).
Para el procesamiento y análisis estadístico de los datos se utilizó el programa Excel y el software estadístico Infostat. Para el cálculo de la diferencia entre la media de los promedios y la variabilidad del halo de inhibición de los diferentes grupos, así como, la diferencia significativa entre los grupos de acuerdo al tiempo de exposición, se hizo mediante las pruebas t-Student para una muestra, análisis estadístico de varianza (ANOVA) y contraste Tukey.
Resultados
Diferentes concentraciones de xilitol (0,25M; 0,50M; 0,75M y 1M) causaron un halo de inhibición en el crecimiento de Streptococcus sanguinis entre 9,89 - 12,89 mm (24 horas) y 10,85 - 13,45 mm (48 horas), este halo de inhibición se incrementó a mayor tiempo de exposición. El control negativo mantuvo la medida del diámetro del disco de sensibilidad en 6 mm y el control positivo ocasiono un halo de inhibición de 16,19 - 19,80 mm a las 24 y 48 horas (Tabla 1).
Tabla 1: Comparación in vitro de los efectos del xilitol en el crecimiento bacteriano frente a Streptococcus sanguinis a las 24 y 48 horas
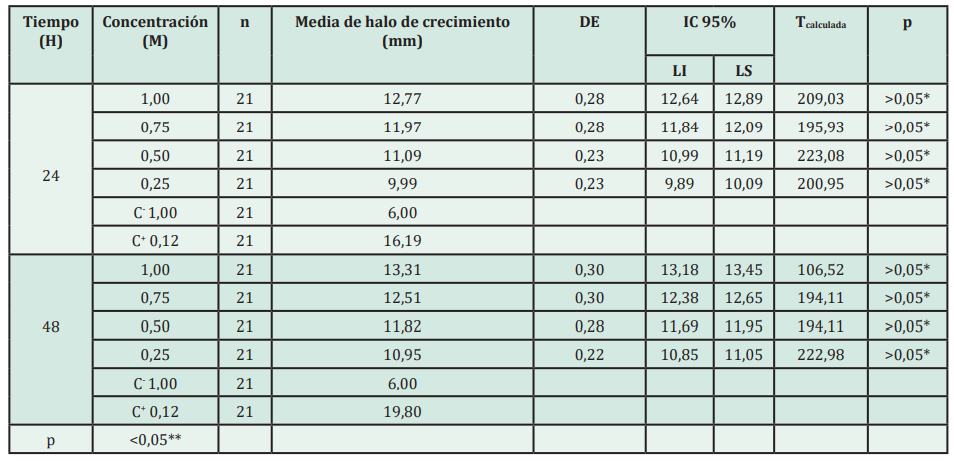
DE: desviación estándar; IC: intervalo de confianza; LI: límite inferior; LS: límite superior; C-: Control negativo, C+: Control positivo, *Significancia p (t Student para una muestra), **Significancia p (ANOVA).
La prueba t Student para una muestra, demostró que los datos referidos a los halos de inhibición en el crecimiento de Streptococcus sanguinis eran homogéneos en los grupos con concentraciones de xilitol (0,25M; 0,50M; 0,75M y 1M) a las 24 y 48 horas (p > 0,05*). Mientras que, el análisis estadístico de varianza (ANOVA) entre las medias de todos los grupos estudiados mostraron que existe diferencia estadística significativa de los efectos inhibitorios en el crecimiento bacteriano de Streptococcus sanguinis (coeficiente de variación 2,18 y p < 0,05**). Por lo que, se sometió a contraste de grupos mediante la prueba Tukey cuyo resultado fue favorable para el grupo control positivo seguido de las disoluciones de xilitol de 1M (48 horas); 1M (24 horas) y 0,75M (48 horas); 0,75M (24 horas) y 0,50M (48 horas); 0,50M (24 horas) y 0,25M (48 horas) y; 0,25M (24 horas) (alfa = 0,05; DMS = 0,28 y gl = 200). Es decir, diferentes concentraciones de xilitol ocasionan inhibición en el crecimiento de Streptococcus sanguinis a las 24 y 48 horas. Además, a mayor concentración de xilitol mayor es el efecto de inhibición en el crecimiento.
Discusión
En la cavidad bucal, los microorganismos presentan una capacidad simbiótica y una relación con el huésped apoyada en favores mutuos, como es el no causar perjuicios a nivel bucal y consentir que las poblaciones comensales restrinjan a las especies patógenas la adhesión a las superficies de la cavidad bucal.7 Es así que las especies del género Streptococcus mayoritariamente se encuentra en las superficies de la mucosa oral,2,3 en la saliva humana,1,3 en las superficies de los dientes y a nivel supragingival e infragingival.3,9 Algunos estudios describen al Streptococcus sanguinis como una especie que se asocia significativamente con la salud dental;3,5,9 además, junto al Streptococcus mutans son parte importante del biofilm dental y se afectan contrariamente durante el proceso de formación del biofilm. Díaz et al.5 Hu et al.16 Wen et al.17 evidenciaron cual es la influencia del Streptococcus sanguinis en la expresión de genes de virulencia del Streptococcus mutans.
Hay evidencia científica acerca del efecto del xilitol sobre Streptococcus mutans.18,19 La exposición habitual al xilitol genera disminución tanto de la formación de biofilm dental como de los niveles de Streptococcus mutans.20 Este biofilm dental es menos adhesivo por la disminución en los recuentos de Streptococcus mutans y la cantidad de polisacáridos insolubles.21) Cobos et al.12 reconocen los efectos remineralizantes en el esmalte que proviene del xilitol.
Este estudio demostró que existe una sensibilidad inhibitoria en el crecimiento de Streptococcus sanguinis frente a diferentes disoluciones de xilitol (0,25M; 0,50M; 0,75M y 1M) p** < 0,05. Resultados similares obtuvieron Ghezelbash et al.22 quienes emplearon soluciones de xilitol (2% y 4% p/v) en agua destilada y, demostraron con significancia estadística la existencia de disminución en el crecimiento bacteriano en un 57% y 65% respectivamente, mostraron también que posee un efecto inhibidor frente al Streptococcus sanguinis para la formación y adhesión a las biopelículas (p < 0,01). Sahni et al.23 también mostraron significancia estadística una inhibición en el crecimiento de tres cepas de Streptococcus orales (S. mutans, S. salivarius y S. sanguinis), las tres cepas se inhibieron significativamente a concentraciones de xilitol al 12,50% y concentraciones superiores; sin embargo, sólo S. mutans se inhibió significativamente a una concentración de xilitol de 1,56%.
Sin embargo, difiere con lo demostrado por Bahador et al.24 quienes refieren que el consumo de xilitol (70% p/p) en una goma de mascar reduceS. mutansyS. sobrinusen la saliva, aunque no presentó significancia estadística en los recuentos deS. sanguinisyS. mitis, probablemente esa diferencia se debió al diseño del estudio (intervención comunitaria). Marttinen et al.25 también mostraron que no hubo diferencia estadística en el crecimiento de S. sanguinis afectados por xilitol (5%).
Otras investigaciones en las que usaron distintos agentes antimicrobianos para medir el efecto inhibitorio en el crecimiento de Streptococcus sanguinis concuerdan con nuestros resultados. Nasution et al.26 indican que el extracto de hoja de Carambola tiene eficacia antimicrobiana estadísticamente significativa frente a Streptococcus sanguinis (p < 0,05), igual que Lyu et al.27 quienes refieren que el Ácido Ursólico tenía una actividad antimicrobiana estadísticamente significativa frente a Streptococcus orales comunes y una actividad antibiofilm contra bacterias patógenas orales (p < 0,05). Asimismo, Berniyanti y Mahmiyah28 indicaron que la Saponina Aloe Vera Linn puede inhibir el crecimiento de Streptococcus sanguinis, así como, Oda et al.29) concluyeron que el fluoruro de sodio (2%) reduce la adhesión de Streptococcus a las superficies de los pilares de los implantes de titanio y zirconia (p < 0,01). También, Cheng et al.30 encontraron diferencias estadísticas en que la pasta de dientes que contiene de fluoruro estañoso (0,45%) favoreció el crecimiento excesivo de S. sanguinis en la biopelícula (p < 0,05).
En conclusión, diferentes concentraciones de xilitol tienen un efecto inhibitorio sobre el crecimiento de Streptococcus sanguinis tanto a las 24 como 48 horas, mostrando un mayor efecto a las 48 horas y en mayores concentraciones.











 texto en
texto en