Introducción
La hipoxia es un estado de deficiencia del oxígeno necesario para llevar a cabo los procesos metabólicos requeridos por las células. El nivel de oxígeno es uno de los parámetros fundamentales del microambiente que rodea a las células, tanto in vitro como a nivel tisular, por lo que una disminución de éste puede llevar a condiciones que impactan profundamente tanto en la fisiología celular como en la homeostasis tisular. A nivel molecular, una disminución de la disponibilidad de oxígeno necesario para las células lleva a la activación de factores de transcripción conocidos como “Factores inducidos por Hipoxia” (HIFs - Hypoxia-inducible factors). Particularmente, HIF-1 es un complejo proteico compuesto por dos subunidades, HIF-1α y HIF-1β1). Este heterodímero se encuentra inactivo cuando hay abundante oxígeno y, por el contrario, es activado en condiciones de hipoxia 2). Su función como factor de transcripción es la de aumentar la transcripción de determinados genes que codifican para proteínas que participan en diferentes procesos celulares como la proliferación celular y el metabolismo energético. De esta forma, HIF-1 permite a las células adaptarse a condiciones adversas, como es el caso de las células alteradas por patologías inflamatorias y por formación de tumores 3). A su vez, se ha visto que la hipoxia, particularmente por la expresión de los factores de transcripción HIFs, tiene un rol muy importante en la diferenciación terminal de los queratinocitos, regulando la queratinización de las células epiteliales de la epidermis 4). A nivel tisular, el estado de hipoxia se encuentra frecuentemente asociado a procesos inflamatorios, pudiendo ser tanto un desencadenante de la inflamación como una consecuencia de ésta 2. Se ha visto que es un factor fundamental en el proceso de génesis tumoral y en el desarrollo de los tumores. En diversos tipos de cáncer, como por ejemplo el cáncer oral, se ha observado que los marcadores de hipoxia aumentan a medida que se incrementa el grado de displasia de la mucosa oral hasta llegar a la formación de un carcinoma oral 5). Por otra parte, la hipoxia también conduce a la reprogramación metabólica de las células tumorales, que adquieren un fenotipo más glucolítico, secretando lactato y produciendo por ende una marcada acidificación del medio extracelular, que ha sido detectada asimismo en cáncer oral 6).
Para comprender el proceso por el que la mucosa oral puede llevar a lesiones precursoras de cáncer oral, y al cáncer en sí mismo, es necesario comprender la composición de la misma. La mucosa oral está constituida por tejido epitelial y tejido conjuntivo. Dentro de la misma, se diferencia y clasifica a la mucosa oral de acuerdo a las funciones que cumple. Es así que en la cavidad oral existen tres tipos de mucosa: la mucosa oral masticatoria, la mucosa oral especializada y la mucosa oral de revestimiento. La primera recubre al paladar y las encías, la segunda es la que recubre la superficie dorsal de la lengua, y la mucosa de revestimiento es la que recubre la superficie interna de las mejillas, la superficie ventral de la lengua, el piso de la boca y la superficie interna de los labios. El tejido epitelial de la mucosa oral, al igual que la epidermis, es un epitelio escamoso estratificado con una capa basal y una capa espinosa, y las células que lo componen son los queratinocitos 7). El Liquen Plano Oral (LPO) es una patología inflamatoria, autoinmune, que afecta el tejido epitelial de la mucosa oral. Se trata de una patología crónica con una gran relevancia clínica. Se estima que el liquen plano oral afecta hasta un 4% de la población mundial 1). De etiología aún no bien definida, hay evidencias de que en el LPO se podría producir un ataque autoinmunológico por parte de linfocitos T citotóxicos a las células epiteliales de la mucosa oral 8). Clínicamente se caracteriza por la presencia de lesiones a nivel de la mucosa oral como manchas blancas reticuladas y elevadas, manchas rojas con edemas, así como llagas abiertas, que pueden causar ardor o dolor. Estas lesiones pueden aparecer en la mucosa que comprende el interior de las mejillas, siendo ésta la ubicación más frecuente, así como en el tejido interno de los labios, las encías, el paladar y la lengua 8). Desde el punto de vista histológico, el LPO se caracteriza por un denso infiltrado de linfocitos T a nivel del epitelio oral, un aumento de las capas superficiales de queratinocitos terminalmente diferenciados y degeneración de los queratinocitos de la capa basal del epitelio oral 9). Existen evidencias de su asociación con el desarrollo de cáncer, específicamente de carcinoma oral de células escamosas (OSCC - Oral squamous cell carcinoma). Se ha demostrado a través de varios estudios que pacientes diagnosticados de LPO han desarrollado OSCC 1). Incluso, pacientes con carcinoma oral desarrollado a partir de OLP presentan un mayor riesgo frente a los que no presentan un diagnóstico proveniente de LPO, debido a que se ha visto un mayor aumento de la metástasis.1 Por estos motivos es que la OMS ha clasificado a esta patología como una condición precursora del carcinoma oral y se la ha reconocido como una patología oral potencialmente maligna (OPMD - Oral potentially malignant disorder)1). De acuerdo a investigaciones realizadas sobre el mecanismo de transformación, se ha visto que la inflamación crónica en LPO estaría involucrada en la tumorigénesis y en el desarrollo de los tumores. A su vez, otra característica del microambiente tumoral de la que hay evidencia de su existencia en LPO, es un microambiente hipóxico 1). Sin embargo, la presencia de marcadores de hipoxia en esta patología aún no ha sido estudiada en profundidad.
En este trabajo se utilizó la línea celular HaCaT, que consiste en queratinocitos humanos inmortalizados no transformados derivados del tejido epitelial de la epidermis. Esta línea celular es ampliamente utilizada en investigaciones sobre tejido epitelial por su alto potencial para diferenciarse y proliferar en cultivos celulares in vitro10). La epidermis es un tejido muy similar al epitelio de la mucosa oral, por lo que la línea celular HaCaT ha sido utilizada frecuentemente como modelo de queratinocitos orales en estudios in vitro de biología celular oral 11). Debido a la evidencia de un microambiente hipóxico en LPO, en este trabajo se recapitulará dicho micraoambiente en la línea celular HaCaT empleando la variante del modelo “Hipoxia inducida por cubreobjetos”12. Dicha variante del método fue diseñada por Arocena y colaboradores 13), y consiste en cubrir una pequeña placa de cultivo con un cubreobjetos de acrílico con un pocillo en el centro, al igual que el método original, pero con un cubreobjetos perforado en el centro (figura 1), de forma que la difusión de oxígeno a todas las células presentes en el pocillo de la placa solo ocurre a través de dicha perforación, en el centro de la misma. De esta manera, se puede evidenciar las diferencias entre las células que se encuentran en el centro de la placa, zona donde se encuentra la única entrada de oxígeno, con respecto a las que se encuentran alejadas de la entrada de oxígeno, zonas periféricas de la placa 13.
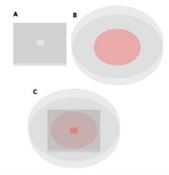
Figura 1: Esquema de la variante del método “Hipoxia inducida por cubreobjetos” tomado de Arocena et al., 2019 13
Materiales y métodos
Línea celular de estudio
La línea celular empleada fue HaCaT, que corresponde a queratinocitos humanos inmortalizados espontáneamente, no transformados. Éstos, fueron mantenidos en el medio de cultivo DMEM low glucose (Dulbecco’s modified Eagle’s medium) con 10% de SFB y antibióticos (Penicilina, Estreptomicina y Anfotericina), e incubados a 37ºC y 5% de CO2. Se realizaron pasajes de las células por tripsinización cada vez que las mismas alcanzaron la confluencia.
Método de inducción de un microambiente hipóxico in vitro mediante la variante por cubreobjetos
El método utilizado para inducir a los queratinocitos a un microambiente hipóxico es una variante del modelo “Coverslip Hypoxia” o “Hipoxia inducida por cubreobjetos”, que consiste en cubrir las placas de cultivo celular con cubreobjetos de acrílico perforados en el centro. A las 24 horas de haber realizado el pasaje de las células a las placas, se agregó el cubreobjetos de acrílico perforado en el centro. Una placa se utilizó como control, por lo que no se le agregó un cubreobjetos para no inducirles a las células un microambiente hipóxico. Estas placas conteniendo los cultivos celulares, con el cubreobjetos y sin cubreobjetos, fueron incubadas a 37ºC y 5% de CO2, por un tiempo de 48 horas.
Observación de la morfología de las células por microscopía de contraste de fases
Las células incubadas con y sin el cubreobjetos luego de 48 horas, fueron observadas mediante microscopía de contraste de fases. Para ello se utilizó un microscopio invertido Nikon Diaphot, y objetivos de contraste de fase de 10X y 20X, perteneciente al Instituto de Investigaciones Biológicas Clemente Estable (IIBCE).
Observación de cambios morfológicos de las células por microscopía confocal
Para la visualización de cambios morfológicos a nivel del citoesqueleto de las células, se realizó un marcado con la sonda fluorescente de detección de filamentos de actina, faloidina conjugada a Alexa Fluor 488. Para ello, se fijaron las células HaCaT con cubreobjetos con PAF 4% y se las incubó por 10 minutos a temperatura ambiente, y pasados los 10 minutos se las lavó con PBS 1X. Luego del último lavado, se realizó la tinción de las células con faloidina conjugada a Alexa Fluor 488 (Invitrogen, Waltham, MA) a una dilución de 1/200, y se las dejó incubando por 30 minutos. Se realizaron tres lavados con 500 µL de PBS 1X, de 5 minutos cada uno. Luego de descartar el PBS del último lavado, se agregó DAPI (Invitrogen) a una dilución 1/1000 para teñir los núcleos, y se incubó durante 15 minutos en oscuridad a temperatura ambiente. Finalmente las células fueron observadas mediante microscopía de fluorescencia en el microscopio confocal Zeiss LSM 800 del Instituto de Investigaciones Biológicas Clemente Estable (IIBCE).
Inmunocitoquímica con el kit Hipoxyprobe in vitro
Para evaluar la presencia de la hipoxia inducida en las células de estudio, se empleó la técnica de inmunocitoquímica utilizando un kit de detección de hipoxia denominado Hipoxyprobe (Hypoxyprobe, Burlington, MA). Para esto se incubó a las células HaCaT con cubreobjetos por 48 horas y luego se les añadió pimonidazol, un nitroimidazol que forma aductos con proteínas a bajos niveles de oxígeno intracelular,, a una concentración final de 200 µM, durante 2 horas. Luego se fijó las células con PAF 4% y se las incubó por 10 minutos a temperatura ambiente, y pasados los 10 minutos se las lavó con PBS 1X. Se permeabilizó las placas con 200 µL de Tritón al 0,1% durante 5 minutos. Luego, se agregó 200 µL de BSA como bloqueante y se incubaron las placas durante 30 minutos a temperatura ambiente. Finalmente se agregó 2 µL de un anticuerpo, que reconoce los aductos proteicos de pimonidazol, conjugado a un fluoróforo (Hypoxyprobe Red Mab Dylight 549 Mab), y se dejó incubando la placa toda la noche a 4ºC. Luego de descartar el PBS del último lavado, se agregó DAPI (Invitrogen) en una dilución de 1/1000 para teñir los núcleos, y se incubó durante 15 minutos en oscuridad a temperatura ambiente. Finalmente las células fueron observadas mediante microscopía de fluorescencia por el microscopio confocal Zeiss LSM 800.
Inmunocitoquímica con GLUT1 in vitro
Se evaluó la presencia del marcador de hipoxia GLUT1 in vitro mediante inmunocitoquímica. Para ello se fijaron las células HaCaT con cubreobjetos con PAF 4%, y se las incubó por 10 minutos a temperatura ambiente. Se realizaron lavados con PBS 1X, y se permeabilizaron las células con 200 µL de Tritón al 0,1% durante 5 minutos. Luego, se bloquearon con 200 µL de BSA y se incubaron las placas durante 30 minutos a temperatura ambiente. Finalmente se agregó el anticuerpo primario anti-Glut1 (anticuerpo monoclonal de ratón, Santa Cruz), a una dilución de 1/200, y se dejó incubando la placa toda la noche a 4ºC. Se descartó el anticuerpo primario, se realizaron tres lavados con PBS, y luego del último lavado se agregó 200 µL del anticuerpo secundario (anticuerpo anti-ratón conjugado a Alexa Fluor 488, de Invitrogen) diluido en BSA (dilución 1:1000 - 0,5 µL de anticuerpo secundario en 450 µL de BSA) y se las dejó incubando durante una hora a temperatura ambiente en oscuridad. Luego de descartar el anticuerpo, se realizaron tres lavados con 500 µL de PBS 1X, de 5 minutos cada uno. Luego de descartar el PBS del último lavado, se agregó DAPI (Invitrogen) 1/1000 para teñir los núcleos, y se incubó durante 15 minutos en oscuridad a temperatura ambiente. Finalmente las células fueron observadas mediante microscopía de fluorescencia por el microscopio confocal Zeiss LSM 800.
Marcado con la sonda fluorescente Nile Red in vitro
Para la detección de lípidos se realizó un marcado con la sonda fluorescente Nile Red (Invitrogen, Waltham, MA), la cual tiñe las gotitas lipídicas que se forman intra-celularmente. Con este objetivo, se fijó las células HaCaT con cubreobjetos con PAF 4% y se las incubó por 10 minutos a temperatura ambiente. Una vez pasados los 10 minutos se las lavó con PBS 1X. Luego se realizó la tinción de las células con la sonda Nile Red a una concentración de 0,1 μg/ml y se las dejó incubando por 15 min. Se realizaron tres lavados con PBS 1X, de 5 minutos cada uno. Luego de descartar el PBS del último lavado, se agregó DAPI (Invitrogen) a una dilución de 1/1000 para teñir los núcleos, y se incubó durante 15 minutos en oscuridad a temperatura ambiente. Finalmente las células fueron observadas mediante microscopía de fluorescencia por el microscopio confocal Zeiss LSM 800. Esta sonda de detección de lípidos, Nile Red, tiene distintos picos de emisión/excitación, según si se une a lípidos neutros o a fosfolípidos, emitiendo en verde para lípidos neutros y en naranja/rojo para fosfolípidos. La fluorescencia de Nile red se detectó con excitación/emisión de 510/582 nm para detectar lípidos neutros, y de 540/624 nm para detectar fosfolípidos 13,14).
Inmunohistoquímica con GLUT1 in vivo
Se evaluó mediante inmunohistoquímica la expresión del marcador de hipoxia GLUT1 en epitelio oral, utilizando cortes histológicos provenientes de biopsias de pacientes con Liquen Plano Oral y de Hiperplasia fibrosa, siendo este último utilizado como control positivo, dispuestas por la Cátedra de Patología Molecular de la Facultad de Odontología. Se utilizaron 6 láminas en total, de las cuales 3 corresponden a biopsias de liquen plano oral, y las otras 3 a Hiperplasia Fibrosa. Primeramente se desparafinaron los preparados en horno a 60°C durante 60 minutos, y luego en Xilol durante 5 minutos. Seguidamente se realizó la hidratación de los preparados en el tren de hidratación, realizando 15 baños para cada uno desde Xilol al 100% hasta agua destilada. Luego se realizó el desenmascaramiento de los preparados en una olla a presión. Se los dejó enfriar durante 8 minutos después de la salida de presión, y luego se los dejó reposando durante 10 minutos en agua corriente. Pasado ese tiempo, se realizaron tres lavados con agua destilada, se dejó los preparados en peróxido de hidrógeno al 0.9% durante 5 minutos, y luego se realizaron tres lavados más con agua destilada. Se montaron las láminas en los racks y “coverplates” correspondientes, se realizó un lavado con PBS 1X durante 5 minutos y pasado ese tiempo se agregó 2 gotas a cada lámina de un bloqueador de peroxidasa (Mouse/Rabbit Immuno detector Peroxidase Blocker) y se lo dejó actuar durante 5 minutos. Luego de varios lavados, se agregó a cada lámina 100 µL del Ac primario Glut-1, el mismo que fue utilizado para la inmunocitoquímica in vitro, (dilución 1:100 con diluyente Da Vinci Green Diluent) y se dejó incubando durante 1 hora. Se lavó con PBS durante 5 minutos, y luego se añadió 2 gotas a cada lámina del Ac secundario anti-ratón con Biotina, y se lo dejó incubando por media hora a temperatura ambiente. Pasada la media hora se realizó otro lavado con PBS 1X durante 5 minutos y luego se agregó 2 gotas a cada lámina del detector inmunológico de Mouse/Rabbit ImmunoDetector HRP Brown y se dejaron las láminas incubando durante media hora. Se realizó un nuevo lavado con PBS 1X durante 5 minutos, se sacaron las láminas de los “coverplates” y se agregó aproximadamente 5 mL del revelador DAB (diaminobencidina) y se las dejó incubando durante 5 minutos. Luego se enjuagaron las láminas con agua destilada y agua corriente por 5 minutos. Pasados los 5 minutos se coloca las láminas en Hematoxilina por 2 minutos, se enjuagan nuevamente en agua destilada y agua corriente por aproximadamente 3 minutos, y se realiza la deshidratación (15 baños desde agua destilada hasta alcohol Xilol al 100 %). Se dejan secar las láminas y luego se montan con una gota de Entellan en cada lámina y un cubreobjetos. Finalmente se observaron las láminas al microscopio Nikon Eclipse Ci de la cátedra de Patología molecular de la Facultad de Odontología de la UdelaR, equipado con una cámara digital Nikon Ds-Fi2.
Resultados
Observación de cambios morfológicos de las células HaCaT sometidas a hipoxia inducida por cubreobjetos
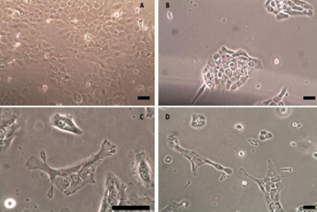
Mediante microscopía de contraste de fases, se observaron las diferencias morfológicas de las células control, que no contenían cubreobjetos, y la morfología de las células que se encuentran en estado de hipoxia inducida por cubreobjetos. Al observar las células por microscopía de contraste de fases se visualizaron diferencias morfológicas con respecto a su ubicación en la placa (figura 2). Las células que se encuentran en las regiones periféricas (figuras 2C y 2D) presentan una forma más alargada y estirada, con respecto a las observadas en el centro de la placa, donde se encuentra la entrada de oxígeno (figura 2B) y, sobretodo, con respecto a las células control, a las que no se les indujo hipoxia (figura 2A).
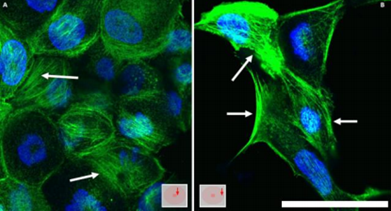
En base a los cambios morfológicos observados por microscopía de contraste de fases en la condición de hipoxia inducida, se estudió más en profundidad la morfología celular mediante la visualización del citoesqueleto de actina, empleando la sonda Faloidina, la cual detecta actina filamentosa. Dicha sonda está conjugada a un fluoróforo (Alexa Fluor 488), por lo que, a través de microscopía confocal, fue posible observar las células marcadas, y así visualizar los cambios morfológicos de las mismas. Como resultado de dicho marcaje, se vio que sobre las zonas periféricas de la placa, las células presentan una señal más intensa de los filamentos de actina (figura 3B) con respecto a las células que se encuentran cerca de la entrada de oxígeno, en el centro de la placa (figura 3A). A su vez, se observa que dichas filamentos de actina se encuentran en fibras de estrés prominentes en las células de las regiones periféricas (figura 3B), con respecto a las observadas en el centro de la placa (figura 3A).
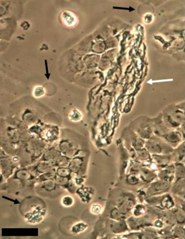
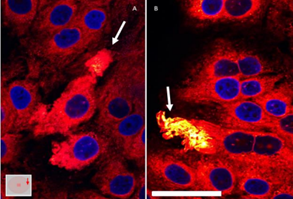
Como resultado observado del microambiente hipóxico inducido en dichas células, se detectó un aumento en la queratinización o cornificación de las células que se encuentran más alejadas de la entrada de oxígeno, observándose células con envolturas córneas (figura 4). La formación de estas envolturas cornificadas, de acuerdo a estudios anteriores, es un evento típico y muy importante de la diferenciación terminal de los queratinocitos 15). Se observó a lo largo de todo el estudio que, 48 horas después de poner el cubreobjetos a las placas, se observaron elementos de cornificación mediante microscopía de contraste de fases, y que estos aumentaban a lo largo de los días. Esta característica observada en las células que se encuentran en un microambiente más hipóxico, se pudo constatar también con el marcador fluorescente de lípidos, Nile Red (ver más adelante, figura 7).
Detección de hipoxia mediante el marcador pimonidazol in vitro en células HaCaT sometidas a hipoxia inducida por cubreobjetos
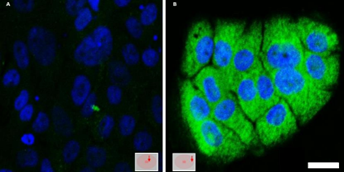
Para la detección de hipoxia en células HaCaT a las que se les indujo un microambiente hipóxico, se realizó una inmunocitoquímica con la sonda pimonidazol. Ésta, forma aductos proteicos, mayoritariamente con proteínas que presentan grupos tioles, cuando los niveles de oxígeno son muy bajos (pO2<10mmHg). Dichos aductos son reconocidos mediante un anticuerpo conjugado a un fluoróforo, por lo que pueden ser visualizados por microscopía confocal16). Por lo tanto, a medida que las células se alejan del centro de la placa se encuentran a niveles de oxígeno cada vez más bajos, y esto se evidencia mediante una mayor señal de pimonidazol hacia las zonas periféricas (figura 5C), y menor señal de la misma en las regiones alejadas de la periferia (figuras 5A y 5B).
Detección de GLUT1 in vitro en células HaCaT sometidas a hipoxia inducida por cubreobjetos
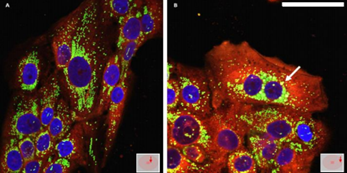
Siguiendo con la caracterización del modelo de inducción de hipoxia, y la identificación de la misma en las zonas alejadas de la entrada de oxígeno a la placa, se realizó una inmunocitoquímica con el marcador de hipoxia GLUT 1. Como resultado de esta inmunofluorescencia, al observar las células a través del microscopio confocal, se obtuvo una marcada señal de GLUT 1 en las regiones periféricas de la placa (figura 6B), no así en el centro de la misma (figura 6A).
Detección de lípidos con el marcador Nile Red in vitro en células HaCaT sometidas a hipoxia
Debido a la observación de mayor cornificación de los queratinocitos, por microscopía de contraste de fases, en las zonas periféricas de la placa con cubreobjetos, se estudió, mediante microscopía confocal, la detección de un un marcador de lípidos de membrana, Nile Red. Dicha sonda se detectó con una excitación/emisión de 510/582 nm (en el caso de lípidos neutros), visualizándose en color verde, y de 540/624 nm en caso de detectar fosfolípidos, en color rojo. Se observó en las regiones periféricas de la placa indicios marcados de queratinización de las células, observándose un comienzo de cornificación con un cúmulo de lípidos (figura 7A), y una cornificación más avanzada (figura 7B), existiendo una correlación con lo observado por microscopía de contraste de fases. Comparando con células HaCaT en el centro de la placa marcadas con Nile Red (figura 8A), las células que se encuentran en la periferia (figuras 7 y 8B) presentan una señal más intensa de lípidos de membrana. También se observó un aumento en la acumulación de gotitas de lípidos neutros en las zonas periféricas (figura 8B), tal como se ha observado en estudios previos 13), así como una mayor intensidad de señal tanto de lípidos neutros como de lípidos de membrana.
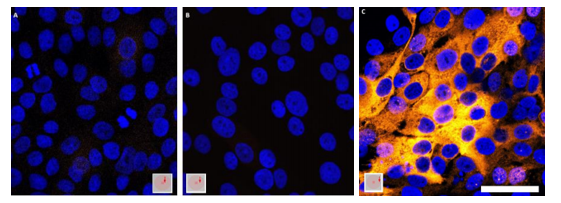
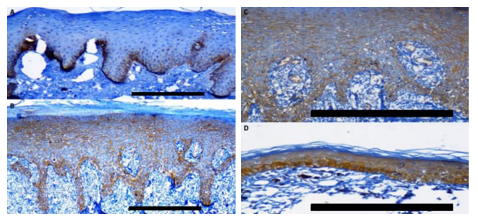
Detección de GLUT1 in vivo en preparados de Liquen Plano Oral
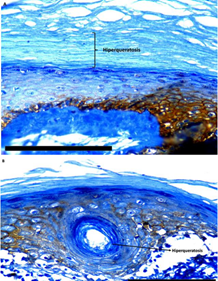
Mediante la técnica de inmunohistoquímica se llevó a cabo el estudio in vivo de queratinocitos de la mucosa oral en el contexto de la patología Liquen Plano Oral, para la búsqueda del marcador de hipoxia GLUT 1, utilizando como control positivo preparados de Hiperplasia Fibrosa. Realizando la observación al microscopio de los diferentes preparados, se obtuvo como resultado una marcada expresión de GLUT 1 en todos los preparados de Liquen Plano Oral (figuras 9A, 9B y 9C). Se observó a su vez un marcado aumento de la queratinización en el epitelio oral de Liquen Plano Oral, lo cual se correlaciona con los resultados obtenidos de los estudios in vitro de queratinocitos humanos (figura 10). En la figura 10A se puede apreciar una extensa capa córnea, y en la figura 10B se visualiza una zona interna del epitelio cornificada.
Discusión
Observación de cambios morfológicos de las células HaCaT sometidas a hipoxia inducida por cubreobjetos
Los resultados obtenidos al observar las células por microscopía de contraste de fases se condicen con los esperados, dado que las células que se encuentran en la región central están ubicadas en la zona de entrada de oxígeno, donde se encuentra la perforación del cubreobjetos, y, por lo tanto, no deberían encontrarse en condiciones muy altas de hipoxia. A medida que la distancia entre las células y el centro de la placa va aumentando, hacia las zonas periféricas, va disminuyendo progresivamente el nivel del oxígeno, por lo que las células que se encuentran más alejadas de la zona central, en la periferia, son las que reciben menos oxígeno y, por lo tanto, las que deberían encontrarse en un ambiente más hipóxico, tal como se ha observado (ver figura 5), por lo que cabe suponer que dicho ambiente alterado se correlaciona con los cambios morfológicos observados. 17). Éstos se confirman con la observación de las células mediante microscopía confocal para la visualización del citoesqueleto de actina, y está en acuerdo con observaciones previas de acumulación de fibras de estrés en hipoxia 17.
A su vez, se ha observado que, como parte del proceso de diferenciación terminal de los queratinocitos, al formarse la capa córnea, se forman “burbujas’’ alrededor de las células queratinizadas (figura 4, señaladas con flechas). Estas “burbujas’’ son vesículas que se excretan de las células terminalmente diferenciadas donde contienen sus componentes citoplasmáticos que son secretados en el espacio extracelular, posiblemente para ser reutilizados por otras células 15;18). La observación de estas vesículas y las envolturas córneas en células expuestas a un ambiente hipóxico sugiere que la hipoxia es un factor que estimula la diferenciación terminal de los queratinocitos, como ya se ha observado previamente 4).
Detección de hipoxia mediante el marcador pimonidazol in vitro en células HaCaT sometidas a hipoxia inducida por cubreobjetos
Al observar a las células HaCaT en un microambiente hipóxico, marcadas con pimonidazol, por microscopía confocal, se obtuvieron los resultados que se esperaban, dado que las células que se encuentran alejadas de la única fuente de oxígeno, se encuentran en estado de hipoxia, a diferencia de las células que se encuentran en el centro de la placa, validando así la variante utilizada del método “hipoxia inducida por cubreobjetos” para estas células.
Cabe destacar que, esta sonda de detección de hipoxia, pimonidazol, detecta niveles de hipoxia extremadamente altos. Es decir, el mismo forma aductos proteicos a niveles de oxígeno muy por debajo de lo normal (pO2 < 10mmHg) 13;16, lo que significa que en las zonas intermedias de la placa, cuando comienza a aumentar la distancia de la zona central, ya podría existir un microambiente hipóxico o pre-hipóxico, pero que no fuera lo suficientemente hipóxico como para ser detectado por la formación de aductos proteínas-pimonidazol.
Detección de GLUT1 in vitro en células HaCaT sometidas a hipoxia inducida por cubreobjetos
A través de la observación de las células HaCaT en un microambiente hipóxico, marcadas con GLUT1, por microscopía confocal, se obtuvieron los resultados esperados, que se condicen con los obtenidos mediante la marcación con pimonidazol, confirmando así que las células que se encuentran alejadas de la única fuente de oxígeno, se encuentran en estado de hipoxia y, por lo tanto, con mayor expresión de GLUT1.
Detección de lípidos con el marcador Nile Red in vitro en células HaCaT sometidas a hipoxia
Los resultados obtenidos a partir de la marcación de las células con Nile Red, confirman lo observado por contraste de fases respecto al aumento de la queratinización en un ambiente hipóxico. Por otra parte, el aumento observado en la intensidad de marcación de gotitas lipídicas conteniendo lípidos neutros en un ambiente hipóxico es similar a lo que se ha observado previamente en otros tipos celulares sometidos a hipoxia 13,19
Detección de GLUT1 in vivo en preparados de Liquen Plano Oral
Como se ha mencionado anteriormente, la patología Liquen Plano Oral presenta un microambiente alterado, eventualmente hipóxico, al igual que el microambiente de las células tumorales. De hecho, es una patología precursora de carcinoma oral. Este aumento en la expresión de GLUT 1 va en la línea de hallazgos previos de otros estudios que reportan que la hipoxia contribuye a la patogenia de esta enfermedad 20,21).
Todos estos datos sugieren la existencia de un microambiente en el Liquen Plano Oral donde está inducida la expresión de GLUT 1 y, a su vez, hay un aumento de la queratinización acompañada de diferenciación terminal de los queratinocitos. Esto es similar a lo que hemos observado en el microambiente hipóxico in vitro, y dicha correlación sugiere entonces que las alteraciones en el epitelio oral de Liquen Plano Oral podrían tener su origen, en parte, debido a la presencia de un microambiente hipóxico in vivo.
Conclusiones
A partir de este trabajo se logró detectar los marcadores de hipoxia, pimonidazol y GLUT 1, en queratinocitos humanos utilizados como modelo de la mucosa oral y sometidos a un microambiente hipóxico in vitro, a través de la variante del método hipoxia inducida por cubreobjetos. Además, se detectaron marcados cambios morfológicos en las células como respuesta al microambiente hipóxico inducido, así como una notable presencia de cornificación como parte de la diferenciación terminal de los queratinocitos. También se ha detectado una marcada expresión del marcador de hipoxia GLUT 1 en tejido epitelial de la mucosa oral en Liquen Plano Oral in vivo. Por otra parte observamos un marcado aumento de la cornificación en la mucosa oral en Liquen Plano Oral, no solamente en la región más externa (capa córnea) sino también en regiones basales (queratinización ectópica). Nuestros resultados sugieren una correlación entre las alteraciones detectadas en queratinocitos humanos inducidos a un microambiente hipóxico in vitro y las alteraciones detectadas in vivo en tejido epitelial de la mucosa oral en el contexto de Liquen Plano Oral, dada por la expresión del marcador de hipoxia GLUT 1, tanto in vitro como in vivo, así como por el aumento de la queratinización. Estos datos son consistentes con la posible presencia de hipoxia en el microambiente de la patología de Liquen Plano Oral. Finalmente, nuestros resultados muestran que la variante de hipoxia inducida por cubreobjetos que hemos empleado, es un método útil para estudiar la respuesta de los queratinocitos de la mucosa oral sometidos a un microambiente hipóxico, así como para correlacionar estas observaciones a la mucosa oral in vivo, en condiciones patológicas.
Limitaciones del estudio
En cuanto al estudio de la detección de la proteína GLUT 1 in vivo en preparados de Líquen Plano Oral (LPO), se utilizó una muestra de 6 LPO, ya que fueron las únicas muestras que se lograron obtener del servicio de Anatomía Patológica de la Facultad. Además dichas muestras eran las únicas que reunían las condiciones óptimas de conservación. Al ser una muestra pequeña de estudio, los resultados obtenidos son preliminares, y por lo tanto al igual que los estudios reportados con tumores raros de baja frecuencia, podemos hablar de una tendencia de los mismos. En estos casos no es recomendado utilizar pruebas estadísticas con un tamaño muestral pequeño. Sin embargo, a pesar de ser pocos casos de LPO, y que esto sea una limitante del estudio in vivo, consideramos que nuestros resultados preliminares in vitro nos permiten apoyar la discusión del artículo.











 texto em
texto em