Introducción
Los tumores odontogénicos (TOs) son entidades patológicas raras que se originan de tejidos odontogénicos o de sus remanentes presentes en los huesos gnáticos 1. Los TOs representan un grupo heterogéneo de patologías que van desde lesiones hamartomatosas hasta neoplasias benignas y malignas, con comportamientos clínicos e histopatológicos muy heterogéneos 2,3. Estas lesiones presentan datos epidemiológicos variables según la región geográfica y la población estudiada, con una prevalencia reportada de menos del 1% entre todos los tumores que afectan la región de cabeza y cuello. La clasificación de los TOs es un tema muy debatido en el escenario científico. La Organización Mundial de la Salud (OMS) publicó su clasificación en ediciones previas (años 1992 y 2005) siendo revisada y actualizada en su última publicación correspondiente al año 20172. Durante las diferentes etapas de estudio de los TOs, se ha intentado simplificar la clasificación de este heterogéneo grupo de lesiones basándose principalmente en su histogénesis 3.
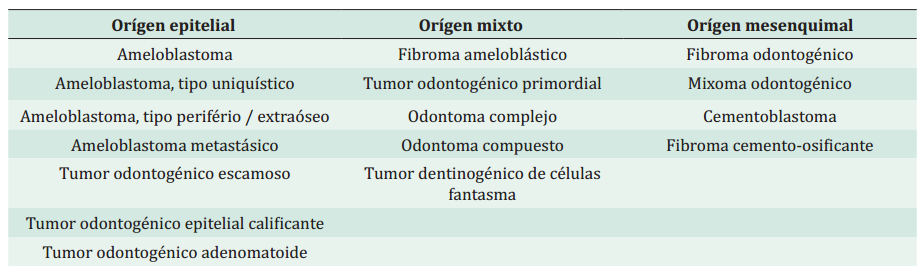
Debido a los avances en los estudios inmunohistoquímicos, en los conocimientos sobre biología molecular y genética, así como en el seguimiento clínico y epidemiológico de los TOs, la OMS en 2017 introdujo modificaciones en su clasificación con el objetivo de descartar subtipos de lesiones que carecían de relevancia clínica 4. Según esta última publicación se diferencian TOs benignos y malignos. Según su origen, los TOs benignos se subdividieron en epiteliales, mixtos (epiteliales y mesenquimáticos) y mesenquimáticos, significativamente más frecuentes que las lesiones odontogénicas malignas 4,5. Los TOs malignos se clasifican en carcinomas, sarcomas y carcinosarcoma oodntogénicos, que se originan de novo o de una lesión odontogénica benigna previa 4. Esta clasificación es dinámica ya que se van incorporando nuevas entidades y eliminando otras, con los avances del conocimiento sobre los TOs (Tabla 1).
Nuevos estudios han investigado las bases moleculares y genéticas de los Tos, enriqueciendo los conocimientos sobre su posible etiopatogenia 6. Se han reportado mutaciones específicas frecuentes en lesiones odontogénicas específicas que tendrían importancia clínica 7-9. Sin embargo, la etiopatogenia de este grupo heterogéneo de lesiones no está completamente establecida en la actualidad. En este contexto, el objetivo de esta revisión narrativa de la literatura fue establecer los aspectos clínico-patológicos y revisar los principales hallazgos de la patología molecular de los TOs, en el contexto de la última clasificación propuesta por la OMS en 2017.
Métodos
Se consultaron las bases de datos electrónicas: PubMed, Web of Science, Embase y Scopus considerando los estudios más importantes de la literatura científica sobre el tema propuesto. El proceso de selección de estudios se realizó considerando los estudios previamente publicados en la literatura sobre los TOs hasta agosto de 2020 (sin fecha de inicio preestablecida). Para la búsqueda se emplearon las siguientes palabras clave: "odontogenic tumors" en una primera etapa; "odontogenic tumors" AND "review" en una segunda etapa y "odontogenic tumors" AND "molecular" en la última etapa. Además, se incorporaron en la búsqueda los términos específicos de cada tipo de TO. Finalmente, se revisaron las referencias secundarias identificadas en la bibliografía de las publicaciones primarias encontradas en las bases de datos. Los artículos se seleccionaron por conveniencia y de forma aleatoria mediante títulos y resúmenes, organizándolos por tema según el tipo de TO estudiado. Los criterios de elección de los artículos se basaron en investigaciones moleculares de los TOs. Cada artículo fue incluido en el grupo respectivo según el tipo de TO para su análisis posterior y extracción de los datos principales.
Revisión de la literatura y discusión
Principales aspectos moleculares y genéticos de los tumores odontogénicos
En distintos estudios se proponen cambios moleculares y genéticos potencialmente involucrados en el desarrollo y progresión de los TOs 3,6. Cambios en oncogenes y en genes supresores de tumores pueden desempeñar un papel en la etiopatogenia de los TOs 10. En esta sección, se presentan algunas evidencias clásicas y recientes de los aspectos moleculares y genéticos de los TOs, destacando la participación de oncogenes, genes supresores de tumores, genes reparadores del ADN, factores de crecimiento, reguladores del ciclo celular, factores apoptóticos, reguladores del desarrollo dentario, moléculas de adhesión celular, proteínas de degradación de la matriz extracelular, factores angiogénicos y citocinas osteolíticas.
Los oncogenes promueven eventos de transformación neoplásica mediante la activación de amplificación genética, mutación o translocación, y los productos de estos genes funcionan como factores de crecimiento y receptores de factores de crecimiento, como, por ejemplo, el receptor del factor de crecimiento epidérmico (EGFR), el factor de crecimiento fibroblástico (FGF), el factor de crecimiento derivado de trombocitos (PDGF), el HER-2 y los transductores de señales (Ras) 6,10. Estos factores participan en eventos relacionados con la proliferación y la diferenciación. En el contexto de los TOs, los productos codificados por el oncogen Ras, p21Ras, por ejemplo, están involucrados en la transducción de estímulos externos inducidos por factores de crecimiento y pueden expresarse más en TOs en comparación con tejidos de desarrollo odontogénico normales. Además, ratones modificados genéticamente que presentaban los oncogenes Myc y H-Ras, posiblemente involucrados en eventos de proliferación celular, presentaron una alta incidencia de Tos 11,12. Los resultados citados podrían sugerir una posible relación entre los oncogenes y la etiopatogenia / comportamiento biológico de los TOs.
Los genes supresores de tumores funcionan reduciendo la probabilidad de que ciertas células se vuelvan cancerosas. Cuando estos genes se inactivan, generalmente por mutación genética, su mecanismo de acción se desregula y pueden desarrollarse tumores. Ejemplos de genes supresores de tumores implicados en el desarrollo de neoplasias son los siguientes: p53 (el gen alterado con mayor frecuencia en tumores y con un papel importante en la respuesta al daño genómico), retinoblastoma (Rb), WT-1, adenomatous polyposis coli (APC) y el patched (PTC) 6. En estudios previos se demostró el aumento de la inmunoexpresión de p53 en TOs benignos y malignos 13-16. El gen APC y su producto se han relacionado con la vía de señalización Wnt y con la inhibición de la proliferación celular. En este contexto, un estudio demostró que la reactividad inmunohistoquímica de APC fue menor en casos de ameloblastomas en comparación con gérmenes dentarios 17.
Los genes de reparación del ADN, como MSH2 y MHL1, actúan ajustando los posibles errores relacionados con la replicación y reparación del ADN. En el estudio inmunohistoquímico de Castrilli et al. 18, las proteínas hMSH2 y hMLH1 se expresaban en células neoplásicas del ameloblastoma, lo que sugiere que el desarrollo / progresión de este tumor no dependería de defectos en el sistema de mantenimiento del ADN.
Los factores de crecimiento tienen un papel en el control de la proliferación y diferenciación. En este sentido, disfunciones en diferentes factores de crecimiento pueden resultar en condiciones patológicas. Según estudios previos, algunos de los factores de crecimiento posiblemente implicados en el origen de los TOs son el factor de crecimiento transformante alfa (TGF-α), el EGFR y el TGF-β.12 Kumamoto et al. 51 demostraron expresión positiva por inmunohistoquímica del factor de crecimiento de hepatocitos (HGF) y del TGF-β y sus receptores en gérmenes dentarios y en TOs de origen epitelial, sugiriendo posible acción de estos factores de crecimiento en células epiteliales. Además, al observar expresiones alteradas de estos factores de crecimiento en los TOs epiteliales, los autores también concluyen su posible influencia en la diferenciación de las células epiteliales neoplásicas odontogénicas. Yamada et al. 52 demostraron que el factor de crecimiento TGF-β1 y la interleucina-1α producidos por quistes odontogénicos y por TOs inducen la osteoclastogénesis al inducir la expresión del ligando de receptor activador para el factor nuclear kappa-B (RANKL) en el componente estromal. Estas son evidencias que pueden reforzar la posibilidad de la participación de diferentes factores de crecimiento en el comportamiento biológico de los TOs.
Los reguladores del ciclo celular están relacionados con eventos de proliferación celular y, cuando están desregulados, pueden involucrarse en el desarrollo de tumores. La actividad proliferativa de los TOs se ha evidenciado por diferentes marcadores de proliferación y ciclo celular, como, por ejemplo, el antígeno nuclear de células en proliferación (PCNA), Ki-67 y el ADN topoisomerasa IIα 21-24. Shahela et al. 24 evaluaron la cinética celular de quistes dentígeros, quistes radiculares, queratoquistes odontogénicos y ameloblastomas para investigar las diferencias entre estas lesiones odontogénicas a través de la expresión inmunohistoquímica del antígeno del ciclo celular PCNA. El estudio demostró que el queratoquiste odontogénico presentó los valores más altos de expresión de la proteína en comparación con otros los quistes odontogénicos evaluados. Además, el ameloblastoma fue la lesión con mayores valores de expresión de PCNA entre todas las lesiones, lo que demuestra la posible relación entre los marcadores del ciclo celular y los diferentes patrones de crecimiento de las lesiones odontogénicas.
Otro punto estudiado en la patología molecular de las neoplasias odontogénicas son los factores apoptóticos. La apoptosis puede estar regulada por el factor de necrosis tumoral (TNF), el Bcl-2 y la proteína inhibidora de la apoptosis (IAP), por ejemplo. Se han observado células apoptóticas en algunos tipos de TOs, lo que sugiere un papel de la apoptosis en la oncogénesis y en la diferenciación celular del epitelio odontogénico 25. Mascitti et al. 26 evaluaron la expresión de la proteína p73 (relacionada con la apoptosis) y el del ligando inductor de apoptosis relacionado con el TNF (TRAIL) en tumores y quistes odontogénicos, demostrando que desequilibrios en las vías apoptóticas pueden desempeñar un papel en el desarrollo de los TOs. El p53 puede actuar en la inducción apoptótica en casos de daño genético irreversible. Tenório et al. 27 investigaron la expresión de ésta y otras proteínas reguladoras de la apoptosis y del ciclo celular (Bcl-2, Bax) en lesiones epiteliales odontogénicas, demostrando diferentes patrones de expresión en diferentes lesiones y su posible relación con sus comportamientos biológicos.
Diferentes reguladores del desarrollo dental, que determinan tanto el posicionamiento y la forma (Msx-1 y -2, Dlx-2, Barx-2) como la morfogénesis y citodiferenciación dentaria (Sonic hedgehog [SHH], proteínas morfogenéticas óseas [BMP], Wnt), también pueden aparecer involucrados en la patogenia de los TOs 6,28. En el estudio de Zhang et al. 29, la vía de señalización SHH, que tiene un papel en el desarrollo de los dientes, y su receptor PTC, SMO y el factor de transcripción GLI1 se localizaran predominantemente en el componente epitelial de diferentes tipos de TOs, lo que sugiere su posible participación en la proliferación epitelial de TOs. Aún en este contexto, Santos et al. 30 sugirieron la participación de las proteínas Regγ, Wnt-1 y β-catenina en la patogenia de lesiones odontogénicas epiteliales benignas. Finalmente, otros factores potencialmente involucrados en el desarrollo y progresión de los TOs son las moléculas de adhesión celular, las proteínas de degradación de la matriz extracelular, los factores angiogénicos y las citocinas osteolíticas 6. Carreón-Burciaga et al. 31 demostraron diferencias en la expresión de las moléculas de adhesión celular E-Cadherin y Syndecan-1 en diferentes tipos de ameloblastomas, asociadas al tamaño y recidiva tumoral, sugiriendo una posible relación entre la expresión de estas moléculas de adhesión celular y el potencial de agresividad de estos tumores. Kumamoto y Ooya 32 demostraron que la BMP y moléculas asociadas pueden desempeñar un papel en la citodiferenciación del epitelio odontogénico normal y neoplásico a través de la interacción epitelio/mesénquima. Kumamoto y Ooya 33 demostraron que se puede considerar el factor de crecimiento endotelial vascular (VEGF) como una molécula importante en la regulación de la angiogénesis en TOs epiteliales y que su sobreexpresión puede asociarse con cambios neoplásicos o malignos en células epiteliales odontogénicas. Sá et al. 34 sugirieron una posible participación de IL-α, TNF-α e IL-10 en la patogénesis de tumores y quistes odontogénicos, demostrando una mayor expresión inmunohistoquímica de factores osteolíticos en tumores con comportamiento biológico más agresivo. Andrade et al. 35 demostraron la expresión de los reguladores del metabolismo óseo RANK, RANKL y osteoprotegerina (OPG) en diferentes tipos de TOs, lo que sugiere su posible asociación con los eventos de resorción ósea local de estos tumores. En resumen, innumerables evidencias científicas sugieren diferentes aspectos moleculares, genéticos y epigenéticos potencialmente implicados en la etiopatogenia de los TOs. A continuación, presentamos los resultados de los análisis moleculares en algunos tipos específicos de TOs benignos.
Ameloblastoma
Recientemente, se han demostrado asociaciones de mutaciones responsables de la desregulación de diferentes funciones celulares en la vía de la proteína quinasa activada por mitógenos (MAPK), especialmente en el oncogen B-Raf (BRAF), en aproximadamente el 60% de los casos de ameloblastomas, en la proteína activadora de BRAF llamada RAS, que incluye KRAS, NRAS y HRAS; y en el receptor del factor de crecimiento fibroblástico 2 (FGRF2) que activa la vía de señalización MAPK (Figura 1) 36-38. Otros estudios también han investigado la propuesta de asociaciones probables entre cambios en los genes para reparar el daño del ADN con el desarrollo de ameloblastomas 39. Sweeney et al. 8 identificaron mutaciones en el gen BRAF que resultaron en la sustitución de ácido glutámico por valina en el codón 600 en el 46% de los casos de una muestra de ameloblastomas. Sorprendentemente, las mutaciones SMO exhibieron una marcada preponderancia en los ameloblastomas maxilares, mientras que las mutaciones BRAF exhibieron un patrón inverso, con mayor frecuencia en los casos mandibulares. Diferentes estudios han demostrado la presencia de esta mutación en casos de ameloblastomas. En el estudio de Fregnani et al. 40, los autores evaluaron si la expresión de BRAF-V600E estaría asociada con una presentación clínica más agresiva o con algún patrón molecular en ameloblastomas. Se realizó un gran panel inmunohistoquímico (citoqueratinas [CK], EGFR, PTHrP, syndecan-1, Ki-67, p53 y BRAF-V600E) en 73 casos de ameloblastomas y se recogieron varios parámetros clínico-patológicos para evaluar posibles asociaciones. Esta investigación demostró positividad de BRAF-V600E en 34 casos (46%), estadísticamente asociado con las expresiones de CK8, CK16, PTHrP y p53, con la ocurrencia de recurrencias, con el aspecto radiográfico multilocular y con rotura de la cortical ósea. Además, los análisis univariados mostraron que los casos positivos para BRAF se asociaron con tasas más bajas de supervivencia sin enfermedad. Así, el estudio sugirió asociaciones de positividad de BRAF-V600E con parámetros relacionados con mayor agresividad clínica en ameloblastomas. Lapthanasupkul et al. 41 también evaluaron la frecuencia de mutaciones de BRAF-V600E en ameloblastomas convencionales y uniquísticos en un grupo de pacientes tailandeses. Se seleccionaron casos de ameloblastomas con información clínicopatológica para la evaluación inmunohistoquímica del anticuerpo anti-BRAF-V600E. Los autores demostraron positividad de BRAF-V600E en el 72.5% de los casos de ameloblastomas convencionales evaluados, sin asociación con ninguno de los parámetros clínico-patológicos evaluados. En las muestras de ameloblastomas uniquísticos se observó positividad en el 95.5% de los casos. A través de la alta positividad de BRAF-V600E en los casos evaluados, los autores sugieren la posibilidad de futuras terapias dirigidas a BRAF en el manejo de ameloblastomas mutados. Por otro lado, otros estudios también han demostrado asociaciones entre los ameloblastomas positivos para BRAF-V600E con una mayor tasa de supervivencia libre de enfermedad 36, lo que demuestra la importancia de realizar más estudios con un número significativo de casos de ameloblastomas para dilucidar mejor los aspectos moleculares de la lesión.
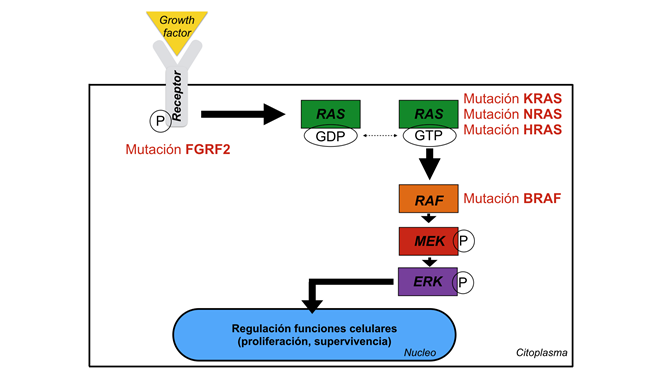
Figura 1: Esquema de la ruta de la proteína quinasa activada por mitógenos/quinasas reguladas por señales extracelulares (MAPK / ERK) que presenta algunas de las mutaciones observadas en el ameloblastoma
En un estudio sobre eventos moleculares en ameloblastomas, Amaral-Silva et al. 42 evaluaron el patrón de expresión de proteínas responsables de la identificación y corrección del daño del ADN (hMSH2, hMSH3 y hMSH6) en tejidos odontogénicos humanos en desarrollo, en ameloblastomas y en carcinomas ameloblásticos. Los autores intentaron identificar si la expresión de estas proteínas podría estar asociada a factores pronósticos en los ameloblastomas. Para eso, se organizaron las muestras para evaluar la expresión de las proteínas y se evaluaron simultáneamente otros 73 casos de ameloblastomas con tissue microarray conteniendo información clínico-patológica y la presencia de mutaciones en el BRAF-V600E. Las proteínas hMSH2 y hMSH6 se expresaron significativamente menos en los ameloblastomas en comparación con las muestras de dientes humanos en desarrollo. Además, las expresiones de hMSH2 y hMSH3 mostraron una asociación significativa con la mutación BRAF-V600E y los casos con expresión simultánea de las proteínas estudiadas se asociaron con recurrencia, sin embargo sin asociación con la predicción de supervivencia libre de enfermedad. Con estos resultados, el estudio demostró que las proteínas evaluadas se expresaban menos en los ameloblastomas y se asociaban a casos de recidiva, pero sin capacidad para predecir la supervivencia libre de enfermedad. A partir de este último estudio se puede inferir una relación entre los cambios en las proteínas responsables de identificar y corregir el daño del ADN con el desarrollo de ameloblastomas, lo que refuerza la necesidad de más estudios sobre el tema y demuestra que existen controversias en la definición de los aspectos moleculares de los TOs. En este contexto, en otro importante estudio desarrollado por Bologna-Molina et al. 43 se evaluaron las expresiones inmunohistoquímicas de las proteínas reparadoras del ADN hMLH1 y hMSH2 y del Ki-67 en ameloblastomas y gérmenes dentarios. El estudio incluyó 40 ameloblastomas convencionales, 40 ameloblastomas uniquísticos y cinco gérmenes dentarios. En este estudio, los ameloblastomas uniquísticos mostraron mayor expresión de hMLH1 y hMSH2 en comparación con los convencionales y la expresión de Ki-67 fue inversamente proporcional a la expresión de proteínas reparadoras del ADN. Además, la expresión de HMLH1, hMSH2 y Ki-67 fue significativamente mayor en los gérmenes dentarios en comparación con los ameloblastomas del estudio. El trabajo concluyó que las expresiones de las proteínas reparadoras del ADN y Ki-67 pueden correlacionarse con el comportamiento biológico de los ameloblastomas y con los mecanismos fisiológicos de gérmenes dentarios.
Considerando la importancia de la angiogénesis en el mantenimiento de tumores y en el crecimiento de neoplasias humanas, Montezuma et al. 44 evaluaron si la expresión de ciclooxigenasa-2 (COX-2), molécula asociada a un aumento del número de vasos sanguíneos en procesos patológicos, se relaciona con la densidad microvascular y con la agresividad tumoral de los ameloblastomas. Los autores utilizaron técnicas inmunohistoquímicas con COX-2 y CD34 en 63 casos de ameloblastomas con información clínico-patológica recogida de las historias clínicas de pacientes atendidos en un servicio odontológico. La expresión BRAF-V600E de los casos se obtuvo de un estudio previo del mismo grupo de investigación. De los casos evaluados, 28 (44.4%) fueron positivos para COX-2 con una densidad microvascular media de 2,2 vasos / mm2. Después de análisis estadísticos específicos, se observaron asociaciones de expresión inmunohistoquímica de COX-2 con casos de recurrencia y con expresión de BRAF-V600E. Además, una menor densidad microvascular se asoció con el uso de terapia conservadora en los casos de los ameloblastomas evaluados. Finalmente, la expresión de COX-2 se asoció significativamente con una menor tasa de supervivencia libre de enfermedad a los 5 años, pero sin asociación con una mayor densidad microvascular. Estos son ejemplos de diferentes estudios moleculares sobre ameloblastomas que muestran resultados que sugieren diferentes propuestas moleculares potencialmente implicadas en su etiopatogenia.
La evaluación de cambios genéticos en ameloblastomas también ha demostrado resultados importantes relacionados con un papel potencial en la patogenia de este tipo de TO. Diferentes desregulaciones moleculares y genéticas pueden afectar el desarrollo y la transformación oncogénica del epitelio odontogénico en ameloblastoma 45. Numerosas vías de transducción de señales están estrechamente asociadas con la aparición, el desarrollo y el pronóstico del ameloblastoma. La MAPK transduce señales intracelulares y se informa que contribuye significativamente a la patogénesis de los ameloblastomas y media la activación de BRAF V600E 46. En este contexto de investigación de alteraciones genéticas implicadas en la etiopatogenia de los ameloblastomas, algunos estudios también han evaluado la influencia del gen homólogo de fosfatasa y tensina (PTEN), que controla la migración y proliferación celular y monitoriza el nivel de Akt, en la patogenia del ameloblastoma. Narayan et al. 47 investigaron cambios genéticos en el exón 5 del gen PTEN en pacientes con ameloblastomas extrayendo el material genético de biopsias incluidas en parafina de 20 ameloblastomas convencionales y 10 gérmenes dentarios. De los 20 ameloblastomas, 5 mostraron alteraciones genéticas. De estos, 3 (15%) mostraron mutación silenciosa, uno (5%) mostró cambio en la secuencia de aminoácidos de valina a ácido glutámico y uno (5%) demostró una desintegración del ARNm. Este estudio mostró un 25% de frecuencia de mutaciones somáticas en la región exónica 5 del gen PTEN, lo que puede indicar un posible papel en la patogenia del ameloblastoma. Se observa, por tanto, que los estudios genéticos también han demostrado posibles vías implicadas en la patogenia de los ameloblastomas.
Tumor odontogénico adenomatoide
En una revisión de Reichart et al. 48, sobre el perfil inmunohistoquímico de los TOs adenomatoides, los autores demostraron que existe un amplio panel investigado en este tipo de lesión reportado en varios estudios. En cuanto a la etiología de los TOs adenomatoides, los autores mencionan que la lesión parece derivar de la lámina dentaria o sus remanentes. Además, la actualización del patrón inmunohistoquímico realizada en esta revisión pareció ser suficiente para explicar que los TOs adenomatoides corresponden más a un trastorno del crecimiento de naturaleza hamartomatosa que una neoplasia en sí. Esta conclusión se basó en los siguientes puntos principales enumerados en el estudio:
(1) los perfiles de expresión inmunohistoquímica de CKs y de algunos tipos de integrinas están relacionados con la invasión en los ameloblastomas, pero no en los TOs adenomatoides;
(2) se observa una alta expresión de la proteína p53 en ameloblastomas, pero no en TOs adenomatoides;
3) los niveles más altos de expresión inmunohistoquímica del marcador de proliferación MDM2 que se muestran en los ameloblastomas no son similares en los TOs adenomatoides;
(4) las bajas tasas de inmunoexpresión de marcadores de proliferación (Ki-67) y antiapoptóticos (Bcl-2) observados en TOs adenomatoides;
(5) los niveles más altos de metalotioneína observados en ameloblastomas en comparación con TOs adenomatoides, lo que confiere menos riesgo y potencial de recurrencia en estos últimos;
(6) los bajos niveles de metaloproteinasas de matriz (MMP) en los TOs adenomatoides, lo que corresponde a un patrón menor de agresividad local en este tipo de lesión.
Bello et al. 49 investigaron el patrón de expresión inmunohistoquímica de FAK, paxillin y PI3K en ameloblastomas y en TOs adenomatoides para evaluar la relación de estas tres proteínas importantes en el desarrollo de neoplasias. Se realizaron técnicas inmunohistoquímicas para FAK, paxillin y PI3K en 45 ameloblastomas, 7 TOs adenomatoides y 2 gérmenes dentarios humanos en desarrollo. Se observó una expresión débil de FAK en los casos de TOs adenomatoides y variable expresion en los ameloblastomas (de débil a intenso). La expresión de paxillin y PI3K fue relativamente similar en los dos tipos de tumores evaluados. En los gérmenes dentarios, FAK y paxillin marcaron fuertemente todos los componentes del órgano del esmalte, mientras que PI3K marcó fuertemente el epitelio interno del órgano del esmalte. Los autores concluyeron que la expresión inmunohistoquímica de estas proteínas en los gérmenes dentarios indicaría un papel importante en la odontogénesis. En cuanto a los tumores, el estudio demostró la débil marcación de FAK en los TOs adenomatoides en comparación con la marcación intensa de esta proteína en algunos ameloblastomas, sugiriendo que esta diferencia molecular estaría potencialmente involucrada en los diferentes patrones de comportamiento biológico de estos dos tipos de lesiones: el comportamiento más indolente de los TOs adenomatoides en comparación con un perfil más agresivo en los ameloblastomas. Esta relación puede estar justificada por la asociación entre FAK y agresividad tumoral, invasión local y metástasis en diferentes estudios de neoplasias malignas 50,51. Sin embargo, este estudio evaluó patrones de expresiones inmunohistoquímicas en muestras específicas de las lesiones. Se necesitan más estudios que evalúen otras muestras de este tipo de TO para obtener más conclusiones sobre estos resultados.
Como se ha observado, la patogenia de los TOs adenomatoides no está completamente establecida. Algunos estudios han reportado una posible alteración genética involucrada en el desarrollo de TOs adenomatoides, especialmente en el gen KRAS 52. La proteína codificada por el gen KRAS se relaciona con la cascada de transducción del EGFR y su mutación se demostró en diferentes tipos de neoplasias 53. En este contexto, en el estudio de Bologna-Molina et al. 54 se evaluó la frecuencia de la mutación KRAS y su asociación con la presencia de la vía de señalización MAPK / ERK en TOs adenomatoides. En este estudio, se recogió el material genético de 9 casos de TOs adenomatoides. Además, las mutaciones genéticas relacionadas con 50 genes asociados con el desarrollo de neoplasias se evaluaron mediante secuenciación de nueva generación en un caso; en los ocho casos restantes, se evaluaron mutaciones en la familia RAS (Luminex assay). Por último, en todos los casos se realizaron técnicas inmunohistoquímicas para KRAS, CRAF, BRAF, EGFR, ERK, MEK y BRAFV600E. El estudio demostró una mutación del gen KRAS en el codón 12, pero no en el tejido estromal de las lesiones. Se detectaron mutaciones KRAS G12V y KRAS G12R en dos y cuatro casos, respectivamente. En cuanto a las técnicas inmunohistoquímicas, todos los casos fueron positivos para EGFR, KRAS, BRAF y CRAF, un caso fue negativo para ERK y otro caso fue negativo para MEK y ERK. A partir de estos resultados, el estudio concluyó que la vía de señalización MAPK / ERK activada acompañada por la mutación del gen KRAS en el codón 12 puede representar un factor patogénico involucrado en el desarrollo de los TOs adenomatoides. Existen diferentes estudios que evalúan los mecanismos potencialmente implicados en la etiopatogenia de los TOs adenomatoides. Sin embargo, la comprensión molecular de esta lesión aún necesita más evidencia científica.
Tumor odontogénico epitelial calcificante
Algunos estudios han evaluado la participación de proteínas de la matriz expresadas durante la formación del esmalte dentario (enamelina, amelogenina, amelotina, ameloblastina y proteína odontogénica asociada con ameloblastos) en neoplasias odontogénicas. La expresión de estas proteínas puede representar marcadores importantes para comprender las diferencias funcionales entre los diferentes tipos de TOs. Crivellini et al. 55 evaluaron la expresión inmunohistoquímica de estas proteínas en TOs adenomatoides, TOs epiteliales calcificantes, odontomas, ameloblastomas, quistes odontogénicos calcificantes, fibromas ameloblásticos, mixomas, fibromas odontogénicos y epitelio reducido del órgano del esmalte. Considerando la heterogeneidad de los TOs y la naturaleza pluripotente de los tejidos odontogénicos involucrados en el desarrollo de estas lesiones, los resultados de este estudio para TOs epiteliales calcificantes demostraron la expresión inmunohistoquímica de sustancias amiloides y parte de las células neoplásicas para la proteína odontogénica asociada con ameloblastos. La expresión inmunohistoquímica de amelotina estuvo restringida al citoplasma celular de algunas de las células neoplásicas y el marcador de ameloblastina fue positivo en uno de los tumores y en algunas células neoplásicas. Finalmente, se observó expresión de amelogenina alrededor de algunas estructuras calcificadas. Teniendo en cuenta los patrones de expresión inmunohistoquímica de la proteína odontogénica asociada a los ameloblastos en otros estudios, Crivellini et al. 55 sugieren que la expresión de esta proteína en TOs epiteliales calcificantes se debe a la estimulación de la formación mineral que se produce en este tipo de TO. Además, los autores comentan que el TO epitelial calcificante probablemente se origina en líneas celulares ameloblásticas porque la afinidad de la proteína odontogénica asociada a los ameloblastos con la estructura mineralizada solo se da en epitelios odontogénicos que contienen este tipo celular. Entre las conclusiones del estudio sobre las teorías histopatogenéticas basadas en la expresión de las proteínas evaluadas, los autores informan que el epitelio de los TOs epiteliales calcificantes, así como los TOs adenomatoides y los odontomas, mostraron actividad secretora especializada inherente a los ameloblastos, diferente al observado en ameloblastomas, fibromas ameloblásticos y fibromas odontogénicos. En este mismo escenario, el estudio de Perdigão et al. 56 evaluó el gen de la ameloblastina en diferentes tipos de TOs. La proteína expresada por este gen está relacionada con la diferenciación y proliferación de células odontogénicas. Los autores realizaron la secuenciación de las regiones codificantes de este gen en un caso de TO epitelial calcificante, dos casos de quistes odontogénicos calcificantes y un caso de fibroma ameloblástico, demostrando que la secuenciación genética solo se alteró en el caso de TO epitelial calcificante. Así, los autores sugirieron que esta alteración genética puede ser relevante en la patogénesis de este tipo de TO.
Sousa et al. 57 evaluaron mutaciones en oncogenes y en genes supresores de tumores en TOs epiteliales calcificantes. En este estudio, se secuenciaron 50 genes comúnmente mutados en neoplasias en nueve TOs epiteliales calcificantes mediante secuenciación de nueva generación. El estudio mostró que solo un caso de las lesiones evaluadas albergaba mutaciones en los genes supresores PTEN y CDKN2A y en los oncogenes JAK3 y MET. Debido a que ocurrió en un solo tumor, los autores sugieren que estos cambios probablemente no se relacionen con la aparición de mutaciones en TOs epiteliales calcificantes. En otro estudio, que también evaluó el perfil genético del TO epitelial calcificante, Peacock et al. 58 demostraron, mediante técnicas inmunohistoquímicas y secuenciación de material genético, cambios en el gen PTCH1. PTH1 es un gen supresor de tumores cuya mutación está relacionada con algunos síndromes y con el desarrollo esporádico de algunas neoplasias. Los autores sugieren que esta alteración genética puede estar implicada en la patogenia del TO epitelial calcificante.
Mixoma odontogénico
Santos et al. 59 evaluaron posibles mutaciones genéticas en mixomas odontogénicos mediante la evaluación de 50 genes comúnmente mutados en casos de neoplasias. Los autores evaluaron nueve muestras de mixoma odontogénico mediante secuenciación de nueva generación, demostrando que no hubo casos con mutaciones genéticas patogénicas. Se detectaron variaciones en KDR, TP53, PIK3CA, KIT y JAK3. Así, los autores concluyeron que los mixomas odontogénicos no parecen presentar mutaciones genéticas que ocurren comúnmente en neoplasias malignas o pueden manifestarse en una baja proporción de casos. Los casos de mixomas odontogénicos pueden presentar mutaciones en otros genes que no fueron evaluados en este último estudio o las variaciones presentadas pueden tener un papel patogénico específico en este tipo de lesión.
Considerando que los mixomas odontogénicos pueden presentar diferenciación miofibroblástica y áreas mixoides similares a miofibromas intraóseos, Siqueira et al. 60 compararon casos de mixomas odontogénicos con miofibromas. Estudios recientes han demostrado mutaciones del gen PDGFRB en casos únicos y múltiples de miofibromas. Así, los autores secuenciaron los exones 12 y 14 del gen PDGFRB en 15 casos de mixomas odontogénicos. El estudio demostró un patrón normal del gen secuenciado en todas las muestras de mixomas odontogénicos, lo que sugiere que el gen PDGFRB no parece tener un papel en la patogenia de este tipo de TO. Además, los autores concluyen que esto puede ser un marcador diferencial entre mixomas odontogénicos y miofibromas.
Los mixomas odontogénicos pueden presentar agresividad local y alta tasa de recurrencia. El fenómeno de la osteoclastogénesis es importante en términos de crecimiento tumoral de neoplasias y en este contexto el estudio de González-Galván et al. 61 evaluó el patrón de expresión inmunohistoquímica de las proteínas relacionadas con eventos osteolíticos OPG, RANK y RANK-L en mixomas odontogénicos. El estudio incluyó 18 casos de mixomas odontogénicos, 4 pequeños y 14 grandes, y 18 folículos dentarios. Los autores demostraron diferencias significativas en la expresión de RANK en mixomas odontogénicos en comparación con los folículos dentarios y en la comparación entre lesiones pequeñas y grandes. Los marcadores RANK-L y OPG no mostraron diferencias estadísticamente significativas. Sin embargo los autores mencionan que hubo un patrón de mayor expresión de estos marcadores en los casos grandes de mixomas odontogénicos. Concluyeron que la activación de RANK / RANK-L / OPG estaría involucrada en el mecanismo de regulación osteolítica y crecimiento tumoral en casos de mixomas odontogénicos. En este contexto, los cambios en esta vía de señalización podrían estar involucrados en el mecanismo más agresivo de invasión ósea que ocurre en algunos casos de mixomas odontogénicos. Bologna-Molina et al. 62 evaluaron el patrón de expresión inmunohistoquímica del VEGF y de la proteína ORM-1, cuyas concentraciones están relacionadas con trastorno de la homeostasis y con el crecimiento tumoral, en 33 casos de mixomas odontogénicos y en 3 gérmenes dentarios. Se realizaron técnicas inmunohistoquímicas para evaluar las proteínas en células tumorales, células endoteliales y matriz extracelular de los casos. El estudio demostró que más de la mitad de los casos no presentaron inmunoexpresión de VEGF en la matriz extracelular y que la expresión de ORM-1 fue intensa en los endoteliocitos y células tumorales y positiva en la matriz extracelular de los mixomas odontogénicos, variando de moderado a intenso en todos los casos. Con estos resultados, los autores sugieren que la expresión de VEGF y ORM-1 puede estar asociada a los mecanismos de angiogénesis y viscosidad estructural que influyen en el crecimiento tumoral de mixomas odontogénico
Tumor odontogénico primordial
Mosqueda-Taylor et al. 63 describieron 6 casos de tumores odontogénicos primordiales. El estudio inmunohistoquímico de las lesiones mostró que las células tumorales mesenquimáticas marcaron positivamente para vimentina y negativamente para α-actina de músculo liso, desmina, S100 y CD34. La expresión de Ki-67 fue baja y el componente epitelial fuertemente positivo para las inmunoexpresiones de AE1/3 y de CKs 5 y 14. Azzi et al. 64 realizaron una revisión sistemática de la literatura para actualizar los datos sobre TOs primordiales. En este trabajo se identificaron 18 casos de TOs primordiales. La edad media observada fue de 11.58 años, con casos que oscilaron entre 2 y 19 años y se observó una ligera preferencia por el sexo masculino (61.11%). Las características clínicas más comunes fueron la presencia de aumento de volumen asintomático en la parte posterior de la mandíbula. El aspecto radiográfico más común fue el de lesiones radiolúcidas uni o multiloculares bien definidas y la mayoría de los casos fueron tratados mediante enucleación quirúrgica. En este contexto, Bologna-Molina et al. 65 realizaron un extenso estudio inmunohistoquímico en cuatro casos de TOs primordiales para investigar su posible histogénesis y comportamiento biológico. El estudio demostró que el componente epitelial que recubre la superficie de los tumores resultó positivo para CKs 14 y 19. La expresión de los anticuerpos amelogenina, glut-1, MOC-31, caveolina-1, PITX2, p53, Bax, Bcl-2, survivina y PTEN mostró variaciones focales. El componente mesenquimático fue positivo para vimentina, syndecan-1, PITX2, CD105, CD34, ciclina D1, Bax, Bcl-2, survivina y p53. PTEN y CD90 fueron moderadamente positivos. BRAF V600E y calretinina fueron negativos en las cuatro muestras. Ki-67 y MCM-7 se expresaron en menos del 5% de las células tumorales. El estudio concluyó que los TOs primordiales son tumores benignos cuya histogénesis involucra actividades epiteliales y mesenquimáticas.
Para investigar la patogenia de los TOs primordiales, Mikami et al. 66 evaluaron 6 casos mediante el análisis de ADN y transcriptoma por secuenciación de nueva generación. Además, se realizaron estudios inmunohistoquímicos de amelogenina, ameloblastina y dentina sialofosfoproteína. La evaluación de los resultados no demostró mutaciones genéticas en ningún gen relacionado con la odontogénesis o con el desarrollo de neoplasias. Se expresaron genes que codifican proteínas del esmalte (Amelx, Ambn y Enam) y dentina (Col1a1, Dspp, Nes y Dmp1). Genes asociados con la dentinogénesis (Bglap, Ibsp y Nfic) se expresaron de forma débil o fueron negativos, lo que sugiere una inhibición de la formación de dentina en los TOs primordiales. Se detectaron expresiones de amelogenina, ameloblastina y dentina sialofosfoproteína. Este estudio concluyó que la patogenia del TO primordial puede considerarse genéticamente diferente a los otros tipos de Tos y se sugiere que la inhibición de la formación de esmalte y dentina puede estar relacionada con defectos en el proceso de dentinogénesis.
Conclusiones
Varios puntos controvertidos relacionados con la clasificación, la etiopatogenia y los aspectos moleculares de los TOs son constantemente discutidos en el escenario científico. En la presente revisión de la literatura, se enumeran diferentes alteraciones moleculares, genéticas y epigenéticas potencialmente implicadas en el desarrollo y progresión de las lesiones odontogénicas. Sin embargo, en base a los diferentes resultados mostrados en los múltiples estudios presentados, se observa que las definiciones etiológicas sobre los TOs siguen siendo un desafío. Esta variabilidad de resultados puede estar justificada por la característica de heterogeneidad observada en el grupo de los TOs. Por tanto, se sugiere el desarrollo de más estudios moleculares y genéticos que evalúen muestras significativas de TOs para consolidar el conocimiento en el campo de la etiopatogenia de las lesiones odontogénicas. Un mayor conocimiento de la etiología y de la patogenia de las neoplasias odontogénicas puede, en última instancia, facilitar su proceso diagnóstico y enriquecer su manejo terapéutico. Adicionalmente, una mejor comprensión de los mecanismos moleculares subyacentes ayudará a predecir el curso de los tumores odontogénicos y conducirá al desarrollo de nuevas aplicaciones terapéuticas, como el tratamiento molecular dirigido y la terapia adaptada al paciente, para los tumores odontogénicos.











 texto em
texto em