Introducción
La enfermedad COVID-19 es causada por la infección por SARS-CoV-2, un nuevo tipo de coronavirus que surgió a fines de 2019 en China 1, desatando la primera pandemia por coronavirus conocida en tiempos modernos. Si bien la infección por SARS-CoV-2 fue originalmente descrita como una “neumonía atípica”, rápidamente se identificaron
manifestaciones extra-pulmonares, en particular en pacientes con comorbilidades (2-6. Gran parte de las manifestaciones fisiopatológicas desencadenadas por este virus se deben a que su punto de entrada es la enzima convertidora de angiotensina 2 (ECA2), elemento esencial del sistema renina-angiotensina (SRA) 7,8. Adicionalmente, las bases fisiopatológicas que determinan que ciertas condiciones preexistentes, como ser enfermedades cardiovasculares (ECV), diabetes u obesidad, predispongan a un peor pronóstico también se basan fundamentalmente en alteraciones previas en los niveles de ECA2 o función del SRA 9-12.
Metodología
Se realizó una búsqueda bibliográfica considerando artículos científicos en inglés y español publicados entre enero 2020 y Mayo de 2021 incluyendo las siguientes palabras claves: “COVID”, “COVID-19”, “SARS-CoV-2” y “coronavirus” en los portales: PubMED, Scielo, Google Scholar, Cochrane y Springer Link, así como en las bases de repositorios científicos
pre-publicación bioRxiv (“bioarchives”) y medRxiv (“med-archives”). Debido que en entre Enero de 2020 y 31 de mayo de 2021 se publicaron más de 150 mil artículos, para la redacción de este artículo se consideraron fundamentalmente revisiones en revistas médicas, odontológicas o generalistas de gran divulgación, información centralizada por agencias internacionales como OMS, CDC, informes publicados por el Grupo Asesor Científico Honorario (GACH13), el Grupo Uruguayo Interdisciplinario de Análisis de Datos de COVID‑19 (GUIAD 14), así como artículos específicos sugeridos por referentes nacionales e internacionales.
Biología del SARS-CoV-2
Los coronavirus se clasifican en 4 grupos llamados α, β, γ, δ 15,16. Las especies que infectan humanos son al menos siete, dos de la familia α, conocidas como HCoV-229E y HCoV-NL63 y cinco de la familia β: HCoV-HKU1, HCoV-OC43, SARS (del inglés “Severe Acute Respiratory Syndrome Coronavirus”, hoy llamado SARS-CoV-1), MERS (del inglés “Middle East Respiratory Syndrome”, hoy llamado MERS-CoV) y el recientemente descubierto SARS-CoV 216. Los HCoV infectan las vías respiratorias altas de niños y adultos, siendo responsables de un porcentaje de las infecciones respiratorias leves estacionales que se diagnostican cada año 15.
Al igual que otros β-coronavirus, el genoma del SARS-CoV-2 es una única hebra de ARN de polaridad positiva, de unos 30 mil nucleótidos, que codifica para pocos genes, incluyendo proteínas no estructurales y estructurales. Las proteina “estructurales” son aquellas que forman la cápside viral e incluyen a la proteína N (nucleocápside) que se une al material genético del virus, la proteína E y M que son proteínas que se anclan en la membrana y la proteína S (de “spike” o espiga) que es la clave para la infectividad del virus ya que porta “la llave” para abrir “la cerradura de la pared celular” 17.
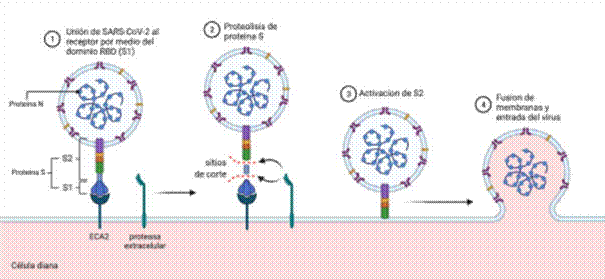
SARS-CoV-2 usa el mismo mecanismo de infección que otros coronavirus, basado en el reconocimiento de un receptor celular ECA2 por parte de la proteína S (Figura 1, etapa 1). La proteína S es una glicoproteína formada por dos dominios, el dominio S1 -que contiene la región conocida como RBD, que se une a ECA2- y el dominio S2, que posee la maquinaria de fusión de membranas que le permite al virus entrar a la célula. La unión a ECA2 induce un cambio conformacional en S1 determinando que se exponga sitios de corte para proteasas presentes en la membrana de varios tipos celulares, en particular la proteasa de serina transmembrana 2 (TMPRSS2) o la furina 17. La actividad de la proteasa corta entre S1 y S2 (Figura 1, etapa 2), lo que desencadena que la maquinaria de fusión de membranas presente en éste dominio quede en condiciones de actuar (Figura 1, etapa 3) y determine la fusión entre la membrana celular y viral y la interiorización del virus por endocitosis (Figura 1, etapa 4).
Una vez dentro de la célula, el ciclo del virus es, en términos generales, similar al de otros virus ARN 17-19.
Fisiopatología de la enfermedad COVID-19
Un número importante de enfermedades o condiciones pre-existentes son consideradas comorbilidades de la enfermedad COVID-19, fundamentalmente porque comparten aspectos fisiopatológicos con el cuadro clínico desarrollado por el virus 2,9,20-24. En las próximas secciones presentaremos un muy breve resumen de las bases fisiopatológicas de la enfermedad COVID-19 así como de las comorbilidades más comunes, incluyendo referencias claves que orientan al lector hacia artículos científicos recientes específicos de cada tema.
El sistema renina-angiotensina
La función más conocida del sistema renina-angiotensina (SRA) es mantener la homeostasis entre los vasos, la sangre y el volumen de líquido del cuerpo 25,26. Este sistema está intrínsecamente asociado al gasto cardíaco, la presión arterial y la regulación del equilibrio de electrolitos 27). Los elementos centrales del SRA son el angiotensinógeno, la angiotensina 1, la angiotensina 2 y las enzimas convertidoras de angiotensina (ECA1 y ECA2). En la circulación, el angiotensinógeno -glicoproteína secretada principalmente por el hígado es proteolizado por acción de la renina, secretada por el riñón en respuesta a un descenso de la presión arterial 25). El producto es un péptido de 10 aminoácidos llamado angiotensina 1, el cual es convertido en angiotensina 2 (8 aminoácidos) por acción de ECA1. ECA1 es una proteína de membrana expresada mayoritariamente en células del tejido pulmonar, epitelio intestinal, riñón y vejiga. La angiotensina 2 ejerce funciones endocrinas en varios órganos a través de la unión a receptores de membrana específicos (AGTR1 y AGTR2), causando fundamentalmente los siguientes cambios:
1) constricción del músculo liso de la pared de los vasos,
2) inducción de la secreción de vasopresina (hormona antidiurética) por parte de la glándula pituitaria,
3) inducción de la secreción de aldosterona por la corteza adrenal del riñón y
4) acción sobre las nefronas para aumentar la reabsorción de agua y sodio.
Afectación del sistema respiratorio
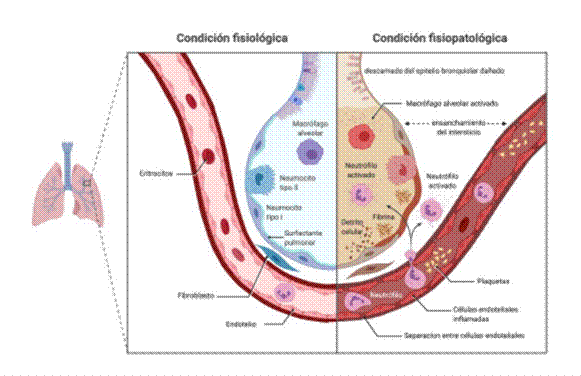
Dado que el SARS-CoV-2 se transmite por el aire en forma de aerosoles o gotas microscópicas 29) es de esperar que tenga tropismo por tejidos de la cavidad nasofaríngea y las vías respiratorias. Este tropismo está dado por la expresión de ECA2 en estos tejidos 12. La infección del sistema respiratorio por SARS-CoV-2 ocurre en tres fases. La primera sucede en la cavidad nasofaríngea, infectando algunos tipos celulares (ver sección 4.7) pero no genera una respuesta inmune muy vigorosa, y es generalmente el tipo de infección que cursan los asintomáticos. La segunda fase implica la infección de las vías respiratorias mayores, bronquios y bronquiolos; que se manifiesta con síntomas de inflamación pulmonar y puede cursar con o sin hipoxia. La tercera fase implica la infección de las estructuras de intercambio gaseoso, los alvéolos, los cuales están formados mayoritariamente por dos tipos celulares de origen epitelial llamados neumocitos tipo I y II 30. Los tipo I presentan morfología epitelial clásica, mientras que los tipo II son cuboidales y más pequeños y contienen unos organelos llamados cuerpos lamelares que secretan el surfactante pulmonar, un tensoactivo sin el cual los alvéolos colapsarían después de la exhalación 27) (Figura 2). La homeostasis pulmonar se mantiene mediante una red de células residentes que incluyen células epiteliales, endoteliales y leucocitos 31. Las macrófagos alveolares residentes y las células epiteliales forman una barrera crítica en el pulmón (Figura 2, izquierda). La infección de un neumocito tipo II determina un cambio en el perfil de expresión génica, incluyendo un aumento en la expresión de genes asociados a la respuesta antiviral, como ser interferones y ciertas interleuquinas, y disminución en la expresión de genes encargados de la producción del surfactante 32. Estas señales activan células del sistema inmune residentes en los alvéolos, como ser los macrófagos, y reclutan otras, como ser neutrófilos, que trasvasan desde la circulación 31 (Figura 2, derecha). Una característica de la infección por SARS-CoV-2 es que las células infectadas pueden desarrollar una alta carga viral 30) y desencadenar un programa de muerte celular llamado piroptosis, que involucra la liberación masiva de mediadores inflamatorios 33, lo cual aumenta exponencialmente el daño de los neumocitos tipo I, con la consiguiente rotura de la barrera alveolar y la infiltración de componentes proteicos y celulares del plasma. El alveolo dañado por la respuesta inmune comienza a llenarse de una mezcla de exudado del vaso, células muertas, partículas virales, células inflamatorias, fibrina, entre otros, aumentando el volumen del intersticio entre vaso y alveolo (Figura 2, derecha). Como consecuencia, se compromete la capacidad de intercambio gaseoso, generando en última instancia la disfunción respiratoria asociada que da nombre al cuadro clínico (“SARS”, síndrome respiratorio agudo grave) 30,31,34. Adicionalmente, la respuesta inmune asociada a la infección puede desencadenar una respuesta conocida como “tormenta de citoquinas”, que es una cascada de eventos inflamatorios que genera un cuadro de hiperinflamación sostenida el cual puede causar hipercoagulabilidad en la microvasculatura, conduciendo a lesión tisular, coagulación intravascular diseminada e insuficiencia multiorgánica 35,36.
Originalmente se consideró que la razón por la cual niños y jóvenes son menos susceptibles que los adultos mayores a infectarse se debía a que la expresión del receptor ECA2 en el tejido pulmonar aumentaba con la edad, aumentando la densidad de dianas para el virus. Sin embargo, no hay diferencias significativas en los niveles de ECA2 entre edades y sexos 12) y la explicación más probable para esta aparente contradicción sugiere que la expresión reducida de ACE2 en la membrana de los neumocitos tipo II con el envejecimiento aumenta los niveles de angiotensina 2 en detrimento de la formación de angiotensina 1-7, desencadenando exageradamente vías proinflamatorias y predispone a los pacientes de edad avanzada a una mayor gravedad de la lesión pulmonar aguda y la mortalidad por COVID-19 37.
Las infecciones bacterianas secundarias son comunes en los pacientes con COVID-19, en particular en los que requieren el uso de ventiladores mecánicos o intubación 1. Una de las posibles razones para ello es que la infección, y el daño asociado, determinan la alteración de la comunidad de microorganismo (microbioma) que residen en las vías áreas dejando lugar para la proliferación de patógenos oportunistas 38. En cualquier caso, las neumonías con infecciones bacterianas son una importante causa de complicación en los pacientes con COVID-19, y determinan un aumento de la mortalidad 39.
Efecto de la infección sobre el sistema cardiovascular
La letalidad de la infección por SARS-CoV-2 está fuertemente asociada a la edad de los pacientes y el tipo de tratamiento que reciban, y va de ser inferior al 1% para niños hasta ser superior al 10% en pacientes mayores de 70 años 39,40. Sin embargo, en cualquier rango etario, la preexistencia de enfermedades cardiovasculares aumenta el riesgo de muerte entre 3 y 4 veces 10,41. De hecho, las principales complicaciones, y la principal causa de muerte, en pacientes con COVID-19 son eventos trombóticos, tromboembolismo venoso o coagulación intravascular diseminada 19,42. Las bases fisiopatológicas de esto se deben a la existencia de circuitos de retroalimentación entre la enfermedad prexistente y el cuadro clínico producido por la infección. Por un lado, la COVID-19 cursa con importantes alteraciones hematológicas (35,36,43, algunas típicamente asociadas a la respuesta antiviral, como ser la leucopenia (presente en el 80% de los pacientes internados), trombocitopenia (30%), y otras muy probablemente relacionadas a la respuesta inmune asociada como ser el incremento de citoquinas inflamatorias IL-6, IL-2, IL-7, interferón-γ, TNF-α y la presencia en sangre de niveles elevados de marcadores de riesgo trombóticos proteína C reactiva, dímero D, procalcitonina 36,44,45. Por otro lado, la infección sistémica lleva a que la expresión o presencia de ECA2 en la membrana celular se reduzca significativamente 7, generando una desregulación del sistema SRA porque la angiotensina 2 no es degradada, provocando un cuadro hipertensivo crónico el cuál, sumado al estado protrombótico, aumenta significativamente el riesgo de tromboembolismo 19. Una de las principales razones para las cuales los pacientes con ECV tienen mayor riesgo de contraer COVID-19, y también un peor desenlace es que muchas enfermedades como la hipertensión, diabetes, enfermedades coronarias, entre otras, determinan una desregulación crónica del SRA 10,41.
Más allá de dudas iniciales sobre el posible efecto del virus sobre el miocardio 19, resultados recientes en base a secuenciación de tejido de autopsias muestran que la infección directa no es una causa probable de la falla cardiaca comúnmente descrita en pacientes terminales 32. En general, se considera que estos efectos sobre el sistema cardiovascular y el corazón son secundarios al cuadro de inflamación sistémica que produce el virus, es decir, son el desenlace de la endotelitis y de la formación de microtrombos. El endotelio es un actor central de la fisiología cardiovascular y numerosa evidencia apunta a que juega un rol preponderante en la patogenia del COVID-19 46.
Efecto de la infección sobre el sistema endocrino
La diabetes tipo 2 (T2DM) está estrechamente asociada al estilo de vida y dieta predominante en el mundo occidental, en particular con la pandemia de obesidad establecida hace ya algunas décadas 6,47,48, de la cual Uruguay no escapa 49. Muy tempranamente se identificó que la T2DM tiene un muy importante impacto en el curso de la actual pandemia ya que se trata de una condición de altísima prevalencia en algunas regiones del mundo (>20% en Uruguay 50) la cual, a su vez, aumenta significativamente las chances de hospitalización y muerte 6,10,23. Es importante recordar que las personas que sufren T2D poseen mayor riesgo de infección en general debido a deficiencia en la respuesta inmune asociadas a la enfermedad metabólica crónica 23,51. También se ha reportado que los pacientes diabéticos presentan una mayor expresión del receptor ECA2 en bronquios y alvéolos, lo que hace suponer que son más propensos al SARS-CoV-252.
Los vínculos patogénicos potenciales entre COVID-19 y la diabetes mellitus incluyen efectos sobre la homeostasis de la glucosa, inflamación, estado inmunológico alterado y activación del SRA 9. Adicionalmente, la infección puede producir tanto cetoacidósis como un aumento en el nivel de glucosa en sangre debido a la desregulación inmune o los esteroides que reciben los pacientes hospitalizados 23) (por ej. glucocorticoides). En este contexto, el manejo de pacientes diabéticos durante el curso de la infección requiere atención especial ya que la medicación de rutina para el control de la condición diabética puede no ser compatible con el tratamiento necesario durante el curso de la enfermedad COVID-19 9,51.
La epidemia de COVID-19 trajo aparejado un incremento muy marcado en los casos de diabetes tipo 1 de nueva aparición (T1DM) 53,54. Originalmente se consideró que la infección directa de células β podría ser la responsable, si bien las autopsias parecen indicar que el páncreas no es un reservorio de relevancia del virus y que es poco probable que infecte células del órgano de manera directa 32. En consecuencia, se han propuestos diversos mecanismos para explicar la insulitis autoinmune y la destrucción de las células β, los cuales aún están en estudio. Se trata de un tema de suma importancia médica ya que la evidencia médica indica que los pacientes recuperados de COVID-19 son 40% más propensos a desarrollar T1DM a raíz de la infección 55.
En cuanto a la función de otros órganos del sistema endocrino, hay reportes que indican que la infección por SARS-CoV-2 produce tanto hipotiroidismo como tirotoxicosis, así como deficiencias en la función de la glándula paratiroides y adrenales 56,57) si bien las autopsias sugieren fallas a raíz de eventos trombóticos 42) y no infección directa de los tejidos glandulares 32.
Efecto de la infección sobre el sistema digestivo
Aproximadamente el 20% de los pacientes que cursan la enfermedad presentan síntomas gastrointestinales como náuseas, vómitos y diarreas 58, y este porcentaje sube al 50% en pacientes hospitalizados 59. El material genético del virus es detectable en heces de pacientes infectados, incluso asintomáticos 60) y hay evidencia concluyente de que los enterocitos son infectados directamente por SARS-CoV-2 61, lo que condice con que la expresión de ECA2 en el epitelio intestinal es la más alta del cuerpo 12. La infección directa de los enterocitos es la responsable de que los pacientes más graves presenten síntomas similares a enfermedades inflamatorias intestinales como ser síndrome de colon irritable, enfermedad de Crohn, entre otras 58, incluyendo la presencia incrementada de biomarcadores de “rotura” de la permeabilidad intestinal 62) como ser un aumento de las células TH17 productoras de IL-17 y una alta citotoxicidad de las células T CD8+ en la sangre periférica, que se cree que tienen un papel importante en la tormenta de citoquinas. Por lo tanto, las características proinflamatorias que vemos en el pulmón parecen estar también presentes en el intestino de pacientes graves 60. Sumado a esto, se han reportado cambios en la microbiota intestinal producto de la infección 63. La infección por SARS-CoV-2 también parece afectar el páncreas exocrino, manifestándose como pancreatitis con alteración de los niveles amilasa y lipasa sanguíneos, si bien la relación etiológica entre la infección y la pancreatitis no es concluyente 64.
Afectación del sistema nervioso central
Aproximadamente el 30% de los pacientes tiene algún síntoma neurológico, desde dolores de cabeza a complicaciones severas como infartos cerebrovasculares. En línea con lo mencionado anteriormente, la fisiopatología del COVID-19 en el sistema nervioso puede deberse a tres factores:
1) la situación de inflamación crónica,
2) eventos trombóticos inducidos por la coagulopatía subyacente,
3) la infección directa de células del sistema nervioso.
Efectos de la infección en la cavidad oral y consecuencias estomatológicas
Desde el comienzo de la pandemia sabemos que la saliva de las personas con COVID-19 puede contener altos niveles de SARS-CoV-2 y, de hecho, gran parte del esfuerzo en la prevención se ha puesto en interrumpir la dispersión del virus por aerosoles y microgotas exhalados por los pacientes portadores 29. A raíz de ello, la práctica odontológica se ha visto severamente afectada 67,68. Se considera que en las personas con síntomas respiratorios el virus detectable en saliva proviene posiblemente del drenaje nasal o del esputo expulsado de los pulmones. Sin embargo, la detección de SARS-CoV-2 en saliva de pacientes asintomáticos sugiere que el virus puede residir y replicarse en tejidos extrapulmonares de las vías aéreas altas 69. Huang y colaboradores demostraron que las glándulas salivares y los epitelios de la cavidad oral pueden ser infectados por SARS-CoV-2 y transmitir la infección a otros órganos 22. Para ello, mediante técnicas de secuenciación, estudiaron la presencia de los receptores de membrana necesarios para la entrada del virus en todos los tipos celulares que hay en la cavidad oral, así como la presencia del virus en biopsias de tejidos, llegando a la conclusión de que la boca es un sitio de infección y un reservorio del virus. Las hipótesis probables que justifican la disgeusia y la ageusia en COVID-19 incluyen la posibilidad de daño causado por el SARS‑CoV-2 las células epiteliales de las glándulas salivales que sean diana del virus debido a la expresión de ECA2 70.
La xerostomía es la manifestación clínica más común causada por la infección por SARS CoV-2, y está asociada a una desregulación del equilibrio de electrolitos productos de la desregulación del sistema SRA 71, pero no la única. A lo largo de estos meses se ha reportado distintas lesiones en la cavidad bucal de pacientes infectados, como ser: úlceras, erosiones, ampollas, vesículas, pústulas, máculas, pápulas, placas, pigmentación, costras, necrosis, petequias, eritema y sangrado espontáneo. La xerostomía y la falta de higiene bucal parecen ser los factores más importantes para predisponer al paciente a la aparición de lesiones, sobre todo en portadores de prótesis, y a la incidencia de caries y paradenciopatías. Sumado a ello, las infecciones oportunistas, el estrés, los traumatismos (secundarios a la intubación), el compromiso vascular y la respuesta hiperinflamatoria secundaria al COVID-19 generan condiciones favorables para el desarrollo de lesiones orales 72-76.
La infección por SARS-CoV-2 también tiene consecuencias en la microbiota oral 77,78, tanto directas como indirectas. La hiposalivación representa un riesgo potencial de infección secundaria debido a que disminuye la cantidad y concentración de componentes esenciales en la respuesta contra patógenos como ser lisozima, mucinas, lactoferrina, peroxidasa, α- defensinas, β-defensinas y cistatinas, entre otras.
5. COVID “post-crónico”
Al momento de escribir este artículo, más de 200 mil personas se habrán recuperado de COVID-19 en Uruguay. En base a la tendencia que se está observando mundialmente, es de esperar que más del 50% continúe con síntomas o complicaciones semanas o meses después del alta médica. A este cuadro se le ha dado en llamar “COVID de largo alcance” o “COVID post-agudo”. Desde el punto de vista de la atención médica y odontológica, constituyen un inmenso reto ya que se desconoce cuál será la respuesta de estos pacientes a patologías que enfrentarán en el lapso de sus vidas, desde tratamientos odontológicos a trasplantes de órganos 55,79. Si nos guiamos por los efectos del SARS-CoV-1, los resultados no son alentadores: un estudio de seguimiento durante 12 años con 25 pacientes sobrevivientes mostró un incremento muy marcado en el desarrollo de hiperlipidemias, enfermedades cardiovasculares y desórdenes metabólicos 80, sin una base fisiopatológica clara. Es interesante destacar que la disbiosis de la microbiota intestinal y oral persiste aún varios meses después de la resolución de la enfermedad, lo que podría contribuir a la persistencia de los síntomas 77,78,81-83) lo que, sea causa o consecuencia de la infección original por SARS CoV-2, sugiere que hay margen para intervenciones terapéuticas no invasivas, incluyendo tratamientos con probióticos, dietarios, antibióticos o antivirales 7,84.
Epidemiología de la pandemia de SARS-CoV-2
Durante los primeros 2 años de la pandemia se reportaron más de 200 millones de casos de COVID-19 en el mundo, y se estima que más de 6 millones de personas han muerto como causa de la infección, lo que posiciona al COVID-19 como la cuarta causa de muerte a nivel mundial (4.4%) en 2020 85. Los números de infectados y fallecidos supera en varios órdenes de magnitud a los ocurridos a raíz de los brotes epidémicos de SARS-CoV-1 (2002-2003) que causó la muerte de 813 de las 8809 personas diagnosticadas 86) y del MERS-CoV (2012- 2013) que causó 858 muertes 87. El número de fallecidos por estos brotes epidémicos sorprende por su bajo número, más considerando que el SARS-CoV-2 posee una tasa de letalidad relativamente baja en comparación: ~10% para SARS-CoV-1, >30% por MERS-CoV y 1-2% para SARS-CoV-2 88. Hay razones biológicas, epidemiológicas y sociales que explican -al menos en parte- porque la epidemia de COVID-19 cobró tal magnitud y sigue desarrollándose.
En primer lugar, hay aspectos de la biología del virus que lo hacen único. La evidencia obtenida con cultivos celulares, modelos animales y autopsias sugiere que el SARS-CoV-2 es más efectivo en el proceso de infección 89) fundamentalmente por presentar diferencias menores pero importantes en la proteína S en comparación con su homóloga en SARS-CoV 1 y MERS-CoV 17. El segundo aspecto es epidemiológico; las infecciones por SARS-CoV-1 y MERS-CoV resultaron casi exclusivamente en infecciones sintomáticas de las vías respiratorias bajas, donde los pacientes desarrollaron rápidamente un cuadro clínico, con un bajo periodo de incubación (2-7 días) 34, lo que permitió la rápida identificación y aislamiento de los infectados. La opinión más aceptada en la actualidad es que la pandemia de COVID 19 escaló debido a que un porcentaje relativamente alto de las personas infectadas son asintomáticas, pero aun así pueden transmitir el virus 90-92. Esta propuesta se apoya fuertemente en la movilidad que han tenido las diferentes estirpes del virus desde su origen en China a todo el mundo, demostrando no solo la importancia de los portadores asintomáticos sino también de la enorme dispersión de las enfermedades contagiosas en el mundo moderno altamente interconectado. Tal es así que incluso en un país pequeño y con escasa conectividad internacional como Uruguay, los estudios genómicos muestran que el SARS-CoV-2 ingreso al país a mediados de febrero de 2020 y que durante el curso de 2020 y 2021 siguieron ingresando estirpes virales desde diferentes regiones del mundo 93-96.
Por último, si bien sabemos que los tres brotes fueron de origen zoonótico, en el caso del SARS-CoV-1 y MERS-CoV su origen fue rápidamente identificado, permitiendo un mejor manejo del reservorio animal. Más allá de la existencia de una duda razonable sobre su origen, la evidencia científica indica que el SARS-CoV-2 es un virus que pasó de murciélagos a humanos a través de un intermediario mamífero aún desconocido 16. Otra característica única del SARS-CoV-2 es que su primer brote ocurrió en una ciudad densamente poblada e interconectada (Wuhan, China) lo que resultó en que, más allá de los esfuerzos por controlar la epidemia, la misma se extendió rápidamente a todo el mundo 1.
Sin embargo, esta epidemia devastadora era previsible, o al menos probable. En un artículo publicado en 2007 Cheng y colaboradores revisan la evidencia científica sobre el riesgo emergente de nuevas crisis de salud pública originadas por coronavirus y concluyen: “Es sabido que los coronavirus experimentan recombinación genética, lo que puede dar lugar a nuevos genotipos y brotes. La presencia de un gran reservorio de virus similares al SARS-CoV en los murciélagos (…) es una bomba de tiempo” 97. Hace décadas que se advierte que nuestro modelo de producción de alimentos y estilos de vida nos expone a enfermedades zoonóticas emergentes, muchas de las cuales han desencadenado pandemias o emergencias, como ser la emergencia sanitaria del 2003 originada por el virus de la influenza aviar H5N1, la pandemia declarada a raíz del virus de la influenza porcina H1N1 en 2009 o la emergencia sanitaria mundial desencadenada por el brote de ébola en 2014. La próxima pandemia está “a la vuelta de la esquina” y es muy probable que sea una vez más producto de una enfermedad viral de origen zoonótico que se transmita al humano como consecuencia de la manipulación de animales para consumo. Al momento de escribir este trabajo- una nueva cepa de influenza aviar (H5N8) ya se ha distribuido por casi 50 países, causando incluso infecciones en humanos 98.
Conclusiones
La pandemia de SARS-CoV-2 nos enfrentó a retos de salud pública nunca antes vistos. Sin embargo, más allá de la abrumadora cantidad de fallecidos, la respuesta de los sistemas de salud y científicos de ciertos países fue determinante para reducir los daños potenciales. En el proceso (re)descubrimos el valor de la ciencia experimental, de la biomedicina, de la interdisciplinariedad, y de la toma de decisiones basada en evidencias 99. Adicionalmente, enfocar el trabajo de tantos científicos y profesionales de la salud en una sola patología durante tanto tiempo llevo a conocer aspectos de la fisiología humana que no estaban completamente caracterizados y, aún más importante, a resaltar incógnitas sobre las bases fisiopatológicas de enfermedades crónicas o infecciosas con las que lidiamos hace décadas 2,55,79,100.











 texto em
texto em