Introducción
La cavidad oral es un sistema abierto y por lo tanto debe considerarse su consecuente intercambio de energía y materia con el ambiente. Está directamente expuesta a numerosos factores ambientales tales como: alimentos, alcohol, humo de cigarrillo, fármacos, tóxicos, microorganismos patógenos, entre otros 1. La presencia de la saliva resulta de vital importancia para el mantenimiento de la salud de piezas dentarias y tejidos blandos y es reconocida como un reflejo del estado de salud, debido a que en su composición se encuentran proteínas, hormonas, anticuerpos y otras moléculas que sirven para monitorear el estado de salud general del individuo 2) (3. Dentro de las funciones de la saliva, una muy importante es que constituye la primera barrera de defensa contra agentes de daño externos. La saliva tiene una batería de proteínas y compuestos con capacidad antioxidante que contrarrestan los efectos de agentes oxidantes externos e internos que afectan la cavidad oral 2) (4. El tabaquismo tiene alto impacto en la composición y función de la saliva. En su composición, diferentes agentes oxidantes y compuestos radicalares, desafían a los sistemas antioxidantes endógenos de la saliva, que a pesar de su alta eficiencia, pueden ser insuficientes para prevenir las repercusiones de la exposición al humo de tabaco. En consecuencia, la acumulación de modificaciones oxidativas lleva a un desbalance del metabolismo redox determinando la aparición de marcadores de estrés oxidativo como pueden ser proteínas nitradas u oxidadas, productos de peroxidación lipídica, entre otros, evidenciado en numerosos reportes en fumadores (4. Además, existe un creciente interés en el estudio del rol que cumplen las especies reactivas en los mecanismos etiopatogénicos de algunas enfermedades orales. En ese sentido, la periodontitis es precisamente una enfermedad íntimamente relacionada con un desequilibrio de la homeostasis redox, donde la inducción de disbiosis oral y el estado inflamatorio que se establece, colaboran en la formación de más especies oxidantes y radicales libres que dañan componentes celulares 5)(6. En ese tipo de patologías, una saliva con baja capacidad antioxidante no solo dificulta el restablecimiento del estado redox salival, sino que además actúa de forma sinérgica al estado proinflamatorio subyacente provocando un mayor daño a nivel tisular y dentario 7. Por lo antedicho, la incorporación de farmacología redox en los tratamientos clínicos de la periodontitis se postula como una alternativa novedosa para contrarrestar los efectos del estrés oxidativo establecido en esta patología, atenuando la progresión de la enfermedad.
Objetivo
Realizar una revisión narrativa sobre la relación entre la producción de especies reactivas y la disminución de la capacidad antioxidante salival inducida por humo de tabaco. Revisar la evidencia acumulada sobre estrés oxidativo en la periodontitis y el potencial uso de farmacología redox para el tratamiento de esta patología.
Revisión y métodos
Se realizó una revisión narrativa a partir de las bases de datos PUBMED (NLM, NIH, NCBI) y SciELO, con artículos originales publicados entre 2012-2021 para el tema en estudio y se agregaron las referencias originales de algunos conceptos fundamentales de biología redox de relevancia académica no comprendidas en este período. Para la búsqueda de los artículos se utilizaron los términos: “periodontitis”, “oxidative stress”, “redox pharmacology”, “salivary antioxidants”, “periodontal disease”, “cigarette smoke” y “saliva”. Se encontraron 121 artículos de los cuales se incluyeron 50 luego de filtrar por título, resumen y texto completo. Se incluyeron tanto estudios con modelos animales, como estudios en humanos.
Desarrollo
Estrés oxidativo en sistemas biológicos
Hace poco más de 30 años se introdujo el concepto de estrés oxidativo, acuñado por Helmut Sies 8, abarcando un espectro de situaciones en las cuales ocurre un desequilibrio entre la formación de oxidantes y la capacidad antioxidante celular, a favor de los oxidantes, lo que conduce a una interrupción de la señalización redox y daño molecular (Figura 1) 9) (10). La formación de oxidantes a nivel celular ocurre, en parte, como consecuencia del metabolismo aeróbico aunque también puede ocurrir como resultado de la exposición ambiental ante agentes oxidantes como radiación UV, humo de tabaco, smog, entre otros. Los oxidantes producidos pueden reaccionar con biomoléculas, pudiendo conducir a modificaciones que determinen cambios de estructura y función, generando daño celular. En contraposición, estos procesos se encuentran atenuados por sistemas antioxidantes enzimáticos y no enzimáticos. 10) (11) Cuando estos sistemas antioxidantes colapsan o son sobrepasados por los oxidantes, se establece una condición de estrés oxidativo celular. En los últimos años, el estudio del rol de las especies reactivas ha llevado a la incorporación de los conceptos de eustres o distrés oxidativo como sustitutos del concepto de estrés oxidativo. De esta manera, se intenta discriminar los roles fisiológicos o patológicos del desbalance redox, respectivamente. 12)(13).
¿Qué son los radicales libres?
Un radical libre es una molécula que contiene un electrón desapareado en su orbital más externo, son intermediarios de vida media corta (del orden de micro a milisegundos) y muy reactivos (captan o ceden electrones) 11) (14. A los radicales libres junto a otras moléculas oxidantes se los denomina “especies reactivas” y las mismas pueden ser derivados del oxígeno, nitrógeno y otros elementos 15. Se forman en condiciones normales y patológicas, y las células han desarrollado diferentes sistemas antioxidantes para atenuar su efecto a nivel biológico. A continuación, profundizaremos en las especies reactivas del oxígeno y del nitrógeno más relevantes en los sistemas biológicos.
Especies reactivas del oxígeno
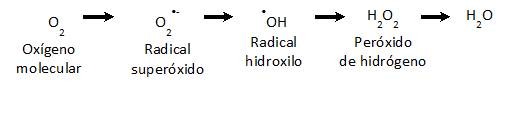
Bajo el término de especies reactivas de oxígeno (ERO), se incluyen los radicales de oxígeno así como también algunos derivados no radicalares 16. En el Esquema 1, se muestra la secuencia de reducción por un electrón del oxígeno molecular (O2):
En condiciones normales la principal fuente celular de ERO es la respiración mitocondrial, generando radical anión superóxido (O2 •-) como subproducto del flujo de electrones a través de la cadena de transporte de electrones 17. La detoxificación de este radical puede ser espontánea o enzimática, por acción de las superóxido dismutasas (SODs, MnSOD o CuZnSOD), dando peróxido de hidrógeno (H2O2). El H2O2 no es un radical libre porque no posee electrones desapareados, es más estable que el O2 •- teniendo en la célula una vida media del orden de ~1 ms, y en condiciones estacionarias alcanza una concentración celular ~10-7 M 18. En consecuencia, el O2 •- habitualmente se consume en el sitio de formación generando H2O2 por dismutación enzimática mediada por SODs 16. Una vez producido el H2O2 puede difundir a través de las membranas alcanzando otros compartimentos diferentes al sitio donde es generado. En organismos aerobios, el H2O2 se metaboliza a agua y O2 principalmente por dos sistemas enzimáticos: catalasa (CAT) y glutatión peroxidasa (GPx). El radical hidroxilo (•OH) es una molécula muy reactiva, capaz de oxidar aminoácidos, lípidos y ácidos nucleicos, lo que determina una vida media corta (~10-9 s) y una baja capacidad de difusión 19. Se genera por medio del Ciclo de Haber-Weiss en presencia de proteínas con centros metálicos con Fe o Cu y H2O2 . Otra fuente de este radical es a partir de la descomposición del anión peroxinitrito (ONOO-), como se explicará más adelante.
Especies reactivas del nitrógeno
Las especies reactivas del nitrógeno (ERN) pueden ser radicalares y no radicalares. Las de mayor interés en biología son: óxido nítrico (•NO), anión peroxinitrito (ONOO-) y dióxido de nitrógeno (•NO2). El •NO es una molécula sin carga, de vida media corta (3-5 s) y es considerado uno de los radicales más importantes del nitrógeno, de hecho, le valió el Premio Nobel de Fisiología y Medicina a L. Ignarro, F. Murad y R. Furchgott en 1998 20. No es un reductor ni oxidante fuerte y por tanto, no reacciona rápido con la mayoría de las biomoléculas a pesar de ser un radical libre 21. Se forma por la acción de enzimas óxido nítrico sintasas (NOS) a partir de la L- Arginina y la reacción involucra intermediario N- hidroxi L- arginina. En presencia de O2 •- y H2O2, así como de centros con metales de transición, es capaz de formar otras especies reactivas del oxígeno como el ONOO-. A nivel fisiológico, es un mensajero intracelular y es el agente citotóxico producido por macrófagos activados y neutrófilos, regula flujo sanguíneo local, es inhibidor de la agregación y adhesión plaquetaria y a bajas concentraciones funciona como antiinflamatorio, pero en altas, actúa como proinflamatorio 21. El ONOO- es un anión producido a partir de la reacción del •NO con el O2 •-, no es un radical libre pero tiene una vida media muy corta del orden de 10- 20 ms 22, se puede formar en los sistemas biológicos siendo un agente oxidante y nitrante potencialmente tóxico 23. Cuando hay un aumento en la generación de O2 •-, la reacción del •NO con el O2 •- se ve cinéticamente favorecida y el •NO compite con la SOD por la captación del O2 •- para producir ONOO- (condición que se ve incrementada en condiciones patológicas). El •NO2 es un radical libre tóxico y muy reactivo que puede nitrar lípidos y proteínas, causando daño a nivel celular, ya que la nitración de residuos aminoacídicos importantes en las proteínas puede comprometer su función en la célula. Puede producirse por la descomposición de ONOO- y también a partir de su reacción con CO2, la cual es muy relevante en los sistemas biológicos. Por otra parte, puede formarse también a través de la oxidación de NO2 - catalizada por algunas peroxidasas (e.g. mieloperoxidasa) o por la autooxidación del •NO 24.
Fuentes de radicales libres y daño a nivel celular
Los oxidantes y los radicales libres se forman continuamente de forma fisiológica en las células y pueden participar en la señalización redox. En los sistemas biológicos se puede establecer una condición de estrés oxidativo a partir de oxidantes y radicales provenientes tanto de fuentes endógenas, como exógenas (Figura 2). Cuando nos encontramos en condiciones patológicas, la formación de estas especies puede aumentar significativamente y mediar el daño oxidativo de diferentes biomoléculas (lípidos, glúcidos, ADN y proteínas). Las especies reactivas generadas pueden provocar daño en ADN, modificación y/o inactivación de proteínas y carbohidratos y también oxidación de lípidos. Para prevenir este daño causado por los radicales libres, los organismos, principalmente aerobios, desarrollaron a lo largo de la evolución, sistemas de defensa o sistemas antioxidantes 1)(25.
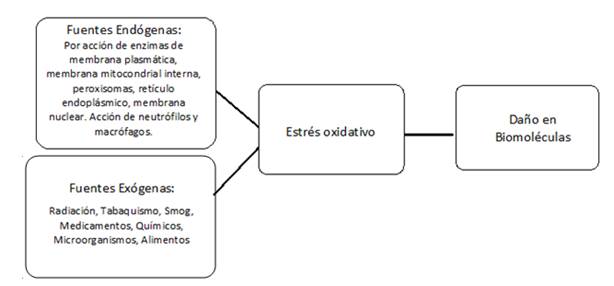
Figura 2: Principales fuentes de radicales libres. Se pueden clasificar como endógenas y exógenas. La generación de los ERO y ERN, determinan el desbalance redox en favor de los prooxidantes, y repercuten dañando biomoléculas.
En el caso de la cavidad bucal, muchos reportes en saliva describen a la capacidad antioxidante globalmente como estatus oxidante total (TOS, del inglés total oxidant status) 26, sin embargo, no se discrimina cual o cuales sistemas son los afectados, por lo tanto a continuación profundizaremos en los sistemas antioxidantes más importantes de la saliva.
Antioxidantes en la saliva
Desde un punto de vista biomédico, se puede definir un antioxidante como un compuesto o proteína que, aún presente en bajas concentraciones en comparación con los de un sustrato oxidable, previene o retrasa significativamente la oxidación del sustrato iniciada por un prooxidante 15)(16. Los antioxidantes de la saliva se pueden agrupar en sistemas antioxidantes enzimáticos y no enzimáticos (Figura 3).
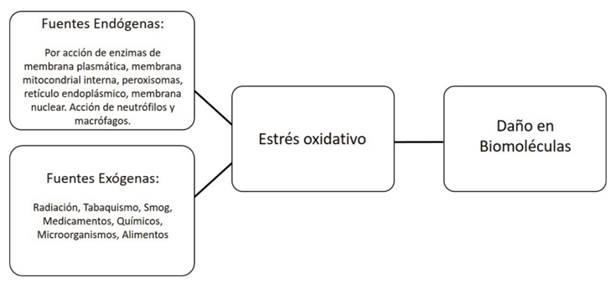
Figura 3: Principales antioxidantes presentes en la saliva. Se los clasifica como enzimáticos y no enzimáticos y representan la barrera principal contra el daño por oxidantes y radicales ya que ejercen su efecto protector sobre las piezas dentales y los tejidos de la cavidad oral
Las peroxidasas, son una familia de enzimas que utilizan diferentes sustratos como fuente de electrones para reducir peróxidos. Algunas de ellas tienen un sustrato específico, como el glutatión reducido (GSH) para la GPx, pero la mayoría actúan sobre varios sustratos27. En la saliva, la peroxidasa salival (SPx) cataliza la formación de hipotiocianato (OSCN-) y ácido hipotiocianoso (HOSCN-), a partir del peróxido de hidrógeno (H2O2) y tiocianato (SCN-). El H2O2 puede ser generado, como dijimos anteriormente, por las bacterias que colonizan la cavidad oral, o también por medio del uso de enjuagues, colutorios, se cree que la principal función de la SPx es eliminar al H2O2 generado localmente por las bacterias. Las SOD son una familia de metaloenzimas que se encuentran en todos los organismos aeróbicos y son las primeras enzimas implicadas en la defensa antioxidante. Como se mencionó antes, las SODs protegen a la célula de las ERO, catalizando la dismutación del O2 •- en H2O227. Representan la vía más importante de detoxificación del O2 •- en los sistemas biológicos. La catalasa pertenece a una familia de enzimas presentes en numerosos tejidos (e.g. grandes concentraciones en células hepáticas). Como ya mencionamos, cataliza la formación de agua y oxígeno a partir de H2O2 y cumple un rol vital en el metabolismo, evitando las modificaciones inducidas por esta especie sobre proteínas y ácidos nucleicos 27. Las glutatión peroxidasas constituyen una familia de selenoenzimas que se expresan en la mayoría de las células, cuya actividad biológica principal es proteger al organismo mediante la detoxificación de peróxidos 27. La GPx reduce al H2O2 y a otros hidroperóxidos a H2O utilizando como co-sustrato al glutatión reducido (GSH) convirtiéndolo a oxidado (GSSG)28. La enzima glutatión reductasa pertenece a una familia de enzimas que catalizan la reducción del GSSG a GSH, a expensas de NADPH que principalmente proviene de la ruta de las pentosas fosfato (27. Entre los antioxidantes no enzimáticos, se destaca el ácido úrico (producto de desecho del catabolismo de las purinas), muy eficaz eliminando especies energéticamente excitadas como el oxígeno singulete y radicalares como peroxilo e hidroxilo 16)(29. El ácido úrico es la principal molécula antioxidante en saliva, representando el 85% de la capacidad antioxidante total30. Por otra parte, la melatonina, que normalmente es secretada por las glándulas salivales (aunque también puede ser adicionada como un tratamiento externo) y cuya secreción máxima es entre las 12:00 y 2:00 am (sigue ritmo circadiano corporal), es capaz de neutralizar las ERO principalmente eliminando H2O231)(32)(33. Por esto se propone una función complementaria a la CAT y GPrx 31. Los polifenoles por su parte son importantes antioxidantes exógenos provenientes de la dieta, presentes en diversos alimentos y bebidas que han demostrado actividad moduladora del metabolismo de las especies reactivas 34) (35.
Estrés oxidativo generado por el humo de tabaco
Está reportado que el humo del tabaco contiene una gran variedad de sustancias potencialmente tóxicas, siendo considerada la nicotina una de las más peligrosas y adictivas, pero además incluyen muchas sustancias prooxidativas y cancerígenas. En el humo, producto de la combustión del tabaco, se vehiculizan una gran variedad de radicales libres que lo convierten en uno de los inductores de estrés oxidativo más poderosos de la cavidad bucal 4)(36. El humo de tabaco aumenta los niveles de ERO, que son tóxicos para el cuerpo humano debido a que alteran la homeostasis redox 5. El cadmio contenido en el humo del cigarrillo, puede reemplazar el hierro y el cobre en las proteínas citoplasmáticas unidas a la membrana, aumentando así la cantidad de cobre y hierro libres o quelados que pueden aumentar aún más el estrés oxidativo a través de reacciones de Fenton 37. Dentro de las especies reactivas reportadas como componentes del humo de tabaco puede encontrarse: H2O2, O2 •-, •OH, ONOO-, •NO2, ROO•, •NO, acroleína, crotonaldehído, nitrosaminas, entre otras. La acroleína y el crotonaldehído, han sido reportados como los principales responsables de la oxidación de grupos tioles de proteínas de la cavidad bucal, provocando cambios estructurales y funcionales en las mismas 31. El tabaquismo puede interferir con los sistemas antioxidantes de los tejidos periodontales, inhibiendo las defensas contra la placa bacteriana, provocando vasoconstricción y enlentecimiento de la cicatrización de heridas, así como el enmascaramiento de signos propios de la periodontitis, como lo es el sangrado gingival 5.
Impacto del estrés oxidativo en la saliva e implicancia en la periodontitis
La periodontitis, se define como una enfermedad inmunoinflamatoria crónica y multifactorial, asociada a una disbiosis de la película bacteriana (microbioma). Está influenciada por la respuesta inflamatoria del huésped, contenidos en el líquido crevicular gingival y la saliva. Además, puede ser afectada por factores ambientales y de comportamiento y su desarrollo puede ser modificado por factores locales (por ejemplo, el tabaquismo), condiciones adquiridas (enfermedades sistémicas) y factores genéticos 6)(38. Al conjunto de microorganismos presentes en la cavidad oral, se le denomina microbioma oral o biofilm oral. Para el desarrollo de la periodontitis, es necesaria una disbiosis en el microbioma (cambios en la composición de la microflora de una condición saludable a una no saludable), estos cambios pueden verse influenciados por factores como la falta de higiene, nutrición, exposición a agentes físicos-químicos (variaciones de pH, temperatura, tabaco entre otros) (39)(40. La persistencia de un biofilm disbiótico en las bolsas periodontales, provoca la migración de leucocitos (los neutrófilos polimorfonucleares -PMN- representan entre el 50% -70% del infiltrado leucocítico total), desde el torrente sanguíneo al sitio de la infección y juegan un papel esencial en la salud periodontal y en el sistema inmunológico innato como células de primera respuesta, actuando a través de varios mecanismos de defensa únicos, que incluyen degranulación, quimiotaxis, fagocitosis, NETosis (del inglés neutrophil extracellular traps) y la liberación de ERO 41. Varios estudios demuestran que el fenotipo de PMN “hiperactivado” caracterizado por la sobreproducción de ERO, está directamente relacionado con la periodontitis, haciendo que el subconjunto de pacientes con niveles más altos de este fenotipo particular de neutrófilos, sea más susceptible al desarrollo de la enfermedad 42. Las ERO juegan un papel importante en la señalización celular, la regulación génica y la defensa antimicrobiana, pero una sobreproducción de ERO conduce a una mayor carga oxidante junto con una capacidad antioxidante alterada o reducida, lo que resulta en un estado de estrés oxidativo dentro de los tejidos afectados, que luego conduce a cambios patológicos y, en consecuencia, a la destrucción de los tejidos del huésped y por lo tanto, a la pérdida de tejidos de soporte dentario 43. La periodontitis, como otras enfermedades inflamatorias crónicas, está ligada al desarrollo de un desequilibrio de la homeostasis redox 44, que ha sido relacionado con la etiología y patogenia de la enfermedad 11. Además de haber una sobreproducción de ERO, en la periodontitis, la acción de estas ERO se ve exacerbada debido al debilitamiento del sistema de defensa antioxidante 30. Esta ruptura de la barrera antioxidante, es directamente responsable de las modificaciones oxidativas y nitro-oxidativas evidenciadas en las biomoléculas de la cavidad oral, como resultado de un descenso en la capacidad de neutralización de estas especies 45. Varios estudios han demostrado que el estrés oxidativo es directamente responsable de la degradación de los componentes de la matriz extracelular del tejido periodontal, incluyendo colágeno, elastina, proteoglicanos y glicosaminoglicanos (por ejemplo, ácido hialurónico), que determinan la pérdida de integridad del periodonto 44. Pero también puede ejercer efectos deletéreos de manera indirecta al generar ácidos grasos oxidados, que activan la adipogénesis, inhibiendo la osteoblastogénesis por un impacto directo sobre los osteoclastos 4. Los parámetros redox más utilizados comúnmente para evaluar el daño oxidativo asociado a enfermedades periodontales son los marcadores de lipoperoxidación (i.e. malondialdehído, 4-hydroxynonenal, 8-oxoguanina), debido a que los ácidos grasos polinsaturados son altamente susceptibles al ataque de las ERO 46. Teniendo en cuenta que el estrés oxidativo juega un papel importante en la patogenia de la periodontitis, se ha sugerido, que la suplementación con antioxidantes podría reducir o retardar el daño periodontal 47.
Farmacología redox aplicada a la enfermedad periodontal
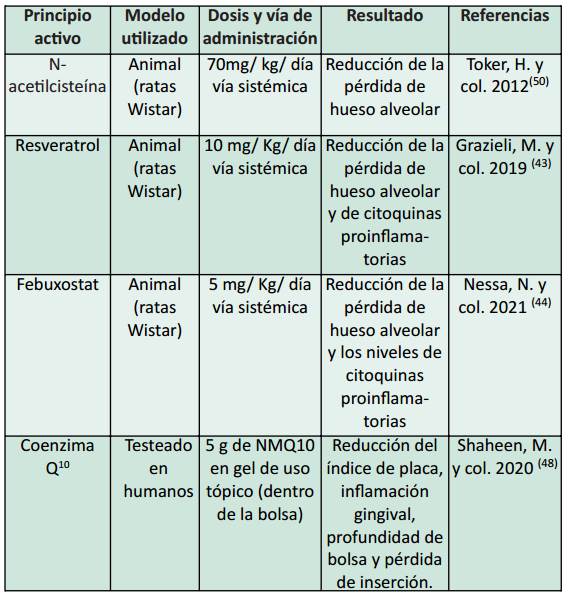
En base a las evidencias del rol principal del estrés oxidativo en la periodontitis, se ha comenzado a intervenir específicamente con farmacología redox, es decir, compuestos que puedan ser administrados a pacientes para atenuar los efectos deletéreos del estrés oxidativo a nivel local 48. En la tabla 1, se muestran los más relevantes de la literatura en el área. Actualmente se están ensayando fármacos como el resveratrol, un estilbenoide natural presente en diferentes alimentos, que a través de formulaciones nutracéuticas administradas por vía sistémica, ha demostrado ser eficaz en disminuir la velocidad de pérdida ósea en modelos animales de periodontitis expuestos al humo de tabaco 43. Por otro lado, existe evidencia de que el febuxostat, un inhibidor de la xantina oxidasa, también podría ser otro potencial agente para el tratamiento de la periodontitis. Como fue mencionado previamente el ácido úrico, producto enzimático de la xantina oxidasa, es uno de los principales antioxidantes de bajo peso molecular de la saliva. Paradójicamente, a pesar de la inhibición de esta enzima y en consecuencia de la disminución en la producción de ácido úrico, el febuxostat ha demostrado ser capaz de enlentecer la pérdida ósea y disminuir los niveles de citoquinas proinflamatorias y de biomarcadores de daño oxidativo (i.e. HNE) 44. Por el contrario, la mayoría de los antioxidantes convencionales presentan inconvenientes como la baja solubilidad en agua, estabilidad y corta duración de acción cuando son de aplicación tópica 48. Por otra parte, la farmacología redox también está siendo probada en la elaboración de nanomateriales (nanopartículas cargadas con fármacos) y presenta la ventaja de que el componente es liberado específicamente en el sitio terapéutico (aplicación tópica), con alta biocompatibilidad y baja toxicidad 49. Si bien el uso de nanopartículas cargadas con antioxidantes se encuentra en etapas iniciales de desarrollo, los pocos ejemplos reportados, entre ellos cargados con coenzima Q10, mostraron un gran potencial para el tratamiento de la periodontitis 48.
Discusión
Producto del progreso tecnológico en métodos analíticos y de la acumulación de conocimientos sobre el rol biológico de los diferentes componentes de la saliva, hemos profundizado nuestro entendimiento sobre el vínculo entre la composición salival y el mantenimiento de la salud bucal. Los componentes antioxidantes de la saliva aportan una primera barrera de defensa (por la presencia de compuestos de bajo peso molecular y proteínas) frente a las ERO y ERN que llegan o se forman en la mucosa oral. Estos oxidantes provocan un desequilibrio en la homeostasis redox celular que puede determinar un escenario patológico. Específicamente, como resultado de la combustión del tabaco en el acto de fumar, se vehiculizan una gran variedad de radicales libres que inducen estrés oxidativo en la cavidad bucal. De hecho, el tabaquismo es un importante factor de riesgo para la periodontitis, enfermedad agravada por la respuesta inflamatoria del huésped y cambios en las poblaciones microbianas, conjuntamente con diversos factores ya mencionados. Las ERO juegan un rol muy importante en la enfermedad periodontal y conducen a un escenario en el que las defensas antioxidantes endógenas claudican ante la sobreproducción de oxidantes. Esto lleva a mayor daño de los tejidos cercanos y a la progresión de la enfermedad, por eso no solo se profundiza cada vez más en los mecanismos moleculares involucrados, sino que además se evalúa el uso de farmacología redox para su tratamiento. A pesar de ser necesario una mayor cantidad de ensayos clínicos aleatorizados que examinen el impacto de agentes farmacológicos con actividad redox, resultados recientes sugieren que esta estrategia sería capaz de impedir la progresión de la enfermedad periodontal.
Conclusiones
El conocimiento de los sistemas antioxidantes salivales es de mayor importancia para la comprensión del desarrollo de muchas enfermedades locales y sistémicas asociadas a la salud bucal.
La periodontitis, que viene siendo ampliamente estudiada en términos redox, podría ser atenuada mediante el uso de antioxidantes exógenos. En ese sentido, la evidencia aquí analizada abre el camino para la aplicación de farmacología redox (Figura 4) como terapia adyuvante a las técnicas tradicionales en el tratamiento de la periodontitis y dan cuenta de lo valioso que es estudiar los mecanismos moleculares subyacentes para poder tomar decisiones más eficaces y certeras en la práctica odontológica.











 text in
text in