Introducción
La periodontitis es una de las enfermedades crónicas más comunes, con una elevada prevalencia que varía en diferentes grupos poblacionales 1,2. Afecta cerca del 46% de los adultos en Estados Unidos de América 1. A su vez, un reciente global burden demostró que más del 11% de la población mundial presenta formas severas 2. En América Latina cerca del 10% de la población joven es afectada por enfermedad periodontal, así como aproximadamente el 35% de los niños presentan gingivitis, con mayor prevalencia en Colombia (77%) y Bolivia (73%) 3. En adultos, la periodontitis afecta hasta 62.6% de los individuos 4. En Uruguay, datos del Primer Relevamiento Nacional de Salud Bucal revelaron que en la población joven (15 a 24 años), el porcentaje de individuos sin signos de sangrado, ausencia de sarro o profundidad de sondaje (PS) >4mm fue cercano al 30% 5. De forma semejante, los individuos entre 35 y 44 años presentaron una prevalencia de 16,5% y 5,9% de enfermedad periodontal moderada y severa, respectivamente 6 La mayor prevalencia fue encontrada in individuos entre 65 y 74 años, donde cerca del 34,7% presentó periodontitis moderada y 17% severa 6. Estos resultados enfatizan la importancia de prevención y tratamiento en los programas de salud bucal 7.
Las Paradenciopatías se caracterizan principalmente por presentar inflamación gingival, formación de bolsas periodontales y destrucción de los tejidos de soporte (hueso alveolar y ligamento periodontal) 8. Son el resultado de la interacción de un biofilm microbiano (factor etiológico necesario - pero no suficiente), un huésped susceptible y factores moduladores 9. Diversos estudios han demostrado la existencia de factores de riesgo, entre los que se mencionan: el tabaco 10, la diabetes 11-14 , obesidad/ sobre - peso 15,16 y factores genéticos 17,18. Estos elementos modulan la susceptibilidad o resistencia del hospedador ante cada desafío microbiano 9.
Recientes publicaciones plantean la posible asociación del cannabis (Cannabis sativa) con el desarrollo de la periodontitis 19-22. Sin embargo, el uso de los componentes del cannabis podría demostrar efectos positivos disminuyendo procesos inflamatorios 23. De esta forma, considerando el incremento de la prevalencia de consumo de cannabis en todo el mundo (llegando a 16% en Estados Unidos, 11% en Francia y 9% en Uruguay) 24, la investigación de los posibles efectos del cannabis en la cavidad oral y en los tejidos periodontales es fundamental para comprender su participación en el inicio y progresión de las enfermedades periodontales, y para poder trazar y dirigir políticas públicas de salud adecuadas.
Por lo tanto, el objetivo de esta Scoping Review fue analizar la posible influencia del consumo de cannabis en la enfermedad periodontal, relevando la evidencia disponible e identificando las variables asociadas en los estudios.
Metodología
Diseño del estudio: La Scoping Review es una revisión que desarrolla una búsqueda sistemática y sin determinar un análisis de la calidad metodológica de los estudios. Plantea una síntesis de los artículos disponibles en la literatura proporcionando una visión general del contenido existente, estableciendo futuras direcciones para los estudios y los “gaps” de la literatura. 25,26.
Estrategia de búsqueda: Se realizó una búsqueda estructurada en PubMed/ MEDLINE, Science Direct, LILACS, SciELO hasta mayo de 2017. Se aplicaron palabras clave y terminología controlada (términos MeSH) basados en preguntas estructuradas por el modelo PICO: "¿Cuál es la posible influencia del consumo de cannabis en la enfermedad periodontal ", donde se definió:
Población: individuos con enfermedad periodontal.
Intervención: uso de cannabis
Control: individuos que no usan cannabis
Resultado: alteración de la enfermedad periodontal
De esta forma, fue utilizada la estrategia de búsqueda siguiente: (periodontal disease OR periodontitis OR gingivitis OR gingival disease) AND (cannabis OR marijuana). Así mismo, fueron incluidos todos los diseños de estudio en humanos y animales.
Selección de estudios y criterios de elegibilidad: Cuatro investigadores participaron de la búsqueda de artículos (MM, AF, LC y EA) para el diseño de la revisión, asesorados por una Licenciada en Bibliotecología. Los registros recuperados se cargaron en el software EndNote (Thomson Reuters, Rochester, Nueva York, NY, EE.UU.), con el objetivo de eliminar duplicados y crear una biblioteca virtual. Los investigadores leyeron y filtraron los títulos y resúmenes de todos los registros bajo criterios predefinidos. Ninguna restricción de idioma y año fue aplicada. Fueron incluidos todos los artículos originales. Cartas para el editor, artículos in vitro y revisiones no fueron incluidos en la presente revisión. A su vez, de todos los artículos recuperados se realizó un seguimiento cita por cita de la bibliografía respectiva de forma de ampliar la búsqueda.
Resultados
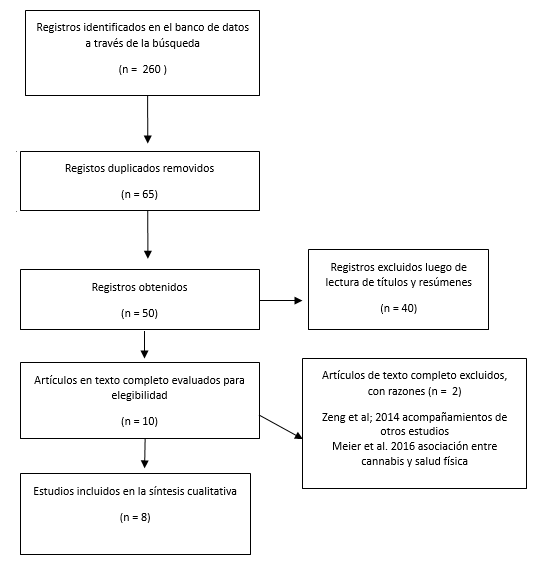
Un total de 260 registros fue el resultado de la búsqueda, de los cuales se recuperaron un total de 65 artículos después de la remoción de los duplicados. Posteriormente a la lectura de títulos y resúmenes, diez artículos quedaron para lectura completa del texto. Dos de estos artículos fueron excluidos 27,28. Las razones de exclusión son presentadas en la figura 1. Finalmente, ocho artículos cumplían con los criterios de inclusión y de esta forma, fueron incluidos en la presente revisión (Figura 1).
Estudios In vivo: Estudios en ratones evaluaron la influencia de la inhalación de cannabis y cannabidiol (CDB) en la enfermedad periodontal a través la pérdida de inserción y la densidad ósea. Así, observaron una mayor pérdida de hueso y menor densidad ósea en los ratones que estuvieron expuestos a cannabis o el cannabidiol, demostrando que esas sustancias son capaces de influenciar negativamente los tejidos periodontales.
Casos clínicos: Dos casos clínicos fueron incluidos en la presente revisión 29,30. Los trabajos revelan que el consumo prolongado de cannabis puede resultar en un agrandamiento gingival con características clínicas semejantes a lo que acontece por la acción de la fenitoína 30 además de periodontitis crónica severa localizada 29.
Estudios epidemiológicos: cuatro estudios epidemiológicos fueron recuperados. En la Tabla 1 es posible observar las principales características de los mismos. El diseño metodológico de la mayoría de los estudios fue transversal 19,20,31 en cuanto uno fue prospectivo a partir de una cohorte de nacimientos 27. Cincuenta por ciento de los estudios fueron de base poblacional 19,27 mientras que uno fue conducido con estudiantes de secundaria 20 y otro con comunidades aborígenes de Australia. Tres de cuatro investigaciones fueron desarrolladas en adultos 19,27,31 mientras solamente uno evaluó adolescentes 20. De manera similar, Shariff et al. 19 ha incluido pacientes con diabetes y con tratamiento periodontal pasado mientras López et al. 20 ha sido el único que evaluó los hábitos de higiene de los pacientes.
Aunque la exposición al cannabis y la clasificación de enfermedad periodontal han sido categorizadas de forma diferente entre los estudios revisados, se observa que el uso de cannabis se relaciona con la enfermedad periodontal (Tabla 2). Una asociación significativa entre el consumo de cannabis y prevalencia de periodontitis fue observada 21,31 donde usuarios de cannabis presentaron una prevalencia 44% mayor de enfermedad periodontal en relación a individuos que no hacen uso de la droga 31. De forma semejante, datos poblacionales de la Encuesta Nacional de Exámenes de Salud y Nutrición de los Estados Unidos mostraron que el uso recreativo de cannabis fue asociado con profundidad de sondaje avanzada y pérdida de inserción clínica 19. Por otro lado, un estudio conducido en estudiantes chilenos encontró una razón de ODDS 53% menor de Gingivitis Ulcero Necrotizante (GUN) en los individuos que nunca usaron cannabis comparados con que siempre la usan 20. Las demás asociaciones no fueron estadísticamente significativas 20.
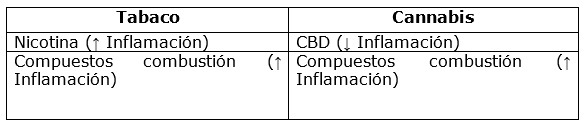
Influencia del cannabis en la enfermedad periodontal: El Cuadro 1. muestra el impacto del cannabis en la enfermedad periodontal según las acciones de sus componentes químicos. Autores adjudican como causantes de la inflamación crónica producida en pacientes consumidores de cannabis a las altas temperaturas y los químicos liberados durante el consumo, seguido del síntoma clínico de xerostomía (por ser una droga con propiedades parasimpaticolíticas), lo que potenciaría el efecto patológico 32. Se debe tener en cuenta que los constituyentes no cannabinoides del cannabis (productos de la combustión) son similares a los del tabaco, pudiendo influir local y sistémicamente. 21,22,33. Se destaca que solamente bajas concentraciones de CBD pueden causar efecto antiinflamatorio, mientras que altas dosis tendrían efecto contrario 34.
Tabla 1: Cuadro en el cual se comparan los estudios epidemiológicos llevados a cabo hasta la fecha. Se señalan las variables relevantes para generar un protocolo de investigación estandarizado que permita comparar resultados
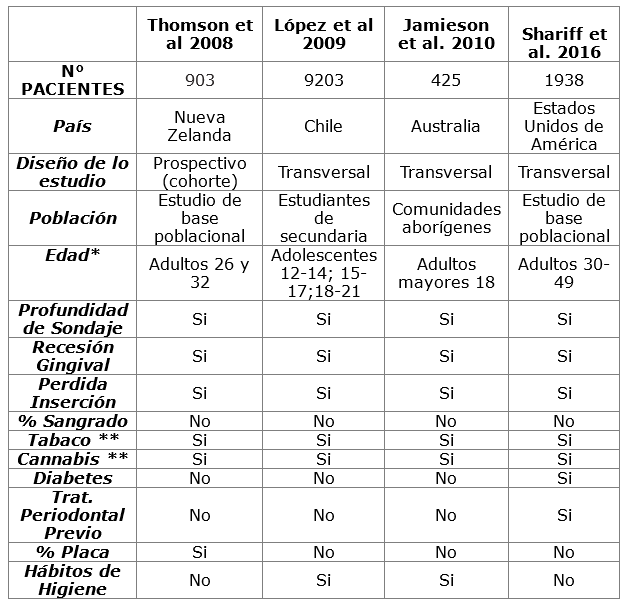
*Mayor a 18 años de edad. **Frecuencia, cantidad y tiempo desde el comienzo de consumo, recreacional o por indicación médica
Tabla 2: Resumen de los trabajos clínicos cuyo objetivo era probar asociación entre presencia de enfermedad periodontal y consumo de cannabis
| Autor | Exposición Cannabis | Registro Periodontal | Enfermedad Periodontal |
|---|---|---|---|
| Asociación / Calidad del estudio | |||
| Thomson 2008 | “No exposición”, “Alguna exposición”, “Alta exposición” | 3 sitios / 2 cuadrantes (26 años) - Boca completa (32 años) (excepto 3° molares e implantes) | PIC ≥ 3mm |
| Fuerte asociación entre uso cannabis y prevalencia de periodontitis | |||
| López 2009 | “Nunca usó cannabis”, “Uso regular cannabis” | 6 sitios /Incisivos, 1° y 2° Molares | PIC ≥3mm, GUN. |
| Solo se encontró asociación para el caso del “Nunca usó” y menor prevalencia de GUN. No hubo asociación para ningún otro caso | |||
| Jamieson et al. 2010 | “Nunca ó una sola vez” “Uso esporádico” “Uso frecuente” | 2 sítios / Boca completa (excepto 3° molares e implantes) | PS ≥ 5mm y PIC ≥4mm (“periodontitis moderada”) |
| Usuarios de cannabis presentaron una prevalencia 44% mayor de enfermedad periodontal que individuos que no hacen uso de cannabis | |||
| Shariff 2016 | “Nunca usó” (No-FRC) “Uso todos los meses por un año” (FRC) | 6 sítios / Boca completa (excepto 3° molares e implantes) | PS ≥ 4mm y PIC ≥3mm (“periodontitis incipiente”) |
| Se encontró fuerte asociación para FRC y presencia de PS Y PIC, respecto a los no-FRC | |||
ACC: Aumento Corona Clínica; PS: Profundidad de Sondaje; PIC: Perdida de Inserción Clínica; GUN: Gingivitis Ulcero Necrotizante; FRC: Cannabis Recreacional Frecuente. No-FRC: Cannabis Recreacional No Frecuente.
Discusión
La presente revisión es la primera Scoping Review en analizar la relación entre la Enfermedad Periodontal y el consumo de Cannabis sintetizando la evidencia disponible. De esa forma, ocho artículos fueron incluidos abarcando desde estudios en animales y casos clínicos hasta observacionales (prospectivos y transversales), indicando una influencia y posible asociación de los individuos que hacen uso de cannabis sobre la periodontitis. Así, este asunto es muy importante en términos de salud pública. Los servicios de salud deben generar conciencia del riesgo de que los usuarios regulares y esporádicos de cannabis puedan presentar dicha patología.
Cannabis sativa L. (Hemp), ha sido conocido durante muchos años por el uso de sus fibras para la industria textil, ropas, construcciones materiales y papel 35,36. No fue sino hasta 1930, cuando a partir del extracto de cannabis se aislaron los compuestos denominados cannabinoides, los más abundantes dentro del extracto son: el delta-9-tetrahidrocannabinol (THC), quien presenta el mayor efecto psicoactivo, su precursor el cannabidiol así como un producto catabólico del THC formado espontáneamente, el cannabiol. Estos dos últimos carecen del efecto psicoactivo del THC, pero se les ha evidenciado actividad anticonvulsivante 35,37.
Actualmente, se conocen diferentes tipos de cannabinoides según su origen: 1) los fitocannabinoides, derivados de la planta de cannabis; 2) los cannabinoides endógenos (endocanabinoides) que son producidos por el propio organismo de seres humanos u otros animales y 3) los cannabinoides sintéticos, de composición química idéntica, pero producidos en el laboratorio 38. La caracterización de estos y otros derivados, así como los receptores con los que interactúan, han incrementado la comprensión del Sistema Endocannabinoide 35,39.
El THC es el mayor constituyente psicoactivo y participa como un agonista parcial en los receptores cannabinoides tipo I (CB1) y tipo II (CB2). El CBD no es psicoactivo y es un antagonista de CB1 y CB2. Actúa en múltiples otros receptores y puede ser un agonista en algunos sistemas 39. Efectos farmacológicos del CBD están mediados por proteínas G acopladas a receptores, CB1 y CB2. Cuando se activan, los receptores CB1 inhiben la transmisión simpática a través de la acción sobre los canales de calcio y de potasio dependientes de voltaje, que son conocidos por modular la actividad epileptiforme y convulsiva. Los receptores CB2 son primariamente expresados en el sistema inmune y tienen limitada expresión en el sistema nervioso central. Los efectos del CBD son receptores CB2 independientes 40,41. Así, el cannabis es típicamente fumado, vaporizado o consumido oralmente en comidas, tés o capsulas 41.
De esta forma, aproximadamente 3,8% de la población mundial consumió cannabis en 2014 (183 millones de personas): siendo Islandia el mayor exponente (18,3% de la población en los últimos 12 meses), seguido por Estados Unidos (16,2%), Chile en la quinta posición (11,83%), Francia en la sexta (11,1%), ubicando a Uruguay undécimo con un 9.3%42. Según el Informe Mundial sobre Drogas del 2011 (publicación anual de la Oficina de las Naciones Unidas), en el 2006, un 14.8% de los jóvenes uruguayos habían consumido cannabis el último año mientras que los adultos solo un 6 %43. El Informe Final de la VI Encuesta Nacional en Hogares sobre Consumo de Drogas publicado por la Junta Nacional de Drogas en el 2016 44, muestra que desde 2011 Uruguay aumentó 3 puntos porcentuales el consumo de marihuana, siendo el más extendido en la población luego del alcohol, tabaco y tranquilizantes. El 23,3 % de las personas de entre 15 y 65 años ha consumido marihuana alguna vez en su vida, en tanto un 9,3 % relata que lo hizo en los últimos 12 meses (161.000 personas) y un 6,5 % en los últimos 30 días. 21.355 uruguayos consumen marihuana diariamente.
A pesar de que el cannabis es considerado una droga “liviana” no más perjudicial que el café o el tabaco, el consumo de cannabis puede causar efectos crónicos secundarios, como enfermedad periodontal 21,32. Si bien la temperatura del humo de combustión es más alta que la del cigarro 30. Se reportan lesiones similares a pacientes consumidores de tabaco, pero siempre de menor severidad 30. Tanto el consumo agudo como crónico, llevan a una estomatitis nicotínica y uvulitis 30. Se puede estrechar aún más esta relación entre consumo de tabaco y cannabis, en una experiencia que menciona que “no todos los consumidores de tabaco fuman cannabis, pero si el 90% de los consumidores de cannabis fuman tabaco” 45. Esto dificulta el diagnóstico de los efectos entre ambos tipos de sustancias en los estudios. Por eso, algunos reportes practican el análisis estadístico también con individuos que no fuman tabaco y permaneciendo aún la asociación con las patologías periodontales19. Considerando que la mayor parte de los individuos que fuman cannabis también hacen uso de tabaco 31, esto puede potenciar los efectos nocivos de ambas drogas.
Múltiples investigaciones han demostrado la asociación del consumo de cannabis con elevados niveles de biofilm oral, caries, cándida albicans (pero no candidiasis) 41, leucoedema, leucoplasia 46 y estomatitis 37,41. Además, la exposición aguda al cannabis se asocia con un aumento de enfermedades de las vías respiratorias y el aumento de prevalencia de cáncer de la región orofaríngea 39. Reportes indican que el 58,3% de las mujeres y el 47,4% de los hombres informaron pulpitis durante el consumo de cannabis. La pulpitis podría añadirse a la lista de efectos vasculares adversos relacionados con el consumo de cannabis ya informados (conjuntivitis, taquicardia, hipotensión, angina de pecho)47,48. Así, es importante destacar que solamente las bajas concentraciones de CBD pueden causar efecto antiinflamatorio siendo las dosis elevadas las perjudiciales34. En el caso del cáncer oral, se han hallado en el humo de cannabis compuestos proinflamatorios y carcinógenos, en composición semejante al humo de tabaco, incluyendo el monóxido de carbono 22,33,49,50.
THC y CBD estimulan la liberación de Prostaglandina E2 (PGE2) desde las células sinoviales e inhiben la síntesis de leucotrienos de las células polimorfo nucleares humanas in vitro51. Por otra parte, también ha sido reportado que existe supresión de mediadores proinflamatorios por parte de los CBDs 52-54, tales como IFN - γ (Interferón gamma), FNT - α (Factor de necrosis tumoral alfa), IL-1b (Interleucina 1 beta)55 e IL-10 (Interleucina 10) 56. En otro estudio, se inyectaron sistémicamente dosis de CBD en ratas, concluyendo que son una emergente clase de mediadores que pueden estar envueltos en el control de la patología periodontal, a causa de su función en la disminución de la inflamación 57. Contrario a estos hallazgos, autores realizaron el mismo ensayo clínico, observando aumento en la pérdida de hueso en el área de furcación de los dientes con periodontitis inducida, mientras que no se observó efecto alguno en sitios periodontalmente sanos, considerando que podría estar relacionado con una alteración de la función inmune durante el proceso de reabsorción ósea, o incluso la activación de receptores específicos que podrían aumentar la destrucción ósea 58. En este sentido, ha surgido alguna especulación sobre el sistema endocanabinoide, el cual podría desempeñar un papel en la regulación del metabolismo óseo 59,60.
Por otro lado, fueron identificados receptores específicos para esta sustancia en los tejidos periodontales, que fue seguido por un aumento en la liberación de anandamida, un agonista del receptor cannabinoide derivado del ácido araquidónico 61. Confirmando estos datos, se estudió la relación entre el sistema endocannabinoide (receptores y mediadores producidos por nuestro organismo) y enfermedad periodontal, describiendo una proliferación de fibroblastos gingivales al activar dicho sistema, sugiriendo un nuevo camino para la terapéutica de las enfermedades periodontales 62,63. Un reciente estudio muestra como células madres mesenquimáticas gingivales humanas, pre-tratadas con CBD antes del trasplante, aumentan su supervivencia en el huésped al modular su respuesta inmune e inflamatoria 41,64.
Por su parte, Rawal y col., en el año 2012 63, en su trabajo realizan la descripción de dos cuadros clínicos en pacientes consumidores. Las características que más se repetían eran inflamación de papilas y margen gingival, con presencia de áreas nodulares, similares a las que se producen en pacientes consumidores de dilantina (fenitoína), dándose principalmente en dientes anteriores. Es interesante el análisis que ellos realizan de la posible coincidencia de estos cuadros clínicos, encontrando similitudes en los componentes químicos de ambas sustancias: 1) El cannabidiol (CBD) también es usado como anticonvulsivo, 2) CBD puede potenciar los efectos de la fenitoína y fenobarbital, 3) CBD y fenitoína poseen similar estructura, presentando anillos en mismas disposiciones. Los autores concluyen que “ambas cumplen con los requisitos estequiométricos sugeridos para la acción de un fármaco anticonvulsivo”, deduciendo que la inflamación se puede dar por el mismo mecanismo 63.
En el año 2016, Momen-Heravi y col., reportaron un caso clínico de un paciente de sexo femenino de 23 años, diagnosticada con enfermedad periodontal. La paciente relató consumir cannabis durante 3 años diariamente. El autor relata inflamación de papilas y márgenes gingivales, principalmente en la zona anterior de la mandíbula, lugar donde posicionaba el cigarrillo de cannabis. En la imagen radiográfica se observó pérdida de hueso alveolar en dicha zona 29. Considerando el tratamiento, autores recomiendan la modificación del comportamiento, la terapia no quirúrgica y quirúrgica para el manejo exitoso de la periodontitis relacionada con cannabis 29.
En este contexto, el primer estudio epidemiológico que investigó la relación entre cannabis y enfermedad periodontal se llevó a cabo el año 2008 por Thomson y col. 21 en Nueva Zelanda. La población estaba conformada por adultos que habían nacido en un hospital de dicho país entre los años 1972 y 1973. El examen clínico periodontal se realizó en dos ocasiones, a los 26 y a los 32 años. El sistema de registro incluyó 2 cuadrantes en 3 sitios por diente, examinando la Recesión Gingival (RG), Profundidad de Sondaje (PS) y Pérdida de Inserción (PI). La exposición al cannabis fue valorada en forma auto reportada. A partir de dicha información se obtuvieron 3 grupos: 1) No exposición 2) Baja Exposición (1-40 ocasiones en el último año) y 3) Alta exposición (más de 41 exposiciones el último año). También se consultó sobre el nivel socioeconómico, el consumo de tabaco, sexo, causa de visitas al servicio dental, y acumulación de biofilm 21.
Un 32,3 % no habían consumido cannabis el último año, un 47,4% y 20,2% lo habían hecho en baja y alta exposición respectivamente. La mayoría de los consumidores eran hombres, de bajo nivel socioeconómico y escasa frecuencia de visita al odontólogo, con niveles significativos de placa bacteriana 21. Esto último confirma lo hallazgos previos que revelan una tendencia a “despreocuparse” por su estado de salud, lo que a su vez puede asociarse con patologías bucales 32. Un 33% eran fumadores de tabaco y un 17 % ex fumadores. Coincidiendo con Fairman 45, los consumidores frecuentes de cannabis lo eran también del tabaco, y a medida que aumentaba la edad aumentaba también el consumo de este último 32.
Los resultados reportados muestran que el consumo de cannabis estaba fuertemente asociado a la prevalencia de periodontitis, donde las mayores diferencias se encuentran en PS >5mm. Sin embargo, no se encontró asociación entre el consumo de ambas sustancias al mismo tiempo y la patología periodontal. Según Thomson, el consumo de cannabis puede ser un factor de riesgo periodontal cuando se usa independiente del tabaco, aumentando la prevalencia e incidencia cuanto mayor es la edad del individuo 21.
La asociación con la gingivitis úlceronecrotizante (GUN) también fue investigada en una muestra de adolescentes. En este caso se midieron 6 sitios en todos los incisivos y segundos molares, y sumado a la observación se generó el diagnóstico de GUN 20. Al igual que Thomson y col., encontró como limitante el no saber la dosis y el tiempo desde que consumen cannabis, ya que el cuestionario incluía “nunca consumió” ó “consumo regular” representando un 18.9% y un 6% respectivamente. Dentro de los que consumían regularmente, solo un 16,3% eran fumadores, al contrario de los estudios de Thomson y col, Fairman. El diagnóstico de GUN no consideraba el dolor ni sangrado, por eso la alta prevalencia de la misma comparado con otros estudios, no pudiéndose encontrar relación con el consumo de cannabis 20,21,45.
Por su parte, en el año 2016, Shariff, realizó las mismas observaciones en adultos de EEUU, en donde el 26.6% eran usuarios frecuentes de la droga, de ese grupo, un 29,2% presentaban PS ≥ 4mm, el 24,8% PS≥ 6 mm, y el 24, 5% PS≥ 8 mm, comprando estos datos con los 22,3%, 19,2% y 18,9% de los usuarios no frecuentes. Concluye que el uso frecuente de cannabis, se asocia con mayor profundidad de sondaje, y recesión gingival, así como mayores probabilidades de tener periodontitis severas 19.
Aunque los estudios presenten una metodología muy variable, los estudios in vivo, casos clínicos y estudios epidemiológicos parecen indicar una asociación del cannabis en la enfermedad periodontal, pudiendo aumentar la pérdida de hueso, agravando o iniciando la periodontitis. Los autores del presente estudio recomiendan incluir las variables allí nombradas (Tabla 1), con el fin de lograr un protocolo de investigación estandarizado, inexistente hasta el momento, que permita comparar resultados en los diferentes estudios que se realicen desde la fecha hacia un futuro. Los autores recomiendan que nuevos estudios epidemiológicos de preferencia prospectivos o estudios de caso control sean conducidos, ya que ensayos clínicos no serían éticamente aceptables. Además, es importante que los futuros estudios realicen los análisis estadísticos, controlando los individuos que hagan uso del tabaco, con finalidad de disminuir posibles sesgos. Los resultados de la presente revisión deben ser interpretados con cuidado ya que se basan en estudios con metodologías diversas.
Conclusiones
Se desconoce el mecanismo específico por el cual el cannabis actúa en los tejidos gingivales, como consecuencia de la escasez de trabajos realizados hasta el momento, a las diferencias que existe en la metodología empleada y las poblaciones de estudio. Sin embargo, el consumo del Cannabis parece agravar la enfermedad periodontal. Así, los servicios de salud deben tomar medidas para aumentar la conciencia de la fuerte probabilidad de que los usuarios regulares de cannabis puedan presentar dicha patología.











 texto en
texto en