Introducción
La práctica implantológica ha contribuido de manera decisiva al logro de la rehabilitación funcional y estética del edentulismo total y parcial. Tratamientos muy exitosos han sido diseñados y protocolizados en cada situación con altas tasas de éxito y de supervivencia de los implantes y de las prótesis cualquiera sea el tipo y modalidad de tratamiento1. Sin embargo, la colonización microbiana en el sistema implante-pilar-restauración con prevalencia de Porphyromonas gingivalis, Prevotella intermedia y Aggregatibacter actinomycetemcomitans entre otras, han mostrado ser capaces de producir enfermedad peri-implantaria, caracterizada como mucositis en su estado inflamatorio marginal y como perimplantitis cuando la interfase hueso-implante es invadida y colonizada por la acción bacteriana desarrollando una infección peri implantaría1 . Esto ocurre desde el momento de la colocación del implante, atribuido a la flora presente en la cavidad bucal, así como también durante la cirugía de segunda fase y a la filtración en el espacio o “gap” entre pilar-implante y entre pilar-restauración, una vez colocada la prótesis. Este “gap” generalmente se encuentra a nivel de la cresta alveolar siendo susceptible a la colonización bacteriana y representando un reservorio de microorganismos2,3..Este fenómeno ampliamente estudiado ha dado origen a diferentes propuestas de medidas preventivas y terapéuticas orientadas al control del biofilm en el entorno de la restauración implantoasistida3. Se le agrega a este proceso, otra área crítica como ser la cámara interna del implante y del sistema implante-pilar-restauración. La contaminación de estos sitios durante la cirugía de segunda fase o la ejecución de los procedimientos protésicos, incluso durante la instalación de la prótesis definitiva, origina una colonización en un ambiente cerrado, no accesible a los elementos de higiene oral (mecánica y química)4. En un estudio realizado tras 14 días de la instalación de la prótesis, el recuento de microorganismos fue mayor en pilares colados respecto a los maquinados, confirmando la microfiltración en el espacio comprendido entre el pilar y el implante5. Este intercambio se da en ambos sentidos: bacterias ingresando a la cámara así como emergiendo de la misma2,6. De esta forma la cámara interna y la conexión pilar-implante se constituyen en un reservorio de actividad microbiana capaz de afectar el entorno del implante7..La contaminación interna es frecuente y capaz de persistir un largo período de tiempo, constatándose filtración microbiana en todos los sistemas de implantes y pilares analizados8,11.
Justificación
Los protocolos tradicionales no han resuelto la problemática planteada y en consecuencia no se han desarrollado medidas específicas para el control de la colonización interna. Con el propósito de reducir la microfiltración se han desarrollado pilares en nitinol (metal con memoria de forma) que en estudios in vitro ha disminuido el micro-gap a 1 micra. Otro camino experimentado es la utilización de agentes antimicrobianos; la clorhexidina ha sido estudiada colocándola en el interior del implante estableciendo la posibilidad de reducir a corto plazo la población microbiana a ese nivel1,13. Groenendijk y col.14, ensayaron el efecto de la clorhexidina al 2%, consiguiendo un resultado inicial alentador con una reducción significativa de UFC (48%grupo control-suero vs. 17% en el grupo experimental-clorhexidina al 2%). Los indicadores periodontales tal como el flujo de fluido gingival, índice de placa e índice gingival, no variaron significativamente en ambos grupos. Un efecto positivo se establece en el tejido peri implantario ya que la clorhexidina puede permear desde el interior a través del “microgap” y reducir la colonización en el surco gingival. Se cuestiona el efecto a largo plazo de este procedimiento por la escasa vida media del producto una vez utilizado. En el estudio realizado por Groenendijk E. y col. no se observaron resultados concluyentes acerca de un control efectivo de la contaminación microbiana interna del implante utilizando la clorhexidina14. La microflora oral juega un papel importante en la iniciación y perpetuidad del proceso infeccioso a nivel de la cavidad bucal. Es por ello, que la investigación de los mismos, y su identificación contribuye con la selección y la aplicación de medidas preventivas, definiendo la etiología e instaurando el tratamiento adecuado15. La aplicación de métodos moleculares en la identificación de patógenos orales, posibilita un mejor manejo y seguimiento de los pacientes, como el multiplex-PCR que permite la detección simultánea de los microorganismos colonizadores de la cámara interna del implante y del sistema implante-pilar16.
El objetivo general del presente estudio, in vitro, fue desarrollar diferentes medidas de control del biofilm en la cámara interna del implante, por medio de la detección de las especies bacterianas presentes y el posible efecto de los agentes antimicrobianos utilizados sobre la superficie del implante. Los objetivos específicos fueron: 1) determinar la acción de diferentes agentes antimicrobianos (hidróxido de calcio, yodoformo y combinados) para combatir la flora del biofilm, 2) cuantificar la microbiota, 3) obtener conclusiones de aplicación clínica en el control de la colonización microbiana de la cámara interna del implante y del sistema implante-pilar.
Materiales y métodos
Se describe como un estudio in vitro de tipo experimental.
1. Selección de medidas antimicrobianas - La selección de los agentes antimicrobianos tuvo en cuenta el cumplimiento de los siguienets criterios:
Ser específicos en relación a la flora prevalente
No afectar la integridad de los componentes del sistema implante-pilar-restauración.
No actuar en ningún caso como material cementante
Ser económico, de sabor agradable y de fácil manipulación.
No agredir a los tejidos gingivales.
Se seleccionaron como agentes antimicrobianos: yodoformo, hidróxido de calcio y una combinación de ambos en un 50% cada uno, (Hidróxido de Calcio en polvo, Leduc®), Yodoformo en polvo, Leduc ®). En todos los casos se utilizó como vehículo Metilcelulosa (Leduc ®)
2. Cepas bacterianas- Se utilizaron las siguientes cepas: Porphyromonas gingivalis (BAA-308), Prevotella intermedia (ATCC 25611), Tannerella forsythia (ATCC 43037) y Fusobacterium nucleatum (ATCC 25586).
3. Grupos de estudio -
1.1. Se utilizaron 80 implantes de titanio, cilíndricos, de conexión externa de 8,5 mm de largo x 3,75 mm de diámetro (3i FI-USA®), con tornillos de tapa respectivos y se conformaron cuatro grupos:
a) Grupo control (GC) : 20 implantes sin colocar nada en la cámara interna del implante
b) Grupo experimental 1(GE1): 20 implantes pinceladas con hidróxido de calcio y metilcelulosa en la cámara interna del implante.
c) Grupo experimental 2(GE2): 20 implantes pincelados con yodoformo y metilcelulosa en la cámara interna del implante.
d) Grupo experimental 3(GE3): 20 implantes pinceladas con hidróxido de calcio, yodoformo y metilcelulosa en la cámara interna del implante.
Para introducir los agentes químicos se utilizaron agujas y jeringas estériles descartables y para la toma de la muestra puntas de papel estériles Nº25. Los implantes del GC fueron colocados en un frasco estéril con tioglicolato17,18 y una suspensión de bacterias fue introducida en dicho medio de cultivo.
Al grupo experimental 1 (GE1) constituido por 20 implantes se le colocó hidróxido de calcio en las cámaras correspondientes (Fig.1). Para ello se pesó 1gr. de este compuesto en balanza electrónica y con técnica aséptica. Se volcó sobre un vidrio estéril y se colocaron dos gotas de metilcelulosa sobre el mismo, procediendo luego a la mezcla. Abrimos un implante, le quitamos la tapa y con una jeringa y aguja descartables tomamos la suspensión e introducimos una gota dentro de la cámara.
Procedimos luego a colocar el tornillo de tapa y con una gasa estéril limpiamos el excedente. Una vez limpio, mediante una pinza estéril lo colocamos en un frasco estéril el medio de tioglicolato y la suspensión de bacterias.
Al Grupo experimental 2(GE2) se le colocó yodoformo con metilcelulosa en las cámaras correspondientes. Para ello pesamos 1gr. de este compuesto, con balanza electrónica y con técnica aséptica Lo volcamos sobre un vidrio estéril y colocamos dos gotas de metilcelulosa sobre el mismo, procediendo luego a la mezcla. Abrimos un implante, quitamos el tornillo de tapa y con una jeringa y aguja descartables se tomó una muestra de la suspensión e introducimos una gota de la misma dentro de la cámara. Procedimos luego a colocar el tronillo de tapa limpiando con una gasa estéril el excedente. Una vez limpio, mediante una pinza estéril lo colocamos en el cultivo en medio de tioglicolato. El mismo procedimiento fue realizado en los diecinueve restantes.
Al grupo experimental 3 (GE3) se le colocó hidróxido de calcio y yodoformo con metilcelulosa en las cámaras correspondientes. Para ello pesamos 1gr. de este hidróxido de calcio y 1 gr. de yodoformo con balanza electrónica y con técnica aséptica. Lo volcamos sobre un vidrio estéril y colocamos dos gotas de metilcelulosa sobre el mismo, procediendo luego a la mezcla. Abrimos un implante, quitamos el tronillo de tapa y con jeringa y aguja descartables tomamos una muestra de la suspensión e introducimos una gota de la misma dentro de la cámara. Procedimos luego a colocar el tornillo de tapa y se limpió con una gasa estéril todo el excedente. Una vez limpio, mediante una pinza estéril lo colocamos en el cultivo con el medio de tioglicolato. Se repitió el procedimiento con los diecinueve implantes restantes. El contenido del frasco consistió en un medio de cultivo tioglicolato con una suspensión de 107-8x108 UFC de Porphyromonas gingivalis, Prevotella intermedia, Tannerellaforsythia y Fusobacterium nucleatum. Estas bacterias se encuentran entre las mas prevalentes en la enfermedad peri-implantaria 17,21) (Fig. 2).
Se incubaron los frascos a 37ºC durante 7 días (Fig.3). Una vez transcurrido ese tiempo, se procedió a retirar a los implantes del cultivo de tioglicolato mediante una pinza estéril y se limpiaron y se secaron con gasa estéril. Retirados los tornillos de cierre, se introdujeron puntas de papel estériles Nº25 (Fig.4) en cada cámara interna de cada uno de los implantes de los 4 grupos. Cada una de las 80 tomas se introdujeron en 80 tubos con una solución de 1,5 ml de RTF (Reduced Trasport Fluid)22. Toda la manipulación de los implantes (tornillado y destornillado de los tronillos de cierre) fue realizada por el mismo operador.
Posteriormente se prepararon las diluciones. En una gradilla por muestra utilizamos: un tubo eppendorf con 1,5 ml de RTF con las correspondientes 2 puntas de papel Nº25 y 2 tubos eppendorf con 900 μl de RTF. Se procedió a diluir la muestra para su cuantificación (Fig.5). En cada muestra había 1,5 ml de RTF con las correspondientes 2 puntas de papel Nº25. Se tomaron 100 μl de la muestra y se colocaron en un eppendorf con 900 μl de RTF. (1ª dilución: 1:10). Luego se tomaron 100 μl de la primera dilución y se colocaron en otro tubo con 900 μl de RTF (2ª dilución: 1:100). Se tomaron 100 μl de la primera y 100 μl de la segunda dilución y se sembraron en placas con medio agar base con sangre, con menadiona y hemina, se expandieron con varilla de extensión de vidrio y se incubaron las placas durante 14 días a 37ºC en anaerobiosis estricta23-24.
Transcurrido el tiempo de incubación se procedió a la lectura de las placas, realizando el recuento de UFC (unidades formadoras de colonias) de cada grupo de estudio, mediante lupa estereoscópica.
Resultados
Transcurridos 14 días se abrieron las placas. (Figs.6 y 7)
Grupo control- Muestras obtenidas de las cámaras de implantes sin compuestos químicos. Todas las placas sembradas con las dos diluciones mostraron desarrollo de colonias. Las muestras sembradas de la primera dilución mostraron: 2 placas con más de 3.000 UFC, 2 placas con 6 UFC, 8 placas con 4 UFC, 6 placas con 3 UFC, 2 con 1 UFC. Las muestras sembradas de la segunda dilución: 2 placas con más de 100 UFC, 2 placas con 5 UFC, 2 placas con 3 UFC, 2 con 4 UFC,6 con 2 UFC,4 con 1 UFC y 2 placas sin crecimiento.
GE1- Muestras obtenidas de las cámaras de implantes con hidróxido de calcio y metilcelulosa. De las placas sembradas de la primera dilución en una placa desarrollaron 2 UFC, las segundas diluciones no mostraron desarrollo de microorganismos.
GE2- Muestras obtenidas de las cámaras de implantes con yodoformo y metilcelulosa. Dos placas sembradas de la primera dilución de las muestras tuvieron desarrollo con 2 UFC. Dos placas sembradas de la segunda dilución de las muestras tuvieron desarrollo con 1 UFC.
GE3- Muestras obtenidas de las cámaras de implantes con mezcla de hidróxido de calcio, yodoformo y metilcelulosa. Dos placas sembradas de la primera dilución tuvieron desarrollo con 1 UFC. Las muestras sembradas de la segunda dilución no tuvieron desarrollo.
Los resultados de este estudio demuestran que existió una filtración de microorganismos hacia la cámara interna del implante. Se desarrollaron colonias en todas las placas sembradas con tomas sin agentes químicos (100%). La colocación de los agentes químicos introducidos en las cámaras de los implantes resultó favorable ya que disminuyeron el número de unidades formadoras de colonias de todas las muestras, tanto en la primeras diluciones (95%- GC1 y 90%- GC2 y GC3) como en las segundas diluciones (90%-GC2 y 100% -GC1 y GC3) obteniéndose los resultados más exitosos con la utilización de la mezcla de hidróxido de calcio y metilcelulosa y en combinación con el yodoformo y metilcelulosa.
El análisis descriptivo de los resultados, identificó una diferencia considerable en el crecimiento de las UFC en el grupo “sin agente” (grupo control) en relación con los otros grupos experimentales, con una disminución en la segunda dilución, pero no se identificó una reducción significativa del recuento de UFC entre ellos (Fig.8). El uso de hidróxido de calcio ya sea utilizándolo solo o en combinación con el yodoformo, mostró el menor recuento de las UFC de los grupos estudiados. El tiempo de duración del efecto de este agente en este estudio no se pudo determinar.
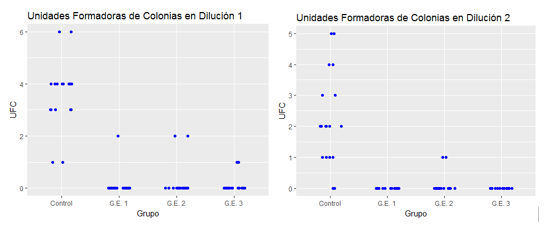
Fig. 8 El promedio de UFC en el grupo control fue de 3,56, en el grupo experimental 1 de 0,1, en el G.E. 2 de 0,2 y en el G.E. 3 de 0,1. Se puede observar una disminución significativa en la cantidad de UFC en los grupos tratados con algún agentemicrobiano respecto al grupo control. Al comparar los distintos grupos experimentales no se observa una diferencia significativa entre ellos. Al analizar los resultados en la segunda dilución, se obtienen los mismos resultados.
Discusión
El presente estudio permitió comparar la eficacia de dos agentes antimicrobianos y la combinación de ambos, en relación a la microflora que coloniza la cámara interna del implante. Los agentes antimicrobianos permitieron determinar cuál de ellos presentaba una mejor eficacia para combatir la flora en la cámara interna del implante. Trabajos que han estudiado este fenómeno de la contaminación del sistema implante-pilar-restauración1,2,4,7,12-14,21, han utilizado a la clorhexidina como agente antimicrobiano, observándose resultados variables y mencionando como característica común, una corta vida útil del mismo. La selección del hidróxido de calcio y del yodoformo, surge como una alternativa a la clorhexidina, tratando de lograr una efectividad mayor para combatir la contaminación. En la revisión de la literatura previa al presente trabajo, no se encontraron estudios que utilizaran a los antimicrobianos empleados en este ensayo. Estos son los utilizados en la práctica odontológica diaria con la misma concentración, lo que garantiza la biocompatibilidad del producto. Posteriormente a la lectura de los cultivos, se pudo establecer, con muestras de 20 implantes cada una, que el hidróxido de calcio solo o en combinación con el yodoformo, mostró el mejor desempeño ya que se observó un mínimo desarrollo de Unidades Formadoras de Colonias en los cultivos que se utilizó este producto, aunque no se puede establecer una diferencia de significación con el grupo que utilizó solamente al yodoformo como antimicrobiano (GE2).
Para este trabajo se utilizaron cepas bacterianas que habitualmente pueden colonizar en esas zonas anaerobias estrictas, se considera de importancia realizar un estudio In Vivo, para evaluar la eficacia a mediano y largo plazo.
Conclusiones
En el presente trabajo se concluye que existió una disminución significativa en el crecimiento de UFC en los Grupos Experimentales respecto al Grupo Control, lo que determina la ventaja de la utilización del Hidróxido de calcio y el yodoformo como agentes antimicrobianos para controlar el crecimiento de microorganismos dentro de la cámara interna de los implantes dentales. Estos resultados abren una puerta para profundizar los trabajos para combatir la contaminación de la cámara del implante, ya sea ampliando la muestra en trabajos in vitro, como con la realización de un estudio clínico prospectivo (próximo a iniciarse) que permitirá corroborar los resultados obtenidos en el laboratorio.











 texto en
texto en