Services on Demand
Journal
Article
Related links
Share
Odontoestomatología
Print version ISSN 0797-0374On-line version ISSN 1688-9339
Odontoestomatología vol.18 no.28 Montevideo Nov. 2016
Metaloproteinasas de la matriz extracelular (mmps) en Odontología
Metalloproteinases (MMPs) of the extracellular matrix in Dentistry
Pereira Prado Vanesa*, Asquino Natalia **, Apellaniz Delmira***, Bueno Rossy Luis****,
Tapia Gabriel *****, Bologna Molina Ronell******
* Ayudante de Clase, Área de Patología Molecular Estomatológica, Maestrando en Ciencias Odontológicas. Facultad de Odontología, Universidad de la República, Uruguay.
Vanesa Pereira Prado: vaneapereira91@hotmail.com
** Ayudante de Clase, Cátedra de Periodoncia. Maestrando PROINBIO, Facultad de Odontología, Universidad de la República, Uruguay.
*** Maestrando en Ciencias Odontológicas, Facultad de Odontología, Universidad de la República, Uruguay.
**** Prof. Tit. de la Cátedra de Periodoncia. Director Especialidad en Periodoncia, Facultad de Odontología, Universidad de la República, Uruguay.
***** Prof. Adjunto, Cátedra de Histología, Facultad de Odontología, Universidad de la República, Uruguay.
****** Prof. Titular área de Patología Molecular Estomatológica, Facultad de Odontología, Universidad de la República, Uruguay.
Resumen
La mayoría de los tejidos del organismo se encuentran en un constante proceso de renovación, modulado por una vasta cantidad de proteínas que inducen la síntesis y degradación tisular a lo largo del tiempo. Las metaloproteinasas de la matriz extracelular (MMPs) son una familia de 25 endopeptidasas zinc dependientes encargadas de escindir los componentes inmediatos de la matriz extracelular (MEC). Ciertas metaloproteinasas de la matriz extracelular, especialmente MMP-2 y MMP-9, se ven implicadas en el desarrollo del germen dental así como con la proliferación e invasión de los tumores odontogénicos, siendo un factor a considerar sobre la posible agresividad tumoral y la base para el tratamiento de los mismos. A su vez, ambas MMPs actúan en la progresión de las lesiones cariosas así como en progresión de la periodontitis apical de pacientes con necrosis pulpar. Varios patógenos periodontales, promueven la secreción tanto de MMP-2 como MMP-9 favoreciendo la destrucción de los tejidos periodontales, íntimamente relacionadas con el avance de la enfermedad. En pacientes bajo tratamiento ortodóncico se encuentran altos niveles de estas MMPs, tanto en zonas de compresión como de tensión, relacionando los movimientos dentales con la renovación de los tejidos. Esta revisión analiza su expresión y utilidad relacionándolas con diferentes disciplinas en el área de las ciencias odontológicas, enfatizando su potencial como biomarcadores.
Palabras clave: metaloproteinasas, matriz extracelular, odontología.
Most body tissues are found in a constant renovation process, modulated by a large number of proteins that induce tissue synthesis and degradation over time. Matrix metalloproteinases (MMPs) are a family of 25 zinc-dependent endopeptidases in charge of the cleavage of the immediate components of the extracellular matrix. Certain MMPs, especially MMP-2 and MMP-9, are related to the development of dental germ as well as odontogenic tumor invasion and proliferation. They are a significant factor in tumor aggressiveness and possible treatments. Moreover, both MMPs participate in the progression of dental caries and apical periodontitis in patients with necrotic pulp. Several periodontal pathogens promote the secretion of both MMP-2 and MMP-9, increasing the destruction of periodontal tissues, which is closely linked to the progression of the disease. High levels of these MMPs are found in patients undergoing orthodontic treatment, not only in the compression side but also on the tension one. This establishes a connection between tooth movement and tissue renovation. This review analyzes MMPs expression and usefulness in different areas of dental science, emphasizing their potential as biomarkers.
Keywords: Matrix metalloproteinases, extracellular matrix, dentistry.
Introducción
En el desarrollo de los gérmenes dentarios intervienen diversos tipos celulares que producen una amplia variedad de macromoléculas, entre ellas diversas proteínas. Dentro de estas proteínas destacamos las denominadas metaloproteinasas de la matriz extracelular (MMPs), que intervienen en la degradación de la misma, y coordinan sus funciones con inhibidores tisulares de metaloproteinasas llamados TIMPs. Ciertas MMPs han sido relacionadas con la progresión de patologías tumorales, metástasis y agresividad tumoral, algunas han sido utilizadas como marcadores auxiliares de diagnóstico y pronostico en diversas neoplasias de origen epitelial. La MMPs-2 puede degradar proteínas del esmalte como la amelogenina y por consecuencia promover un tejido dentario más propenso al ataque cariogénico (1). Las lesiones apicales, provocadas tras una necrosis pulpar, marcan un incremento de la actividad de las MMPs-2 y 9, pudiendo contribuir con la progresión de la periodontitis apical (2). Estudios han revelado una mayor expresión y actividad de MMPs-9 en pacientes con periodontitis, pudiendo considerarse un indicador predictivo de la enfermedad (3). Se ha demostrado que varias MMPs, entre ellas MMPs-2 y 9, se encuentran en proporciones aumentadas en sitios de compresión y tensión donde se realizan movimientos ortodoncicos (4). El objetivo de este trabajo se centra en la recopilación de información en relación a la expresión de dichas proteínas en los tumores odontogénicos y en los gérmenes dentarios, así como su participación en odontología restauradora, endodoncia y periodoncia.
Metodología
Se realizó una búsqueda electrónica de la literatura en español e inglés usando la base de datos de Pubmed, SciELO, Science Direct y Timbó (portal de acceso a materiales ofrecido por la Agencia Nacional de Investigación e Innovación del Uruguay) en el período comprendido entre los años 2005 y 2015, empleando palabras claves como: “metaloproteinasas, matriz extracelular, odontología, matrix-metalloproteinases, extracellular-matrix, dentistry”, seleccionando 29 artículos de los últimos 6 años para orientar la presente revisión bibliográfica.
¿Qué son las metaloproteinasas de la matriz?
Las MMPs son proteínas integrantes de la matriz extracelular (MEC) las cuales son capaces, en su medioambiente inmediato, de activar factores de crecimiento, receptores de superficie y moléculas de adhesión (5). Dichas metaloproteinasas constituyen una importante familia de endopeptidasas zinc dependiente. Su actividad se encuentra regulada por inhibidores específicos conocidos como inhibidores tisulares de metaloproteinasas llamados TIMPs (5).
Se han descrito 25 miembros de la familia MMPs, que se clasifican en cinco subfamilias dependiendo de su función y estructura: colagenasas, gelatinasas, estromelisinas, metaloproteasas de membrana (MT-MMPs) y otras MMPs (5).
La estructura de las MMPs comprende varios dominios comunes a la mayoría de ellas los cuales son necesarios para el desplazamiento intracelular de la enzima hasta la membrana y que es eliminado después de la secreción de la proteasa, así como un dominio con capacidad enzimática latente (6).
Funciones de las metaloproteinasas de la matriz
Las MMPs forman un conjunto de enzimas encargadas de escindir los componentes que forman la MEC, actuando en diferentes procesos fisiológicos y patológicos que se desarrollan en los tejidos vivos. A forma de clasificación, dependiendo de la función que cumplan dentro de los tejidos, encontramos que las Colagenasas, conformadas por MMPs-1, MMPs-8, MMPs-13 y MMPs-18, son capaces de degradar el colágeno intersticial I, II y III dando lugar a colágeno desnaturalizado o gelatina. MMPs-1 sintetizada por macrófagos, fibroblastos y células dendríticas, se encarga a su vez de promover la sobrevida celular. MMPs-8 sintetizada por neutrófilos, exhibe propiedades antitumorales y anti invasivas por su papel en la regulación de los receptores hormonales. MMPs-13 por su parte es únicamente secretada por fibroblastos.
La gelatinasa A (MMPs-2) y B (MMPs-9) son dos miembros que han demostrado, entre otros, degradar el colágeno tipo IV de la membrana basal (5). MMPs-2, de un peso molecular de 72kDa, también digiere colágenos I, II y III y es expresada en condiciones normales por las células del estroma de la mayoría de los tejidos (macrófagos, mastocitos, fibroblastos, células dendríticas, endoteliales, hematopoyéticas). La MMPs-9, de 92kDa, está casi ausente en tejidos normales y se encuentra secretada por células dendríticas, hematopoyéticas, neutrófilos, macrófagos, mastocitos, fibroblastos y linfocitos (6).
Las estromelisinas, que son MMPs-3, MMPs-10 y MMPs-11 digieren diversos componentes de la MEC y la membrana basal. MMPs-3 tiene un control indirecto en la migración celular y es secretada por linfocitos, células endoteliales, dendríticas y fibroblastos. MMPs-11, por su parte, se encuentra relacionada con los procesos de adipogenesis, siendo expresada por el tejido adiposo en el medio ambiente inmediato a un proceso tumoral, regulando negativamente la diferenciación de pre adipocitos y des diferenciando adipocitos maduros, llevando a la acumulación de células peri tumorales similares a fibroblastos, favoreciendo la progresión tumoral (7).
Por otra parte, las matrilisinas, MMPs-7 y MMPs-26, que estructuralmente son las más simples debido a que carecen del dominio hemopexina, el cual interviene en la unión a sustratos específicos de las MMPs y los inhibidores endógenos, actúan sobre moléculas de la superficie celular y son expresadas específicamente por células tumorales de origen epitelial. MMPs-7 se encuentra secretado por osteoclastos, macrófagos y células endoteliales, participando a su vez de procesos de angiogénesis, invasión e inflamación celular.
Las metaloproteasas asociadas a membrana denominadas MT-MMPs (membrane-type matrix metalloproteases), forman parte de las membranas basales e intervienen en la actividad proteolítica de otras MMPs. Estas a su vez pueden ser de dos tipos: - Proteínas transmembrana: unidas a la misma por un sitio hidrófobo: MMPs-14, MMPs-15, MMPs-16, MMPs-24 - Proteínas que poseen glicofosfatidilinositol (GPI): MMPs-17 y MMPs-25. Dentro de ella la más estudiada es la MMPs-14, secretada por macrófagos, fibroblastos, células endoteliales y hematopoyéticas, que interviene a su vez en procesos de angiogénesis, adipogenesis y crecimiento celular.
Además de las MMPs que son incluidas por su función y similitud estructural en alguna familia, se encuentran MMPs individuales: MMPs-12 es una metalloelastasa, expresada principalmente en macrófagos, e influye en su capacidad migratoria. Su principal sustrato es la elastina. MMPs-20 o enamelisina, digiere a los miembros de la familia de las amelogeninas, proteínas de la matriz extracelular. MMPs-22, cuya función aún se desconoce. MMPs-23, se expresa principalmente en tejido reproductor y carece del dominio hemopexina. MMPs-28, se expresa en queratinocitos e interviene en la hemostasis y la cicatrización de heridas (6).
Estas funciones son especialmente reguladas por los TIMPs, en donde diferenciamos tres tipos. TIMP-1 inhibe potencialmente la actividad de la mayoría de las MMPs, con excepción de MT1-MMPs y MMPs-2, sintetizado por neutrófilos, linfocitos, mastocitos (7). TIMP-2 también inhibe la actividad de la mayoría de las MMPs, exceptuando MMPs-9, y es sintetizada al igual que el TIMP1 por células endoteliales, dendríticas y hematopoyéticas. TIMP-3 inhibe la actividad tanto de MMPs-1, -2, -3, -9, así como de MT1-MMPs (5). Todos ellos son sintetizados en conjunto por los macrófagos tisulares y los fibroblastos.
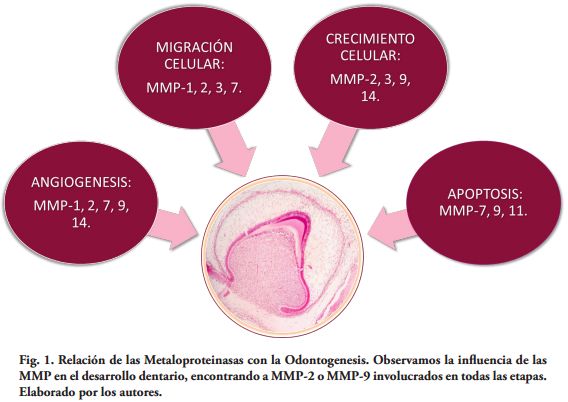
Relación de las metaloproteinasas con la odontogenesis
Existen evidencias de la participación de las MMPs en el proceso de odontogenesis. Como es sabido, la perdida de proteínas de la matriz del esmalte ocurre durante la etapa de maduración de dicho proceso, previo a la erupción dental. Se sugiere que las proteínas MMPs 1-2-3 y 9 contribuyen en la morfogénesis temprana dental. A su vez, TIMP-2 se coexpresa con las gelatinasas A (MMPs-2) y B (MMPs-9) durante la morfogénesis dental. El balance entre MMPs-TIMPs en el espacio peri celular determinará los eventos proteolíticos más significativos en el remodelado tisular.
MMPs 9 está involucrado en la reabsorción ósea y degradación de la membrana basal del epitelio reducido del esmalte durante el desarrollo dentario así como también de la MEC, asociado con la erupción dental (8). Varios estudios indican que MMPs-9 se une a la amelogenina u ambos se coexpresan en ameloblastos en el desarrollo del germen dental. Su distribución espacial fue colocalizada en pre ameloblastos, ameloblasto secretor, matriz del esmalte y odontoblastos (9).
Las MMPs pueden promover el movimiento celular al realizar la hidrolisis de caderinas, que son proteínas de unión intercelular. MMPs-3,-7, y -9 rompen el dominio extracelular de E-caderina, promoviendo el movimiento celular, invasión, y proliferación. MMPs2, MMPs3, y MMPs9 y MMPs8 (10) a su vez pueden romper varios componentes del complejo TJ (tissular junction) favoreciendo estos procesos. Por lo tanto, si los ameloblastos mantuvieran la estrecha unión célula-célula por inactivación de las MMPs, causaría una displasia en la etapa de maduración del esmalte (amelogénesis imperfecta) (11) a falta del movimiento celular.
Por lo tanto consideramos las funciones de las MMPs en la gran mayoría de las etapas y estadios de formación dentaria (Fig. 1).
Relación de las metaloproteinasas con la odontología restauradora
El polimorfismo funcional de los genes de las MMPs y los TIMPs puede desencadenar un incremento o descenso en su actividad, afectando así el desarrollo del esmalte y el establecimiento de las caries. En el desarrollo de la caries dental se relaciona a la MMPs-2 y 20, que pueden fragmentar la amelogenina, mayor proteína estructural que compone la matriz del esmalte (1). MMPs-2 no es detectada en túbulos dentinarios sanos, pero sí en toda la extensión cariosa que afecta éstas estructuras. Se intuye que los odontoblastos son los responsables de secretar MMPs-2 en respuesta a una lesión cariosa (12).
Al estudiar los materiales de restauración odontológica se observa que la capa híbrida creada por adhesivos contemporáneos es inestable en medios acuosos por la degradación hidrolítica tanto del adhesivo resinoso como las fibras de colágeno; se ha demostrado que las proteasas endógenas de la matriz orgánica de la dentina pueden degradar las fibras colágenas expuestas conjuntamente con las capas híbridas si no se encuentra protegida por un adhesivo monomérico. Se considera a las MMPs como causantes de dicha degradación, debido a que la dentina contiene MMPs-8, MMPs-2, MMPs-9, MMPs-3, MMPs-20 (éstas son cubiertas por nanocristales de apatita durante la mineralización dentinaria, quedando inmóviles e inactivas). Cuando la dentina es parcialmente desmineralizada (ya sea por un proceso carioso o por el ataque ácido de materiales odontológicos, reduciendo el pH, generando un ambiente favorable), se activan las formas latentes de MMPs-2 MMPs-9 (13). La aplicación de inhibidores artificiales de MMPs en la superficie dentinaria luego del grabado ácido o su incorporación en el sistema adhesivo promueve la integridad y estabilidad de la restauración dentaria a lo largo del tiempo. Se ha sugerido la aplicación de clorhexidina al 2% y al 0,2% con este fin (14).
Relación de las metaloproteinasas con la endodoncia
Las lesiones apicales, provocadas tras una necrosis pulpar, marcan un desbalance oxidante acompañado con un incremento de la actividad de las MMPs-2 y 9, pudiendo contribuir con la progresión de la periodontitis apical (PA). Además esto se ve reflejado en el fluido crevicular gingival de piezas con PA, y se resuelve a niveles normales luego de un tratamiento endodóntico adecuado (2). Variaciones en los niveles de MMPs-2, 3 y 9 se asocian con lesiones periapicales no tratadas, pero se constata que el tratamiento del conducto radicular reduce su expresión. La falta de una respuesta positiva en el tratamiento endodóntico se debe a una infección del sistema de conductos radiculares, manteniendo las lesiones apicales; los componentes microbianos entonces inducen la producción de citoquinas pro inflamatorias jugando un papel clave en la destrucción tisular a través de las MMPs (15).
Relación de las metaloproteinasas con la periodoncia
Determinadas proteasas producidas por la treponema denticola, considerado patógeno periodontal del complejo rojo de Socransky, son las encargadas de activar a las pro-MMPs-2, secretadas en forma inactiva por las células del ligamento periodontal. La MMPs-2 producirá la fragmentación de fibronectina, induciendo la apoptosis o supresión de la diferenciación osteoblastica, estableciendo un fenotipo destructivo del proceso.
Varios estudios han sugerido que la porphyromona gingivalis también tiene la habilidad de activar MMPs-2 (16) a través de sus gingipaínas, incrementando a su vez la migración de células monociticas al aumentar la activación y expresión de MMPs-9 (17) dando lugar a la lesión indirecta de los tejidos.
Estudios han revelado una mayor expresión y actividad de MMPs-9 en pacientes con periodontitis, comparado con MMPs-2, pudiendo considerarse un indicador predictivo de la actividad de la enfermedad (3). Luego del tratamiento de cuadros de periodontitis agresiva localizada mediante raspado y alisado así como antibioterapia sistémica se ha observado un descenso de los niveles de MMPs-1, 8, 9, 12 y 13 en el fluido gingival crevicular, correlacionándolo con un estado clínico de salud de los tejidos periodontales; deduciendo así que la presencia de dichas proteasas provocan el detrimento del periodonto, favoreciendo un microambiente destructivo (18, 19).
Cuando estudiamos la situación del tejido periimplantario, se relaciona la presencia de MMPs-1, 8 y 13 en el fluido del surco periimplantario con periodos activos de perdida ósea vertical anual. Se considera en estos casos a la MMPs-8 como posible marcador de perdida ósea progresiva en implantes (20).
Al estudiar pacientes bajo tratamiento ortodóncico encontramos que la aplicación de fuerzas ortodoncicas sobre un diente genera áreas de tensión y compresión en el ligamento periodontal, lo cual afecta el remodelado del hueso alveolar y tejido gingival. Se ha demostrado que las MMPs-1, 8, 2 y 9 se encuentran en proporciones aumentadas en sitios de compresión y tensión. La inhibición química de MMPs-9 reduce los movimientos ortodoncicos dentales (4). Las hiperplasias gingivales en ausencia de signos de inflamación pueden deberse a una reacción del tejido gingival a los mecanismo de stress inducidos por las fuerzas ortodoncicas, desencadenando la actividad de MMPs-9, considerándola un marcador del fluido gingival crevicular y los tejidos gingivales para ésta situación. Los valores de MMPs-9 son mayores que en el caso de una gingivitis crónica, pero menores que en presencia de enfermedad periodontal activa (21).
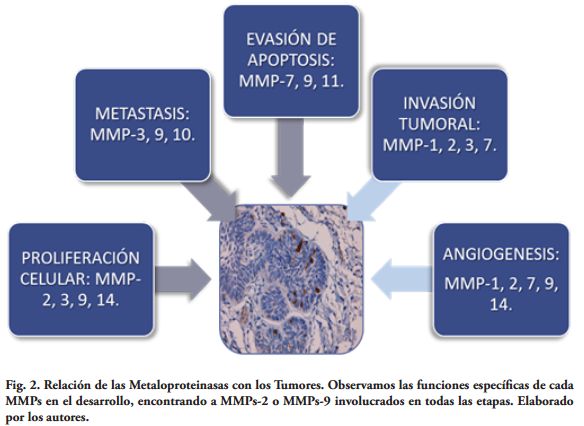
Relación de las metaloproteinasas con los tumores
La presencia de estas proteasas dentro del proceso de formación dentario, sugiere una participación dentro del desarrollo embrionario del órgano dentario, por lo que diferentes autores han estudiado su expresión en tumores odontogénicos, así como otras displasias y procesos patológicos (5, 6).
Las MMPs son las principales mediadoras en las alteraciones observadas en el microambiente tumoral durante la progresión del cáncer. En el crecimiento tumoral juegan un papel fundamental en la degradación del tejido conectivo y los componentes de la membrana basal, además de activar factores de crecimiento, receptores de superficie para moléculas de adhesión y quimiocinas. Esta interacción altera la respuesta celular, lo que permite que las células tumorales se tornen menos adherentes y por lo tanto con más posibilidades de migrar y producir metástasis. Las MMPs pueden jugar distintos papeles durante la progresión del cáncer, dependiendo del estadio del tumor (Fig. 2).
En estadios tempranos tumorales, la proteólisis mediada por MMPs 3 y 7 de las proteínas específicas que unen factores de crecimiento contribuye a la proliferación celular. A su vez, MMPs-7 produce el clivaje de los ligandos de los receptores FAS (apoptosis antigen 1), suspendiendo la actividad apoptótica celular (7). MMPs-7 indirectamente modula la actividad de diversas moléculas al producir el clivaje de syndecan-1 (proteína transmembrana que contribuye con la supresión tumoral) de la superficie celular. A su vez, ésta MMPs es expresada por osteoclastos en la interfase tumor-hueso, desencadenando la osteolisis y la subsecuente metástasis ósea (7).
Posteriormente, el clivaje de las moléculas de adhesión E-caderina y CD44 mediante MMPs-3 activa la motilidad de las células tumorales y facilita las metástasis. La migración e invasión celular está altamente ligada a la presencia de MMPs-14 en la membrana celular así como la unión de MMPs-2 a integrinas de células del mesénquima (22).
La diferenciación y acumulación de tejido adiposo peri tumoral favorece la progresión y supervivencia de células cancerosas. MMPs-14 contribuye a la coordinación de diferenciación de los adipocitos. A su vez, MMPs-11, expresada en tejido adiposo durante la invasión tumoral, regula negativamente la adipogenesis, promoviendo la progresión tumoral (7).
El proceso de angiogénesis, que consiste en la formación de vasos sanguíneos nuevos a partir de aquellos pre-existentes, permite el crecimiento tumoral y es imprescindible para su diseminación. La mayoría de las MMPs se encuentran involucradas en la angiogénesis tumoral, principalmente relacionamos a MMPs-2, 9, 14, y en menor medida MMPs-1 y 7. MMPs-9 se encarga de regular la biodisponibilidad del factor de crecimiento endotelial vascular (VEGF), potente inductor angiogénico tumoral, así como también se relaciona con la vasculogenesis (7).
A su vez, la infiltración linfática y la metástasis en ganglios linfáticos se encuentra asociada a un aumento de la expresión de MMPs-1, 2 y 3 (7).
La Fig. 3 resume la relación entre las disciplinas estudiadas y las MMPs más involucradas; se encontraron MMPs-2 o MMPs-9 participando de todas las áreas de estudio.

Conclusión
Se concluye que, MMPs-2 y MMPs-9 actúan en todos los procesos patológicos anteriormente nombrados, durante el desarrollo del germen dental así como su influencia en la proliferación e invasión de los tumores odontogénicos, su participación en la degradación de los tejidos dentarios y periodontales promoviendo la instalación de la lesión cariosa, gingivitis y periodontitis; confirmando que esta familia de proteínas puede llegar a jugar un rol preponderante dentro de diversos procesos biológicos bucales. A su vez a lo anteriormente dicho, hace que las MMPs actualmente sean consideradas biomarcadores de importancia para la investigación en las diferentes áreas de la odontología.
Referencias
2. Dezerega A, Madrid S, Mundi V, Valenzuela MA, Garrido M, Paredes R, García-Sesnich J, Ortega AV, Gamonal J, Hernández M. Pro-oxidant status and matrix metalloproteinases in apical lesions and gingival crevicular fluid as potential biomarkers for asymptomatic apical periodontitis and endodontic treatment response. J Inflamm (Lond). 2012; 9(1): 8.
3. Kim KA, Chung SB, Hawng EY, Noh SH, Song KH, Kim HH, Kim CH, Park YG. Correlation of expression and activity of matrix metalloproteinase-9 and -2 in human gingival cells of periodontitis patients. J Periodontal Implant Sci. 2013; 43(1): 24-29.
4. Grant M, Wilson J, Rock P, Chapple I. Induction of cytokines, MMPs9, TIMPs, RANKL and OPG during orthodontic tooth movement. Eur J Orthod. 2013; 35(5): 644-651.
5. Cascales M, Álvarez-Gómez JA. Metaloproteinasas, matriz extracelular y cáncer. An R Acad Nac Farm, 2010, 76 (1): 59-84.
6. Coronato S, Laguens G, Vanda Di Girolamo V. Rol de las metaloproteinasas y sus inhibidores en patología tumoral. Medicina (Buenos Aires) [en línea] 2012; 72: 495-502 citado 11 de agosto 2016. Disponible en http://www.scielo.org.ar/pdf/medba/v72n6/v72n6a12.pdf.
7. Kessenbrock K, Plaks V, Werb Z. Matrix Metalloproteinases: Regulators of the Tumor Microenvironment. Cell. 2010; 141(1): 52-67.
8. Basi DL, Hughes PJ, Thumbigere-Math V, Sabino M, Mariash A, Lunos SA, Jensen E, Gopalakrishnan R. Matrix metalloproteinase-9 expression in alveolar extraction sockets of zoledronic acid-treated rats. J Oral Maxillofac Surg. 2011; 69:2698–2707.
9. Feng J, McDaniel JS., Chuang HH., Huang O, Rakian A., Xu X., Steffensen B., Donly KJ., MacDougall M, Chen S. Binding of amelogenin to MMPs-9 and their co-expression in developing mouse teeth. J Mol Hist. 2012; 43(5): 473–485.
10. Schubert-Unkmeir A, Konrad C, Slanina H, Czapek F, Hebling S, Frosch M. Neisseria meningitidis induces brain microvascular endothelial cell detachment from the matrix and cleavage of occludin: a role for MMPs-8. PLoS Pathog [en línea]. 2010; 29; 6(4):e1000874 citado: 11 de agosto 2016. Disponible en: http://dx.doi.org/10.1371/journal.ppat.1000874
11. Bartlett JD, Smith CE. Modulation of cell-cell Junctional complexes by matrix metalloproteinases. J Dent Res. 2013; 92(1): 10-17.
12. Boushell LW, Nagaoka H, Nagaoka H, Yamauchi M. Increased Matrix Metalloproteinase-2 and Bone Sialoprotein Response to Human Coronal Caries. Caries Res. 2011; 45(5): 453-459.
13. Mazzoni A, Scaffa P, Carrilho M, Tjäderhane L, Di Lenarda R, Polimeni A, Tezvergil-Mutluay A, Tay FR, Pashley DH, Breschi L. Effects of Etch-and-Rinse and Self-etch Adhesives on Dentin MMPs-2 and MMPs-9. J Dent Res. 2013; 92(1): 82-86.
14. Montagner AF, Sarkis-Onofre R, Pereira-Cenci T, Cenci MS. MMPs Inhibitors on Dentin Stability: A Systematic Review and Meta-analysis. J Dent Res. 2014; 93(8): 733-743.
15. Menezes-Silva R, Khaliq S, Deeley K, Letra A, Vieira AR. Genetic Susceptibility to Periapical Disease: Conditional Contribution of MMPs2 and MMPs3 Genes to the Development of Periapical Lesions and Healing Response. J Endod. 2012; 38(5): 604-607.
16. Miao D, Godovikova V, Qian X, Seshadrinathan S, Kapila YL, Fenno JC. Treponema denticola upregulates MMPs-2 activation in periodontal ligament cells: interplay between epigenetics and periodontal infection. Arch Oral Biol. 2014; 59(10): 1056-1064.
17. Zhou J, Zhang J, Chao J. Porphyromonas gingivalis Promotes Monocyte Migration by Activating MMPs-9. J Periodontal Res. 2012; 47(2): 236-242.
18. Gonçalves PF, Huang H, McAninley S, Alfant B, Harrison P, Aukhil I, Walker C, Shaddox LM. Periodontal Treatment Reduces Matrix Metalloproteinase Levels in Localized Aggressive Periodontitis. J Periodontol. 2013; 84(12): 1801-1808.
19. Şurlin P, Oprea B, Solomon SM, Popa SG, Moţa M, Mateescu GO, Rauten AM, Popescu DM, Dragomir LP, Puiu I, Bogdan M, Popescu MR. Matrix metalloproteinase -7, -8, -9 and -13 in gingival tissue of patients with type 1 diabetes and periodontitis. Rom J Morphol Embryol. 2014; 55(3 Suppl): 1137-1141.
20. Arakawa H, Uehara J, Hara ES, Sonoyama W, Kimura A, Kanyama M, Matsuka Y, Kuboki T. Matrix metalloproteinase-8 is the major potential collagenase in active periimplantitis J Prosthodont Res. 2012; 56(4): 249-255.
21. Şurlin P, Rauten AM, Pirici D, Oprea B, Mogoantă L, Camen A. Collagen IV and MMPs-9 expression in hypertrophic gingiva during orthodontic treatment. Rom J Morphol Embryol. 2012; 53(1): 161-165
22. Wolf K, Friedl P. Mapping proteolytic cancer cell-extracellular matrix interfaces. Clin. Exp. Metastasis 2009; 26(4): 289-298.
23. Paula-Silva FW, da Silva LA, Kapila YL. Matrix metalloproteinase expression in teeth with apical periodontitis is differentially modulated by the modality of root canal treatment. J Endod. 2010; 36(2): 231-237.
24. Zehnder M, Wegehaupt FJ, Attin T. A first study on the usefulness of matrix metalloproteinase 9 from dentinal fluid to indicate pulp inflammation. J Endod. 2011; 37(1): 17-20.
25. Capelli J Jr, Kantarci A, Haffajee A, Teles RP, Fidel R Jr, Figueredo CM. Matrix metalloproteinases and chemokines in the gingival crevicular fluid during orthodontic tooth movement. Eur J Orthod. 2011; 33(6): 705-711.
26. Chen X, Li N, LeleYang, Liu J, Chen J, Liu H. Expression of collagen I, collagen III and MMPs-1 on the tension side of distracted tooth using periodontal ligament distraction osteogenesis in beagle dogs. Arch Oral Biol. 2014; 59(11): 1217-1225.
27. Canavarro C, Teles RP, Capelli Júnior J. Matrix metalloproteinases -1, -2, -3, -7, -8, -12, and -13 in gingival crevicular fluid during orthodontic tooth movement: a longitudinal randomized split-mouth study. Eur J Orthod. 2013; 35(5): 652-658.
28. Díaz Caballero A, Méndez Cuadro D, Martínez Serrano E, Orozco Páez J, Velásquez M. Metaloproteinasas de la matriz en Odontología y sus consideraciones desde el campo de la química computacional. Rev Cubana Estomatol [en línea]. 2014: 51(1):80-92 citado: 11 de agosto 2016. Disponible en: http://scielo.sld.cu/pdf/est/v51n1/est09114.pdf
29. Rai B, Kaur J, Jain R, Anand SC. Levels of gingival crevicular metalloproteinases 8 and -9 in periodontitis. Saudi Dent J [en línea] 2010; 22(3): 129-131 citado: 11 de agosto 2016. Disponible en: http://www.saudidentaljournal.com/article/S1013-9052(10)00044-1/pdf











 text in
text in