Services on Demand
Journal
Article
Related links
Share
Odontoestomatología
Print version ISSN 0797-0374On-line version ISSN 1688-9339
Odontoestomatología vol.17 no.25 Montevideo May 2015
Detección y prevalencia de patógenos periodontales de una población con periodontitis crónica en Uruguay mediante metodología convencional y metagenómica
Detection and prevalence of periodontal pathogens in a Uruguayan population with chronic periodontitis using conventional methodology and metagenomics
Papone, Virginia*,
Verolo, Carolina*,
Zaffaroni, Lourdes*,
Batlle, Alicia*,
Capo, Capó** ,
Bueno, Luis**,
Gamonal, Jorge***,
Silva, Nora***,
Soria, Sandra*
Resumen
Las enfermedades periodontales son un significativo problema mundial a nivel de salud humana. Décadas de investigaciones, evidencian que en la mayoría de los casos la periodontitis crónica es la más común, caracterizada por ser de evolución lenta, con formación de bolsas periodontales, posterior reabsorción del hueso alveolar, pérdida y destrucción de piezas dentarias y tejido óseo. Si bien se reconoce el origen multifactorial en el desarrollo de la periodontitis, es relevante la participación de la microbiota subgingival en la etiología de la enfermedad periodontal. Algunas de las especies bacterianas patógenas que han sido asociadas con el desarrollo de la enfermedad periodontal son Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia, Fusobacterium nucleatum, entre otras.
En este estudio, nos propusimos investigar cuáles de éstas cinco especies estaban presentes en las bolsas periodontales de 51 pacientes uruguayos con periodontitis crónica. Para alcanzar éste objetivo se utilizó una técnica convencional microbiológica y metagenómica (multiplex-PCR). Los resultados de la técnica convencional microbiológica evidenciaron la presencia de A. actinomycetemcomitans (33%) y de bacterias negras pigmentadas anaerobias (100%) en las muestras. De los resultados obtenidos en la multiplex-PCR, se demostró que las especies de mayor prevalencia fueron F. nucleatum (100%), T. forsythia (92%) y P. gingivalis (88%). Por el contrario, las especies de menor prevalencia fueron P. intermedia (39%) y A. actinomycetemcomitans (33%).
Palabras clave: Microbiota, Prevalencia, Periodontitis crónica, Metagenómica, PCR-Multiplex.
Abstract
Periodontal diseases are a major problem in human health. Decades of research have shown that the most common disease is chronic periodontitis, characterized by a slow evolution with the formation of periodontal pockets, subsequent alveolar bone resorption, loss and destruction of teeth and bone tissue. While we know the multifactorial origin of the development of periodontitis, the participation of subgingival microbiota is relevant in the etiology of periodontal disease. Some pathogenic bacteria species that have been associated with the development of periodontal disease are Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia, Fusobacterium nucleatum, among others. In this work we studied which of these five species were present in the periodontal pockets of 51 Uruguayan patients with chronic periodontitis. To achieve the results a conventional microbiological technique and metagenomics (multiplex-PCR) were used.
The results of the microbiological conventional technique showed the presence of A. actinomycetemcomitans (33%) and black pigmented anaerobic bacteria (100%) in the samples. From the results obtained in the multiplex-PCR we saw that the most prevalent species were F. nucleatum (100%), T. forsythia (92%) and P. gingivalis (88%). In contrast, lower prevalence species were P. intermedia (39%) and A. actinomycetecomitans (33%).
Keywords: Microbiota, Prevalence, Periodontal disease, Metagenomics, Multiplex-PCR.
* Facultad de Odontología, Cátedra de Microbiología. Universidad de la República. Uruguay
** Facultad de Odontología, Clínica de Periodoncia. Universidad de la República. Uruguay
Fecha recibido: 07.01.15 - Fecha aceptado: 26.03.15
Las infecciones en la cavidad oral son un grave problema de salud pública a nivel mundial, debido a su elevada prevalencia en la población infantil y adulta. La etiología de estas patologías es multifactorial, viéndose involucrados factores del hospedero, del ambiente y factores de carácter infeccioso. Dentro de las mismas, debemos destacar el potencial riesgo de pérdida de piezas dentarias por periodontitis crónica en niños como en adultos, el posible desarrollo de endocarditis infecciosa e incluso la aparición de cáncer oral y colorectal (1-6) En el caso particular de la periodontitis crónica o enfermedad de los tejidos de soporte de las piezas dentarias, cursa con pérdida de inserción y pérdida ósea (hueso alveolar horizontal y vertical).
Generalmente esta enfermedad se presenta con mayor prevalencia en adultos (> 40 años), aunque puede aparecer en las personas en su primera o segunda dentición. Es una enfermedad de lenta evolución, donde se reconocen los siguientes síntomas: inflamación gingival con edema, aumento de volumen de la encía, márgenes gingivales redondeados, papilas aplanadas, sensibilidad gingival, acumulación de placa supra y subgingival, formación de cálculos, una mayor movilidad y exfoliación dental. En todas estas circunstancias pueden afectar a un número variable de dientes en función de cada individuo, con tasas variables de progresión.(7, 8) Relacionadas con la aparición de la periodontitis se han identificado más de 300 especies bacterianas que se aislaron en los sacos periodontales, sin embargo, solamente un bajo porcentaje se consideran de importancia etiológica; como el grupo de bacilos anaerobios Gram negativos pigmentados pertenecientes a los géneros Porphyromonas, Prevotella, Bacteroides y Fusobacterium, de la familia Bacteroidaceae. A su vez, en estudios realizados hacia la identificación de las especies como potenciales indicadores de riesgo en el desarrollo de periodontitis, se encuentran: Aggregatibacter actinomycetemcomitans (Aa), Porphyromonas gingivalis (Pg), Prevotella intermedia (Pi), Tannerella forsythia (Tf) y Fusobacterium nucleatum (Fn), entre otros.(7, 9, 10)
A nivel mundial, se han intensificado las investigaciones sobre la composición de la microbiota oral de pacientes periodontopáticos, mediante diferentes metodologías como lo demuestra el trabajo de Herrera et al. en Colombia, España y Chile. En América del Sur, la especie F.nucleatum es la de mayor prevalencia en Chile (90%)(11); sin embargo en Colombia dos especies presentaron una prevalencia del 80%, P. gingivalis y T. forsythia.(12, 13) En las investigaciones realizadas en pacientes brasileños con periodontitis, las especies P. intermedia y F. nucleatum fueron los patógenos periodontales con una frecuencia de detección de 67%. Las especies menos prevalentes fueron P. gingivalis (26.7%), T. forsythia (20%) y A. actinomycetemcomitans (13%) (14).
En el Uruguay, por su parte, desde la década de los 90’ se realizan seguimientos de los pacientes con infecciones orales (Cátedra de Microbiología de la Facultad de Odontología, UDELAR), donde se realiza la identificación de los patógenos por medio de metodologías microbiológicas convencionales y de los resultados obtenidos se lleva adelante el adecuado tratamiento de cada paciente. Es de señalar que los métodos convencionales de diagnóstico directo presentan importantes limitaciones, como por ejemplo; a) el transporte y conservación de la muestra; b) el procesamiento de la misma; d) el tiempo de desarrollo (2 – 14 días) y la dificultad en el crecimiento del cultivo.(15, 16) Es de gran relevancia el empleo de metodología metagenómica ,que permite reducir los tiempos en la obtención de los resultados, aumentar la sensibilidad de detección y especiación. La metagenómica representa una aproximación al estudio de las comunidades microbianas, definida como el análisis funcional y de secuencias de los genomas microbianos colectivos contenidos en una muestra de la cavidad oral, basándose ya sea en expresión o secuenciación.(17, 18) Por ejemplo, la técnica del multiplex-PCR (multiplex - polymerase chain reaction) es muy utilizada en la detección directa de la composición del metagenoma de la microbiota a nivel de especie y/o serotipos, sin la necesidad de realizar la siembra, aislamiento y caracterización morfológica de patógenos de difícil y/o lento crecimiento. En la técnica molecular, se utilizan oligonucleótidos complementarios a regiones conservadas en el ADN de cada especie que codifica a la subunidad pequeña del ARN ribosomal 16S, en este caso con la finalidad de la detección de patógenos periodontales.(11, 19-22)
En este trabajo se realizó la rápida identificación simultánea de la microbiota involucrada en procesos orales, utilizando multiplex-PCR, en paralelo con una metodología microbiológica convencional en 51 pacientes uruguayos asistidos en la clínica de Periodoncia de la Facultad de Odontología, UDELAR.
Metodología
Selección de pacientes.
Se seleccionaron 51 pacientes ≥ 30 años (23 mujeres y 28 hombres) con cuadro clínico de periodontitis crónica moderada (PIC =3-4mm) y avanzada (PIC ≥ 5mm), sangrado al sondaje, bolsas patológicas y pérdida ósea. El diagnóstico periodontal fue realizado de acuerdo a los parámetros de la Academia Americana de Periodoncia (AAP)(23), con al menos 12 dientes presentes excluyendo el tercer molar, sin previo tratamiento periodontal; pacientes libres de diabetes, artritis, colitis ulcerativas, VIH, cáncer y patología cardiovascular. Tampoco incluyeron en este estudio a pacientes con periodontitis inicial, (pacientes con pérdida de inserción clínica entre 1 a 3 mm) mujeres embarazadas, ni aquellos que recibieron dos meses antes , tratamientos con antibióticos y/o antiinflamatorios. Todos los pacientes fueron informados de la investigación y aceptaron firmar en presencia de un testigo un consentimiento, de acuerdo a las Normas del MERCOSUR. El comité de ética de la Facultad de Odontología UDELAR, aprobó el diseño del estudio basándose en la normativa MERCOSUR y la Declaración de Helsinki sobre la experimentación en la cual participan seres humanos.
Muestras.
Se seleccionaron 4 sitios en cada cuadrante basándose en el estudio clínico y radiográfico, con profundidad de bolsa ≥ 5.0 mm y pérdida ósea de ≥ 2.0 mm. Se removió la placa supragingival evitando sangrado usando gasa estéril, se secó con rollos de algodón estériles. Se introdujeron las puntas estériles de papel medianas (Nº25) en lo más profundo de la bolsa y se dejaron durante 15 s. Se colocaron en 1.5 ml de medio reducido RTF (Reduced Transport Fluid) (24). Cada muestra presentaba 8 puntas de papel que fueron procesadas inmediatamente. El procedimiento consistió en la agitación rigurosa durante 45 - 60 s y posteriormente se realizaron diluciones seriadas en RTF.Se tomaron 100 µl de la muestra y se colocaron en un eppendorf con 900 µl de RTF. (1º dilución: 1:10). De esta se sembró 100 µl ,expandiendo la muestra con una varilla de vidrio sobre una placa de TSVB: tripticasa soya, bacitracina (75 µg/ml), vancomicina (5.0 µg/ml), 10 ml de suero de caballo (10%) para el aislamiento de Aggregatibacter actinomycetemcomitans . Se colocaron las placas en jarra con atmósfera enriquecida en CO2 , incubándolas durante 7 días a 37ºC.Se tomaron 100 µl de la muestra original de RTF, se colocaron en 900 µl de RTF. Se tomaron 100 µl de éste tubo y se colocaron en otro con 900 µl (2ª dilución: 1:100). Se tomaron 100 µl y se sembraron en medio agar base con sangre con menadiona y hemina, y se incubaron durante 14 días a 37ºC en anaerobiosis estricta. De la muestra original en RTF se tomaron 500 µl, se almacenaron a -30ºC y luego fueron utilizadas en los multiplex-PCR .
Se utilizaron las siguientes cepas como controles positivo: Aggregatibacter actinomycetemcomitans (ATCC 29522), Porphyromonas gingivalis (BAA-308), Prevotella intermedia (ATCC 25611), Tannerella forsythia (ATCC 43037) y Fusobacterium nucleatum (ATCC 25586) y como control negativo la cepa de Escherichia coli (ATCC 47076).
Identificación y recuento de colonias.
Las colonias presuntivas de A. actinomycetem-comitans fueron identificadas por la presencia de una estructura semejante a una estrella en el interior de las colonias (lupa estereoscópica), técnica de coloración de Gram , prueba de catalasa (+) y MUG negativa (4-Metilumbeliferil-β-D-galactósido, para investigar la fermentación de la lactosa). Se realizó el cálculo del número total de unidades formadoras de colonias por mililitro de cada muestra (UFC/ml) a partir de los medios de cultivo sembrados. El porcentaje relativo de recuperación se calculó a partir del total de UFC por el factor de dilución. Se realizó el recuento de unidades formadoras de colonias de bacterias pigmentadas anaerobias de cada muestra. En general no se identificaron especies de las colonias pigmentadas y se contaron todas las UFC pigmentadas por factor de dilución.
Cepas control.
Extracción del metagenoma de la microbiota oral.
Las muestras fueron descongeladas y homogenizadas durante 30 s con vórtex. Posteriormente se transfirieron a otro tubo eppendorf y se centrifugaron a 13.500 rpm durante 3 min. Se descartó el sobrenadante y nuevamente se resuspendió el pellet por pipeteo en 500 µl del buffer RTF durante 5 min. a 100ºC. Posteriormente se colocaron en hielo por 5 min. y luego se centrifugaron a 13500 rpm por 5 min. a 4ºC. Finalmente se descartó el pellet y el sobrenadante conteniendo el metagenoma microbiano se almacenó a -30ºC hasta el momento de realizar los multiplex-PCR.
Extracción de genomas bacterianos y selección de oligonucleótidos.
La extracción del genoma de cada cepa control, se realizó utilizando el Kit Zymo BeadTM Genomic DNA (como lo describen los fabricantes). La determinación de la concentración del ADN (ng/µl) en cada cepa fue cuantificada en el NanoDrop 2000.
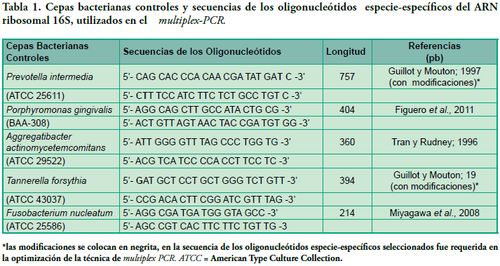
En la selección de los oligonucleótidos especie-específicos, se utilizó información bibliográfica con reportes de los oligonucleótidos especie-específicos a nivel del 16S ribosomal en cada cepa control positivo de este estudio. La optimización de las condiciones del multiplex-PCR se resolvió mediante la adición de bases a las secuencias de algunos oligonucleótidos. (Tabla 1 -Figuras 1, 2, 3).

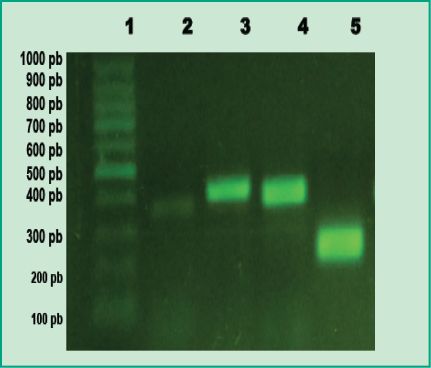
Fig 1. Productos de PCR en gel de agarosa: Carril 1, marcador de peso molecular 100pb (DMF-50, sbs); Carril 2, control positivo de A. actinomycetemcomitans; Carril 3, control positivo de P. gingivalis; Carril 4, control positivo de T. forsythia; Carril 5, control positivo de F. nucleatum (Gel de agarosa 1%, GoodView 5%).

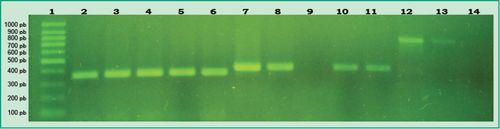
Fig 2. Productos de PCR en gel de agarosa: Carril 1, marcador de peso molecular 100pb (DMF-50, sbs); Carril 2, control positivo de A. actinomycetemcomitans; Carriles 3-6, muestras de diferentes pacientes que dieron positiva la presencia de A. actinomycetemcomitans; Carril 7, control positivo de P. gingivalis; Carril 8, muestra de un paciente que dio positiva la presencia de P. gingivalis; Carril 9, muestra de paciente que dio negativa la presencia de P. gingivalis; Carriles 10-11, muestras de diferentes pacientes que dieron positiva la presencia de P. gingivalis; Carril 12, control positivo de P. intermedia; Carril 13, muestra de un paciente que dio positiva la presencia de P. intermedia; Carril 14, muestra de un paciente que dio negativo P intermedia (Gel de agarosa 1%, GoodView 5% ).

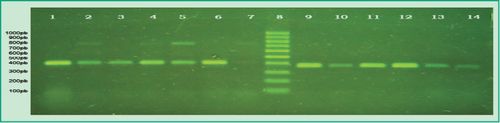
Fig 3. Productos de multiplex-PCR en gel de agarosa: Carril 1, control positivo de P.gingivalis; Carril 2, muestra de un paciente que dio positiva la presencia de las especies P.gingivalis y P. intermedia; Carril 3, muestra de un paciente que dio positiva la presencia de P.gingivalis y negativa P. intermedia; Carriles 4-5, muestras de pacientes que dieron positiva la presencia de P. gingivalis y P. intermedia; Carril 6, muestra de un paciente que dio positiva la presencia de P. gingivalis y negativa P. intermedia; Carril 7, muestra de un paciente que dio positiva la presencia de las especies P. gingivalis y P. intermedia; Carril 8, marcador de peso molecular 100pb (DMF-50, sbs); Carril 9, control positivo de la especie T. forsythia; Carriles 10-14, muestras de pacientes que dieron positiva la presencia de la especie T. forsythia (Gel de agarosa 1%, GoodView 5% ).
Determinación del límite de detección.
El límite más bajo de detección se definió como el menor número de microorganismos presentes en una muestra que podría ser detectado por el multiplex-PCR. Este procedimiento se realizó por medio de diluciones seriadas (0 a 1.75x106 células/ml) de una mezcla de cultivos puros de todas las cepas que se describen anteriormente.
Multiplex-PCR.
La optimización de las condiciones de programación se diseñaron conforme a los parámetros de cada secuencia de oligonucleótidos diseñadas en este estudio (nt, G+C%, Tm). Cada mezcla de reacción (25 µl) contiene buffer 1.0X PCR (10 mM Tris-HCl, 50 mM KCl, pH 8.3), 1.5 µl de 2.5 mM dNTPs, 1 mM MgCl2, 10 pmol de cada oligonucleótido (Tabla 1, Figuras 1, 2, 3) y 1.2 U de la Taq ADN polimerasa y 5 ng del metagenoma extraído de cada muestra y 2 ng del genoma de las cepas controles (NanoDrop 2000).
En la detección por multiplex-PCR de las especies P. gingivalis y P. intermedia, se utilizaron las siguientes condiciones: 1 ciclo de desnaturalización a 95ºC por 3 min; 35 ciclos de 94ºC durante 1 min., 55ºC por 1 min., 72ºC por 2 min.; y 1 ciclo de extensión final de 72ºC por 5 min.
En la detección por multiplex-PCR de las especies A. actinomycetemcomitans, T. forsythia y F. nucleatum, se utilizaron las siguientes condiciones: 1 ciclo de desnaturalización a 95ºC por 2 min; 35 ciclos de 94ºC durante 30 s., 57ºC por 1 min., 72ºC por 2 min.; y 1 ciclo de extensión final de 72ºC por 5 min.
La visualización de los resultados de las amplificaciones (bandas) se realizó en geles de agarosa al 1.2%, buffer TBE (Tris-borato-EDTA) 0.5 X, 5% de GoodView, 1% de cyan/orangeloading buffer; 2 µl del producto del PCR durante 2h a 80 V. La documentación se realizó por medio de la obtención de fotos digitalizadas obtenidas con el foto documentador (FOTO/Phoresis; Fotodyne, UV).
Análisis estadístico.
Los resultados de la multiplex-PCR se efectuaron utilizando frecuencias absolutas en porcentaje y las condiciones clínicas fueron comparadas mediante el Test Student-T con un nivel de significancia < 0.05.
Resultados
Un total de 51 muestras colectadas de pacientes con periodontitis crónica, fueron procesadas utilizando el método convencional de cultivos microbiológicos. Los resultados de este estudio evidenciaron que un 23 % de los pacientes presentaban A. actinomycetemcomitans en valores de 3 x 105 UFC/ml y un 10% en un rango del 2-7 x 104 UFC/ml. Se determinó que el 100% de las muestras presentaron bacterias negras pigmentadas anaerobias (BNPA) en los siguientes porcentajes: 14% presentaron recuentos menores de 105 UFC/ml, un 74 % se cuantificó entre el 105 - 106 UFC/ml y finalmente un 12 % presentaron recuentos mayores de 106 UFC/ml de muestra. Estos resultados evidenciaron que en todos los pacientes se confirmó la presencia de BNPA en las bolsas periodontales. Si se tiene en cuenta, que dentro del grupo de las BNPA cuantificados en los cultivos probablemente se encuentren algunos de los géneros Porphyromonas, Prevotella y Fusobacterium, entonces, se puede estar estableciendo eventos de adhesión, agregación y coagregación entre estos géneros que componen la microbiota gingival. Por ejemplo, se ha demostrado que F. nucleatum es capaz de participar en eventos de coagregación mediante la interacción de ciertos lipopolisacáridos que reconocen y se unen a los O-galactósidos de superficie de A. actinomycetemcomitans, P. gingivalis y P. intermedia (25, 26). La gran importancia de éste fenómeno, posiblemente sea el papel que juega de “puente” la especie F.nucleatum en los eventos de colonización de la región subgingival. F. nucleatum puede sobrevivir a elevadas concentraciones de oxígeno, y es una de las especies bacterianas más importante con función de puente entre aerobios y anaerobios estrictos, participando activamente en el enlace y establecimiento del consorcio microbiano (27).
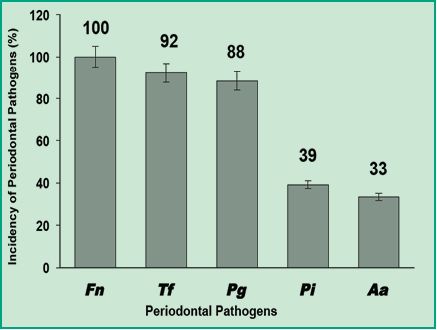
Los resultados obtenidos mediante la detección simultánea de seis especies bacterianas patógenas orales de 51 pacientes por multiplex-PCR, evidenciaron que un 100% dio positiva la presencia de F. nucleatum; lo cual demuestra que es la especie con mayor prevalencia en una población uruguaya con periodontitis crónica (Figura 4).

Fig. 4. Gráfica con los porcentajes de incidencia de patógenos periodontales en los pacientes uruguayos con periodontitis crónica.
Estos resultados indican que al igual que los estudios realizados en Chile, la especie de mayor prevalencia fue F. nucleatum (11). Esta información es de gran relevancia debido a que se ha demostrado que F. nucleatum puede colonizar el colon y ser un factor biológico relevante en el desarrollo del carcinoma colorectal. Este tipo de cáncer es el responsable de aproximadamente 610.000 muertes por año de personas en todo el mundo y está correlacionado clínicamente con la infección por F. nucleatum, que se produce principalmente por vía oral (6). Asimismo, los patógenos T. forsythia y P. gingivalis, también mostraron elevada prevalencia del 92% y 88%, respectivamente. Estos resultados demuestran que en la población uruguaya con periodontitis crónica estos patógenos son los que presentan elevada frecuencia. En comparación con los estudios realizados en Colombia y Chile (1, 11); también se evidenció que la especie P. gingivalis, presenta una elevada prevalencia como en Uruguay . La gran importancia de la elevada prevalencia de ambos, radica en primera instancia, de que son patógenos endógenos, o sea, capaces de realizar invasión del tejido epitelial y permitir la entrada de otros microorganismos oportunistas como Herpes virus, Candidas spp., entre otros. Por el contrario, P. intermedia y A. actinomycetemcomitans fueron detectados con menor frecuencia del 49% y 33%, respectivamente (Fig. 4). En función de los porcentajes de prevalencia, Gajardo y colegas, utilizaron el criterio de considerar que a mayor porcentaje de detección de una especie patógena, mayor será la fuerza de asociación del patógeno al desarrollo de la periodontitis crónica. Entonces, según este criterio, en este estudio consideramos a las especies F. nucleatum, T. forsythia y P. gingivalis como patógenos críticos en la asociación a la periodontitis crónica y a las especies P. intermedia y A. actinomycetemcomitans como bacterias asociadas a la periodontitis crónica con menor prevalencia.
Es de importancia destacar que existen fuertes evidencias de la potencial asociación entre las enfermedades periodontales y la aparición como evolución de complicaciones cardiovasculares en hombres como en mujeres (28-30) Por dicha razón, es relevante llegar a una rápida detección y tratamiento en los pacientes, evitando la acción de estos patógenos invasivos capaces de favorecer la adherencia a leucocitos al epitelio vascular, que podrían desarrollar un efecto pro-coagulante entre otros, como se ha reportado en la bibliografía (3).
De la comparación de nuestros resultados con los obtenidos en Chile (1, 11), España, Chile, Colombia (31) y Brasil (14) ,podemos observar que en cada país varía la especie de mayor prevalencia. Entonces, posiblemente las diferencias puedan deberse a varios factores como lo son la existencia de diferencias raciales, geográficas, etiológicas, genéticas, medioambientales, costumbres y hábitos de higiene oral.
Las diferencias significativas detectadas entre el grupo de hombres y el grupo de mujeres, probablemente se puedan deber a los diferentes factores y mecanismos involucrados en los eventos de colonización de las bolsas periodontales en ambos sexos. Además, es muy posible que el establecimiento y multiplicación de una especie patógena no sea similar al de otra especie patógena; o que una especie bacteriana pueda ser favorecida por las condiciones medioambientales de un hospedero pero no en otros hospederos. Klinger y colega, determinaron que los nutrientes disponibles al consorcio bacteriano dentro de la bolsa periodontal es muy diferente entre hombres y mujeres, fenómeno mediado principalmente por el nivel hormonal (32). El origen étnico probablemente pueda influir en la selección de las especies bacterianas de la microbiota gingival. Además, existen reportes donde se han observado una predilección de microorganismos por una determinada etnia, por ejemplo la especie P. gingivalis se encuentra mayoritariamente asociada a los pacientes afroamericanos con periodontitis; mientras que F. nucleatum parece ser más frecuente en sujetos caucasianos.
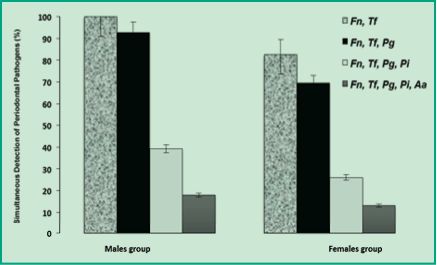
En la figura 5, se observan las valores de la detección simultánea y combinada por orden de incidencias; de los cinco patógenos periodontales presentes en ambos grupos de pacientes masculinos y femeninos. Interesantemente, en el grupo de hombres se observaron los valores de detección simultánea más elevados que en el grupo de mujeres. Además, en el grupo de hombres la co-detección de F. nucleatum y T. forsythia alcanzó el 100%, mientras que en el grupo de mujeres fue significativamente menor (83%). Con igual tendencia, se observó la detección simultánea de los tres patógenos F. nucleatum, T. forsythia y P. gingivalis; la cual fue del 93% en los hombres y del 70% en las mujeres. A medida que se incrementa la detección simultánea (F. nucleatum, T. forsythia, P. gingivalis y P. intermedia), se observa que los porcentajes de detección disminuyen; sin embargo, siguen siendo significativamente mayores en el grupo de los hombres (39%) que en las mujeres (26%). Finalmente, la detección simultánea de todos los patógenos periodontales de este estudio (F. nucleatum, T. forsythia, P. gingivalis, P. intermedia y A. actinomycetecomitans), revelaron valores del 18% en el grupo de los hombres y del 13% en el grupo de las mujeres (Figura 5). Estos resultados sugieren que la microbiota subgingival difiere significativamente entre el grupo de hombre y mujeres de una población uruguaya con periodontitis crónica. Se plantea en el sexo masculino el establecimiento de coagregaciones multigenéricas bacterianas, quizás mayormente favorecido por el microambiente hormonal, diferenciado del sexo femenino.
Fig. 5. Detección múltiple en porcentajes de los patógenos periodontales en grupos de hombres y mujeres.
Conclusiones
Los resultados de la técnica convencional microbiológica evidenciaron la presencia de 33% de la especie A. actinomycetemcomitans y de 100% de bacterias negras pigmentadas anaerobias en las muestras. El análisis de las secuencias especie-específicas a nivel del ARN ribosomal 16S por mutiplex-PCR, permitieron la rápida detección a nivel de especie de cinco patógenos periodontales en muestras de 51 pacientes de ambos sexos. Dentro de las especies bacterianas identificadas F. nucleatum, fue el único patógeno periodontal que se detectó en todos los pacientes de ambos sexos. Las especies patógenas con mayor prevalencia en una población uruguaya con periodontitis crónica fueron F. nucleatum, T. forsythia y P. gingivalis.
Agradecimientos
Agradecemos el soporte técnico que realizó la Escuela de Graduados de la Facultad de Odontología-UDELAR, a Paul Gaytán, Jorge Yáñez y Eugenio López por la síntesis de oligonucleótidos IBT-UNAM (México).
Referencias
1. Gajardo M, Silva N, Gómez L, León R, Parra B, Contreras A, Gamonal J. Prevalence of Periodontopathic Bacteria in Aggressive Periodontitis Patients in a Chilean Population.J. Periodontol. 2005;76: 289-294.
2. Bertl K, Zatorska B, Leonhard M, Matejka M, Schneider-Stickler B. Anaerobic and microaerophilic pathogens in the biofilm formation on voice prostheses: A pilotstudy. Laryngoscope. 2011; 6. 10.1002/lary.23193. [Epub ahead of print].
3. Figuero E., Sánchez M., Cuesta S., Tejerina J., Del Castro J., Gutiérrez J., Herrera D., Sanz M. Detection of Periodontal Bacteria in Atheromatous Plaque by Nested Polymerase Chain Reaction. J. Periodontol.2011; 82(10): 1469-1477.
4. Byakodi R, Krishnappa R, Keluskar V, Bagewadi A, Shetti A. The microbial flora associated with oral carcinomas. Quintessence Int.2011;42(9): 118-123.
5. Cao H, Qi Z, Jiang H, Zhao J, LiuTang. Detection of Porphyromonas endodontalis, Porphyromonas gingivalis and Prevotella intermedia in primary endodontic infections in a Chinese population. Int. Endod. J. 2012 Mar 19. doi: 10.1111/j.1365-2591.2012.02035.x. [Epubahead of print].
6. Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res.2012; 22(2): 299-306.
7. Albandar JM. Periodontal diseases in North America. Periodontol 2000.2002; 29:31-69.
8. Bascones-Martinez A F. Las enfermedades periodontales como infecciones bacterianas. Av Periodon Implantol.2005;17(3):147-56. (Albandar; Kleonatas et al.; Ghizoni et al.).
9. Kleontas A, Asteriou C, Efstathiou A, Konstantinou E, Tsapas C, Barbetakis N. Actinomyces israelii: a rare cause ofthoracicempyema. Tuberk Toraks.2011; 59(4): 399-401.
10. Ghizoni JS, Taveira LA, Garlet GP, Ghizoni MF, Pereira JR, Dionísio TJ, Brozoski DT, Santos CF, Santana AC. Increased levels of Porphyromonas gingivalis are associated with ischemic and hemorrhagic cerebrovascular disease in humans: an in vivo study. J. Appl. Oral Sci.2012; 20(1): 104-112.
11. Mujica TC., Castillo-Ruiz M., Daille LK., Fuentevilla A., Bittner M. Co-detection of Periodontal Pathogens in Chilean Patients with Chronic Periodontitis. Rev. Clin. Periodoncia Implantol. Rehabil. Oral.2010;3(3): 118-122.
12. Fayad I., Lafaurie G., Contreras A., Castillo D., Barón M. Microflora subgingival en periodontitis crónica y agresiva en Bogotá, Colombia: un acercamiento epidemiológico. Biomédica., 2007;27(1);16-20.
13. Medina A., Montoya A., Zuluaga G. Perfil microbiológico subgingival de pacientes con periodontitis crónica en una población de Colombia. Avances en Periodoncia.2012;24(1): 47-53.
14. Taba M Jr., Souza SL., Mariguela VC. Periodontal disease: a genetic perspective. Braz Oral Res.2012; 1:32-38.
15. Papone V, Batlle A. Porphyromonas gingivalis. Su relación con Periodontitis Rápidamente Progresiva. Odontología de Postgrado.1997;3(4): 51-55.
16. Papone V, Morteo G. Un patógeno periodontal virulento Actinobacillus actinomycetemcomitans. Actas odontológicas .2005;2(1): 43-47.
17. Handelsman J, Rondon MR, Brady SF, Clardy J, Goodman RM. Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products.Chemistry&biology.1998;5(10), R245-R249.
18. Rondon MR, August PR, Bettermann AD, Brady SF, Grossman TH, Liles MR, Loiacono KA, Lynch BA, MacNeil IA, Minor C, Tiong CL, Gilman M, Osburne MS, Clardy J, Handelsman J, Goodman RM. Cloning the Soil Metagenome: a Strategy for Accessing the Genetic and Functional Diversity of Uncultured Microorganisms. Appl.Environmental Microbiology.2000;66(6): 2541-2547.
19. Mullis KB, Ferré F, Gibbs R. The Polymerase chain reaction. Optimization of Multiplex PCRs. Ed. Birkhäuser.1994; Boston. 38-54.
20. Tran SD, Rudney JD. Multiplex PCR Using conserved and species-specific 16S rRNA gene primers for simultaneous detection of Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis. J. Clin. Microb.1996; 34 (11): 2674–2678.
21. Tran SD, Rudney JD. Improved Multiplex PCR using conserved and species-specific 16S rRNA gene primers for simultaneous detection of Actinobacillus actinomycetemconitans, Bacteroides forsythus and Porphyromonas gingivalis. J. Clin. Microb. 1999;35(11):3504-3508.
22. Willis SG., Smith KS., DUNN VL., Gapter LA., Riviere KH., Riviere GR. Identification of Seven Treponema Species in Health- and Disease-Associated Dental Plaque by Nested PCR. American Society Microbiology. 1999;37(3): 867-869.
23. Armitage, G.Development of a classification system for periodontal diseases and conditions. Annals of Peridontology .1999;4, 1-6.
24. Syed SA., Loesche WJ. Survival of Human Dental Plaque Flora in Various Transport Media. App. Microbiology.,1972; 24(4): 638-644.
25. Kolenbrander PE. Multispecies communities: interspecies interactions influence growth on saliva as sole nutritional source. Int J Oral Sci.2011; 3: 49-54.
26. Rosen G, Nisimov I, Helcer M, Sela M. Actinobacillus actinomycetemcomitans Serotype b Lipopolysaccharide Mediates Coaggregation with Fusobacterium nucleatum. Inf Immunity.2003 71(6): 3652–3656.
27. Huang R., Li M., Gregory R. Bacterial interactions in dental biofilm. Virulence.2011; 2(5): 435-444.
28. Bahekar AA, Singh S, Saha S, Molnar J, Arora R. The prevalence and incidence of coronary heart disease is significantly increased in periodontitis: A meta-analysis. J Am Heart.2007; 154: 830-837.
29. Humphrey LL, Fu R, Buckley DI, Freeman M, Helfand M. Periodontal disease and coronary heart disease incidence: A systematic review and meta-analysis. J Gen Intern Med.2008; 23: 2079-2086.
30. Blaizot A, Vergnes JN, Nuwwareh S, Amar J, Sixou M. Periodontal diseases and cardiovascular events: Meta- analysis of observational studies. J Int Dent; 2009;59: 197-209.
31. Herrera D, Contreras A, Gamonal J, Oteo A, Jaramillo A, Silva N, Sanz M, Botero J, León R. Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. J. Clin. Periodontol.2008; 35: 106-113.
32. Klinger G., Glänzer S., Sigusch B., Klinger G., Römer WP. Influence of sexual steroids on cell functions of PMNL in the gingival sulcus. Pharmazie. 2000; 55(9): 678-680.
33. Uruguay. Ministerio de Salud Pública. Normativa MERCOSUR. Estudios clínicos con medicamentos. junio2007. Resolución Nº 129/96. Disponible en: http://www.msp.gub.uy











 text in
text in