Services on Demand
Journal
Article
Related links
Share
Odontoestomatología
Print version ISSN 0797-0374On-line version ISSN 1688-9339
Odontoestomatología vol.17 no.25 Montevideo May 2015
Analisis inmunohistoquimico de CK14 y CK19 en germen dentario y ameloblastoma
Immunohistochemical analysis of ck14 and ck19 in tooth germs and ameloblastoma
Apellaniz Delmira*,
Nieves Sabrina*,
Tapia Gabriel**,
Maglia Álvaro***,
Mosqueda-Taylor Adalberto****,
Bologna-Molina Ronell*****
* Becario Área de Patología Molecular, Facultad de Odontología, Universidad de la República. Uruguay
** Profesor Adjunto, Grado 3, Cátedra de Histología, Facultad de Odontología, Universidad de la República. Uruguay
*** Profesor Titular, Grado 5, Cátedra de Histología, Facultad de Odontología, Universidad de la República. Uruguay
**** Especialista en Patología y Medicina Bucal, Master in Oral Pathology, Profesor Investigador Tiempo Completo Departamento de Atención a la Salud, Universidad Autónoma Metropolitana. México
***** Especialista en Patología y Medicina Bucal, Doctor en Ciencias Biológicas (Patología Molecular), Profesor Titular, Grado 5, Dedicación Total, Área de Patología Molecular, Facultad de Odontología, Universidad de la República. Uruguay
ronllbologna@hotmail.com
Resumen
Introducción. La odontogénesis es el proceso de formación de los órganos dentarios, en el cual se expresan diversas moléculas, dentro de las cuales encontramos las citoqueratinas 14 y 19 (CK14, CK19). Una vez concluido el proceso de formación del diente quedan restos del epitelio odontogénico, el cual se ha sugerido se encuentra implicado en el desarrollo del ameloblastoma, uno de los tumores odontogénicos más frecuentes. Se ha sugerido que las CK14 y CK19 tienen utilidad como marcadores de diferenciación ameloblástica, y podrían tener implicación dentro del comportamiento tumoral de los ameloblastomas. El objetivo del presente estudio fue describir los patrones de expresión inmunohistoquímica de estas dos citoqueratinas en gérmenes dentarios y ameloblastomas. Materiales y métodos. Se incluyeron 6 ameloblastomas sólidos multiquísticos y 5 gérmenes dentarios a los cuales se les realizó técnica de inmunohistoquímica para CK14 y CK19. Resultados. Este estudio permitió visualizar la inmunoexpresión de CK14 y CK19 en el epitelio y la negatividad en el ectomesénquima, tanto en los gérmenes dentarios como en ameloblastomas. También permitió concluir que CK19 puede ser considerada como un eficiente marcador de diferenciación ameloblástica, mientras que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose marcada inmunoexpresión de esta última en ameloblastos secretores.
Palabras clave. odontogénesis, germen dentario, ameloblastoma, citoqueratinas 14 y 19.
Abstract
Introduction. Odontogenesis is the process by which teeth form, and where different molecules are expressed, among them some cytokeratins (CK) like CK14 and CK19. Remnants of odontogenic epithelium may persist once the development process is complete, which has been suggested to be involved in the development of ameloblastoma, one of the most common benign odontogenic tumours. It has been suggested that CK14 and CK19 are useful markers of ameloblast differentiation and that they could have implications for tumour behaviour. The aim of this study is to describe the patterns of immunohistochemical expression of these cytokeratins in tooth germs and ameloblastomas. Materials and methods. We worked with 6 solid multicystic ameloblastomas and 5 tooth germs. The immunohistochemistry technique was used to visualise CK14 and CK19. Results. We detected CK14 and CK19 immunoexpression in the epithelium and no expression in the ectomesenchyme in both tooth germs and ameloblastomas. It was concluded that CK19 can be considered an efficient marker of ameloblast differentiation, whereas CK14 is gradually replaced by CK19 in the inner epithelium of the enamel organ, showing strong immunoexpression in secretory ameloblasts.
Keywords. odontogenesis, tooth germ, ameloblastoma, cytokeratins 14 and 19.
Fecha recibido: 08.05.14 - Fecha aceptado: 02.02.15
Introducción
La odontogénesis es un proceso biológico, mediante el cual las células ectodérmicas del estomodeo, interactúan con las células del ectomesénquima subyacente, con la finalidad de formar los órganos dentarios. El desarrollo dentario implica tanto crecimiento, migración y diferenciación celular, así como una serie de eventos resultantes de una compleja e intrincada cascada de genes que se expresan en determinado lugar y en determinada secuencia (1).
Tanto en el ectomesénquima como en el ectodermo se expresan diversas moléculas, las cuales presentan roles diferentes (2). Un ejemplo de ello son las citoqueratinas que expresan las células epiteliales y que son responsables de diversos mecanismos biológicos en que participan los epitelios (3-6). Una vez culminada la odontogénesis, en los maxilares existen diferentes zonas donde podemos encontrar restos del epitelio odontogénico (7). Se ha sugerido que estos restos, son los responsables de la formación de diferentes lesiones entre las cuales encontramos los quistes y los tumores odontogénicos. Y dentro de estos últimos, uno de los más frecuentes es el ameloblastoma, neoplasia benigna localmente agresiva, que tiene un amplio espectro de patrones histológicos que se asemejan a la odontogénesis temprana (8).
El objetivo del presente estudio fue describir los patrones de expresión inmunohistoquímica de dos citoqueratinas, CK14 y CK19 en gérmenes dentarios y ameloblastomas. Dado que la expresión de estas dos citoqueratinas ha sido demostrada en procesos tanto de odontogénesis como de carcinogénesis, y se ha evidenciado su utilidad pronóstica en diversas neoplasias malignas, se cree importante tratar de entender el rol que desempeñan estos filamentos intermedios en procesos embrionarios y procesos de progresión tumoral (9). Por esta razón se decidió estudiar estas dos citoqueratinas en procesos embrionarios normales (odontogenesis) y en procesos patológicos neoplásicos (ameloblastoma).
Materiales y métodos
Para el estudio inmunohistoquímico se incluyeron 6 ameloblastomas sólidos multiquísticos provenientes del Laboratorio de Patología Bucal de la Universidad Autónoma Metropolitana Xochimilco (México) y 5 gérmenes dentarios provenientes de la Cátedra de Histología de la Facultad de Odontología de la Universidad de la República (Uruguay). Tanto los tumores como los gérmenes dentarios se encontraban almacenados e incluidos en bloques de parafina. Se realizó un estudio descriptivo observacional.
Técnica de inmunohistoquímica
Se realizaron cortes de 2 μm de espesor y fueron montados en laminillas tratadas con poly-L-lisina. Los cortes fueron desparafinados en la estufa a 45 oC por 30 minutos y posteriormente dejados en xilol por 5 minutos. Los cortes se hidrataron en concentraciones decrecientes de alcoholes absoluto al 90, 70 y 50% y enjuagues con agua destilada. Para el desenmascaramiento de los epítopes se realizó recuperación antigénica con solución de citrato de sodio 10mM (pH 6.2) con olla a presión en microondas a potencia máxima (750 W) por 5 minutos, dejando enfriar a temperatura ambiente y posteriormente se enjuagó con agua destilada. Las peroxidasas endógenas fueron bloqueadas con peróxido de hidrógeno al 0.9%, seguidos por lavados con agua destilada y solución salina amortiguada, solución salina de fosfatos pH 7.4 (PBS). Se incubaron los anticuerpos primarios monoclonales contra citoqueratina 14 (clona N3C3 Genetex, CA, USA, dilución 1:100) y contra citoqueratina 19 (clona RCK108 Dako Corporation, Carpinteria CA, USA, dilución 1:100) por un período de 45 min. Posteriormente, los cortes fueron incubados con el segundo anticuerpo biotinilado anti -ratón/anti-conejo y con el complejo streptavidina/peroxidasa (LSA-B + Labeledstreptavidin-biotin, DakoCorporation, Carpinteria CA, USA) por 30 minutos cada uno. Los productos de la reacción fueron visualizados con sustrato de 3,3’-diaminobenzidina-H2O2 (Dako Corporation, Carpintería, CA, USA). Las secciones fueron contrateñidas con hematoxilina de Mayer. Como controles positivos fueron utilizados fragmentos de mucosa oral y piel; para los controles negativos se omitió la incubación con los anticuerpos primarios.
Resultados
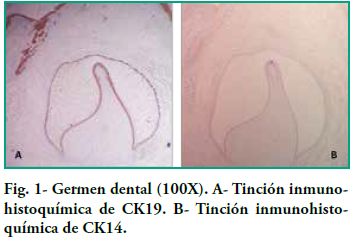
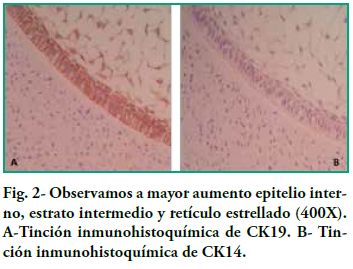
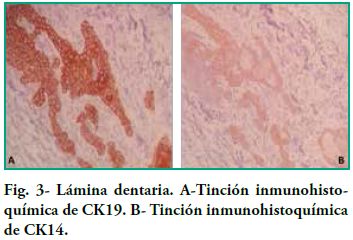
Nuestro estudio nos permitió ver la inmunoexpresión de CK14 y CK19 en el epitelio y la negatividad del ectomesénquima, tanto en los gérmenes dentarios como en ameloblastomas. En el germen dentario, al observar el órgano del esmalte podemos ver como en los diferentes estratos la expresión de CK19 varía dependiendo del área de observación (Figura 1A). Por ejemplo, al analizar el epitelio interno del órgano del esmalte, la expresión de CK19 es más marcada en la membrana celular (en los extremos basal, apical y las paredes laterales); en el estrato intermedio la expresión de CK19 es fuertemente positiva entorno al núcleo, en el retículo estrellado CK19 tiene una alta positividad en las prolongaciones siendo menor en el cuerpo celular (Figura2-A), mientras que en el epitelio externo la expresión es uniforme a nivel del citoplasma siguiendo la forma aplanada del cuerpo celular y por último en la lámina dentaria en involución se observó una tinción intensa y con un patrón homogéneo (Figura 3-A). Con respecto a CK14 la inmunotinción fue negativa a excepción de una débil inmunotinción observada en el epitelio interno (Figura 1-B y 2-B). Mientras que se evidenció mayor inmunotinción en la lámina dentaria (Figura3-B).
En cuanto a ameloblastomas, tres de los seis ameloblastomas sólidos/multiquísticos incluidos en este estudio, fueron del tipo folicular y tres fueron plexiformes. Todos los tumores mostraron positividad para CK14 y CK19. Se encontró mayor inmunopositividad para CK14 comparado con CK19, observándose inmunotinción focal para CK19 y predominantemente difusa para CK14.
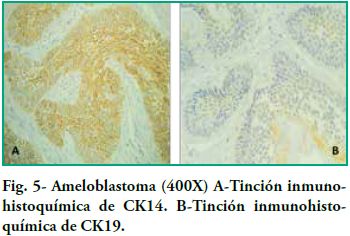
La positividad para CK19 fue predominantemente moderada, mostrando algunas variaciones en la positivad dependiendo de la zona tumoral, pues en el caso de los ameloblastomas foliculares se encontró inmunotinción en las islas y folículos de epitelio odontogénico que presentaron positividad citoplasmática tanto en las células periféricas basales con polarización inversa como en las células centrales que recuerdan el retículo estrellado, pero dicha tinción no fue uniforme, ya que dentro del mismo tumor se encontraron focos más positivos que otros, y dentro de los mismos folículos se encontraron áreas con variaciones en la positividad sin seguir un patrón establecido (ver figura 5). En el caso de los ameloblastomas plexiformes los plexos y cordones mostraron también inmunotinción moderada y no uniforme, evidenciándose áreas con mayor positividad que otras.
La positividad para CK14 fue en general más intensa y menos focal, encontrándose distribuida uniformemente a lo largo de todos los cordones y plexos de epitelio odontogénico cuando se trató de la variante plexiforme, y cuando se trató de la variante folicular se evidenciaron los folículos e islas de epitelio odontogénico uniformemente positivos en todo el tumor.
Discusión
Los patrones de expresión de citoqueratinas en el epitelio odontogénico han sido pobremente descriptos (10-16). Domingues et al. (10), en su estudio inmunohistoquímico demostraron que las células epiteliales del germen dental y los remanentes de la lámina dental son positivos para CK14 y CK19, con ligeros cambios en el patrón dependiendo de la fase de la odontogénesis. Nuestro estudio muestra resultados similares sobre todo para CK19, basándonos en los cambios que se van dando en el epitelio interno desde el ansa cervical al futuro borde incisal, zona donde comienza la posición de material calcificado. El grupo de Domingues et al. encontró que el epitelio interno del órgano del esmalte reveló fuerte positividad para CK14 en el estadio de campana, mientras que en el estadio de campana tardío, este epitelio, ahora diferenciado en ameloblastos, mostró una tinción más débil para CK14, la que apareció principalmente en los extremos apical y basal de las células, en nuestro estudio encontramos áreas del epitelio interno que mostraron inmunotinción débil para CK14. En contraste, CK19 tuvo una inmunotinción débil en el epitelio interno del esmalte en el estadio de campana, pero cuando estas células se diferencian en ameloblastos se vuelve intensamente positivo y se ve delineando la membrana de la célula (es decir, extremos apical y basal y paredes laterales).
Nuestros estudios concuerdan con estos hallazgos, pues vemos como el epitelio interno va aumentando la expresión de CK19 a medida que las células se van diferenciando a ameloblastos, también muestra que no sólo cambia la intensidad en la tinción de CK19, sino que también cambia la distribución de la misma. Las células menos diferenciadas muestran una tinción difusa mientras que las más diferenciadas muestran una tinción marcada a nivel de las zonas próximas a la membrana celular (Figura 4). Domingues et al. plantean que la citoqueratina predominante en los restos de la lámina dental fue CK14, que tiñó fuertemente todas las células, y en su estudio CK19 apareció sólo en algunas células de la lámina dental, dando un patrón no homogéneo. En cambio, en nuestros preparados la tinción es intensa y con un patrón homogéneo para ambas citoqueratinas (Figura 3). Domingues et al. relatan que en el retículo estrellado también se vio la expresión de CK14, siendo más fuerte en la fase temprana de campana, con respecto a CK 19 también encontraron expresión pero ligeramente más débil. En nuestros casos no encontramos inmunoexpresión de CK14 probablemente debido a que pertenecen a estadios embriológicos más avanzados que el de campana temprana. Con respecto a CK19 encontramos una alta positividad en las prolongaciones siendo menor en el cuerpo celular (Figura 2). En cuanto al epitelio externo del órgano esmalte solo relatan que fue teñido tanto para CK14 como para CK19; nosotros sólo podemos agregar que la expresión de CK19 es uniforme a nivel del citoplasma siguiendo la forma aplanada del cuerpo celular.
Crivelini et al (11), Ferreira Lopes et al (12), Leon et al (13), Kasper et al (14), Heikinheimo et al (15) y Gao et al (16), aunque no describen en forma tan detallada, también estudiaron la expresión de CK19 en el germen dental. Encontraron CK19 en el órgano del esmalte (11-16) y en la lámina dental (11,13, 14). Crivelini et al y Leon et al, concuerdan con nuestros hallazgos, encontrando que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose marcada inmunoexpresión de esta última en ameloblastos secretores (15).
Dado los cambios de la expresión de CK14 y CK19 en el epitelio interno del esmalte, algunos autores han sugerido que esta última puede ser considerada como un marcador de diferenciación ameloblástica (10, 11).
Son varios los autores que se detienen en el estudio de estas dos citoqueratinas en tumores y entre estos en los tumores odontogénicos, ya sea para determinar su histogénesis o como diagnóstico diferencial con otras lesiones. Varios han demostrado que la expresión aberrante de CK14 y CK19 puede ser un hallazgo temprano en la patogénesis del carcinoma oral de células escamosas y pueden ser utilizados como un marcador de diferenciación tumoral (17-19). Varios estudios demuestran que la expresión de CK19 se ve aumentada acorde al grado y estadio del cáncer incluyendo a las neoplasias epiteliales de la cavidad oral (20,21).
Nuestros estudios muestran que la expresión de CK19 fue predominantemente moderada, mostrando algunas variaciones en la positivad dependiendo de la zona tumoral, y en el caso de los ameloblastomas foliculares se encontró inmunotinción en las islas y folículos de epitelio odontogénico mostrando positividad citoplasmática tanto las células periféricas basales con polarización inversa como en las células centrales que recuerdan el retículo estrellado, aunque dicha tinción no fue uniforme, ya que dentro del mismo tumor se encontraron focos más positivos que otros, y dentro de los mismos folículos se encontraron áreas con variaciones en la positividad sin seguir un patrón establecido.
Algunos autores (12, 22, 23) estudiaron la expresión de CK19 en ameloblastomas y relatan que la encontraron en todas las células del tumor, no haciendo referencia a los cambios de intensidad que nosotros encontramos. Crivelini et al. relatan haber encontrado expresión de CK19 en algunos grupos de células con metaplasia escamosa y débil reacción en las células estrelladas centrales y células aplanadas de las estructuras quísticas, lo que sugiere una tinción no uniforme como la que observamos en nuestros estudios, lo que adjudican a que CK19 caracteriza sólo ameloblastos y preameloblastos con diferenciación completa, que no se produce en ameloblastomas.
En nuestros estudios, la positividad para CK14 fue en general más intensa y menos focal, encontrándose distribuida uniformemente a lo largo de todos los cordones y plexos de epitelio odontogénico cuando se trató de la variante plexiforme, y cuando se trató de la variante folicular se evidenciaron los folículos e islas de epitelio odontogénico uniformemente positivos en todo el tumor. Varios autores describen la presencia de positividad para CK14 en las células de la periferia de los folículos (11, 12, 22), pero no hay acuerdo en cuanto a si se presenta o no en las células internas, ya que algunos describen que hay negatividad en la parte central de las células que recuerdan el retículo estrellado (12), y otros que CK14 se expresa en mayoría de las células internas (11, 22), mientras que nosotros, como ya relatamos, vemos la expresión de CK14 en todas las células.
Concluimos que, como relatan diversos autores, CK19 puede ser considerada como un marcador de utilidad en la diferenciación ameloblástica (10, 11, 20, 21), ya que cuando las células del epitelio interno se diferencian en ameloblastos tiende a predominar la inmunotinción intensamente positiva, mientras que a la vez disminuye la expresión de CK14, esto sugiere una participación de estos dos filamentos intermedios dentro de la biología de la formación del órgano dentario. En cuanto a los resultados observados en ameloblastomas, la mayor expresión de CK14 con respecto a CK19 podría sugerir que estas células neoplásicas no sufren diferenciación ameloblástica, esto podría justificarse en el hecho de que estos tumores no producen material calcificado.
Cabe señalar que dadas las limitaciones propias de este estudio tanto en número de casos incluidos, así como la limitante que genera el uso exclusivo de una técnica de inmunoexpresión, se deben de desarrollar futuros estudios incluyendo una muestra representativa de las diferentes variantes de ameloblastomas y gérmenes dentarios abordado enfoques experimentales diversos.
Referencias
1. Mass R, Bei M. The genetic control of early tooth development. Crit. Rev. Oral Biol. Med. 1997; 8(1): 4-39.
2. Thesleff I, Keränen S, Jernvall J. Enamel knots as signaling centers linking tooth morphogenesis and odontoblast differentiation. Adv. Dent. Res. 2001; 15: 14-18.
3. Oriolo AS, Wald FA, Ramsauer VP, Salas PJ. Intermediate filaments: a role in epithelial polarity. Exp. Cell Res. 2007; 313(10): 2255-2264.
4. Pan X, Hobbs RP, Coulombe PA. The expanding significance of keratin intermediate filaments in normal and diseased epithelia. Curr. Opin. Cell Biol. 2013; 25(1): 47-56.
5. Chung BM, Rotty JD, Coulombe PA. Networking galore: intermediate filaments and cell migration. Curr. Opi. Cell Biol. 2013; 25(5): 600-612.
6. Pallari HM, Eriksson JE. Intermediate filaments as signaling platforms Sci. STKE 2006; (366): 53
7. Kumamoto H. Molecular pathology of odontogenic tumors. J. Oral Pathol. Med. 2006; 35(2): 65-74.
8. Gardner DG, Heikinheimo K, Shear M, Philipsen HP, Coleman H. Odontogenic Tumours. In World Health Organization Classification of Tumors. Pathology and Genetics Head and Neck Tumors. Lyon: IARCPress; 2005. p283-327.
9. Schantz SP. Head and neck oncology research. Curr Opin Oncol. 1994; 6(3): 265-71.
10. Domingues MG, Jaeger MM, Araújo VC, Araújo NS. Expression of cytokeratins in human enamel organ. Eur. J. Oral Sci. 2000; 108(1): 43-47.
11. Crivelini MM, de Araújo VC, de Sousa SO, De Araújo NS. Cytokeratins in epithelia of odontogenic neoplasms. Oral Dis. 2003; 9(1): 1-6.
12. Ferreira Lopes F, Fontoura MC, do Amaral AL, Dantas EJ, Cavalcanti H, Batista L et al. Análise imuno-histoquímica das citoqueratinas em ameloblastoma e tumor odontogênico adenomatóide. J Bras. Patol. Med. Lab. 2005; 41(6): 425-430.
13. Leon JE, Mata GM, Fregnani ER, Carlos-Bregni R, de Almeida OP, Mosqueda-Taylor A et al. Clinicopathological and immunohistochemical study of 39 cases of Adenomatoid Odontogenic Tumour: a multicentric study. Oral Oncol. 2005; 41(8): 835–842.
14. Kasper M, Karsten U, Stosiek P, Moll R. Distribution of intermediate-filament proteins in the human enamel organ: unusually complex pattern of coexpression of cytokeratin polypeptides and vimentin. Differentiation 1989; 40(3): 207-214.
15. Heikinheimo K, Hormia M, Stenman G, Virtanen I, Happonen RP. Patterns of expression of intermediate filaments in ameloblastoma and human fetal tooth germ. J. Oral Pathol. Med. 1989; 18(5): 264-273.
16. Gao Z, Mackenzie IC, Cruchley AT, Williams DM, Leigh I, Lane EB. Cytokeratin expression of the odontogenic epithelia in dental follicles and developmental cysts. J. Oral. Pathol. Med. 1989; 18(2): 63-67.
17. Fillies T, Jogschies M, Kleinheinz J, Brandt B, Joos U, Buerger H. Cytokeratin alteration in oral leukoplakia and oral squamous cell carcinoma. Indian. J. Dent. Res. 2005; 16(1):6-11.
18. Zhong LP, Chen WT, Zhang CP, Zhang ZY. Increased CK19 expression correlated with pathologic differentiation grade and prognosis in oral squamous cell carcinoma patients. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2007; 104(3): 377-84.
19. Ram Prassad VV, Nirmala NR, Kotian MS. Immunohistochemical evaluation of expression of cytokeratin 19 in different histological grades of leukoplakia and oral squamous cell carcinoma. Indian. J. Dent. Res. 2005; 16 (1): 6-11.
20. Babiker AY, Rahmani AH, Abdalaziz MS, Albutti A, Aly SM, Ahmed HG. Expressional analysis of p16 and cytokeratin19 protein in the genesis of oral squamous cell carcinoma patients. Int. J. Clin. Exp. Med. 2014 (6): 1524-30.
21. Schantz SP. Basic science advances in head and neck oncology: the past decade.. Curr Opin Oncol. 1994; 6(3): 265-71.
22. Pal SK, Sakamoto K, Aragaki T, Akashi T, Tamaquachi A. The expression profiles of acidic epithelial keratins in ameloblastoma. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2013; 115(4): 523-531.
23. Fukumashi K, Enokiya Y, Inoue T. Cytoqueratins expression of constituting cells in ameloblastoma. Bull. Tokyo. Dent.. Coll. 2002; 43(1): 13-21
Immunohistochemical analysis of ck14 and ck19 in tooth germs and ameloblastoma
Apellaniz Delmira*,
Nieves Sabrina*,
Tapia Gabriel**,
Maglia Álvaro***,
Mosqueda-Taylor Adalberto****,
Bologna-Molina Ronell*****
* Becario Área de Patología Molecular, Facultad de Odontología, Universidad de la República. Uruguay
** Profesor Adjunto, Grado 3, Cátedra de Histología, Facultad de Odontología, Universidad de la República. Uruguay
*** Profesor Titular, Grado 5, Cátedra de Histología, Facultad de Odontología, Universidad de la República. Uruguay
**** Especialista en Patología y Medicina Bucal, Master in Oral Pathology, Profesor Investigador Tiempo Completo Departamento de Atención a la Salud, Universidad Autónoma Metropolitana. México
***** Especialista en Patología y Medicina Bucal, Doctor en Ciencias Biológicas (Patología Molecular), Profesor Titular, Grado 5, Dedicación Total, Área de Patología Molecular, Facultad de Odontología, Universidad de la República. Uruguay
ronllbologna@hotmail.com
Resumen
Introducción. La odontogénesis es el proceso de formación de los órganos dentarios, en el cual se expresan diversas moléculas, dentro de las cuales encontramos las citoqueratinas 14 y 19 (CK14, CK19). Una vez concluido el proceso de formación del diente quedan restos del epitelio odontogénico, el cual se ha sugerido se encuentra implicado en el desarrollo del ameloblastoma, uno de los tumores odontogénicos más frecuentes. Se ha sugerido que las CK14 y CK19 tienen utilidad como marcadores de diferenciación ameloblástica, y podrían tener implicación dentro del comportamiento tumoral de los ameloblastomas. El objetivo del presente estudio fue describir los patrones de expresión inmunohistoquímica de estas dos citoqueratinas en gérmenes dentarios y ameloblastomas. Materiales y métodos. Se incluyeron 6 ameloblastomas sólidos multiquísticos y 5 gérmenes dentarios a los cuales se les realizó técnica de inmunohistoquímica para CK14 y CK19. Resultados. Este estudio permitió visualizar la inmunoexpresión de CK14 y CK19 en el epitelio y la negatividad en el ectomesénquima, tanto en los gérmenes dentarios como en ameloblastomas. También permitió concluir que CK19 puede ser considerada como un eficiente marcador de diferenciación ameloblástica, mientras que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose marcada inmunoexpresión de esta última en ameloblastos secretores.
Palabras clave. odontogénesis, germen dentario, ameloblastoma, citoqueratinas 14 y 19.
Abstract
Introduction. Odontogenesis is the process by which teeth form, and where different molecules are expressed, among them some cytokeratins (CK) like CK14 and CK19. Remnants of odontogenic epithelium may persist once the development process is complete, which has been suggested to be involved in the development of ameloblastoma, one of the most common benign odontogenic tumours. It has been suggested that CK14 and CK19 are useful markers of ameloblast differentiation and that they could have implications for tumour behaviour. The aim of this study is to describe the patterns of immunohistochemical expression of these cytokeratins in tooth germs and ameloblastomas. Materials and methods. We worked with 6 solid multicystic ameloblastomas and 5 tooth germs. The immunohistochemistry technique was used to visualise CK14 and CK19. Results. We detected CK14 and CK19 immunoexpression in the epithelium and no expression in the ectomesenchyme in both tooth germs and ameloblastomas. It was concluded that CK19 can be considered an efficient marker of ameloblast differentiation, whereas CK14 is gradually replaced by CK19 in the inner epithelium of the enamel organ, showing strong immunoexpression in secretory ameloblasts.
Keywords. odontogenesis, tooth germ, ameloblastoma, cytokeratins 14 and 19.
Fecha recibido: 08.05.14 - Fecha aceptado: 02.02.15
Introducción
La odontogénesis es un proceso biológico, mediante el cual las células ectodérmicas del estomodeo, interactúan con las células del ectomesénquima subyacente, con la finalidad de formar los órganos dentarios. El desarrollo dentario implica tanto crecimiento, migración y diferenciación celular, así como una serie de eventos resultantes de una compleja e intrincada cascada de genes que se expresan en determinado lugar y en determinada secuencia (1).
Tanto en el ectomesénquima como en el ectodermo se expresan diversas moléculas, las cuales presentan roles diferentes (2). Un ejemplo de ello son las citoqueratinas que expresan las células epiteliales y que son responsables de diversos mecanismos biológicos en que participan los epitelios (3-6). Una vez culminada la odontogénesis, en los maxilares existen diferentes zonas donde podemos encontrar restos del epitelio odontogénico (7). Se ha sugerido que estos restos, son los responsables de la formación de diferentes lesiones entre las cuales encontramos los quistes y los tumores odontogénicos. Y dentro de estos últimos, uno de los más frecuentes es el ameloblastoma, neoplasia benigna localmente agresiva, que tiene un amplio espectro de patrones histológicos que se asemejan a la odontogénesis temprana (8).
El objetivo del presente estudio fue describir los patrones de expresión inmunohistoquímica de dos citoqueratinas, CK14 y CK19 en gérmenes dentarios y ameloblastomas. Dado que la expresión de estas dos citoqueratinas ha sido demostrada en procesos tanto de odontogénesis como de carcinogénesis, y se ha evidenciado su utilidad pronóstica en diversas neoplasias malignas, se cree importante tratar de entender el rol que desempeñan estos filamentos intermedios en procesos embrionarios y procesos de progresión tumoral (9). Por esta razón se decidió estudiar estas dos citoqueratinas en procesos embrionarios normales (odontogenesis) y en procesos patológicos neoplásicos (ameloblastoma).
Materiales y métodos
Para el estudio inmunohistoquímico se incluyeron 6 ameloblastomas sólidos multiquísticos provenientes del Laboratorio de Patología Bucal de la Universidad Autónoma Metropolitana Xochimilco (México) y 5 gérmenes dentarios provenientes de la Cátedra de Histología de la Facultad de Odontología de la Universidad de la República (Uruguay). Tanto los tumores como los gérmenes dentarios se encontraban almacenados e incluidos en bloques de parafina. Se realizó un estudio descriptivo observacional.
Técnica de inmunohistoquímica
Se realizaron cortes de 2 μm de espesor y fueron montados en laminillas tratadas con poly-L-lisina. Los cortes fueron desparafinados en la estufa a 45 oC por 30 minutos y posteriormente dejados en xilol por 5 minutos. Los cortes se hidrataron en concentraciones decrecientes de alcoholes absoluto al 90, 70 y 50% y enjuagues con agua destilada. Para el desenmascaramiento de los epítopes se realizó recuperación antigénica con solución de citrato de sodio 10mM (pH 6.2) con olla a presión en microondas a potencia máxima (750 W) por 5 minutos, dejando enfriar a temperatura ambiente y posteriormente se enjuagó con agua destilada. Las peroxidasas endógenas fueron bloqueadas con peróxido de hidrógeno al 0.9%, seguidos por lavados con agua destilada y solución salina amortiguada, solución salina de fosfatos pH 7.4 (PBS). Se incubaron los anticuerpos primarios monoclonales contra citoqueratina 14 (clona N3C3 Genetex, CA, USA, dilución 1:100) y contra citoqueratina 19 (clona RCK108 Dako Corporation, Carpinteria CA, USA, dilución 1:100) por un período de 45 min. Posteriormente, los cortes fueron incubados con el segundo anticuerpo biotinilado anti -ratón/anti-conejo y con el complejo streptavidina/peroxidasa (LSA-B + Labeledstreptavidin-biotin, DakoCorporation, Carpinteria CA, USA) por 30 minutos cada uno. Los productos de la reacción fueron visualizados con sustrato de 3,3’-diaminobenzidina-H2O2 (Dako Corporation, Carpintería, CA, USA). Las secciones fueron contrateñidas con hematoxilina de Mayer. Como controles positivos fueron utilizados fragmentos de mucosa oral y piel; para los controles negativos se omitió la incubación con los anticuerpos primarios.
Resultados
Nuestro estudio nos permitió ver la inmunoexpresión de CK14 y CK19 en el epitelio y la negatividad del ectomesénquima, tanto en los gérmenes dentarios como en ameloblastomas. En el germen dentario, al observar el órgano del esmalte podemos ver como en los diferentes estratos la expresión de CK19 varía dependiendo del área de observación (Figura 1A). Por ejemplo, al analizar el epitelio interno del órgano del esmalte, la expresión de CK19 es más marcada en la membrana celular (en los extremos basal, apical y las paredes laterales); en el estrato intermedio la expresión de CK19 es fuertemente positiva entorno al núcleo, en el retículo estrellado CK19 tiene una alta positividad en las prolongaciones siendo menor en el cuerpo celular (Figura2-A), mientras que en el epitelio externo la expresión es uniforme a nivel del citoplasma siguiendo la forma aplanada del cuerpo celular y por último en la lámina dentaria en involución se observó una tinción intensa y con un patrón homogéneo (Figura 3-A). Con respecto a CK14 la inmunotinción fue negativa a excepción de una débil inmunotinción observada en el epitelio interno (Figura 1-B y 2-B). Mientras que se evidenció mayor inmunotinción en la lámina dentaria (Figura3-B).




En cuanto a ameloblastomas, tres de los seis ameloblastomas sólidos/multiquísticos incluidos en este estudio, fueron del tipo folicular y tres fueron plexiformes. Todos los tumores mostraron positividad para CK14 y CK19. Se encontró mayor inmunopositividad para CK14 comparado con CK19, observándose inmunotinción focal para CK19 y predominantemente difusa para CK14.

La positividad para CK19 fue predominantemente moderada, mostrando algunas variaciones en la positivad dependiendo de la zona tumoral, pues en el caso de los ameloblastomas foliculares se encontró inmunotinción en las islas y folículos de epitelio odontogénico que presentaron positividad citoplasmática tanto en las células periféricas basales con polarización inversa como en las células centrales que recuerdan el retículo estrellado, pero dicha tinción no fue uniforme, ya que dentro del mismo tumor se encontraron focos más positivos que otros, y dentro de los mismos folículos se encontraron áreas con variaciones en la positividad sin seguir un patrón establecido (ver figura 5). En el caso de los ameloblastomas plexiformes los plexos y cordones mostraron también inmunotinción moderada y no uniforme, evidenciándose áreas con mayor positividad que otras.
La positividad para CK14 fue en general más intensa y menos focal, encontrándose distribuida uniformemente a lo largo de todos los cordones y plexos de epitelio odontogénico cuando se trató de la variante plexiforme, y cuando se trató de la variante folicular se evidenciaron los folículos e islas de epitelio odontogénico uniformemente positivos en todo el tumor.
Discusión
Los patrones de expresión de citoqueratinas en el epitelio odontogénico han sido pobremente descriptos (10-16). Domingues et al. (10), en su estudio inmunohistoquímico demostraron que las células epiteliales del germen dental y los remanentes de la lámina dental son positivos para CK14 y CK19, con ligeros cambios en el patrón dependiendo de la fase de la odontogénesis. Nuestro estudio muestra resultados similares sobre todo para CK19, basándonos en los cambios que se van dando en el epitelio interno desde el ansa cervical al futuro borde incisal, zona donde comienza la posición de material calcificado. El grupo de Domingues et al. encontró que el epitelio interno del órgano del esmalte reveló fuerte positividad para CK14 en el estadio de campana, mientras que en el estadio de campana tardío, este epitelio, ahora diferenciado en ameloblastos, mostró una tinción más débil para CK14, la que apareció principalmente en los extremos apical y basal de las células, en nuestro estudio encontramos áreas del epitelio interno que mostraron inmunotinción débil para CK14. En contraste, CK19 tuvo una inmunotinción débil en el epitelio interno del esmalte en el estadio de campana, pero cuando estas células se diferencian en ameloblastos se vuelve intensamente positivo y se ve delineando la membrana de la célula (es decir, extremos apical y basal y paredes laterales).
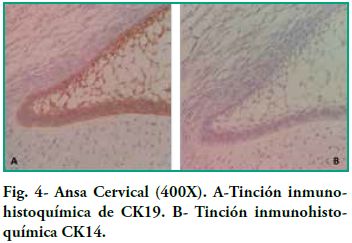
Nuestros estudios concuerdan con estos hallazgos, pues vemos como el epitelio interno va aumentando la expresión de CK19 a medida que las células se van diferenciando a ameloblastos, también muestra que no sólo cambia la intensidad en la tinción de CK19, sino que también cambia la distribución de la misma. Las células menos diferenciadas muestran una tinción difusa mientras que las más diferenciadas muestran una tinción marcada a nivel de las zonas próximas a la membrana celular (Figura 4). Domingues et al. plantean que la citoqueratina predominante en los restos de la lámina dental fue CK14, que tiñó fuertemente todas las células, y en su estudio CK19 apareció sólo en algunas células de la lámina dental, dando un patrón no homogéneo. En cambio, en nuestros preparados la tinción es intensa y con un patrón homogéneo para ambas citoqueratinas (Figura 3). Domingues et al. relatan que en el retículo estrellado también se vio la expresión de CK14, siendo más fuerte en la fase temprana de campana, con respecto a CK 19 también encontraron expresión pero ligeramente más débil. En nuestros casos no encontramos inmunoexpresión de CK14 probablemente debido a que pertenecen a estadios embriológicos más avanzados que el de campana temprana. Con respecto a CK19 encontramos una alta positividad en las prolongaciones siendo menor en el cuerpo celular (Figura 2). En cuanto al epitelio externo del órgano esmalte solo relatan que fue teñido tanto para CK14 como para CK19; nosotros sólo podemos agregar que la expresión de CK19 es uniforme a nivel del citoplasma siguiendo la forma aplanada del cuerpo celular.
Crivelini et al (11), Ferreira Lopes et al (12), Leon et al (13), Kasper et al (14), Heikinheimo et al (15) y Gao et al (16), aunque no describen en forma tan detallada, también estudiaron la expresión de CK19 en el germen dental. Encontraron CK19 en el órgano del esmalte (11-16) y en la lámina dental (11,13, 14). Crivelini et al y Leon et al, concuerdan con nuestros hallazgos, encontrando que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose marcada inmunoexpresión de esta última en ameloblastos secretores (15).
Dado los cambios de la expresión de CK14 y CK19 en el epitelio interno del esmalte, algunos autores han sugerido que esta última puede ser considerada como un marcador de diferenciación ameloblástica (10, 11).
Son varios los autores que se detienen en el estudio de estas dos citoqueratinas en tumores y entre estos en los tumores odontogénicos, ya sea para determinar su histogénesis o como diagnóstico diferencial con otras lesiones. Varios han demostrado que la expresión aberrante de CK14 y CK19 puede ser un hallazgo temprano en la patogénesis del carcinoma oral de células escamosas y pueden ser utilizados como un marcador de diferenciación tumoral (17-19). Varios estudios demuestran que la expresión de CK19 se ve aumentada acorde al grado y estadio del cáncer incluyendo a las neoplasias epiteliales de la cavidad oral (20,21).
Nuestros estudios muestran que la expresión de CK19 fue predominantemente moderada, mostrando algunas variaciones en la positivad dependiendo de la zona tumoral, y en el caso de los ameloblastomas foliculares se encontró inmunotinción en las islas y folículos de epitelio odontogénico mostrando positividad citoplasmática tanto las células periféricas basales con polarización inversa como en las células centrales que recuerdan el retículo estrellado, aunque dicha tinción no fue uniforme, ya que dentro del mismo tumor se encontraron focos más positivos que otros, y dentro de los mismos folículos se encontraron áreas con variaciones en la positividad sin seguir un patrón establecido.
Algunos autores (12, 22, 23) estudiaron la expresión de CK19 en ameloblastomas y relatan que la encontraron en todas las células del tumor, no haciendo referencia a los cambios de intensidad que nosotros encontramos. Crivelini et al. relatan haber encontrado expresión de CK19 en algunos grupos de células con metaplasia escamosa y débil reacción en las células estrelladas centrales y células aplanadas de las estructuras quísticas, lo que sugiere una tinción no uniforme como la que observamos en nuestros estudios, lo que adjudican a que CK19 caracteriza sólo ameloblastos y preameloblastos con diferenciación completa, que no se produce en ameloblastomas.
En nuestros estudios, la positividad para CK14 fue en general más intensa y menos focal, encontrándose distribuida uniformemente a lo largo de todos los cordones y plexos de epitelio odontogénico cuando se trató de la variante plexiforme, y cuando se trató de la variante folicular se evidenciaron los folículos e islas de epitelio odontogénico uniformemente positivos en todo el tumor. Varios autores describen la presencia de positividad para CK14 en las células de la periferia de los folículos (11, 12, 22), pero no hay acuerdo en cuanto a si se presenta o no en las células internas, ya que algunos describen que hay negatividad en la parte central de las células que recuerdan el retículo estrellado (12), y otros que CK14 se expresa en mayoría de las células internas (11, 22), mientras que nosotros, como ya relatamos, vemos la expresión de CK14 en todas las células.
Concluimos que, como relatan diversos autores, CK19 puede ser considerada como un marcador de utilidad en la diferenciación ameloblástica (10, 11, 20, 21), ya que cuando las células del epitelio interno se diferencian en ameloblastos tiende a predominar la inmunotinción intensamente positiva, mientras que a la vez disminuye la expresión de CK14, esto sugiere una participación de estos dos filamentos intermedios dentro de la biología de la formación del órgano dentario. En cuanto a los resultados observados en ameloblastomas, la mayor expresión de CK14 con respecto a CK19 podría sugerir que estas células neoplásicas no sufren diferenciación ameloblástica, esto podría justificarse en el hecho de que estos tumores no producen material calcificado.
Cabe señalar que dadas las limitaciones propias de este estudio tanto en número de casos incluidos, así como la limitante que genera el uso exclusivo de una técnica de inmunoexpresión, se deben de desarrollar futuros estudios incluyendo una muestra representativa de las diferentes variantes de ameloblastomas y gérmenes dentarios abordado enfoques experimentales diversos.
Referencias
1. Mass R, Bei M. The genetic control of early tooth development. Crit. Rev. Oral Biol. Med. 1997; 8(1): 4-39.
2. Thesleff I, Keränen S, Jernvall J. Enamel knots as signaling centers linking tooth morphogenesis and odontoblast differentiation. Adv. Dent. Res. 2001; 15: 14-18.
3. Oriolo AS, Wald FA, Ramsauer VP, Salas PJ. Intermediate filaments: a role in epithelial polarity. Exp. Cell Res. 2007; 313(10): 2255-2264.
4. Pan X, Hobbs RP, Coulombe PA. The expanding significance of keratin intermediate filaments in normal and diseased epithelia. Curr. Opin. Cell Biol. 2013; 25(1): 47-56.
5. Chung BM, Rotty JD, Coulombe PA. Networking galore: intermediate filaments and cell migration. Curr. Opi. Cell Biol. 2013; 25(5): 600-612.
6. Pallari HM, Eriksson JE. Intermediate filaments as signaling platforms Sci. STKE 2006; (366): 53
7. Kumamoto H. Molecular pathology of odontogenic tumors. J. Oral Pathol. Med. 2006; 35(2): 65-74.
8. Gardner DG, Heikinheimo K, Shear M, Philipsen HP, Coleman H. Odontogenic Tumours. In World Health Organization Classification of Tumors. Pathology and Genetics Head and Neck Tumors. Lyon: IARCPress; 2005. p283-327.
9. Schantz SP. Head and neck oncology research. Curr Opin Oncol. 1994; 6(3): 265-71.
10. Domingues MG, Jaeger MM, Araújo VC, Araújo NS. Expression of cytokeratins in human enamel organ. Eur. J. Oral Sci. 2000; 108(1): 43-47.
11. Crivelini MM, de Araújo VC, de Sousa SO, De Araújo NS. Cytokeratins in epithelia of odontogenic neoplasms. Oral Dis. 2003; 9(1): 1-6.
12. Ferreira Lopes F, Fontoura MC, do Amaral AL, Dantas EJ, Cavalcanti H, Batista L et al. Análise imuno-histoquímica das citoqueratinas em ameloblastoma e tumor odontogênico adenomatóide. J Bras. Patol. Med. Lab. 2005; 41(6): 425-430.
13. Leon JE, Mata GM, Fregnani ER, Carlos-Bregni R, de Almeida OP, Mosqueda-Taylor A et al. Clinicopathological and immunohistochemical study of 39 cases of Adenomatoid Odontogenic Tumour: a multicentric study. Oral Oncol. 2005; 41(8): 835–842.
14. Kasper M, Karsten U, Stosiek P, Moll R. Distribution of intermediate-filament proteins in the human enamel organ: unusually complex pattern of coexpression of cytokeratin polypeptides and vimentin. Differentiation 1989; 40(3): 207-214.
15. Heikinheimo K, Hormia M, Stenman G, Virtanen I, Happonen RP. Patterns of expression of intermediate filaments in ameloblastoma and human fetal tooth germ. J. Oral Pathol. Med. 1989; 18(5): 264-273.
16. Gao Z, Mackenzie IC, Cruchley AT, Williams DM, Leigh I, Lane EB. Cytokeratin expression of the odontogenic epithelia in dental follicles and developmental cysts. J. Oral. Pathol. Med. 1989; 18(2): 63-67.
17. Fillies T, Jogschies M, Kleinheinz J, Brandt B, Joos U, Buerger H. Cytokeratin alteration in oral leukoplakia and oral squamous cell carcinoma. Indian. J. Dent. Res. 2005; 16(1):6-11.
18. Zhong LP, Chen WT, Zhang CP, Zhang ZY. Increased CK19 expression correlated with pathologic differentiation grade and prognosis in oral squamous cell carcinoma patients. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2007; 104(3): 377-84.
19. Ram Prassad VV, Nirmala NR, Kotian MS. Immunohistochemical evaluation of expression of cytokeratin 19 in different histological grades of leukoplakia and oral squamous cell carcinoma. Indian. J. Dent. Res. 2005; 16 (1): 6-11.
20. Babiker AY, Rahmani AH, Abdalaziz MS, Albutti A, Aly SM, Ahmed HG. Expressional analysis of p16 and cytokeratin19 protein in the genesis of oral squamous cell carcinoma patients. Int. J. Clin. Exp. Med. 2014 (6): 1524-30.
21. Schantz SP. Basic science advances in head and neck oncology: the past decade.. Curr Opin Oncol. 1994; 6(3): 265-71.
22. Pal SK, Sakamoto K, Aragaki T, Akashi T, Tamaquachi A. The expression profiles of acidic epithelial keratins in ameloblastoma. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2013; 115(4): 523-531.
23. Fukumashi K, Enokiya Y, Inoue T. Cytoqueratins expression of constituting cells in ameloblastoma. Bull. Tokyo. Dent.. Coll. 2002; 43(1): 13-21











 text in
text in 


