Services on Demand
Journal
Article
Related links
Share
Odontoestomatología
On-line version ISSN 1688-9339
Odontoestomatología vol.16 no.24 Montevideo Nov. 2014
Citoqueratinas 14 y 19 en quistes y tumores de origen odontogénico. Una revisión
Cytokeratins 14 and 19 in odontogenic cysts and tumors: a review
Nieves Sabrina*,
Apellaniz Delmira*,
Tapia Gabriel**,
Maglia Alvaro***,
Mosqueda-Taylor Adalberto****,
Bologna-Molina Ronell*****.
* Becario Área de Patología Molecular, Facultad de Odontología, Universidad de la República, Uruguay
** Profesor Adjunto, Grado 3, Cátedra de Histología, Facultad de Odontología, Universidad de la República, Uruguay
*** Profesor Titular, Grado 5, Cátedra de Histología, Facultad de Odontología, Universidad de la República, Uruguay
**** Especialista en Patología y Medicina Bucal, Master in Oral Pathology, Profesor Investigador Tiempo Completo Departamento de Atención a la Salud, Universidad Autónoma Metropolitana. México
***** Especialista en Patología y Medicina Bucal, Doctor en Ciencias Biológicas (Patología Molecular), Profesor Titular, Grado 5, Dedicación Total, Área de Patología Molecular, Facultad de Odontología, Universidad de la República, Uruguay
ronellbologna@hotmail.com
Resumen
Todas las células de los mamíferos contienen un sistema citoplasmático de fibras esencial para la movilidad celular, el citoesqueleto, el cual se encuentra integrado por tres unidades estructurales principales y proteínas asociadas: microfilamentos, microtúbulos y filamentos intermedios. Las citoqueratinas son filamentos intermedios que forman una red compleja que se extiende desde la superficie del núcleo a la porción periférica de la célula, donde se insertan en desmosomas y hemidesmosomas. Las citoquerarinas 14 y 19 han sido utilizadas como marcadores de diagnóstico y pronóstico en diversas neoplasias de origen epitelial, no sólo permiten identificar a una célula como epitelial, sino que permiten identificar diferentes etapas durante diferenciación del epitelio y caracterizar el tumor. Existen numerosos trabajos en la literatura biomédica que han ejemplificado la utilidad de citoqueratinas 14 y 19 para identificar epitelio odontogénico. Esta revisión analiza la utilidad de su inmunoexpresión en los diferentes quistes y tumores odontogénicos.
Palabras clave: Citoqueratina 14, Citoquerarina 19, Quistes odontogénicos, Tumores odontogénicos
Abstract
All mammal cells include a cytoplasmic fiber system essential for cell mobility, the cytoskeleton, formed by three main structural units and associated proteins: microfilaments, microtubules and intermediate filaments. Cytokeratins are intermediate filaments forming a complex network which extends from the nucleus surface to the peripheral cell sector, where they are inserted into desmosomes and hemidesmosomes. Cytokeratins 14 and 19 have been used as diagnosis and prognosis markers in various tumors of epithelial origin, not only to identify a cell as epithelial, but also to identify different stages during epithelial differentiation and to characterize the tumor. There are numerous studies in biomedical literature that have exemplified the utility of cytokeratins 14 and 19 to identify odontogenic epithelium. This review analyzes the utility of their immunologic expression in the different cysts and odontogenic tumors.
Keywords: Cytokeratin 14, Cytokeratin 19, Odontogenic cysts, Odontogenic tumors.
Fecha recibido: 08.05.14 - Fecha aceptado: 01.09.14
¿Qué son las citoqueratinas?
Todas las células de los mamíferos contienen un sistema citoplasmático de fibras esencial para la movilidad celular, denominado citoesqueleto. Tratando de explicarlo de una manera muy sencilla y coloquial podríamos decir que de modo similar a las varillas de acero que sostienen la estructura de un edificio, el citoesqueleto desempeña un papel importante, al sostener la membrana plasmática y formar carriles a lo largo de los cuales se pueden desplazar los organelos y otros elementos en el citosol. Sin embargo a diferencia del pasivo marco de un edificio, el citoesqueleto es sometido a reordenamientos constantes, capaces de producir movimientos (1). El citoesqueleto se encuentra integrado por tres unidades estructurales principales y proteínas asociadas: microfilamentos, microtúbulos y filamentos intermedios. Los filamentos intermedios se dividen en seis tipos en función de sus características moleculares, de los cuales las citoqueratinas (CK) constituyen el tipo I y tipo II (2,3).
Moll et al. (4) clasificaron un total de 19 queratinas epiteliales humanas con pesos moleculares variables dentro del rango 40-70kDa, y posteriormente se identificó una queratina adicional, la CK20. Estas se pueden clasificar según el peso molecular, en alto y bajo peso y según su punto isoeléctrico en formas ácidas y básicas (2).
Las CK’s 14 y 19 pertenecen a las queratinas tipo I, la segunda es la más pequeña y es excepcional, ya que a diferencia de las otras citoqueratinas carece del dominio típico (no alfa hélice) (5).
La CK14 se encuentra en los queratinocitos del epitelio escamoso estratificado, tanto en la epidermis como en la mucosa no queratinizada (4), mientras que la CK19 se expresa en la mayoría de epitelios simples, en varios epitelios ductales, en el epitelio intestinal, en el epitelio foveolar gástrico, y en el mesotelio. Además, está presente en la mayoría de las células de epitelios pseudoestratificados y urotelio, así como en las células basales del epitelio escamoso estratificado no queratinizado (4).
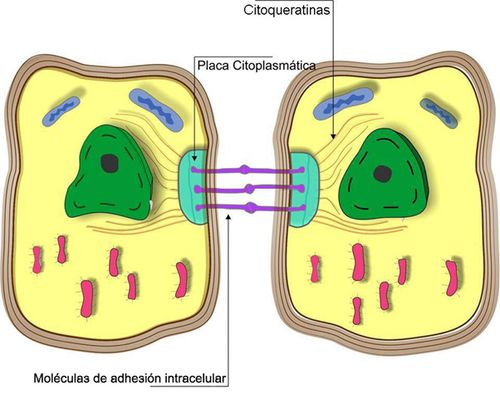
¿Cuáles son sus funciones?
Las citoqueratinas forman una red compleja que se extiende desde la superficie del núcleo a la porción periférica de la célula, donde se insertan en desmosomas y hemidesmosomas (Fig. 1). Al conectar a la superficie nuclear con la membrana plasmática, proporcionan un continuo vínculo que puede tener implicaciones importantes para la organización del citoplasma, la comunicación celular, y quizás para el transporte de información dentro y fuera del núcleo (2,4). Por otra parte al insertarse en desmosomas y hemidesmosomas, contribuyen no sólo a la estabilidad de las células epiteliales, sino también a la unión de estas con la membrana basal y el tejido conjuntivo subyacente (4,6).
En los últimos años se ha establecido la idea de que las queratinas cumplen dos roles fundamentales en las células epiteliales:
a) apoyo estructural, sin el cual un trauma físico conduce a la pérdida de la integridad, y
b) la regulación de los procesos metabólicos y crecimiento, de proliferación, migración y apoptosis.
Estas dos funciones generales implican interacciones reguladas con un grupo diverso de proteínas (2,7), que incluyen moléculas de señalización, como las proteínas 14-3-3, proteínas relacionadas con la apoptosis, quinasas y fosfatasas (8).
Oriolo et al. (9), plantean que también pueden desempeñar un papel en la polaridad epitelial y en el tráfico de membrana.
Se ha propuesto también la intervención de algunas citoqueratinas en la reparación de heridas, ya que confieren a la célula un citoesqueleto más plegable que favorece la migración de queratinocitos al sitio de cierre de la herida (10).
En cuanto a la CK14, se han evidenciado mutaciones en el gen CK14 que causan la epidermólisis bullosa simple (11, 12), que es una enfermedad hereditaria, y por esto se le atribuye importancia en la estabilidad física de la epidermis (4), y a su vez las CK’s 15 y 20 han sido utilizadas como marcadores de diagnóstico y pronóstico en diversas neoplasias de origen epitelial (13,14).
Utilidad de las citoqueratinas como marcadores
No todas las queratinas son sintetizadas simultáneamente por una célula, más bien, diferentes subconjuntos de queratinas se expresan durante el curso de la diferenciación terminal, en diferentes etapas de desarrollo, así como en diferentes epitelios. Por lo tanto, todos los epitelios (simples y complejos) pueden ser clasificados con base en la expresión de las citoqueratinas. Los epitelios simples o monoestratificados generalmente expresan queratinas (7, 18, 19, 20) mientras que los epitelios complejos (estratificados), expresan queratinas (5, 6, 10, 14, 15). Cuando un epitelio sufre transformación maligna su perfil de queratina por lo general sigue siendo más o menos constante (2), por lo que los patrones de expresión de queratina no sólo permiten identificar a una célula como epitelial, sino que permite determinar las etapas de diferenciación del epitelio y tipificar el tumor, lo que hace que anticuerpos contra varias queratinas se utilicen de forma rutinaria en los laboratorios de inmunohistoquímica para el diagnóstico de carcinomas, en particular en metástasis poco claras (4).
Otra aplicación clínica es la detección de fragmentos de proteínas de queratina derivados de CK8, CK18, y CK19 en la circulación de pacientes con cáncer; tales fragmentos se utilizan cada vez más para monitorizar la carga del tumor y la progresión de la enfermedad en el caso de ciertos carcinomas, como el cáncer de pulmón (15,16). Además, se ha visto que más del 95% de las células escamosas del carcinoma de pulmón son positivas para CK14 (13, 17).
La CK19, es uno de los marcadores inmunohistoquímicos más frecuentemente estudiados en patología tiroidea, la cual puede actuar como una herramienta útil de diagnóstico y pronóstico debido a que puede ser determinada antes del procedimiento terapéutico en los hallazgos citológicos (14).
La tinción inmunohistoquímica para CK19 permite hacer el diagnóstico diferencial entre carcinoma papilar que muestra una tinción fuerte y difusa y otras neoplasias de la glándula tiroides que muestran tinciones débiles y focales. También se ha sugerido que podría ser un predictor útil de progresión en el carcinoma de tiroides (14).
Tsuruba et al. (18), demostraron que CK8 y CK14 pueden ser útiles en el diagnóstico de los tumores de apéndices de la piel. En general, son CK8 negativos y CK14 positivos los tumores de epidermis, las glándulas sebáceas y los folículos pilosos, mientras que tumores derivados de las glándulas ecrinas y las glándulas sudoríparas apocrinas son CK8 positivos y CK14 negativos.
Los carcinomas de células escamosas, así como los mesoteliomas malignos expresan fuertemente CK14 mientras que poca, o ninguna expresión se encuentra en adenocarcinomas (2, 4, 19). Diferentes estudios han sugerido que la expresión de ciertas queratinas de epitelios simples, como CK19, en los carcinomas de células escamosas, parece ser un hallazgo de aquellos carcinomas poco diferenciados (4). CK19 es detectada en el epitelio cerca de carcinomas de células escamosas, lo que sugiere su uso como un agente biológico fundamental de la progresión maligna (20). Obviamente estos hallazgos son transpolables a carcinoma de células escamosas de cavidad bucal, evidenciando de esta manera la utilidad de estas citoqueratinas en el diagnóstico y como posible factor pronóstico en diversas neoplasias que afectan la región maxilofacial (21), así como lesiones de la mucosa bucal consideradas potencialmente malignas (22, 23).
En cuanto a los tumores de las glándulas salivales, estos se pueden dividir en dos grandes categorías: los tumores derivados de epitelio estratificado (adenoma pleomórfico, mioepitelioma, carcinoma de células escamosas basaloide, carcinoma adenoide quístico y el carcinoma mucoepidermoide) y los tumores que surgen de los epitelios simples (adenocarcinoma NOS, adenocarcinoma monomórfico, y carcinoma de células acinares). Los primeros expresan CK14 y CK19, mientras que los segundos no lo hacen (24,25). La CK14 es un marcador de las células mioepiteliales, por lo tanto, los tumores de glándulas salivales con un componente de células mioepiteliales son generalmente positivos para CK14. Estos tumores incluyen mioepitelioma benigno o maligno, carcinoma adenoideo quístico y el adenoma pleomorfo (13, 26,27).
Citoqueratinas y Odontogénesis
Los patrones de expresión de citoqueratinas en el epitelio odontogénico se han descrito de una manera muy general. Domingues et al. (28), en su estudio inmunohistoquímico mostraron que las células epiteliales del germen dental y los remanentes de la lámina dental son positivos a CK14 y CK19 con ligeros cambios en el patrón de expresión, dependiendo de la fase de la odontogénesis. Por ejemplo en el epitelio interno del órgano del esmalte describen que la expresión de CK14 Y CK19 varia en los estadios de campana y folículo, en el estadio de campana (estadio de campana temprana para el autor), observan que es fuertemente positivo para CK14 mientras que CK 19 tuvo una inmunotinción débil, en el estadio de campana tardío o folículo fue a la inversa. CK19 se vuelve intensamente positivo, disminuyendo la expresión de CK14. En este mismo estudio la citoqueratina predominante en los restos de la lámina dental fue CK14, que tiñó fuertemente todas las células, mientras que la CK19 apareció sólo en algunas células de la lámina dental, dando un patrón no homogéneo. En el retículo estrellado también se vio la expresión de CK14, siendo más fuerte en la fase temprana de campana. La CK19 también se expresó pero más débilmente. El epitelio externo del órgano del esmalte fue marcado tanto para CK14 como para CK19.
Crivelini et al (20), Ferreira Lopes et al (29), Leon et al (30), Kasper et al (31), Heikinheimo et al (32), Gao et al (33), aunque no describen en forma tan detallada, también estudiaron la expresión de CK14 y CK19 en el germen dental.
Encontraron CK14 y CK19 en el órgano del esmalte (20, 29-33) y en la lámina dental (20, 30, 31).
Crivelini et al y Leon et al, concuerdan con los hallazgos de Domingues et al. En cuanto a que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose inmunoexpresión de CK19 muy positiva en preameloblastos (32).
Dado los cambios de la expresión de CK14 y CK19 en el epitelio interno del esmalte, algunos grupos de investigación han propuesto que CK19 podría ser considerada un efectivo marcador de diferenciación ameloblástica (20, 28).
Quistes y tumores odontogénicos
La presencia de estas citoqueratinas dentro del proceso de formación dentario, sugiere una participación dentro del desarrollo embrionario del órgano dentario, por lo que diferentes autores han estudiado su expresión en quistes y tumores odontogénicos (20, 29, 30, 32-47). Los patrones de expresión de queratina no sólo permiten identificar a una célula como epitelial, sino que también permiten identificar etapas durante la diferenciación del epitelio (4). Anticuerpos contra estas citoqueratinas han sido empleados para elucidar la histogénesis y tipificar el tumor. Existen numerosos trabajos en la literatura biomédica que han ejemplificado la utilidad de estas dos citoqueratinas para identificar epitelio odontogénico, y por ende han demostrado ser auxiliares importantes en el diagnóstico de algunas neoplasias o quistes donde se sospecha un posible origen odontogénico, así mismo han sido de gran utilidad para determinar la posible histogénesis de varias lesiones quísticas o tumorales propias de la región maxilofacial que hoy se sabe son de origen odontogénico. (20, 29, 30, 32-34, 37, 40-45, 47)
Un ejemplo de esto son los estudios realizados en ameloblastomas (20, 29, 34-36) donde se estudió la expresión de CK14 y CK19 con el fin de dilucidar el posible origen (20,29), mientras que otros autores estudiaron estas mismas citoqueratinas para diferenciarlo de otras lesiones, como es en el caso de Yoon et al. que estudiaron la expresión de CK14 y CK19 para diferenciarlo de carcinoma ameloblástico, encontrando que en ambos tumores la expresión de ambas citoqueratinas es fuerte y difusa.
Otro trabajo interesante es el realizado por Pal et al (35), quienes estudian la expresión de estas mismas citoqueratinas en ameloblastoma central y en ameloblastoma periférico, y con los resultados obtenidos concluyen que la expresión de CK19 puede ser utilizada como un auxiliar para diferenciar ambas neoplasias ya que en los casos de ameloblastoma central estudiados, CK19 es positiva en todas las células mientras que en ameloblastoma periférico se ven células CK19 negativas. Gao et al. (33) estudiaron la expresión de CK14 y CK19 en el epitelio odontogénico de los folículos dentarios normales, así como en el epitelio de quiste dentígero y tumor odontogénico queratoquístico, dado que todos derivan del epitelio odontogénico del órgano dental, y estos patrones fueron comparados con los de quistes de diferentes orígenes de desarrollo, como el quiste nasopalatino y quiste epidermoide.
Los resultados obtenidos confirmaron la expectativa de que los quistes del desarrollo que surgen del epitelio odontogénico compartían la expresión de CK 14 y CK 19, pero diferían de los quistes originados del epitelio no odontogénico. Por lo tanto el epitelio odontogénico y sus derivados (quistes y tumores), muestran ciertas similitudes en sus patrones de expresión de CK, pero difieren de los quistes nasopalatinos por ejemplo, que derivan de restos epiteliales del conducto nasopalatino, y del quiste epidermoide que surge de enclavamientos del epitelio durante el desarrollo embrionario.
En la Tabla 1, se esquematizan diferentes trabajos donde se estudió la expresión de CK14 y/o CK19 en varios quistes y tumores odontogénicos.
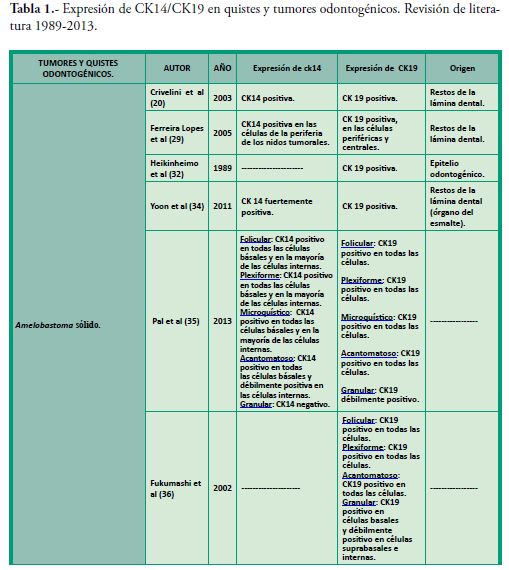
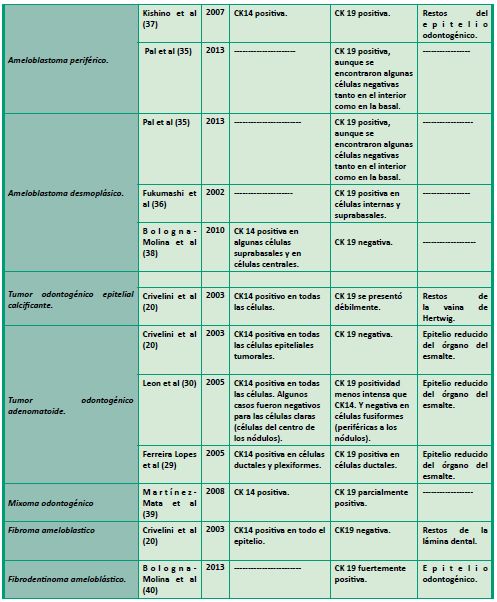
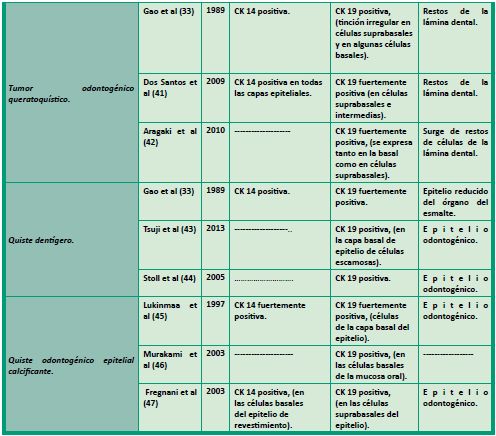
En conclusión los diferentes estudios e investigaciones recientes cada vez con más fuerza le confieren a las citoqueratinas un papel mucho más complejo que la sola constitución del citoesqueleto. Existen diversos grupos que actualmente están estudiando la influencia que tienen sus funciones estructurales y reguladoras dentro de diversas enfermedades y cada día resultan más evidentes las interacciones moleculares de estas proteínas en diferentes procesos normales y patológicos. Todos estos nuevos aportes evidencian la importancia de esta familia de filamentos intermedios como biomarcadores de utilidad pronóstica y diagnóstica en diversos tumores de la anatomía humana, y la región buco-maxilofacial no es la excepción.
Referencias
1. Lodish H, Berk A, Zipursky S, Matsudaira P, Baltimare D, Darnell J. Movilidad y forma de la célula I: microfilamentos. En Biología celular y molecular. 4ed. Buenos Aires: Panamericana, 2002: 751-794.
2. Chu PG, Weiss LM. Keratin expression in human tissues and neoplasms. Histopathology. 2002; 40(5): 403–439.
3. Chung BM, Rotty JD, Coulombe PA. Networking galore: intermediate filaments and cell migration. Curr. Opi. Cell. Biol. 2013; 25(5): 600-612.
4. Moll R, Franke WW, Schiller DL, Geiger B, Krepler R. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell. 1982; 31(1): 11–24.
5. Bader BL, Magin TM, Hatzfeld M, Franke WW. Amino acid sequence and gene organization of cytokeratin no. 19, an exceptional tail-less intermediate filament protein. EMBO J. 1986; 5(8): 1865-1875.
6. Moll R, Franke WW, Volc-Platzer B, Krepler R. Different keratin polypeptides in epidermis and other epithelia of human skin: a specific cytokeratin of molecular weight 46,000 in epithelia of the pilosebaceous tract and basal cell epitheliomas. J. Cell. Biol. 1982; 95(1): 285–295.
7. Pan X, Hobbs RP, Coulombe PA. The expanding significance of keratin intermediate filaments in normal and diseased epithelia. Curr. Opin. Cell. Biol. 2013; 25(1): 47-56.
8. Toivola DM, Strnad P, Habtezion A, Omary MB. Intermediate filaments take the heat as stress proteins. Trends. Cell. Biol. 2010; 20(2): 79-91.
9. Oriolo AS, Wald FA, Ramsauer VP, Salas PJ. Intermediate filaments: a role in epithelial polarity. Exp. Cell. Res. 2007; 313(10): 2255-2264.
10. Magin TM, Vijayaraj P, Leube RE. Structural and regulatory functions of keratins. Exp. Cell. Res. 2007; 313(10): 2021-2032.
11. Omary MB, Coulombe PA, McLean WH. Intermediate filament proteins and their associated diseases. N. Engl. J. Med. 2004; 351(20): 2087–2100.
12. Lane EB, McLean WH. Keratins and skin disorders. J. Pathol. 2004; 204(4): 355–366.
13. Chu PG, Lyda MH, Weiss LM. Cytokeratin 14 expression in epithelial neoplasms: a survey of 435 cases with emphasis on its value in differentiating squamous cell carcinomas from other epithelial tumours. Histopathology. 2001; 39(1): 9–16.
14. Isic Dencic T, Cvejic D, Paunovic I, Tatic S, Havelka M, Savin S. Cytokeratin19 expression discriminates papillary thyroid carcinoma from other thyroid lesions and predicts its aggressive behavior. Med. Oncol. 2013; 30(1): 362.
15. Barak V, Goike H, Panaretakis KW, Einarsson R. Clinical utility of cytokeratins as tumor markers. Clin. Biochem. 2004; 37(7): 529–540.
16. Linder S. Cytokeratin markers come of age. Tumour. Biol. 2007; 28(4): 189–195.
17. Lyda MH, Weiss LM. Immunoreactivity for epithelial and neuroendocrine antibodies are useful in the differential diagnosis of lung carcinomas. Hum. Pathol. 2000; 31(8): 980–987.
18. Tsubura A, Okada H, Sasaki M, Dairkee SH, Morii S. Immunohistochemical demonstration of keratins 8 and 14 in benign tumours of the skin appendage. Virchows Arch. A Pathol. Anat. Histopathol. 1991; 418(6): 503–507.
19. Moll R. Cytokeratins as markers of differentiation in the diagnosis of epithelial tumors. Subcell. Biochem. 1998; 31: 205–262.
20. Crivelini MM, de Araújo VC, de Sousa SO, De Araújo NS. Cytokeratins in epithelia of odontogenic neoplasms. Oral. Dis. 2003; 9(1): 1-6.
21. Fillies T, Jogschies M, Kleinheinz J, Brandt B, Joos U, Buerger H. Cytokeratin alteration in oral leukoplakia and oral squamous cell carcinoma. Oncol. Rep. 2007; 18(3): 639-643.
22. Rivarola de Gutierrez E, Innocenti AC, Cippitelli MJ, Salomón S, Vargas-Roig LM. Determination of cytokeratins 1, 13 and 14 in oral lichen planus. Med. Oral. Patol. Oral. Cir. Bucal. 2014;19(4):e359-65
23. Nanda KD, Ranganathan K, Devi U, Joshua E. Increased expression of CK8 and CK18 in leukoplakia, oral submucous fibrosis, and oral squamous cell carcinoma: an immunohistochemistry study. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 2012;113(2):245-53 24.
24. Tsubochi H, Suzuki T, Suzuki S, Ohashi Y, Ishibashi S, Moriya T et al. Immunohistochemcial study of basaloid squamous cell carcinoma, adenoid cystic and mucoepidermoid carcinoma in the upper aerodigestive tract. Anticancer Res. 2000; 20(2B): 1205–1211.
25. de Araújo VC, de Sousa SO, Carvalho YR, de Araújo NS. Application of immunohistochemistry to the diagnosis of salivary gland tumors. Appl. Immunohistochem. Mol. Morphol. 2000; 8(3): 195–202.
26. Ogawa Y, Toyosawa S, Ishida T, Ijuhin N. Keratin 14 immunoreactive cells in pleomorphic adenomas and adenoid cystic carcinomas of salivary glands. Virchows Arch. 2000; 437(1): 58–68.
27. Nagao T, Sugano I, Ishida Y, Tajima Y, Matsuzaki O, Konno A et al. Salivary gland malignant myoepithelioma: a clinicopathologic and immunohistochemical study of ten cases. Cancer. 1998; 83(7): 1292–1299.
28. Domingues MG, Jaeger MM, Araújo VC, Araújo NS. Expression of cytokeratins in human enamel organ. Eur. J. Oral. Sci. 2000; 108(1): 43-47.
29. Ferreira Lopes F, Fontoura MC, do Amaral AL, Dantas EJ, Cavalcanti H, Batista L et al. Análise imuno-histoquímica das citoqueratinas em ameloblastoma e tumor odontogênico adenomatóide. J. Bras. Patol. Med. Lab. 2005; 41(6): 425-430.
30. Leon JE, Mata GM, Fregnani ER, Carlos-Bregni R, de Almeida OP, Mosqueda-Taylor A et al. Clinicopathological and immunohistochemical study of 39 cases of Adenomatoid Odontogenic Tumour: a multicentric study. Oral. Oncol. 2005; 41(8): 835–842.
31. Kasper M, Karsten U, Stosiek P, Moll R. Distribution of intermediate-filament proteins in the human enamel organ: unusually complex pattern of coexpression of cytokeratin polypeptides and vimentin. Differentiation 1989; 40(3): 207-214.
32. Heikinheimo K, Hormia M, Stenman G, Virtanen I, Happonen RP. Patterns of expression of intermediate filaments in ameloblastoma and human fetal tooth germ. J. Oral. Pathol. Med. 1989; 18(5): 264-273.
33. Gao Z, Mackenzie IC, Cruchley AT, Williams DM, Leigh I, Lane EB. Cytokeratin expression of the odontogenic epithelia in dental follicles and developmental cysts. J. Oral. Pathol. Med. 1989; 18(2): 63-67.
34. Yoon HJ, Jo BC, Shin WJ, Cho YA, Lee JI, Hong SP et al. Comparative immunohistochemical study of ameloblastoma and ameloblastic carcinoma. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2011; 112(6): 767-776.
35. Pal SK, Sakamoto K, Aragaki T, Akashi T, Tamaquachi A. The expression profiles of acidic epithelial keratins in ameloblastoma. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 2013; 115(4): 523-531.
36. Fukumashi K, Enokiya Y, Inoue T. Cytoqueratins expression of constituting cells in ameloblastoma. Bull. Tokyo. Dent. Coll. 2002; 43(1): 13-21
37. Kishino M, Murakami S, Yuki M, Lida S, Ogawa Y, Kogo M et al. A immunohistochemical study of the peripheral ameloblastoma. Oral. Dis. 2007; 13(6): 575–580.
38. Bologna-Molina R, Mosqueda-Taylor A, de Almeida-Osley P, Toral-Rizo V, Martínez-Mata G. Peripheral desmoplastic ameloblastoma: histopathological and immunohistochemical profile of a case. Med. Oral. Patol. Oral. Cir. Bucal. 2010; 15 (6): 846-849.
39. Martínez-Mata G, Mosqueda-TaylorA, Carlos-Bregni R, de Almeida OP, Contreras-Vidaurre E, Vargas PA et al. Odontogenic myxoma: clinico-pathological, immunohistochemical and ultrastructural findings of a multicentric series. Oral. Oncol. 2008; 44(6): 601– 607.
40. Bologna-Molina R, Salazar-Rodríguez S, Bedoya-Borella AM, Carreón-Burciaga RG, Tapia-Repetto G, Molina-Frechero N. A histopathological and inmunohistochemical analysis of ameloblastic fibrodentinoma. Case. Rep. Pathol. 2013; 1-7.
41. Dos Santos JN, Oliveira GQ, Gurgel CA, de Souza RO, Sales CB, de Aquiar Pires Valenca Neto A, et al. Altered expression of cytokeratins in primary, recurrent and syndrome keratocystic odontogenic tumors. J. Mol. Histol. 2009; 40(4): 269–275.
42. Aragaki T, Michi Y, Katsube K, Uzawa N, Okada N, Akashi T et al. Comprehensive keratin profiling reveals different histopathogenesis of keratocystic odontogenic tumor and orthokeratinized odontogenic cyst. Hum. Pathol. 2010; 41(12): 1718–1725.
43. Tsuji K, Wato M, Hayashi T, Yasuda N, Matsushita T, Ito T et al. The expression of cytokeratin in keratocystic odontogenic tumor, orthokeratinized odontogenic cyst, dentigerous cyst, radicular cyst and dermoid cyst. Med. Mol. Morphol. 2013.
44. Stoll C, Stollenwerk C, Riediger D, Mittermayer C, Alfer J. Cytokeratin expression patterns for distinction of odontogenic keratocysts from dentigerous and radicular cysts. J. Oral. Pathol. Med. 2005; 34(9): 558-564.
45. Lukinmaa PL, Leppaniemi A, Hietanen J, Allemanni G, Zardi L. Features of odontogenesis and expression of cytokeratins and tenascin-C in three cases of extraosseous and intraosseous calcifying odontogenic cyst. J. Oral. Pathol. Med. 1997; 26(6): 265-272.
46. Murakami S, Koike Y, Matsuzaka K, Ohata H, Uchiyama T, Inoue T. A case of calcifying odontogenic cyst with numerous calcifications: immunohistochemical analysis. Bull. Tokyo. Dent. Coll. 2003; 44(2): 61-66.
47. Fregnani ER, Pires FR, Quezada RD, Shih IeM, Vargas PA, de Almeida OP. Calcifying odontogenic cyst: clinicopathological features and immunohistochemical profile of 10 cases. J. Oral. Pathol. Med. 2003; 32(3): 163-170.
Cytokeratins 14 and 19 in odontogenic cysts and tumors: a review
Nieves Sabrina*,
Apellaniz Delmira*,
Tapia Gabriel**,
Maglia Alvaro***,
Mosqueda-Taylor Adalberto****,
Bologna-Molina Ronell*****.
* Becario Área de Patología Molecular, Facultad de Odontología, Universidad de la República, Uruguay
** Profesor Adjunto, Grado 3, Cátedra de Histología, Facultad de Odontología, Universidad de la República, Uruguay
*** Profesor Titular, Grado 5, Cátedra de Histología, Facultad de Odontología, Universidad de la República, Uruguay
**** Especialista en Patología y Medicina Bucal, Master in Oral Pathology, Profesor Investigador Tiempo Completo Departamento de Atención a la Salud, Universidad Autónoma Metropolitana. México
***** Especialista en Patología y Medicina Bucal, Doctor en Ciencias Biológicas (Patología Molecular), Profesor Titular, Grado 5, Dedicación Total, Área de Patología Molecular, Facultad de Odontología, Universidad de la República, Uruguay
ronellbologna@hotmail.com
Resumen
Todas las células de los mamíferos contienen un sistema citoplasmático de fibras esencial para la movilidad celular, el citoesqueleto, el cual se encuentra integrado por tres unidades estructurales principales y proteínas asociadas: microfilamentos, microtúbulos y filamentos intermedios. Las citoqueratinas son filamentos intermedios que forman una red compleja que se extiende desde la superficie del núcleo a la porción periférica de la célula, donde se insertan en desmosomas y hemidesmosomas. Las citoquerarinas 14 y 19 han sido utilizadas como marcadores de diagnóstico y pronóstico en diversas neoplasias de origen epitelial, no sólo permiten identificar a una célula como epitelial, sino que permiten identificar diferentes etapas durante diferenciación del epitelio y caracterizar el tumor. Existen numerosos trabajos en la literatura biomédica que han ejemplificado la utilidad de citoqueratinas 14 y 19 para identificar epitelio odontogénico. Esta revisión analiza la utilidad de su inmunoexpresión en los diferentes quistes y tumores odontogénicos.
Palabras clave: Citoqueratina 14, Citoquerarina 19, Quistes odontogénicos, Tumores odontogénicos
Abstract
All mammal cells include a cytoplasmic fiber system essential for cell mobility, the cytoskeleton, formed by three main structural units and associated proteins: microfilaments, microtubules and intermediate filaments. Cytokeratins are intermediate filaments forming a complex network which extends from the nucleus surface to the peripheral cell sector, where they are inserted into desmosomes and hemidesmosomes. Cytokeratins 14 and 19 have been used as diagnosis and prognosis markers in various tumors of epithelial origin, not only to identify a cell as epithelial, but also to identify different stages during epithelial differentiation and to characterize the tumor. There are numerous studies in biomedical literature that have exemplified the utility of cytokeratins 14 and 19 to identify odontogenic epithelium. This review analyzes the utility of their immunologic expression in the different cysts and odontogenic tumors.
Keywords: Cytokeratin 14, Cytokeratin 19, Odontogenic cysts, Odontogenic tumors.
Fecha recibido: 08.05.14 - Fecha aceptado: 01.09.14
¿Qué son las citoqueratinas?
Todas las células de los mamíferos contienen un sistema citoplasmático de fibras esencial para la movilidad celular, denominado citoesqueleto. Tratando de explicarlo de una manera muy sencilla y coloquial podríamos decir que de modo similar a las varillas de acero que sostienen la estructura de un edificio, el citoesqueleto desempeña un papel importante, al sostener la membrana plasmática y formar carriles a lo largo de los cuales se pueden desplazar los organelos y otros elementos en el citosol. Sin embargo a diferencia del pasivo marco de un edificio, el citoesqueleto es sometido a reordenamientos constantes, capaces de producir movimientos (1). El citoesqueleto se encuentra integrado por tres unidades estructurales principales y proteínas asociadas: microfilamentos, microtúbulos y filamentos intermedios. Los filamentos intermedios se dividen en seis tipos en función de sus características moleculares, de los cuales las citoqueratinas (CK) constituyen el tipo I y tipo II (2,3).
Moll et al. (4) clasificaron un total de 19 queratinas epiteliales humanas con pesos moleculares variables dentro del rango 40-70kDa, y posteriormente se identificó una queratina adicional, la CK20. Estas se pueden clasificar según el peso molecular, en alto y bajo peso y según su punto isoeléctrico en formas ácidas y básicas (2).
Las CK’s 14 y 19 pertenecen a las queratinas tipo I, la segunda es la más pequeña y es excepcional, ya que a diferencia de las otras citoqueratinas carece del dominio típico (no alfa hélice) (5).
La CK14 se encuentra en los queratinocitos del epitelio escamoso estratificado, tanto en la epidermis como en la mucosa no queratinizada (4), mientras que la CK19 se expresa en la mayoría de epitelios simples, en varios epitelios ductales, en el epitelio intestinal, en el epitelio foveolar gástrico, y en el mesotelio. Además, está presente en la mayoría de las células de epitelios pseudoestratificados y urotelio, así como en las células basales del epitelio escamoso estratificado no queratinizado (4).

¿Cuáles son sus funciones?
Las citoqueratinas forman una red compleja que se extiende desde la superficie del núcleo a la porción periférica de la célula, donde se insertan en desmosomas y hemidesmosomas (Fig. 1). Al conectar a la superficie nuclear con la membrana plasmática, proporcionan un continuo vínculo que puede tener implicaciones importantes para la organización del citoplasma, la comunicación celular, y quizás para el transporte de información dentro y fuera del núcleo (2,4). Por otra parte al insertarse en desmosomas y hemidesmosomas, contribuyen no sólo a la estabilidad de las células epiteliales, sino también a la unión de estas con la membrana basal y el tejido conjuntivo subyacente (4,6).
En los últimos años se ha establecido la idea de que las queratinas cumplen dos roles fundamentales en las células epiteliales:
a) apoyo estructural, sin el cual un trauma físico conduce a la pérdida de la integridad, y
b) la regulación de los procesos metabólicos y crecimiento, de proliferación, migración y apoptosis.
Estas dos funciones generales implican interacciones reguladas con un grupo diverso de proteínas (2,7), que incluyen moléculas de señalización, como las proteínas 14-3-3, proteínas relacionadas con la apoptosis, quinasas y fosfatasas (8).
Oriolo et al. (9), plantean que también pueden desempeñar un papel en la polaridad epitelial y en el tráfico de membrana.
Se ha propuesto también la intervención de algunas citoqueratinas en la reparación de heridas, ya que confieren a la célula un citoesqueleto más plegable que favorece la migración de queratinocitos al sitio de cierre de la herida (10).
En cuanto a la CK14, se han evidenciado mutaciones en el gen CK14 que causan la epidermólisis bullosa simple (11, 12), que es una enfermedad hereditaria, y por esto se le atribuye importancia en la estabilidad física de la epidermis (4), y a su vez las CK’s 15 y 20 han sido utilizadas como marcadores de diagnóstico y pronóstico en diversas neoplasias de origen epitelial (13,14).
Utilidad de las citoqueratinas como marcadores
No todas las queratinas son sintetizadas simultáneamente por una célula, más bien, diferentes subconjuntos de queratinas se expresan durante el curso de la diferenciación terminal, en diferentes etapas de desarrollo, así como en diferentes epitelios. Por lo tanto, todos los epitelios (simples y complejos) pueden ser clasificados con base en la expresión de las citoqueratinas. Los epitelios simples o monoestratificados generalmente expresan queratinas (7, 18, 19, 20) mientras que los epitelios complejos (estratificados), expresan queratinas (5, 6, 10, 14, 15). Cuando un epitelio sufre transformación maligna su perfil de queratina por lo general sigue siendo más o menos constante (2), por lo que los patrones de expresión de queratina no sólo permiten identificar a una célula como epitelial, sino que permite determinar las etapas de diferenciación del epitelio y tipificar el tumor, lo que hace que anticuerpos contra varias queratinas se utilicen de forma rutinaria en los laboratorios de inmunohistoquímica para el diagnóstico de carcinomas, en particular en metástasis poco claras (4).
Otra aplicación clínica es la detección de fragmentos de proteínas de queratina derivados de CK8, CK18, y CK19 en la circulación de pacientes con cáncer; tales fragmentos se utilizan cada vez más para monitorizar la carga del tumor y la progresión de la enfermedad en el caso de ciertos carcinomas, como el cáncer de pulmón (15,16). Además, se ha visto que más del 95% de las células escamosas del carcinoma de pulmón son positivas para CK14 (13, 17).
La CK19, es uno de los marcadores inmunohistoquímicos más frecuentemente estudiados en patología tiroidea, la cual puede actuar como una herramienta útil de diagnóstico y pronóstico debido a que puede ser determinada antes del procedimiento terapéutico en los hallazgos citológicos (14).
La tinción inmunohistoquímica para CK19 permite hacer el diagnóstico diferencial entre carcinoma papilar que muestra una tinción fuerte y difusa y otras neoplasias de la glándula tiroides que muestran tinciones débiles y focales. También se ha sugerido que podría ser un predictor útil de progresión en el carcinoma de tiroides (14).
Tsuruba et al. (18), demostraron que CK8 y CK14 pueden ser útiles en el diagnóstico de los tumores de apéndices de la piel. En general, son CK8 negativos y CK14 positivos los tumores de epidermis, las glándulas sebáceas y los folículos pilosos, mientras que tumores derivados de las glándulas ecrinas y las glándulas sudoríparas apocrinas son CK8 positivos y CK14 negativos.
Los carcinomas de células escamosas, así como los mesoteliomas malignos expresan fuertemente CK14 mientras que poca, o ninguna expresión se encuentra en adenocarcinomas (2, 4, 19). Diferentes estudios han sugerido que la expresión de ciertas queratinas de epitelios simples, como CK19, en los carcinomas de células escamosas, parece ser un hallazgo de aquellos carcinomas poco diferenciados (4). CK19 es detectada en el epitelio cerca de carcinomas de células escamosas, lo que sugiere su uso como un agente biológico fundamental de la progresión maligna (20). Obviamente estos hallazgos son transpolables a carcinoma de células escamosas de cavidad bucal, evidenciando de esta manera la utilidad de estas citoqueratinas en el diagnóstico y como posible factor pronóstico en diversas neoplasias que afectan la región maxilofacial (21), así como lesiones de la mucosa bucal consideradas potencialmente malignas (22, 23).
En cuanto a los tumores de las glándulas salivales, estos se pueden dividir en dos grandes categorías: los tumores derivados de epitelio estratificado (adenoma pleomórfico, mioepitelioma, carcinoma de células escamosas basaloide, carcinoma adenoide quístico y el carcinoma mucoepidermoide) y los tumores que surgen de los epitelios simples (adenocarcinoma NOS, adenocarcinoma monomórfico, y carcinoma de células acinares). Los primeros expresan CK14 y CK19, mientras que los segundos no lo hacen (24,25). La CK14 es un marcador de las células mioepiteliales, por lo tanto, los tumores de glándulas salivales con un componente de células mioepiteliales son generalmente positivos para CK14. Estos tumores incluyen mioepitelioma benigno o maligno, carcinoma adenoideo quístico y el adenoma pleomorfo (13, 26,27).
Citoqueratinas y Odontogénesis
Los patrones de expresión de citoqueratinas en el epitelio odontogénico se han descrito de una manera muy general. Domingues et al. (28), en su estudio inmunohistoquímico mostraron que las células epiteliales del germen dental y los remanentes de la lámina dental son positivos a CK14 y CK19 con ligeros cambios en el patrón de expresión, dependiendo de la fase de la odontogénesis. Por ejemplo en el epitelio interno del órgano del esmalte describen que la expresión de CK14 Y CK19 varia en los estadios de campana y folículo, en el estadio de campana (estadio de campana temprana para el autor), observan que es fuertemente positivo para CK14 mientras que CK 19 tuvo una inmunotinción débil, en el estadio de campana tardío o folículo fue a la inversa. CK19 se vuelve intensamente positivo, disminuyendo la expresión de CK14. En este mismo estudio la citoqueratina predominante en los restos de la lámina dental fue CK14, que tiñó fuertemente todas las células, mientras que la CK19 apareció sólo en algunas células de la lámina dental, dando un patrón no homogéneo. En el retículo estrellado también se vio la expresión de CK14, siendo más fuerte en la fase temprana de campana. La CK19 también se expresó pero más débilmente. El epitelio externo del órgano del esmalte fue marcado tanto para CK14 como para CK19.
Crivelini et al (20), Ferreira Lopes et al (29), Leon et al (30), Kasper et al (31), Heikinheimo et al (32), Gao et al (33), aunque no describen en forma tan detallada, también estudiaron la expresión de CK14 y CK19 en el germen dental.
Encontraron CK14 y CK19 en el órgano del esmalte (20, 29-33) y en la lámina dental (20, 30, 31).
Crivelini et al y Leon et al, concuerdan con los hallazgos de Domingues et al. En cuanto a que CK14 es gradualmente remplazada por CK19 en el epitelio interno del órgano del esmalte, evidenciándose inmunoexpresión de CK19 muy positiva en preameloblastos (32).
Dado los cambios de la expresión de CK14 y CK19 en el epitelio interno del esmalte, algunos grupos de investigación han propuesto que CK19 podría ser considerada un efectivo marcador de diferenciación ameloblástica (20, 28).
Quistes y tumores odontogénicos
La presencia de estas citoqueratinas dentro del proceso de formación dentario, sugiere una participación dentro del desarrollo embrionario del órgano dentario, por lo que diferentes autores han estudiado su expresión en quistes y tumores odontogénicos (20, 29, 30, 32-47). Los patrones de expresión de queratina no sólo permiten identificar a una célula como epitelial, sino que también permiten identificar etapas durante la diferenciación del epitelio (4). Anticuerpos contra estas citoqueratinas han sido empleados para elucidar la histogénesis y tipificar el tumor. Existen numerosos trabajos en la literatura biomédica que han ejemplificado la utilidad de estas dos citoqueratinas para identificar epitelio odontogénico, y por ende han demostrado ser auxiliares importantes en el diagnóstico de algunas neoplasias o quistes donde se sospecha un posible origen odontogénico, así mismo han sido de gran utilidad para determinar la posible histogénesis de varias lesiones quísticas o tumorales propias de la región maxilofacial que hoy se sabe son de origen odontogénico. (20, 29, 30, 32-34, 37, 40-45, 47)
Un ejemplo de esto son los estudios realizados en ameloblastomas (20, 29, 34-36) donde se estudió la expresión de CK14 y CK19 con el fin de dilucidar el posible origen (20,29), mientras que otros autores estudiaron estas mismas citoqueratinas para diferenciarlo de otras lesiones, como es en el caso de Yoon et al. que estudiaron la expresión de CK14 y CK19 para diferenciarlo de carcinoma ameloblástico, encontrando que en ambos tumores la expresión de ambas citoqueratinas es fuerte y difusa.
Otro trabajo interesante es el realizado por Pal et al (35), quienes estudian la expresión de estas mismas citoqueratinas en ameloblastoma central y en ameloblastoma periférico, y con los resultados obtenidos concluyen que la expresión de CK19 puede ser utilizada como un auxiliar para diferenciar ambas neoplasias ya que en los casos de ameloblastoma central estudiados, CK19 es positiva en todas las células mientras que en ameloblastoma periférico se ven células CK19 negativas. Gao et al. (33) estudiaron la expresión de CK14 y CK19 en el epitelio odontogénico de los folículos dentarios normales, así como en el epitelio de quiste dentígero y tumor odontogénico queratoquístico, dado que todos derivan del epitelio odontogénico del órgano dental, y estos patrones fueron comparados con los de quistes de diferentes orígenes de desarrollo, como el quiste nasopalatino y quiste epidermoide.
Los resultados obtenidos confirmaron la expectativa de que los quistes del desarrollo que surgen del epitelio odontogénico compartían la expresión de CK 14 y CK 19, pero diferían de los quistes originados del epitelio no odontogénico. Por lo tanto el epitelio odontogénico y sus derivados (quistes y tumores), muestran ciertas similitudes en sus patrones de expresión de CK, pero difieren de los quistes nasopalatinos por ejemplo, que derivan de restos epiteliales del conducto nasopalatino, y del quiste epidermoide que surge de enclavamientos del epitelio durante el desarrollo embrionario.
En la Tabla 1, se esquematizan diferentes trabajos donde se estudió la expresión de CK14 y/o CK19 en varios quistes y tumores odontogénicos.



En conclusión los diferentes estudios e investigaciones recientes cada vez con más fuerza le confieren a las citoqueratinas un papel mucho más complejo que la sola constitución del citoesqueleto. Existen diversos grupos que actualmente están estudiando la influencia que tienen sus funciones estructurales y reguladoras dentro de diversas enfermedades y cada día resultan más evidentes las interacciones moleculares de estas proteínas en diferentes procesos normales y patológicos. Todos estos nuevos aportes evidencian la importancia de esta familia de filamentos intermedios como biomarcadores de utilidad pronóstica y diagnóstica en diversos tumores de la anatomía humana, y la región buco-maxilofacial no es la excepción.
Referencias
1. Lodish H, Berk A, Zipursky S, Matsudaira P, Baltimare D, Darnell J. Movilidad y forma de la célula I: microfilamentos. En Biología celular y molecular. 4ed. Buenos Aires: Panamericana, 2002: 751-794.
2. Chu PG, Weiss LM. Keratin expression in human tissues and neoplasms. Histopathology. 2002; 40(5): 403–439.
3. Chung BM, Rotty JD, Coulombe PA. Networking galore: intermediate filaments and cell migration. Curr. Opi. Cell. Biol. 2013; 25(5): 600-612.
4. Moll R, Franke WW, Schiller DL, Geiger B, Krepler R. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell. 1982; 31(1): 11–24.
5. Bader BL, Magin TM, Hatzfeld M, Franke WW. Amino acid sequence and gene organization of cytokeratin no. 19, an exceptional tail-less intermediate filament protein. EMBO J. 1986; 5(8): 1865-1875.
6. Moll R, Franke WW, Volc-Platzer B, Krepler R. Different keratin polypeptides in epidermis and other epithelia of human skin: a specific cytokeratin of molecular weight 46,000 in epithelia of the pilosebaceous tract and basal cell epitheliomas. J. Cell. Biol. 1982; 95(1): 285–295.
7. Pan X, Hobbs RP, Coulombe PA. The expanding significance of keratin intermediate filaments in normal and diseased epithelia. Curr. Opin. Cell. Biol. 2013; 25(1): 47-56.
8. Toivola DM, Strnad P, Habtezion A, Omary MB. Intermediate filaments take the heat as stress proteins. Trends. Cell. Biol. 2010; 20(2): 79-91.
9. Oriolo AS, Wald FA, Ramsauer VP, Salas PJ. Intermediate filaments: a role in epithelial polarity. Exp. Cell. Res. 2007; 313(10): 2255-2264.
10. Magin TM, Vijayaraj P, Leube RE. Structural and regulatory functions of keratins. Exp. Cell. Res. 2007; 313(10): 2021-2032.
11. Omary MB, Coulombe PA, McLean WH. Intermediate filament proteins and their associated diseases. N. Engl. J. Med. 2004; 351(20): 2087–2100.
12. Lane EB, McLean WH. Keratins and skin disorders. J. Pathol. 2004; 204(4): 355–366.
13. Chu PG, Lyda MH, Weiss LM. Cytokeratin 14 expression in epithelial neoplasms: a survey of 435 cases with emphasis on its value in differentiating squamous cell carcinomas from other epithelial tumours. Histopathology. 2001; 39(1): 9–16.
14. Isic Dencic T, Cvejic D, Paunovic I, Tatic S, Havelka M, Savin S. Cytokeratin19 expression discriminates papillary thyroid carcinoma from other thyroid lesions and predicts its aggressive behavior. Med. Oncol. 2013; 30(1): 362.
15. Barak V, Goike H, Panaretakis KW, Einarsson R. Clinical utility of cytokeratins as tumor markers. Clin. Biochem. 2004; 37(7): 529–540.
16. Linder S. Cytokeratin markers come of age. Tumour. Biol. 2007; 28(4): 189–195.
17. Lyda MH, Weiss LM. Immunoreactivity for epithelial and neuroendocrine antibodies are useful in the differential diagnosis of lung carcinomas. Hum. Pathol. 2000; 31(8): 980–987.
18. Tsubura A, Okada H, Sasaki M, Dairkee SH, Morii S. Immunohistochemical demonstration of keratins 8 and 14 in benign tumours of the skin appendage. Virchows Arch. A Pathol. Anat. Histopathol. 1991; 418(6): 503–507.
19. Moll R. Cytokeratins as markers of differentiation in the diagnosis of epithelial tumors. Subcell. Biochem. 1998; 31: 205–262.
20. Crivelini MM, de Araújo VC, de Sousa SO, De Araújo NS. Cytokeratins in epithelia of odontogenic neoplasms. Oral. Dis. 2003; 9(1): 1-6.
21. Fillies T, Jogschies M, Kleinheinz J, Brandt B, Joos U, Buerger H. Cytokeratin alteration in oral leukoplakia and oral squamous cell carcinoma. Oncol. Rep. 2007; 18(3): 639-643.
22. Rivarola de Gutierrez E, Innocenti AC, Cippitelli MJ, Salomón S, Vargas-Roig LM. Determination of cytokeratins 1, 13 and 14 in oral lichen planus. Med. Oral. Patol. Oral. Cir. Bucal. 2014;19(4):e359-65
23. Nanda KD, Ranganathan K, Devi U, Joshua E. Increased expression of CK8 and CK18 in leukoplakia, oral submucous fibrosis, and oral squamous cell carcinoma: an immunohistochemistry study. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 2012;113(2):245-53 24.
24. Tsubochi H, Suzuki T, Suzuki S, Ohashi Y, Ishibashi S, Moriya T et al. Immunohistochemcial study of basaloid squamous cell carcinoma, adenoid cystic and mucoepidermoid carcinoma in the upper aerodigestive tract. Anticancer Res. 2000; 20(2B): 1205–1211.
25. de Araújo VC, de Sousa SO, Carvalho YR, de Araújo NS. Application of immunohistochemistry to the diagnosis of salivary gland tumors. Appl. Immunohistochem. Mol. Morphol. 2000; 8(3): 195–202.
26. Ogawa Y, Toyosawa S, Ishida T, Ijuhin N. Keratin 14 immunoreactive cells in pleomorphic adenomas and adenoid cystic carcinomas of salivary glands. Virchows Arch. 2000; 437(1): 58–68.
27. Nagao T, Sugano I, Ishida Y, Tajima Y, Matsuzaki O, Konno A et al. Salivary gland malignant myoepithelioma: a clinicopathologic and immunohistochemical study of ten cases. Cancer. 1998; 83(7): 1292–1299.
28. Domingues MG, Jaeger MM, Araújo VC, Araújo NS. Expression of cytokeratins in human enamel organ. Eur. J. Oral. Sci. 2000; 108(1): 43-47.
29. Ferreira Lopes F, Fontoura MC, do Amaral AL, Dantas EJ, Cavalcanti H, Batista L et al. Análise imuno-histoquímica das citoqueratinas em ameloblastoma e tumor odontogênico adenomatóide. J. Bras. Patol. Med. Lab. 2005; 41(6): 425-430.
30. Leon JE, Mata GM, Fregnani ER, Carlos-Bregni R, de Almeida OP, Mosqueda-Taylor A et al. Clinicopathological and immunohistochemical study of 39 cases of Adenomatoid Odontogenic Tumour: a multicentric study. Oral. Oncol. 2005; 41(8): 835–842.
31. Kasper M, Karsten U, Stosiek P, Moll R. Distribution of intermediate-filament proteins in the human enamel organ: unusually complex pattern of coexpression of cytokeratin polypeptides and vimentin. Differentiation 1989; 40(3): 207-214.
32. Heikinheimo K, Hormia M, Stenman G, Virtanen I, Happonen RP. Patterns of expression of intermediate filaments in ameloblastoma and human fetal tooth germ. J. Oral. Pathol. Med. 1989; 18(5): 264-273.
33. Gao Z, Mackenzie IC, Cruchley AT, Williams DM, Leigh I, Lane EB. Cytokeratin expression of the odontogenic epithelia in dental follicles and developmental cysts. J. Oral. Pathol. Med. 1989; 18(2): 63-67.
34. Yoon HJ, Jo BC, Shin WJ, Cho YA, Lee JI, Hong SP et al. Comparative immunohistochemical study of ameloblastoma and ameloblastic carcinoma. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod. 2011; 112(6): 767-776.
35. Pal SK, Sakamoto K, Aragaki T, Akashi T, Tamaquachi A. The expression profiles of acidic epithelial keratins in ameloblastoma. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 2013; 115(4): 523-531.
36. Fukumashi K, Enokiya Y, Inoue T. Cytoqueratins expression of constituting cells in ameloblastoma. Bull. Tokyo. Dent. Coll. 2002; 43(1): 13-21
37. Kishino M, Murakami S, Yuki M, Lida S, Ogawa Y, Kogo M et al. A immunohistochemical study of the peripheral ameloblastoma. Oral. Dis. 2007; 13(6): 575–580.
38. Bologna-Molina R, Mosqueda-Taylor A, de Almeida-Osley P, Toral-Rizo V, Martínez-Mata G. Peripheral desmoplastic ameloblastoma: histopathological and immunohistochemical profile of a case. Med. Oral. Patol. Oral. Cir. Bucal. 2010; 15 (6): 846-849.
39. Martínez-Mata G, Mosqueda-TaylorA, Carlos-Bregni R, de Almeida OP, Contreras-Vidaurre E, Vargas PA et al. Odontogenic myxoma: clinico-pathological, immunohistochemical and ultrastructural findings of a multicentric series. Oral. Oncol. 2008; 44(6): 601– 607.
40. Bologna-Molina R, Salazar-Rodríguez S, Bedoya-Borella AM, Carreón-Burciaga RG, Tapia-Repetto G, Molina-Frechero N. A histopathological and inmunohistochemical analysis of ameloblastic fibrodentinoma. Case. Rep. Pathol. 2013; 1-7.
41. Dos Santos JN, Oliveira GQ, Gurgel CA, de Souza RO, Sales CB, de Aquiar Pires Valenca Neto A, et al. Altered expression of cytokeratins in primary, recurrent and syndrome keratocystic odontogenic tumors. J. Mol. Histol. 2009; 40(4): 269–275.
42. Aragaki T, Michi Y, Katsube K, Uzawa N, Okada N, Akashi T et al. Comprehensive keratin profiling reveals different histopathogenesis of keratocystic odontogenic tumor and orthokeratinized odontogenic cyst. Hum. Pathol. 2010; 41(12): 1718–1725.
43. Tsuji K, Wato M, Hayashi T, Yasuda N, Matsushita T, Ito T et al. The expression of cytokeratin in keratocystic odontogenic tumor, orthokeratinized odontogenic cyst, dentigerous cyst, radicular cyst and dermoid cyst. Med. Mol. Morphol. 2013.
44. Stoll C, Stollenwerk C, Riediger D, Mittermayer C, Alfer J. Cytokeratin expression patterns for distinction of odontogenic keratocysts from dentigerous and radicular cysts. J. Oral. Pathol. Med. 2005; 34(9): 558-564.
45. Lukinmaa PL, Leppaniemi A, Hietanen J, Allemanni G, Zardi L. Features of odontogenesis and expression of cytokeratins and tenascin-C in three cases of extraosseous and intraosseous calcifying odontogenic cyst. J. Oral. Pathol. Med. 1997; 26(6): 265-272.
46. Murakami S, Koike Y, Matsuzaka K, Ohata H, Uchiyama T, Inoue T. A case of calcifying odontogenic cyst with numerous calcifications: immunohistochemical analysis. Bull. Tokyo. Dent. Coll. 2003; 44(2): 61-66.
47. Fregnani ER, Pires FR, Quezada RD, Shih IeM, Vargas PA, de Almeida OP. Calcifying odontogenic cyst: clinicopathological features and immunohistochemical profile of 10 cases. J. Oral. Pathol. Med. 2003; 32(3): 163-170.











 text in
text in 


