Tratamiento odontológico integral del paciente oncológico. Parte II
Lanza Echeveste, Damián Guillermo*
Tratamiento odontológico integral del paciente oncológico. Parte II
Lanza Echeveste, Damián Guillermo*
* Ayudante de Clase, Grado 1, Cátedras de Cirugía Buco Maxilo Facial II y III. (2003-2008). Facultad de Odontología. Universidad de la República. Uruguay.
Resumen
El tratamiento odontológico del paciente con cáncer es uno de los mayores desafíos a los que se puede enfrentar el odontólogo, ya que requiere de una atención meticulosa, coordinada y con la participación de un equipo multidisciplinario, cuyo objetivo debe ser asistir al paciente de manera integral y con la menor cantidad posible de efectos secundarios. Para lograr este objetivo se debe seguir un protocolo odontológico dividido en tres etapas: pre, intra y post terapia oncológica, que abarcan diversos tratamientos. El paciente acude al hospital para realizar el tratamiento oncológico específico y este debe ofrecerle la asistencia intra y post cirugía en condiciones hospitalarias o sanatoriales. Este artículo está dirigido al odontólogo general integrado al equipo de salud y continúa la descripción, iniciada en la parte I, de las patologías, agudas y crónicas, generadas por la terapia oncológica, como prevenirlas y como tratarlas.
Palabras claves: Tratamiento, odontología oncológica.
Abstract
Dental treatment of a cancer patient maybe one of the largest challenges that a dentist can confront with because it requires a meticulous comprehensive, tidy and coordinated assistance by a multidisciplinary team, with the aim of the integral treatment of the patient with the lowest side effects. In order to achieve this, it is essential to follow a dental protocol divided in three stages: pre, intra and post oncologic therapy which have different treatments. The patient goes to the hospital to look for an oncospecific treatments and the institution must give the intra and post care in hospital or sanatorium conditions. This paper is mainly referred to the general dentist integrated in health-team, and it continues with the description, initiated in Part I, of the odontologic acute and chronic pathologies generated by oncologic therapy, and how to prevent and treat them.
Key words: Multi disciplinary treatment, oncologic-dentistry.
Introducción
En la publicación anterior (1) se hizo referencia al tratamiento odontológico previo al tratamiento oncológico, descripción del tratamiento oncológico, planificación multidisciplinaria, descripción de las complicaciones tales como mucositis, disgeusia, xerostomía, dolor y su tratamiento. En esta segunda parte se hace referencia a infecciones de diversa índole que se asocian frecuentemente, hemorragias, neurotoxicidad, osteorradionecrosis (ORN), su tratamiento, así como la rehabilitación luego del tratamiento oncológico.
Revisión
Para el siguiente trabajo se revisó la literatura científica relacionada a las palabras clave como tratamiento multidisciplinario odontología-oncología, complicaciones de la terapia oncológica y su tratamiento. Los idiomas seleccionados fueron el inglés, español e italiano recurriendo a la base de datos de Pubmed (Medline) y Lilacs (Bireme) y se limitó el período de búsqueda a la literatura existente de los últimos 20 años.
Infecciones bacterianas
La mucosa oral normal controla el número de microorganismos orales que la colonizan al renovarse constantemente y limita la penetración de muchos compuestos en el epitelio mediante el mantenimiento de la integridad de la mucosa, que forma una barrera física y la formación de una barrera química, gracias a la secreción de inmunoglobulina A, G y M en la saliva, entre otras sustancias (2-4). Los organismos grampositivos que comprenden las especies Streptococcus viridans y enterococcus se relacionan hoy día con la infección sistémica de origen oral (5-8). Además son importantes los patógenos oportunistas gramnegativos, entre los que figuran la Pseudomonas Aeruginosa, Neisseria sp, Capnocytophaga sputigena y Escherichia coli (5-8). Los pacientes con enfermedad periodontal crónica inmunosuprimidos pueden desarrollar infecciones periodontales agudas como: gingivitis ulcero necrotizante aguda (GUNA) y periodontitis ulcero necrotizante aguda (PUNA) y sus correspondientes secuelas. Es posible que los signos inflamatorios estén ocultos debido a la inmunosupresión subyacente. Por lo tanto, los protocolos de higiene oral que reducen la colonización microbiana de la dentición y el periodonto resultan importantes durante la inmunosupresión (7).
Entre las terapias tópicas tenemos las siguientes: enjuagatorios orales con clorhexidina (CHX) al 0,12%, buches con agua oxigenada que afectan las bacterias anaeróbicas que colonizan el alvéolo periodontal y remoción mecánica suave de la placa (9, 10). Es importante recordar que estos microorganismos orales pueden diseminarse por aspiración, deglución o por vía sanguínea y causar enfermedades sistémicas (7). En cuanto a la terapia sistémica se debe elegir al antibiótico adecuado para cada caso específico (11).
Infecciones micóticas
La candidiasis es la infección micótica más común de la orofaringe en los pacientes que reciben radio-quimoterapia (RQT), con una frecuencia del 70%. Es causada por el sobrecrecimiento del hongo nativo Cándida Albicans, que ante ciertas circunstancias se vuelve oportunista (12). Existen factores que favorecen la candidiasis como: inmunosupresión, tabaquismo, alcoholismo, uso de prótesis, hiposialia, etc. Asimismo, los antibióticos que se utilizan durante la neutropenia prolongada o terapia esteroide simultánea alteran típicamente la flora nativa oral, creando un ambiente favorable para el sobrecrecimiento micótico. Esta infección puede agravar los síntomas de la mucositis orofaríngea, ya que favorece la acidez del medio (2, 4, 5,8, 12-16).
Ante una lesión mucosa eritematosa se debe sospechar de infección por cándida (2, 16). La forma más típica de presentación en pacientes inmunocomprometidos es la forma seudomembranosa o “muguet”, caracterizada por presentar una seudomembrana superficial blanda, blanquecina o grisácea que se remueve con facilidad dejando una base eritematosa, ulcerada y dolorosa. Si se deja evolucionar la seudomembrana se desprende sola dejando una zona enrojecida y muy dolorosa (4, 13, 16). Otra forma de presentación es la eritematosa y se puede confundir con mucositis o sobreinfectar a ésta (14, 16).
Los fármacos antimicóticos orales tópicos parecen tener eficacia variable en la prevención y el tratamiento de infecciones micóticas en los pacientes con inmunosupresión. El clotrimazol, miconazol y las soluciones orales de anfotericinas tienen alta eficacia en la reducción de la colonización y en el tratamiento de esofagitis candidiásicas en el paciente con cáncer cuyo sistema inmunitario está debilitado (4, 8, 9, 13-15). Cada vez hay más pruebas de que los antifúngicos azólicos sistémicos profilácticos pueden reducir eficazmente los índices globales de colonización micótica oral y reducir el riesgo de candidiasis oral, siendo el fluconazol el fármaco preferido (14).
El protocolo de tratamiento es el siguiente:
Las infecciones candidiásicas sistémicas representan un riesgo considerable para el paciente con mielosupresión (15). Cuando hay riesgo de diseminación sistémica de la micosis esta debe tratarse con los fármacos sistémicos apropiados. Los fármacos tópicos suelen no absorberse bien y resultan ineficaces contra las infecciones micóticas invasoras más profundas. Por lo tanto, los fármacos sistémicos se indican para el tratamiento de todas las infecciones de la cavidad oral, excepto las formas superficiales. Se ha observado que las dosis terapéuticas de fluconazol y de itraconazol producen respuestas eficaces en los pacientes con trasplante de médula. La anfotericina B suele ser el fármaco de preferencia para el tratamiento de la candidiasis sistémica (12). También se recomienda ketoconazol 200 mg, 1 o 2 veces/día y fluconazol 100 mg, 1 o 2 veces/día, ambos regímenes por al menos dos semanas (8, 10, 12). Los antifúngicos no deben contener azúcares en su composición, para evitar la acidificación del medio y disminuir el riesgo al desarrollo de caries dental (2, 16).
Infecciones micóticas no candidiásicas
En los últimos años se han relacionado, en el paciente con cáncer y con inmunidad disminuída, la infección oral con un número creciente de organismos micóticos oportunistas diferentes; estos incluyen infección por especies de Aspergillus, género mucoraceae y rhizopus (4, 13). Suelen asentar sobre la cavidad oral, fosas nasales y senos paranasales. La documentación micológica es imprescindible (8). Se manifiesta clínicamente de forma grave con inflamación, dolor, ulceración y necrosis (13). La terapia sistémica, generalmente en ámbito hospitalario, tiene que instituirse rápidamente debido a la alta morbi-mortalidad por la tendencia a la diseminación sanguínea precoz, usando anfotericina B en altas dosis por vía intravenosa. Cuando la micosis es my agresiva e invasiva es necesaria la cirugía (8, 13).
Herpes virus
El grupo de herpes virus abarca: el virus herpes simple 1 y 2 (VHS-1 y VHS-2), el virus varicela-zoster (VVZ) y el citomegalovirus (CMV), el virus Epstein-Barr (VEB), el virus de la roseola infantum (HHV6) y el virus del sarcoma de Kaposi (VHSK) (17). En este artículo se tratarán las infecciones causadas por los primeros 4 virus nombrados. Las infecciones víricas del grupo herpes pueden resultar en diferentes enfermedades que oscilan entre afecciones leves y severas en pacientes tratados con terapia oncológica (5, 13, 18). La gravedad y el impacto de estas lesiones, así como las secuelas sistémicas se relacionan directamente con el grado de compromiso inmunitario del paciente. Las afecciones orales, como mucositis o enfermedad de injerto contra huésped, pueden agravarse drásticamente por una sobreinfección e incrementar considerablemente la dificultad del diagnóstico (18). En la mayoría de los casos, las infecciones con el VHS-1, el VVZ y el VEB son el resultado de la reactivación de un virus latente, mientras que las infecciones de CMV pueden resultar de la reactivación de un virus latente o de un virus recientemente adquirido (4, 8, 17, 18). La reactivación de estos virus sucede por stress, traumatismo, inmunosupresión, radiación ultravioleta, radioterapia (RT), etc. (17). La profilaxis con medicamentos antivíricos ha demostrado reducir drásticamente la incidencia de la enfermedad. Esto incluye principalmente a pacientes que reciben dosis alta de QT y que se someten al trasplante de células madre hematopoyéticas. El diagnóstico temprano y la terapia oportuna con aciclovir continúan siendo los pilares del tratamiento (17, 19). Al igual que con otras infecciones, el riesgo de diseminación sistémica, morbilidad y mortalidad aumenta con el grado y la duración del compromiso inmunitario. Las infecciones pueden ser mortales, según el grado de supresión inmunitaria.
Virus herpes simple
Las lesiones herpéticas orales pueden manifestarse en grados variables desde herpes labial hasta gingivoestomatitis grave. Ambas son expresiones de la misma patología y son enfermedades autolimitantes que dejan inmunidad, pero que no protegen contra la reactivación, por lo general no dejan cicatriz, y se caracterizan por la aparición de vesículas dolorosas considerables en toda la boca (9, 13, 17, 18, 20). La gravedad de las lesiones aumenta considerablemente con grados crecientes de supresión inmunitaria (17, 20). La incidencia de estas lesiones se ha reducido considerablemente después de la introducción del aciclovir profiláctico y más recientemente, valaciclovir (8, 20). En pacientes sin profilaxis antivírica, las lesiones orales generalmente surgen simultáneamente con la quimioterapia (QT) o la RQT durante el período de supresión inmunitaria más significativo ya que el virus queda latente en el tejido nervioso, generalmente el ganglio trigeminal (13, 17, 18). Las infecciones orales recurrentes por VHS-1 que se manifiestan simultáneamente con mucositis oral inducida por la terapia oncológica pueden resultar en el desarrollo de ulceraciones amplias de la mucosa. Como tal, la estomatitis por VHS-1 puede confundirse con mucositis ulcerativa inducida por la terapia oncológica. Realizar cultivos víricos o solicitud de anticuerpos de las lesiones es esencial para el diagnóstico preciso. Su tratamiento clásico es con ungüentos de aciclovir al 5%, 5 veces por día durante 7-10 días o vía oral 400 mg, 5 veces por día por una semana (3, 8-10, 13, 19, 20). Pero también el VHS-1 puede diseminarse y provocar encefalitis necrotizante y neumonía (4, 20).
Virus varicela-zoster
Este virus provoca la varicela y en la reactivación el herpes zoster o “culebrilla” (4, 13). Esta infección es autolimitante, se propaga por los nervios espinales sensitivos afectando su zona de inervación y causan lesiones muy dolorosas de carácter neurálgico. En la esfera oral suelen asentar en paladar duro, dorso de lengua y mucosa vestibular (4, 5, 8, 13), aunque pueden afectar cualquier sector de la mucosa bucal, siguiendo un ramo nervioso sensitivo. La evolución natural es: erupción, vesícula, pústula (sólo si se sobreinfecta) y generalmente ulceración dolorosa (13). En el caso de los pacientes sometidos a dosis altas de QT, las lesiones por VVZ orofaciales se observan en general varias semanas después de la interrupción de la QT. Esto contrasta con el VHS-1, el cual suele ocurrir entre 2 y 3 tres semanas después de la discontinuidad de la misma. Se recomienda Aciclovir 800 mg, 5 veces por día durante 7-10 días (13). Valaciclovir y famciclovir son otras opciones que se utilizan en la actualidad en el tratamiento, aunque también se puede recurrir a la γ-globulina (8). Este virus también se puede diseminar y generar encefalitis desmielinizante aguda y necrosis (4).
Citomegalovirus
Las lesiones orales relacionadas con el CMV se han documentado en pacientes con compromiso inmunitario, como aquellos que se han sometido a un trasplante de médula (4, 8, 13). La lesión inicialmente se presenta durante los primeros períodos de regeneración medular, por ejemplo, 3 semanas después de discontinuarse la QT. La apariencia no es patognomónica y se caracteriza por ulceraciones múltiples, leves o moderadas, no específicas, con márgenes irregulares, seudomembranosas y cubiertas por exudado de fibrina con base granulomatosa. Los cultivos superficiales por hisopo pueden producir resultados falsos negativos, quizás debido a la propensión viral de infectar las células endoteliales y los fibroblastos con los resultantes bajos índices de virus libre. La tinción inmunohistoquímica específica al CMV de los especímenes de la biopsia sigue siendo el método de diagnóstico estándar. En la actualidad, ganciclovir es el tratamiento de elección para la infección aguda por CMV o también se puede usar γ-globulina (9). Este virus también se puede diseminar y provocar una neumonía y encefalitis subaguda (4, 9).
Virus Epstein-Barr
Este virus provoca la mononucleosis infecciosa en adolescentes y adultos, cuadro autolimitado que puede asociarse a neoplasias y linfomas, aunque la mayor parte de las infecciones por VEB son asintomáticas y se presentan como faringitis con o sin amigdalitis. La lesión no parece tener significación clínica en los pacientes de QT. Otras manifestaciones clínicas son fiebre no muy intensa pero duradera, fatiga, mialgias, esplenomegalia y malestar general (4, 13). En contraste, los pacientes de trasplante de células madre hematopoyéticas, que tienen el sistema inmunitario deprimido durante un lapso prolongado corren el riesgo de desarrollar linfomas en la región de la cabeza y el cuello y leucoplasia vellosa en la cavidad bucal relacionados con el VEB. El riesgo de infección con VEB suele surgir característicamente meses después del cese de la terapia inmunosupresora utilizada para el trasplante.
Infecciones de virus no herpes
Las infecciones producidas por virus no herpéticos son más comunes en pacientes con compromiso inmunitario. Existe un riesgo de infección creciente directamente proporcional con la profundidad y la duración de la supresión inmunitaria. Se han descrito las lesiones orales producidas por el adenovirus y el virus del papiloma humano (VPH) oral. Con frecuencia, los pacientes que presentan lesiones cutáneas por VPH también tienen lesiones orales. Estas lesiones pueden presentarse como lesiones verrugosas hiperqueratósicas o como lesiones planas semejantes a condiloma acuminado. El tratamiento de estas lesiones se realiza principalmente con cirugía convencional y estudio anatomopatológico pero el tratamiento usual es con cirugía láser o crioterapia. Las inyecciones intralesionales de interferón alfa pueden resultar eficaces en las lesiones recurrentes (2, 8).
Hemorragia
La hemorragia puede ocurrir durante la trombocitopenia o la coagulopatía inducidas por la QT y constituye un elemento de preocupación para aquellos pacientes tratados con dosis altas de QT o trasplante de células madre hematopoyéticas (3, 5, 6, 9, 14, 21). También la RT daña las células endoteliales resultando en una pérdida de capilares y una isquemia microcirculatoria (23). Puede haber sangrado espontáneo de la encía cuando el número de plaquetas disminuye por debajo de las 30.000/mm3, especialmente cuando se observa gingivitis o periodontitis previamente (5). Recordemos que el número normal de plaquetas se encuentra entre los 150.000-400.000/mm3 (4). Incluso la masticación o la higiene oral habitual pueden provocar sangrado gingival (4). Aunque raramente resulta grave, puede preocupar al paciente y su familia. Es difícil cuantificar el grado de pérdida de volemia debido a la saliva y vómitos por ingestión de sangre. El sangrado oral puede ser leve, como petequias situadas en los labios, el paladar blando o el piso de la boca, o severo como hemorragia gingival persistente o sangrado por úlceras provocadas por el VHS ante trombocitopenia grave o mucositis (5, 6).
Es usual que se recomiende a los pacientes que no utilicen cepillos de dientes e hilo dental cuando el recuento plaquetario desciende por debajo de 40.000/mm3. Pero esta indicación no es correcta ya que los tejidos gingivales sanos no sangran, a menos que estén traumatizados (10). Por el contrario la interrupción de la higiene oral habitual puede aumentar el riesgo de infección que podría facilitar el sangrado y también el riesgo de infección local y sistémica debido a la acumulación de placa bacteriana, con lo cual se producen infecciones periodontales sangrantes. Esto respalda aún más la utilidad de los tratamientos dentales previos a la terapia oncológica con el propósito de reducir o eliminar las alteraciones gingivales o periodontales (10). El colágeno hemostático puede utilizarse en la organización y la estabilización de coágulos, que por lo general son muy friables, también las esponjas de gelatina (5, 10). La aplicación de productos como el cianoacrilato ayuda a sellar sitios sangrantes y proteger coágulos organizados. Hay que tener cuidado de no perturbar la integridad de los coágulos, cuya eliminación puede fomentar el sangrado. En casos severos de trombocitopenia y anemia se debe internar al paciente en un centro hospitalario y el equipo médico-oncológico evaluará la necesidad de recurrir a transfusiones de concentrado de plaquetas y/o concentrado de hematíes (5).
Neurotoxicidad
Ciertos fármacos antineoplásicos como los antimetabolitos (metotrexato) o los alcaloides de la vinca (vincristina y vinblastina) pueden causar neurotoxicidad directa (5, 9). Puede haber síntomas a nivel general como insensibilidad, hormigueo, mareos, vómitos, ataxia, debilidad motora y confusión, y a nivel oral dolor mandibular profundo y pulsátil (5, 9). Como este último síntoma también ocurre con la enfermedad aguda de la pulpa dental, es importante tener un historial completo y hacer un examen clínico oral cuando hay dolor; por lo general se necesitan Rx y exámenes de la vitalidad de la pulpa dental. Una vez que se haya diagnosticado correctamente, la neurotoxicidad se maneja apoyando al paciente, explicándole la corta duración de la misma y ofreciéndole orientación respecto al dolor (5). Los síntomas generalmente se resuelven dentro de una semana después del cese de la QT. Ocasionalmente, la hipersensibilidad dental puede surgir semanas o meses después que el paciente haya discontinuado la QT. La aplicación tópica de fluoruro o dentífrico desensibilizante puede reducir la incomodidad. La RT también puede generar neurotoxicidad tardía (meses o años) dando síntomas como cefaleas, náuseas, vómitos y edema (4).
Complicaciones tardías o crónicas
Las complicaciones crónicas incluyen fibrosis y atrofia de la mucosa, xerostomía, caries por radiación, infecciones (candidiasis principalmente), necrosis de los tejidos blandos y ORN, disfunción del gusto (disgeusia/ageusia) y fibrosis muscular y cutánea (2). Las complicaciones tardías de la RT surgen principalmente a causa de una lesión crónica en la vasculatura, las glándulas salivales, la mucosa, el tejido conjuntivo y los huesos. Los tipos y la severidad de estos cambios están relacionados directamente con la dosis total de la RT, el tamaño del fraccionamiento y la duración del mismo. Los cambios de las mucosas incluyen atrofia epitelial, vascularización reducida y fibrosis submucosa (2). Estos trastornos producen una mucosa friable y atrófica. La fibrosis que implica al músculo, la piel, mucosas y la ATM dan lugar a una función oral comprometida.
Caries dental secundaria a radiación
El riesgo de tener caries aumenta como efecto secundario a una serie de factores, entre ellos los cambios en la flora debido a la inmunosupresión y acidificación del pH, hiposialia, concentraciones reducidas de proteínas antimicrobianas salivales, malnutrición, dieta semisólida y rica en carbohidratos y pérdida de los elementos mineralizadores (22, 23). Las superficies más afectadas son las cervicales (2, 9, 12-14, 22). Hay que mantener una higiene oral óptima y evitar los alimentos y bebidas azucaradas (14, 22). Se puede mejorar la resistencia a la caries usando fluoruros tópicos o fármacos remineralizantes. Se ha demostrado que realizar enjuagues con productos que contengan sales de Zn evita la formación de la placa bacteriana y reducen la acidez generada por ella (22). Los iones de zinc inhiben el transporte de azucares en los Streptococcus Mutans e interfieren en el metabolismo de la glucosa en los Streptococcus Sobrinus. Además el zinc tiene una alta capacidad de adhesión, se adhiere a la mucosa oral y se libera lentamente por horas y evita la formación del fosfato cálcico, principal componente del sarro. La hiposialia altera la capacidad de autolimpieza mecánica, contribuyendo así a la caries dental y a la enfermedad periodontal progresiva (5, 22, 23). Hay mayor colonización de Streptococcus Mutans y Lactobacillus que aumentan el riesgo de desarrollar caries (23). Los fluoruros tópicos y los enjuagues de clorhexidina podrían reducir el índice de Streptococcus Mutans pero no el de Lactobacillus. Los fármacos remineralizantes que contienen una alta concentración de fosfato de calcio y de fluoruro pueden ser efectivos (22). Generalmente los pacientes sufren de hiposialia, mucositis e infecciones oportunistas lo que hace que la alimentación sea dificultosa y dolorosa. Por lo tanto se alimentan con una dieta blanda y rica en hidratos de carbono muy cariogénica, con lo que se aumenta el riesgo de caries e infecciones (2, 9, 14, 22). La clave de estas medidas es evitar la caries postradiación y que de instalarse esta avance hasta un grado tal que sea necesaria la extracción de la pieza, con el riesgo latente de ORN (12, 22).
Disfunción mandibular
En los tumores de cabeza y cuello pueden desarrollarse síndromes musculoesqueléticos secundarios a la radiación y a la cirugía. Los pacientes pueden sufrir dolor por disfunción temporomandibular que incluye nervios, músculos de la masticación, ATMs y/o dientes (2). Esta afección se correlaciona con hábitos de estrés y disfuncionales, incluso bruxismo. Las lesiones incluyen: fibrosis de los tejidos blandos, trismus, discontinuidad mandibular y/o maxilar provocada por la pérdida de sustancia ósea que genera la resección quirúrgica del tumor, y hábitos parafuncionales relacionados con tensión emocional causada por el cáncer y su tratamiento. El trismus suele aparecer a los 3-6 meses después de la RT y es mucho más frecuente cuando la dosis supera los 70 Gy (2). Los métodos estándar para manejar este trastorno son el uso de relajantes musculares o de fármacos ansiolíticos acompañados de mecanoterapia como aplicaciones de calor húmedo, masaje y extensión suave de las ATM (2). Para los pacientes con propensión a padecer bruxismo durante el sueño, podría resultar valioso el uso de aparatos protéticos ideados para reducir la severidad de la fibrosis como algunas placas neuromiorrelajantes. Es importante que estos enfoques se instituyan antes del desarrollo del trismus. De presentarse alteraciones clínicas significativas, se puede pensar en utilizar varios enfoques, incluso estabilización de la oclusión, inyección al punto gatillo y otras estrategias para controlar el dolor (2).
Enfermedad de injerto contra huésped
El trasplante de células hematopoyéticas de la médula ósea para tratar neoplasias hematológicas y no hematológicas es cada día más común (24, 25). El rechazo al injerto depende del reconocimiento por parte del hospedero del tejido injertado como ajeno y el rechazo es tanto celular como humoral. En la enfermedad de injerto contra huésped (EICH) ocurre lo contrario, aquí las células inmunocompetentes o sus precursoras trasplantadas reconocen a los antígenos del hospedero como ajenos y reaccionan contra él, ya que el sistema inmunitario del hospedero está disminuido. Es por esta razón que los trasplantes se hacen entre individuos histocompatibles. Debido a que la EICH es mediada por linfocitos T últimamente se están eliminando estas células del donante, pero también se ha observado que al hacerlo hay mayor índice de fracasos del injerto y de recidivas tumorales (4, 25). La lesión puede afectar los tejidos orales y suele imitar a las enfermedades autoinmunes que ocurren naturalmente como el liquen plano oral, forma erosiva, lupus eritematoso, esclerodermia y el Síndrome de Sjögren (25). Existen dos variantes de EICH, aguda y crónica. La EICH aguda puede presentarse tempranamente, incluso dos o tres semanas después del trasplante; sus manifestaciones típicas se observan en la mucosa, piel, hígado, intestinos y sistema inmunitario. En la piel se observa exantema, descamación y se puede observar también ictericia. También ocurre diarrea sanguinolenta e inmunodeficiencia caracterizada por una neumonitis por CMV (4). Los cambios de la EICH crónica pueden reconocerse a partir del día 70 posterior al trasplante. El patrón y los tipos de lesiones observados en la EICH aguda se ven también en la EICH crónica pero más acentuados. Hay estenosis esofágica, involución del timo, agotamiento linfocítico e infecciones oportunistas que pueden llevar a la muerte (3). La EICH crónica puede terminar en la aparición de recidivas tumorales a corto y mediano plazo (25).
Las manifestaciones orales pueden ser hiposialia, mucositis, sensibilidad, dolor e infecciones oportunistas (25). Estas patologías aumentan ante el consumo de especias, alcoholes y sabores artificiales, especialmente el sabor menta en dentífricos y productos de higiene oral ya que generan irritación y conducen a la odinofagia, caquexia, etc. Se recomienda no consumir alcohol, ni condimentos y sustituir la pasta de dientes tradicional por geles fluorados. Estos geles fluorados presentan como ventajas que no tienen abrasivos como algunos dentífricos (carbonato cálcico) ni detergentes (lauryl sulfato de sodio), su concentración de flúor es mayor, y también pueden tener CHX que actúa como antiséptico. Se pueden usar los de aplicación profesional que son de alta dosis y baja frecuencia de aplicación o los de uso domiciliario que son de concentración más baja y mayor frecuencia de aplicación. Se deben preferir los geles fluorados tixotrópicos y de pH neutro que son a base de FNa al 2% y liberan 9040 ppm de ion fluoruro. Los geles a base de flúor fosfato acidulado se desaconsejan ya que su pH varía en valores de 3 o 4. (20, 21, 24).
La biopsia de la mucosa oral o de las glándulas salivales labiales, puede ser conveniente para el establecimiento de un diagnóstico final. La presencia de infiltrado linfocítico (grado I) con necrosis de células epiteliales (grado II) constituye la base para el diagnóstico de la EICH. En casos de resultados de exámenes ambiguos, la biopsia puede mejorar el reconocimiento de la evolución oral. Para el manejo de la EICH oral se deben hacer controles periódicos estrictos a modo de reconocer tumores en su estado inicial (24). Para las lesiones orales menores se puede usar un amplio arsenal de medicamentos como:
El tratamiento odontológico de las lesiones orales dependerá de la elección terapéutica adecuada a cada caso en particular. La terapia sistémica es con prednisona, ciclosporina y otros fármacos inmunosupresores, todos de exclusiva interconsulta con el médico (4).
Necrosis de los tejidos blandos
La necrosis y la infección secundaria de tejidos previamente irradiados son una complicación seria para los pacientes que han recibido radiación para tumores de la cabeza y el cuello (14, 22, 23). Hay cambios crónicos que implican a los huesos y a la mucosa y son el resultado de trastornos hipovasculares, hipocelulares e hipóxicos (2). La necrosis de los tejidos blandos puede afectar cualquier superficie de la mucosa oral, si bien las superficies no queratinizadas parecen enfrentarse a un riesgo moderadamente más alto: pilares amigdalinos anteriores, cresta milohioidea, flanco lingual, etc. Estas lesiones aparecen entre 2 meses a un año después de la terapia oncológica y son asintomáticas, por ello la importancia de los controles odontológicos periódicos. La necrosis de tejidos blandos ocurre debido a la muerte de las células del endotelio, seguida por la migración de fibroblastos que deponen colágeno generando fibrosis (2, 12, 14). El trauma y las lesiones orales pueden generar lesiones necróticas de tejido blando no cicatrizantes, si bien pueden ocurrir lesiones espontáneas. La necrosis del tejido blando comienza como una ulceración superficial que puede aumentar en diámetro y profundidad dejando en ocasiones hueso denudado, puerta de entrada a la infección y posterior ORN (2, 12, 14).
Para su tratamiento es indispensable la instalación previa de una rutina diaria de higiene ayudada por enjuagues de agua oxigenada al 0,5% o soluciones desinfectantes sin alcohol como la clorhexidina (2, 12, 22).
ORN
La primera vez que se reportó necrosis ósea consecutiva a la RT fue en 1926. La ORN significa la muerte del hueso irradiado y clínicamente es la exposición de hueso irradiado que no cura por un período de 3 meses sin que haya tumor recurrente o persistente. El grado de afectación puede ir desde la lesión de sólo tejidos blandos hasta la exposición de hueso necrótico. La patogénesis de la ORN aún no está del todo clara pero parecen intervenir fenómenos como formación de radicales libres, atrofia fibrosa, disfunción endotelial, inflamación, trombosis microvascular, etc. La teoría más aceptada es la de Marx que plantea hipovascularidad, hipocelularidad e hipoxia. Estos desórdenes metabólicos y homeostáticos generan lesiones que no curan (12, 26-29). Hoy en día hay técnicas más avanzadas como la RT de intensidad modulada, o intensity-modulated radiation therapy (IMRT) por sus siglas en ingles. La IMRT es una modalidad avanzada de radioterapia de alta precisión que utiliza aceleradores lineales de rayos X controlados por computadora para administrar dosis de radiación precisas a un tumor maligno o áreas específicas dentro del tumor. La IMRT también hace posible enfocar dosis más altas en regiones dentro del tumor, al tiempo que se minimiza la exposición a la radiación en las estructuras circundantes normales. De esta manera sólo pequeñísimas áreas no tumorales son irradiadas reduciendo con esto el riesgo de complicaciones que conlleva el tratamiento oncológico tradicional. Un ejemplo de IMRT es la tomoterapia helicoidal que es una técnica de RT avanzada guiada por tomografía computada (TC) (27). Las células óseas vulnerables son el endotelio vascular y los osteocitos. El hueso irradiado sufre una necrosis aséptica con pérdida de la regeneración y trombosis de vasos sanguíneos ocurriendo trastornos hipovasculares, hipocelulares e hipóxicos que imposibilitan al hueso recuperarse adecuadamente de las agresiones (2, 13, 22, 26, 27, 31). Los osteoblastos deben ser estimulados para que entren en mitosis, por ejemplo ante una lesión ellos se activan. Si bien se sabe que el hueso es uno de los tejidos más radiorresistentes del cuerpo, cuando surge un traumatismo, como puede ser en una extracción dentaria, el osteoblasto es estimulado a dividirse para reparar el daño, pero debido a la RQT estos están dañados y allí ocurre la muerte celular y la consecuente ORN (12, 26, 27).
Las características clínicas comprenden dolor, pérdida parcial o completa de la sensibilidad, fístulas orales y cutáneas, infecciones, eliminación natural de secuestros y fractura patológica (Figuras 1 y 2) (9, 12, 31). En las Rx extraorales y OPT se pueden ver zonas radiolúcidas de osteólisis, secuestros y fracturas (2). Para apreciar mejor la extensión y características de la lesión se puede recurrir a TC en 3D que combina los planos axial, coronal y sagital en una sola imagen.
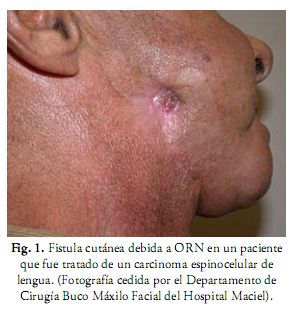
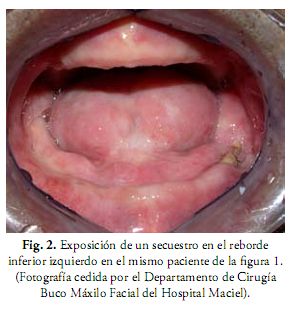
Su frecuencia varía entre el 5-22%, se presenta entre los 2 meses y 5 años después de finalizada la terapia oncológica, con un año como promedio. Se ve más afectada la mandíbula que el maxilar, debido a que el maxilar tiene mayor porcentaje de hueso esponjoso, es menos denso y más vascularizado que la mandíbula. La zona más comúnmente afectada es la de premolares y molares inferiores (12, 26, 27, 29). La evolución es bastante impredecible, puede ocurrir desde una curación espontánea o destrucción amplia por lo que la actitud en su inicio debe ser conservadora. En algunos casos es necesaria la hemimandibulectomía y su posterior reconstrucción (2, 26, 27).
Hay factores de riesgo que inciden en la frecuencia de la ORN: edad, trastornos metabólicos, malnutrición, alcoholismo, tabaquismo, drogadicción, dosis de radiación, localización del tumor, QT conjunta, uso nocturno de prótesis, traumatismos, infecciones, bruxismo, extracciones dentarias post RT, etc. (2, 12, 26, 27).
El hueso afectado por ORN es incapaz de repararse debidamente y puede ocurrir una fractura patológica (14). Los pacientes que han recibido altas dosis de RT en cabeza y cuello (60-70 Gy) corren el riesgo de desarrollar ORN en cualquier momento de su vida, dosis menores a 60 Gy no suelen producir ORN (2, 12, 14). El tratamiento de la ORN se debe centrar en la prevención, la cual comienza con atención oral y odontológica integral antes de la RQT (2, 12). En caso de que ocurra ORN los antibióticos tópicos o antisépticos como la CHX pueden contribuir a la resolución de la herida. Entre los ATB la Tetraciclina es la más indicada en dosis de 250 mg, vía oral 4 veces por día por 10 días combinada o no con 200 mg, vía oral de Metronidazol 3 veces por día para las bacterias anaeróbicas (12). En caso de ser necesaria una secuestrectomía se hará incisión sobre la cresta alveolar y se extirpará todo el hueso necrótico hasta que aparezcan zonas sangrantes (2, 12, 14, 26, 27).
Se recomienda la terapia de oxígeno hiperbárico (OHB) para la prevención y manejo de la ORN, así como para reducir la hiposialia. Se ha informado que la terapia de OHB aumenta la oxigenación del tejido irradiado, promueve la angiogénesis, afianza la repoblación de osteoblastos, mejora la función de los fibroblastos y tiene acción bacteriostática y/o bactericida (12, 23). La terapia de OHB suele indicarse en forma de 20 a 30 sesiones de hora y media, una vez por día, en cámaras con oxígeno al 100% y de 2 a 2,5 atmósferas de presión (2, 9, 23).
Otra alternativa al OHB para evitar la ORN puede ser la estimulación electromagnética de 20 gauss y 5A/cm² por electrodos en la zona a tratar 12 horas por día durante varios meses. El campo electromagnético favorecería la angiogénesis, que es la clave para la curación de la ORN, y promueve la captación de calcio (26). En caso de no ser posible, se puede usar láser infrarrojo de 30 W, 50-60 Hz de frecuencia en 3 sesiones de 20 minutos después de la cirugía (2). También se puede usar ultrasonido el cual ha quedado demostrado que promueve la angiogénesis, estimula los osteoblastos, promueve la proliferación celular, etc. (27). Otra alternativa es el uso de agentes antioxidantes como el tocoferol o vitamina E y la pentoxifilina que actúan sinérgicamente como potentes agentes antifibróticos (27). El uso de esteroides antes o después de la RT reduce la incidencia de la ORN en un 96% al evitar la primera fase de esta que es la etapa inflamatoria (27). El uso de la hormona tiroidea calcitonina, plasma rico en plaquetas y moléculas biológicas como la proteína morfogenética ósea está en estudio en animales (2, 27, 29). El consenso es que se debe preferir la terapia de OHB por sobres las otras terapias, mucho más teniendo en cuenta que con estas alternativas aún no se ha demostrado su efectividad o están en etapa de experimentación.
Osteonecrosis por bifosfonatos
La administración intravenosa de bifosfonatos es muy usual para el tratamiento de la osteoporosis, osteopenia, osteogénesis imperfecta, enfermedad de Paget, aliviar el dolor óseo en pacientes que tienen lesiones osteolíticas, hipercalcemia, metástasis óseas, así como en pacientes con cáncer de mama, pulmón, próstata y enfermedad ósea asociada a neoplasmas. Estos fármacos pueden desencadenar osteonecrosis por bifosfonatos (ONB) en los maxilares aunque éstos no hayan sido irradiados y el primer caso fue descrito en el 2003 por Marx (30). Sin embargo la administración vía oral no es tan riesgosa como la intravenosa, esta última es exclusiva de uso oncológico (26, 29). En la ONB ocurre una potente inhibición de la actividad de los osteoclastos, reducción de la actividad de los osteoblastos, facilitación de su apoptosis (muerte celular programada del osteoclasto) y la neogénesis (regeneración de los tejidos) se ve dificultada (26). También se ha demostrado que el nitrógeno presente en los bifosfonatos afecta la integridad de la mucosa al atacar a los queratinocitos. La incidencia de estos efectos indeseados dependen de la edad del paciente, dosis, duración del tratamiento, medicación concomitante (esteroides), cirugías orales, traumatismos y la vía de administración de los bifosfonatos: zoledronato, pamidronato, (administración intravenosa) ibandronato, (administración intravenosa y oral), alendronato (administración oral), etc. Por lo tanto aquellos pacientes que vayan a ser tratados con bifosfonatos deben previamente ser sometidos al mismo protocolo de atención odontológica que se describe en este trabajo para los pacientes oncológicos. Algunos estudios indican que en caso de que el paciente ya se encuentre en tratamiento se debe consultar al médico tratante sobre la posibilidad de suspender el mismo tres meses antes de la cirugía oral y restablecerlo cuando la herida haya reparado completamente, aunque la suspensión no disminuye el riesgo ya que los bifosfonatos permanecen acumulados y activos durante muchos años, sobre todo en los pacientes tratados por vía intravenosa (26, 29). Para la resección de zonas necróticas actualmente se usa una técnica de cirugía guiada por RM auxiliada con la administración previa de tetraciclina (Doxiciclina 100 mg/2 veces por día) durante 10 días, que al ser expuesta a una fuente de luz de 400-460 nm de longitud de onda con la lámpara de Wood, se vuelve fluorescente y permite ver con exactitud los límites de la zona necrótica, demarcando así los límites exactos de la zona a resecar (Figs. 3 y 4) (26, 30, 31).
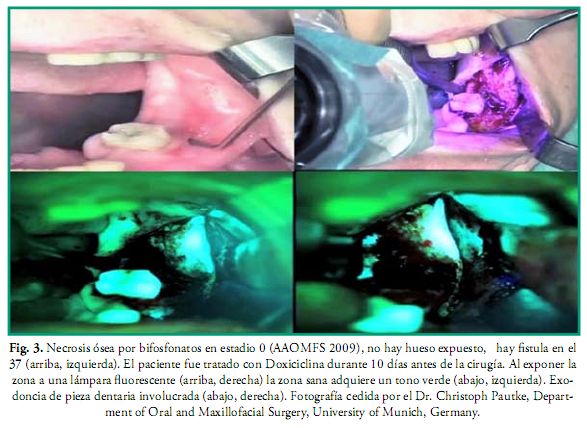
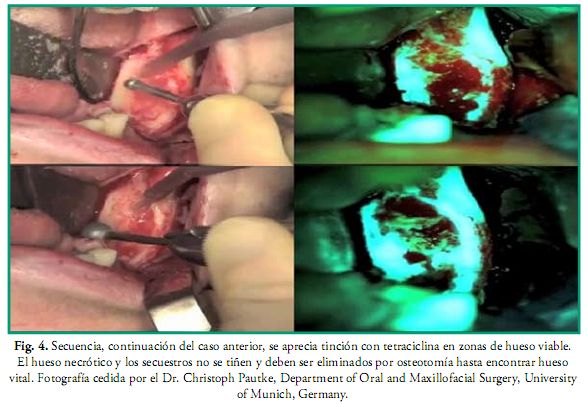
Anomalías del desarrollo craneofacial y dental
Otra complicación tardía son las anomalías del crecimiento y del desarrollo general en los pacientes pediátricos y la emergencia de tumores secundarios en la región de la cabeza y el cuello (2, 28). Tanto la RT como la QT afectan los mecanismos neuroendócrinos que regulan el crecimiento (28). En cuanto al área que le compete al odontólogo una complicación que se presenta con frecuencia en los sobrevivientes de cáncer a largo plazo que recibieron altas dosis de RQT en cabeza y cuello por neoplasias infantiles es el crecimiento y desarrollo craneofacial y dental alterados en un 55%. Dosis tan bajas como 4 Gy afectan el desarrollo dental normal (2, 28). Los trastornos del desarrollo en los niños tratados cuando son menores de 12 años de edad por lo general afectan el tamaño, color, forma y erupción de los dientes, además del desarrollo craneofacial. Sin embargo, no hay tanta diferencia en cuanto al período de erupción comparado con niños sanos; por otra parte, es muy común la impactación de los caninos en el maxilar (2). La formación anormal de los dientes se manifiesta como microdontia que es un cuadro en que el diente tiene un tamaño reducido de la corona, raíces más cortas y cónicas y cierre apical prematuro. Ocasionalmente puede ocurrir la agenesia completa (2, 28). También se pueden ver opacidades blancas, amarillas o marrones (28). Se sospecha que los ameloblastos son más resistentes a la radiación que los odontoblastos y se sabe que el germen dentario sin calcificar es más sensible a la radiación (2). El tamaño acortado de la raíz se relaciona con procesos alveolares reducidos que, a su vez, reducen la dimensión vertical oclusal.
Además, la lesión inducida a los centros de crecimiento maxilar y mandibular puede afectar toda la maduración del complejo craneofacial. La mandíbula es más sensible que el maxilar, debido al tipo de hueso, y el cóndilo mandibular es muy sensible por contener cartílago de crecimiento y de afectarse puede generar alteraciones en una o ambas ATM, desórdenes cráneomandibulares, micrognatismo y retrusión mandibular con clásico “perfil de pájaro” (2, 28).
Dependiendo del tumor y su localización estos cambios pueden ser simétricos, aunque no es lo más común, y el efecto no siempre es obvio clínicamente; por lo tanto es necesario realizar un análisis cefalométrico para determinar la amplitud de la afección. Se han detectado variaciones leves a importantes de los valores cefalométricos normales dependiendo del análisis y los puntos analizados.
El tratamiento de esta complicación es preventivo mediante la participación del equipo multidisciplinario en cuanto al uso de radio y quimioprotectores, ya que incluso en los casos de irradiación total el complejo craneofacial recibe más del 20% de esa radiación (28). El tratamiento luego de la terapia oncológica debe ser correctivo mediante ortodoncia y cirugía. La terapia con hormona de crecimiento puede ser otra opción, pero ésta obviamente escapa a la profesión odontológica.
Tratamiento odontológico posterior a la terapia oncológica
En esta etapa se debe controlar periódicamente la eficacia de las medidas de higiene oral establecidas, controlar el estado de salud oral y la eficacia de las restauraciones realizadas antes de la terapia oncológica. También se deben diagnosticar las lesiones y/o patologías encontradas y realizar su tratamiento lo antes posible. Es de especial importancia la realización de una OPT cada seis meses para detectar una posible ORN (2, 9, 24). Hay que tener en cuenta que los pacientes de cáncer sometidos a QT de altas dosis, RT o a ambos suelen presentar cansancio relacionado ya sea con la enfermedad o con su tratamiento, caquexia, depresión, y todo esto contribuye a que obedezca pobremente a los protocolos de higiene oral ideados para reducir al mínimo el riesgo de complicaciones (2, 9, 24). Por lo tanto se le debe recordar al paciente que la higiene oral sistemática y rutinaria es importante para reducir la incidencia y la severidad de las secuelas orales de la terapia contra el cáncer y motivarlos en su compromiso. Las prótesis dentales pueden utilizarse para retener medicamentos necesarios para la higiene bucal como antibióticos o antimicóticos (2, 9, 24). Todas estas medidas de higiene cobran mayor importancia si hay hiposialia, ya que la placa y el detrito de los alimentos pueden acumularse como resultado de la función salival reducida y podría ser necesario aumentar la frecuencia de la higiene.
Si se ha planeado bien el protocolo de atención odontológica previo a la terapia oncológica no se concibe la realización de exodoncias postradiación, esto sólo es admisible en casos en que el paciente ha sido negligente en su higiene. De ser así, en lo posible se debe evitar hacer exodoncias entre los 2 meses y un año luego de la radiación por el riesgo de ORN (2, 9, 12, 13, 24, 27). En caso de no poder esperar tanto tiempo se puede recurrir al siguiente protocolo:
Otro aspecto a considerar es restablecer la función y la estética oral y facial, en la medida de lo posible, luego de la cirugía y RQT en cabeza y cuello (2, 9, 12, 14). Para ello se puede recurrir a las prótesis orales y/o buco máxilo faciales implantosoportadas con un grado de éxito variable que depende de muchos factores, entre ellos el más importante es la dosis de radiación. Para obtener un mayor índice de éxito se deben seguir las siguientes sugerencias:
Reconstrucción quirúrgica de defectos y prótesis buco máxilo facial
En los casos de neoplasias muy severas, o de ORN, en la región buco máxilo facial quedan defectos quirúrgicos extensos tanto en tejidos duros como en tejidos blandos que deben, en lo posible, reconstruirse para ofrecer funcionalidad y continuidad estética (Fig. 5).
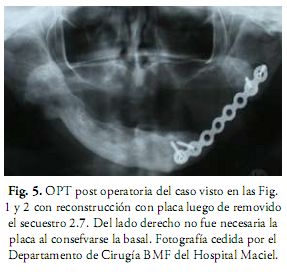
Es muy común ver pacientes que han sido sometidos a cirugías muy extensas como la hemimandibulectomía con o sin implicación articular que deben ser solucionadas con injertos de cresta ilíaca, costilla, injerto vascularizado de peroné o la técnica más indicada para cada caso (2). De necesitarse la cirugía, se recomienda el mismo protocolo de terapia de OHB usado para prevenir la ORN. Si se realiza la reconstrucción inmediata (de preferencia), no se hace OHB. Esta reconstrucción debe ser realizada lo más inmediatamente posible, lo ideal es que se realice al mismo tiempo que la cirugía oncológica. O sea, al mismo tiempo que se crea el defecto se debe realizar la reconstrucción y de esta manera evitar la distorsión de los tejidos remanentes (12, 14).
Conclusiones
A lo largo de este artículo hemos visto como el tratamiento oncológico intensivo produce un gran número de complicaciones y/o secuelas en la mucosa oral, muchas de ellas muy graves e incluso mortales. La mucosa oral es muy sensible a ellas por su alta tasa de renovación, la microflora diversa, los traumatismos y otros factores ya descritos. Para evitar o disminuir la incidencia de estas complicaciones el odontólogo debe ser una pieza clave en el equipo multidisciplinario y posicionarse en la primera línea de prevención y defensa. Su participación debe establecerse antes, durante y después del tratamiento oncológico propiamente dicho, debe existir una correcta interrelación y comunicación fluida entre todos los integrantes del equipo oncológico multidisciplinario para de esta manera buscar el mejor resultado posible del tratamiento oncológico, lo que repercutirá favorablemente en la cantidad y calidad de la sobrevida del paciente.
Agradecimientos
A los Dres. José Crestanello, Claudio Fernández y Augusto Robano del Departamento de Cirugía BMF del Hospital Maciel y al Dr. Christoph Pautke (M.D, D.D.S. Ph.D.) Director Médico Asistente del Dept. de Cirugía BMF l de la Universidad de Munich por la cesión de fotos.
Referencias
1.Lanza Echeveste, D. G.: Tratamiento odontológico integral del paciente oncológico. Parte 1. Odontoestomatología. Mayo 2011; XIII, (17): 14-25.
2.Gay Escoda C & Berini Aytés L. Cirugía bucal. 1ª Edición. España. Ediciones Ergon S.A. 1999. Capítulo 24.
3.Garfunkel AA. Oral mucositis. The search for a solution. N. Eng. J. Med. 2004. 351 (25), 2649-2651.
4.Kumar V, Abbas AK, Fausto N. Robbins & Cotran Patología estructural y funcional. 7ªed. Elsevier España. 2005.
5.Mealey BL, Semba SE. & Hallmon WW. Dentistry and the cancer patient: Part 1-Oral manifestations and complications of chemotherapy. Compend. 1994, 15 (10): 1252-1261.
6.Pasqualotto AC, Rosa DD, Medeiros LR et al. Candidaemia and cancer: patients are not all the same. BMC Infect Dis; 2006, 6: 50.
7.Akintoye SO, Brennan MT, Graber CJ et al. A retrospective investigation of advanced periodontal disease as a risk factor for septicaemia in hematopoietic stem cell and bone marrow transplant recipients. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod. 2002, 94 (5): 581-588.
8.Pumarola A, Rodríguez-Torres A, García-Rodríguez JA et al. Microbiología y parasitología médica. 2ª Edición. España. Masson, S.A. 1998.
9.De Vita Jr VT, Hellman S, Rosenberg SA. Cancer. Principles & practice of oncology. 5ed. Philadelphia: Lippincott-Raven, 1997.
10. Bensadoun RJ, Patton LL, Lalla RV et al. Oropharyngeal candidiasis in head and neck cancer patients treated with radiation: update 2011. Support Care Cancer. 2011, 19(6): 737-44.
11. Garg A & Guez G. Head and neck cancer, dental implants, and dental oncology. Dent. Update. 2011, 22(1): 1-8.
12.Yang C, Gong W, Lu J et al. Antifungal drug susceptibility of oral Candida albicans isolates may be associated with apoptotic responses to Amphotericin B. J. Oral Pathol. & Med.; 2010, 39(2): 182-7.
13.Langdon JD & Henk JM. Malignant tumours of the mouth, jaws et salivary glands. 2nd Edition. England. Edward Arnold Editors. 1995.
14.Regezi JA, Sciubba JJ. Patología bucal. Correlaciones clinicopatológicas. 3ª Edición. México. Mc Graw-Hill Interamericana. 2006.
15. Barclay SC, Turani D. Current practice in dental oncology in the U.K. Dent. Update. 2010, 37(8): 555-561.
16.Corvo R, Amichetti M, Ascarelli A. et al: Effects of fluconazole in the prophylaxis of oropharyngeal candidiasis in patients undergoing radiotherapy for head and neck tumour: results from a double-blind placebo-controlled trial. Eur. J. Cancer Care. 2008, 17(3): 270-7.
17.Parikh PM & Davison SP. Herpes zoster after reconstruction for head and neck cancer. Plast. Reconstr. Surg. 2008, 122(6): 211e-213e.
18.Epstein JB, Gorsky M, Hancock P, et al.: The prevalence of herpes simplex virus shedding and infection in the oral cavity of seropositive patients undergoing head and neck radiation therapy. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod. 2002, 94 (6): 712-716.
19.Lugliè PF, Mura G, Mura A, et al.: Prevenzione delle paradontopatie e delle stomatomucositi in corso di chemoterapia antineoplastica. Studio clinico. Minerva Stomatol. 2002, 51 (6): 231-239.
20.Goodman & Gilman: Las bases farmacológicas de la terapéutica. 10ed. México: Mc Graw-Hill Interamericana. 2003. Volumen II, Sección IX. Capítulo 52, p 1371-1387.
21.Abdelsayed RA, Sumner T, Allen CM. et al. Oral precancerous and malignant lesions associated with graft-versus-host disease: Report of 2 cases. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod. 2002, 93 (1): 75-80.
22.Bonan PR, Lopes MA, Pires FR. et al. Dental management of low socioeconomic level patients before radiotherapy of the head and neck with special emphasis on the prevention of osteorradionecrosis. Braz. Dent. J. 2006, 17(4): 336-42.
23.Cankar K, Finderle Z, Jan J. The effect of hyperbaric oxygenation on postradiation xerostomia and saliva in patients with head and neck tumours. Caries Res. 2011, 45(2): 136-41.
24.Sennhenn-Kirchner S, Freund F, Grundmann S et al. Dental therapy before and after radiotherapy--an evaluation on patients with head and neck malignancies. Clin. Oral Investig. 2009, 13(2): 157-64.
25.Flowers M.E, Inamoto Y, Carpenter PA.et al: Comparative analysis of risk factors for acute graft-versus-host disease and for chronic graft-versus-host disease according to National Institutes of Health consensus criteria. Blood. 2011, 117(11): 3214-9.
26.Madrid C, Bouferrache K, Abarca M. et al. Bisphosponate-related osteonecrosis of the jaws: How to manage cancer patients. Oral Oncol. 2010, 46(6): 468-470.
27.Madrid C, Bouferrache K, Abarca, M. et al.: Osteoradionecrosis: an update. Oral Oncol. 2010, 46(6): 471-474.
28.Sabater Recolons MM, Rodríguez de Rivera Campillo ME, López López J & Chimenos Küstner E. Manifestaciones orales secundarias al tratamiento oncológico. Pautas de actuación odontológica. Av. Odontoestomatol. 2006, 22(6): 335-342.
29.Ruggiero SL, Dodson TB, Assael LA et al. American Association of Oral and Maxillofacial Surgeons Position Paper on Bisphosphonate-Related Osteonecrosis of the Jaws—2009 Update. J. Oral Maxillofac. Surg. 2009 Suppl. 1, 67:2-12.
30.Pautke C, Bauer F, Tischer T et al. Fluorescence-guided bone resection in bisphosphonate-associated osteonecrosis of the jaws. J. Oral Maxillofac. Surg. 2009, 67:471-476.
31.Pautke C, Bauer F, Bissinger O et al. Tetracycline bone fluorescence: A valuable marker for osteonecrosis characterization and therapy. J. Oral Maxillofac. Surg. 2010, 68:125-129.
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons