Osteonecrosis de los maxilares inducida por bifosfonatos; lo que el odontólogo debe saber hoy: pautas y protocolos
Bisphosphonate related Osteonecrosis of the jaws: what the dentist must know todays: guidelines and protocols
Osteonecrosis de los maxilares inducida por bifosfonatos; lo que el odontólogo debe saber hoy: pautas y protocolos
Bisphosphonate related Osteonecrosis of the jaws: what the dentist must know todays: guidelines and protocols
* Asistente Cátedra Prótesis Fija y Trastornos Témporo Mandibulares Especialista en Prostodoncia Integrante del Departamento de Implantología Oral y Maxilofacial - Facultad de Odontología Udelar.
** Integrante del Departamento de Implantología Oral y Maxilofacial - Facultad de Odontología Udelar.
Resumen
Visto el incremento en el consumo de los bifosfonatos, siendo uno de los 19 medicamentos más prescriptos a nivel mundial, utilizados para el tratamiento de diversas patologías óseas, se reporta en el año 2003 la aparición de una lesión asociada al consumo de estos fármacos, denominada osteonecrosis de los maxilares inducida por bifosfonatos (ONMB). (1)
El objetivo de éste trabajo es informar a la profesión acerca del consumo de éstas drogas, sus acciones y efectos en el área buco-maxilar, de forma de ampliar las medidas preventivas y los posibles tratamientos que disponemos en la actualidad.
La profesión dental está ciertamente en una posición de privilegio, para prevenir y diagnosticar precozmente esta alteración. Nos corresponde dar información sobre este tema y estar familiarizados con las recomendaciones de tratamiento.
Hemos realizado una revisión bibliográfica, de los protocolos más adecuados aplicables en la consulta, tomando como base los datos de la historia clínica, las indicaciones terapéuticas de estos fármacos, de manera que podamos evaluar los posibles daños asociados a nuestros tratamientos.
Palabras claves: bifosfonatos, osteonecrosis, prevención.
Key words: bisphosphonates, osteonecrosis, prevention.
Abstract
Having seen an increase on the use of bisphosphonates, being one of the top 19 prescribed medications Worldwide, used for the treatment of several bone pathologies, the occurrence of a new injury called Bisphosphonate Related Osteonecrosis of the Jaw (BRONJ) was reported in the year 2003. (1)
The main goal of this work is to inform colleagues on the use of these drugs, their actions and effects, to increase the preventive measures and the potential treatments we have today.
The dental profession certainly is in an advantageous position to prevent and be the precursor diagnosing this alteration. We must to give information on this subject and being familiar with the treatment recommendations are matters of our interest.
We have carried out a bibliographical revision, so as to search for the most acceptable protocols applicable in the practice, taking the outstanding data on the clinical history as a starting point, the therapeutic indications of this drugs, allowing us to evaluate the potential damage we could cause.
Introducción
Los bifosfonatos o bisfosfonatos (BFs), antes denominados difosfonatos, fueron sintetizados en el siglo XIX por químicos alemanes, los cuales buscaban prevenir el depósito industrial de carbonato de calcio en sus chimeneas. Se usaron en la industria química desde principios de siglo XX, como agente anticorrosivo y antisarro, por la capacidad de inhibir la formación de depósitos de calcio en varias superficies. (1)
En 1960 fue introducido el primer bifosfonato en el mercado con fines terapéuticos. Se observó una gran afinidad de la droga con el tejido óseo, inhibiendo la conversión de fosfato de calcio amorfo a hidroxiapatita, lo cual reducía la velocidad de disolución de los cristales óseos.
En 1990 se introducen en el mercado, como una alternativa a las terapias de reemplazo de hormonas para el tratamiento de la osteoporosis posmenopáusica y/o ciertas patologías osteolíticas.(2)
En la actualidad, se indican para el tratamiento de la osteoporosis en las mujeres posmenopáusicas; como forma de aumentar la masa ósea en hombres con osteoporosis y en osteoporosis inducida por glucocorticoides. También son administrados para el tratamiento de la enfermedad de Paget, en la hipercalcemia tumoral maligna, en metástasis óseas y en lesiones osteolíticas del mieloma múltiple. (3, 4)
Más recientemente (2003), se establece una correlación entre el consumo de la droga y la aparición de exposiciones óseas en los maxilares, lesión denominada osteonecrosis de los maxilares inducida por bifosfonatos (ONMB). (3, 4) Esta lesión puede manifestarse espontáneamente o ser desencadenada por procedimientos odontológicos. Su incidencia se incrementa ante la presencia de diferentes factores de riesgo, dependiendo también de su vía de administración.
Datos epidemiológicos muestran el incremento significativo del consumo de estos fármacos y en lo que a la odontología refiere, podría crear un aumento importante de casos clínicos de ONMB en los próximos años. (5) No se dispone de un tratamiento eficaz para ONMB, por lo que se debe poner especial atención en la aplicación de medidas preventivas.
Tejido óseo, fisiología
El tejido óseo es un tejido conectivo formado por una matriz extracelular mineralizada y células especializadas; osteoblastos, osteocitos y osteoclastos. El componente orgánico más abundante en la matriz es el colágeno tipo I, que supone el 90%, mientras que el otro 10 % está integrado por proteínas no estructurales como osteocalcina, osteonectina, sialoproteinas, factores de crecimiento y proteínas séricas. El componente inorgánico fundamental, son los cristales de hidroxiapatita, cuya unión a las fibras de colágeno confiere al hueso sus características principales de rigidez, flexibilidad y resistencia. Está sometido a un incesante fenómeno de renovación llamado remodelado, que involucra el proceso de reabsorción y formación dentro de una misma área, generando un recambio continuo del tejido. (Fig. 1)
Consta de 4 fases sucesivas: Activación-Resorción-Inserción-Formación. Se lleva a cabo por múltiples unidades celulares funcionales, llamadas unidades básicas de remodelado (UBR) que se componen de un frente de osteoclastos, seguido de un grupo de osteoblastos, un aporte vascular, nervioso y tejido conectivo. Todas ellas con un componente enzimático de autorregulación y regulación externa (hormonal). Tienen una vida media de 6 a 9 meses, estando activas entre 1.5 y 2 millones de ellas en forma simultánea, no coincidentes en su fase. (6-9). La tasa de remodelado es aquella que se define como el tiempo requerido por el hueso nuevo para reparar o reemplazar el hueso preexistente. Se estima que en un año involucra del 3-4% del hueso cortical y entre el 25-30% del trabecular. (10, 11) Este fenómeno de homeostasis ósea y mineral puede ser modificado por la acción de diversos fármacos, en particular por los BFs.
Bifosfonatos
CLASIFICACIÓN
-nitrogenados o aminados (alendronato, risedronato, ibandronato, pamidronato, ácido zoledrónico).
-no nitrogenados o no aminados (etidronato, clodronato, tiludronato). (Tabla 1)
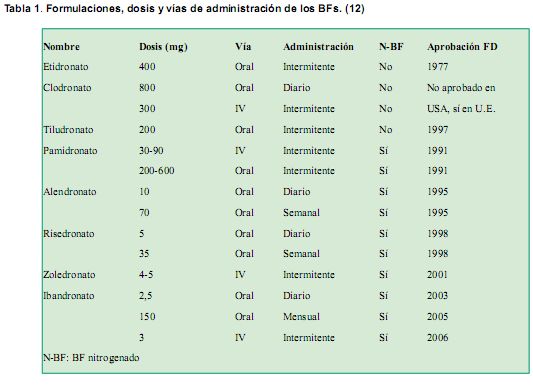
Se utilizaron en primer lugar los BFs no nitrogenados, actualmente se utilizan en la práctica clínica los BFs nitrogenados, mucho más potentes que los anteriores. También se clasifican según el procedimiento de síntesis y sus propiedades en BFs de primera, segunda y tercera generación. (Tabla 2)
Los pacientes que consumen BFs, a los cuales nos enfrentamos con mayor frecuencia en la consulta odontológica, son aquellas mujeres con osteoporosis posmenopáusica. Es importante conocer, que un porcentaje importante de hombres también puede padecer ésta patología (30 %) y consumir los BFs. (14) La osteoporosis es una enfermedad esquelética, crónica y progresiva, caracterizada por una resistencia ósea disminuida (en densidad y/o calidad), que predispone a un riesgo aumentado de fractura. (3, 4).
Es prevenible y tratable. El tratamiento contribuye a mejorar la calidad de vida de los pacientes, minimizando la morbi-mortalidad asociada a las fracturas. En el año 2000 se estimaba que había 9 millones de fracturas osteoporóticas. (15).
Los fármacos antirreabsortivos utilizados para el tratamiento de la osteoporosis y otras patologías osteolíticas, consiguen incrementar la resistencia del hueso, preservan su microarquitectura e inducen un balance positivo en la unidad de remodelado.
Se consideran fármacos antirreabsortivos: bifosfonatos, raloxifeno, terapia hormonal sustitutiva (estrógenos), calcitonina, hormona paratiroidea, sales de estroncio, calcio y vitamina D.
Los BFs son los fármacos mejor estudiados para la prevención de la pérdida ósea y la reducción de las fracturas. La vía de administración más utilizada para la osteoporosis, es la vía oral (V/O) y las dosis son muy inferiores a las indicadas en pacientes con otras afecciones óseas, como ser osteoporosis inducida por medicamentos, enfermedad de Paget, en tumores óseos malignos, metástasis óseas y en lesiones osteolíticas del mieloma múltiple, en las cuales la administración de los BFs es intravenosa (I/V). (Ver tabla 1). Han surgido formulaciones I/V con régimen anual, para el tratamiento de osteoporosis.
Provocan un aumento de la densidad mineral ósea. (DMO)
Es de importancia para su prescripción el estudio de la DMO, realizando una correcta evaluación riesgo-beneficio del uso de éste medicamento. La densitometría es una técnica no invasiva, de fácil realización, que permite la cuantificación de la DMO. (16-18)
Los BFs son análogos estables del pirofosfato, tienen efectos sobre los osteoclastos o sus precursores.
Uno de sus mecanismos de acción, es actuar sobre el osteoclasto maduro. Una vez que es depositado en la matriz es fagocitado por el mismo, produciendo un incremento de la muerte celular y en consecuencia un descenso en la reabsorción ósea, alterando la tasa de remodelado óseo.
El pirofosfato inorgánico, que en su constitución presenta un átomo de oxígeno unido a dos átomos de fósforo (P-O-P), está presente en el plasma y en el líquido extracelular. Su función es inhibir la deposición de minerales en la matriz orgánica de los tejidos.
En el hueso, el osteoblasto produce la fosfatasa alcalina; enzima que pertenece a la familia de las pirofosfatasas, cuya función es degradar el pirofosfato inorgánico permitiendo de ésta manera la deposición de minerales en la matriz colágena del hueso.
Los BFs, a diferencia del pirofosfato, poseen un átomo de carbono en lugar del átomo de oxígeno (P-C-P), lo que les da una gran resistencia a ser degradados por la fosfatasa alcalina y a su vez potencia su acción antirreabsortiva. Se depositan en la matriz ósea donde permanecen durante muchos años.
Los maxilares son más susceptibles, debido a que la tasa de recambio del hueso alveolar es 10 veces mayor que en los huesos largos. Además en la mandíbula, la tasa de recambio en el proceso alveolar es 2 veces mayor que en la zona del conducto mandibular y 3 a 5 veces mayor que en la basal. (2) Estudios indican que en la mandíbula la tasa de remodelado puede alcanzar el 40 % cada año, lo que lo hace más sensible a su acción. (11)
Entre las propiedades biológicas y los mecanismos de acción de los BFs se encuentran los siguientes: 1) inhibición de la reabsorción ósea osteoclástica; 2) inducción de los osteoblastos a secretar un inhibidor de la secreción ósea mediada por osteoclastos; 3) inducción de apoptosis en los osteoclastos (“muerte celular programada”); 4) prevención de la apoptosis de osteocitos y células de la línea osteoblástica, evitando la liberación del contenido celular y sus efectos y 5) efecto antiangiogénico que reduce el factor de crecimiento endotelial (EGF), lo que puede ser insuficiente en situaciones de curación y/o infección.
Además, los BFs presentan propiedades antitumorales: inhibición de la proliferación e invasión de las células tumorales; inhibición de la adhesión de las células tumorales al tejido óseo; inducción de apoptosis en varias líneas celulares malignas e inhibición de la actividad proteolítica de las metaloproteinasas de la matriz. (19-21).
Asociada a éstos, se describe la alteración de los macrófagos y de la cicatrización de la mucosa oral por afectación de los fibroblastos y los queratinocitos.
A modo de resumen podemos decir que los BFs inhiben la actividad osteoclástica dando lugar a una disminución de la reabsorción y la remodelación del hueso.
Ambos maxilares son los huesos del organismo más expuestos a las agresiones externas, teniendo la mandíbula una diferente configuración arquitectónica. (22)
La combinación de estas acciones y la infección del hueso maxilar, una vez expuesto al medio externo, por las bacterias de la cavidad bucal, destacándose el actinomices, pueden dar como resultado la ONMB. (19, 23, 24, 27)
Osteonecrosis de los maxilares inducida por bifosfonatos (ONMB)
Son numerosos los profesionales expertos y las asociaciones multidisciplinarias que han proporcionado una descripción clínica de ésta patología:
La American Society for Bone and Mineral Research (ASBMR), define a la ONMB como un área de hueso expuesto en la región buco-maxilar que persiste durante más de 8 semanas después de su identificación, en un paciente que está o estuvo recibiendo tratamiento con BFs y en ausencia de radiación previa en la región craneofacial. (25)
La American Association of Oral and Maxilofacial Surgeons (AAOMS), utilizó criterios similares para su definición:
1) tratamiento actual o previo con BFs;
2) presencia de hueso necrótico expuesto en la región maxilofacial que persiste más de 8 semanas; y
3) ausencia de radioterapia de los maxilares. (26)
La ONMB presenta una serie de manifestaciones que la caracteriza, siendo las pruebas complementarias una ayuda, pero no esenciales para el diagnóstico inicial.
Se clasifica la progresión de la lesión, en 4 estadíos: (Tabla 3)

La exposición ósea suele tener un diámetro de 0,5 a 2 cm, pudiendo ocurrir en varios sitios simultáneamente. (Figura 2). Con el paso del tiempo, las lesiones pueden incrementar su tamaño, fundamentalmente con los BFs por vía parenteral, pudiendo producir fistulizaciones a piel, comunicaciones a senos maxilares e incluso originar fracturas mandibulares. Puede provocar parestesia en el territorio del nervio dentario inferior. (20, 29).
Es una lesión crónica de lenta progresión, sin tendencia a la curación espontánea.
LOCALIZACIÓN
Ésta es más frecuente en la mandíbula que en el maxilar superior, prevaleciendo en áreas posteriores. (figura 3) La lesión suele desencadenarse posterior a un procedimiento odontológico invasivo, proceso infeccioso, o lesión mucosa que genere una exposición ósea. Siendo un 1% su porcentaje promedio de aparición espontánea. (Ver gráficas 1, 2, 3) La presencia de la lesión en ambos maxilares simultáneamente es aún más infrecuente. (14)
EPIDEMIOLOGÍA
En 2003 fueron publicadas las primeras referencias de ONMB, con la sospecha de la influencia de los BFs I/V en su etiología, anuncianldose una creciente epidemia de nuevos casos, dada la gran cantidad de pacientes que estaban recibiendo en esos momentos diversos tipos de BFs. (3, 4)
En setiembre de 2004 Novartis, fabricante de dos de los más importantes BFs: el pamidronato (Aredia ®) y el ácido zoledrónico (Zometa ®) realiza las primeras advertencias respecto a la posibilidad de que éstos fármacos estén induciendo ONMB.
En Uruguay encontramos en la descripción de los efectos adversos, el reconocimiento como posibles generadores de ONMB, en algunos de los prospectos de los diferentes BFs.
El número de casos publicados se ha disparado en los últimos años.
En el año 2005 se realizaron 200 millones de prescripciones a nivel mundial, de las cuales 39 millones fueron para consumo por vía oral.
Durante los últimos 7 años fueron reportados más de 4000 casos de ONMB. Sabiendo que no todos los casos son informados.
Los porcentajes más elevados, se vieron en pacientes que reciben los BFs I/V combinados con corticoides, con valores de hasta 18%. (5)
Por vía oral se encuentran datos de ONMB espontánea de 0.01 a 0.04%, aumentando el número de ellos en casos de realizar una extracción dental, llegando a un estimado entre 0.09% a 0.34%. (Gráficas 1-2-3)
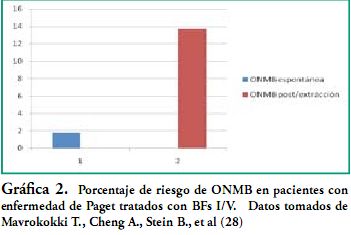
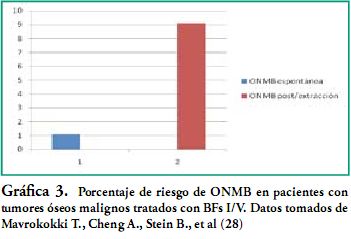
La principal razón de la diferencia de porcentajes de ONMB, es el hecho de su baja biodisponibilidad para los administrados V/O menor de 1%, comparado con un 50% para los administrados por vía parenteral.
Se estima que luego de un período de 3 años (30 a 52 meses), el paciente entra en una zona de riesgo debido al depósito sucesivo incremental a nivel óseo, estableciéndose un tiempo medio para el Zolendronato menor de 12 meses, para el Pamidronato de 14 meses y para el Alendronato de 24 meses. (26, 29, 30).
Es de importancia la vía de administración, destacándose la vía parenteral en el aumento del riesgo.
Otros factores a tener en cuenta son, la potencia relativa del fármaco y la dosis consumida.
A ello se le suman ciertos factores de comorbilidad, destacándose entre ellos: edad mayor de 60 años, sexo femenino, consumo de corticoides, inmunosupresión, quimioterapia, anemia, diabetes, tabaquismo, alcohol, obesidad, infección oral activa y pobre higiene bucal. (26, 28, 29, 31)
Es probable que en nuestro país se den valores epidemiológicos similares, siendo relevante obtener datos a nivel nacional, para poder interpretarlos e implementar medidas preventivas. A tales efectos, se creó en la Universidad de la República, un Nodo de Farmacovigilancia, al cual se puede acceder para reportar los casos diagnosticados. (Figura 4)

Prevención y tratamiento de onmb
Existe consenso en la comunidad científica internacional en el valor de las medidas preventivas, siendo éstas hasta el momento el mejor recurso disponible en casos de pacientes que son tratados con BFs y requieren tratamientos quirúrgicos. (30, 32)
Así como también proponer a los laboratorios farmacéuticos que incluyan en todos sus prospectos como posible reacción adversa la aparición de ONMB.
Cuando en la historia clínica detectamos que el paciente consume BFs debemos indagar acerca de: duración del consumo, indicación, dosis, vías de administración, forma de ingesta y evaluar los posibles factores de comorbilidad.
No confundir pacientes que dicen tomar “calcio”, con aquellos que realmente consumen BFs. En nuestro medio también se les suele llamar “fijadores de calcio”.
Protocolos de tratamiento para los pacientes que consumen los BFs por V/O.
Grupo A: pacientes que van a comenzar el tratamiento con BFs.
- Estudio de imágenes, como ortopantomografías y/o radiografías periapicales.
-Enseñanza de medidas de higiene rigurosa.
-Instalación de medidas preventivas acordes al paciente.
- Tratar las infecciones bucales activas.
- Extraer piezas retenidas que estén en posición submucosa, piezas no restaurables y las que periodontalmente están muy comprometidas.
- Realizar remodelado de rebordes filosos, y torus prominentes, para evitar ulceraciones mucosas.
- Colocación de Implantes dentales.
- Ortodoncia: más allá de ser tratamientos a largo plazo y de no estar netamente comprobado, es de suponer, que el movimiento dentario puede verse enlentecido o detenido.
- Realizar endodoncias y restauraciones de piezas con caries activas.
- Exploración y tratamiento periodontal y peri implantar.
- Identificar posibles factores irritativos (ej.: protéticos) que puedan provocar ulceraciones mucosas con exposición ósea, realizando la exploración minuciosa de los rebordes.
- Dar información exhaustiva al paciente.
- Controles odontológicos periódicos (cada 6 meses). (14, 30, 32)
Grupo B: pacientes que consumen BFs y no presentan ONMB.
Si el paciente consume los BFs hace menos de 3 años, el tratamiento es igual al grupo A, evaluando la presencia o no de factores de comorbilidad. (31)
Si el paciente consume los BFs hace más de 3 años, se recomienda evitar todo tipo de maniobras quirúrgicas electivas.
Ante la presencia de un foco infeccioso periapical, el tratamiento endodóntico debe ser la primera elección, se debe minimizar el trauma en el margen gingival al aislar al paciente y procurar un mínimo trauma periapical y periodontal, con cobertura antibiótica simultánea.
Control minucioso de las prótesis removibles existentes y/o rebasados con material blando de base, con la finalidad de evitar úlceras. (2)
En el caso de tener que realizar tratamientos invasivos, como una extracción dental, es muy importante hacer hincapié en la asepsia, utilizar los instrumentos adecuados, realizar una minuciosa exploración visual y táctil del alvéolo post extracción, constatando la formación del coágulo para minimizar la probabilidad de infección, evaluar la posibilidad de protección del área intervenida y no dejar espículas óseas que puedan llegar a provocar úlceras por trauma a futuro.
La posibilidad de aparición de ONMB para procedimientos de colocación de implantes dentales, es poco probable. No se observan variaciones en los porcentajes de oseointegración. Se recomienda realizar una técnica quirúrgica atraumática, con mínimo decolado del periostio y evitar la cicatrización por segunda intención. (33)
Se recomienda no realizar injertos óseos.
Se reportan casos aislados de aparición de la lesión.
Algunos autores recomiendan el uso de anestésicos sin vasoconstrictor. (29, 34)
Siempre administrar antibióticos sistémicos previos y posteriores al tratamiento. De elección amoxicilina/clavulánico 875/125 mg cada 8 horas, desde 2 días antes hasta 10 días después.
En casos de alergia se puede sustituir por clindamicina 300 mg cada 6 horas. Otros autores recomiendan levofloxacino 500 mg cada 24 horas, metronidazol 500 mg cada 8 horas, doxiciclina 100 mg cada 24 horas o azitromicina 500 mg cada 24 horas. (26, 30, 34, 35)
Enjuagues con colutorio de clorhexidina (CHX) al 0,12% tres veces al día durante 15 días, comenzando los mismos 48 hs antes de la intervención y programar revisiones semanales, hasta los 30-45 días para comprobar la reepitelización completa del lecho quirúrgico. (26, 30)
La Sociedad Española de cirugía oral y maxilofacial (SECOM) recomienda suspender la ingesta del fármaco 3 meses antes, hasta 3 meses después del tratamiento, con el aval del médico tratante. (30)
Estos tiempos se basan en datos de un análisis sanguíneo en el cual se investiga un marcador bioquímico, como es la concentración del telopéptido carboxiterminal del colágeno tipo I (CTX). Este telopéptido es “cortado” de la molécula de colágeno por los osteoclastos durante la reabsorción ósea, de modo que su nivel en sangre sería proporcional al grado de actividad reabsortiva osteoclástica (ver fisiología del tejido óseo). De lo mencionado anteriormente, surge que sería un método de diagnóstico para analizar el grado de remodelación ósea. El valor medio normal de CTX ronda los 400 pg/ml, habiendo variaciones interindividuo de importancia de acuerdo a la existencia o no de factores asociados (edad, corticoides, osteoporosis, sexo, etc.).
Viéndose, una reducción de los valores de un 53% luego de la administración de BFs por un período de 3 meses. (36)
Si los niveles de CTX son iguales o superiores a 150 pg/ml, se asume que el riesgo de necrosis en relación con procedimientos quirúrgicos es mínimo. Sin embargo, si la cifra de CTX es inferior a 150 pg /ml es aconsejable diferir la cirugía y contactar al médico que ha indicado el uso de BFs para valorar la posibilidad de “tomar unas vacaciones del fármaco”.
3 meses después de suspender el uso de BFs se puede repetir la determinación de CTX. Si los valores se restablecieron se podrá intervenir con menor riesgo.
De no ser así, se podrá mantener “las vacaciones del fármaco y realizar nuevas evaluaciones.
Las vacaciones del fármaco no condicen con la fisiopatología del depósito del fármaco en la matriz ósea, solo tendría valor en los tejidos blandos.
El CTX no es un predictor de ONMB, pero sí identifica una “zona de riesgo”. (26, 36-39)
Disponemos en nuestro medio, de laboratorios que realizan estos estudios, enviando las muestras al exterior.
Previo a un tratamiento invasivo, debemos informar a nuestros pacientes de la posibilidad de aparición de la lesión (ONMB), la gravedad de la misma y que ésta puede empeorar.
No disminuye necesariamente el riesgo de la lesión, incluso en los casos que el médico que prescribió los BFs decida suspenderlo y/o sustituirlo por otro.
No obstante, para todas las terapias que involucren al tejido óseo, se debe incluir un consentimiento informado por escrito que deberá ser firmado por el paciente previamente, especificando el riesgo de aparición de ONMB.(40-42)
Grupo C: pacientes que consumen BFs y presentan ONMB.
Si un paciente que consume BFs presenta una exposición a la cavidad oral de hueso necrótico, se debe explicar la naturaleza de su cuadro e informar que es probable que la situación se agrave. Debemos corroborar el diagnóstico, basándonos en la historia farmacológica y la clínica. Son necesarios los estudios complementarios como radiografías periapicales, panorámicas o tomografías computadas, los podemos utilizar para determinar la extensión lesional. Se pueden ver aumentos en la radiodensidad ósea, hueso denso, intercalado y “moteado”, deposición de hueso subperióstico, cambios escleróticos en el conducto mandibular, ensanchamiento de la lámina dura y disminución del espacio del ligamento periodontal. (2, 43)
La biopsia no está indicada, únicamente se realiza el estudio histopatológico del hueso expuesto en el caso que el tratamiento de elección sea quirúrgico, dando como resultado una osteomielitis crónica con zonas de secuestro y la frecuente infección por actinomices. Cabe resaltar que la vida media de ésta medicación excede los 10 años, por lo que el cese del consumo no nos asegura el éxito. Si la condición sistémica permite la suspensión de la administración de los BFs, esto tiene un efecto positivo sobre los tejidos blandos.
Tratamiento
Estadio I - se recomienda enjuagues con solución de clorhexidina al 0,12 % o al 0.2 %, 3 veces por día, o topicaciones con gel de clorhexidina a las que podemos ayudar con placas de protección, combinada o no con ATB.
Estadio II - Además de los cuidados locales con clorhexidina gel o solución, se agrega el uso de AINES y antibioterapia para evitar la infección, que es una de las causas de progresión de la lesión.
Amoxicilina/clavulánico 875/125 mg cada 8 horas, por un período de 15 días.
En casos de alergia clindamicina 300 mg cada 6 horas, levofloxacino 500 mg cada 24 horas, metronidazol 500 mg cada 8 horas, doxiciclina 100 mg cada 24 horas ó azitromicina 500 mg cada 24 horas. Estas pautas son variables y según la evolución de la lesión, se describen combinaciones de antibióticos.
Si se sospecha de la posibilidad de una micosis, se dispone de la nistatina, miconazol o del fluconazol. (26, 30, 34, 35)
Estadio III - Se recomienda utilizar antibioterápicos de forma I/V. Los cultivos microbiológicos no son de utilidad, por la contaminación superficial habitual de la flora oral (biofilm). El tipo de tratamiento quirúrgico y el momento de realizarlo es quizá la cuestión donde más dudas se plantean. La mayoría de los autores son partidarios de un tratamiento conservador, evitando debridamientos agresivos debido a las recidivas y a las secuelas posteriores, corriendo el riesgo de aumentar el tamaño de la lesión. Se han utilizado desde técnicas basadas en el legrado y/o extirpación de fragmentos móviles y técnicas más agresivas que integran secuestrectomías y extirpaciones marginales o segmentarias. Si el hueso expuesto exhibe movilidad o evidencia radiográfica de secuestro, entonces debe ser eliminado. Los partidarios de tratamientos quirúrgicos agresivos prefieren debridar ampliamente la zona y hacer un cierre primario, separando así la lesión de la flora oral, intentando evitar las infecciones crónicas y asociando en ocasiones técnicas de reconstrucción.
Pautas de tratamiento para los pacientes que consumen los BFs por vía parenteral.
La variante fundamental en éstos pacientes, es la dosis y la rápida y alta biodisponibilidad del fármaco, por lo que los tiempos establecidos de 3 años para quienes se les administra por V/O, se acortan a 3 meses. Por lo que se hace estricto el rápido protocolo odontológico preventivo previo a iniciar su administración. (Ver grupo A)
Conclusiones
La osteonecrosis maxilar secundaria a bifosfonatos (ONMB), es un cuadro clínico de importante repercusión para el paciente y para el odontólogo. Su incidencia aumentará en los próximos años, debido al aumento del consumo de ésta droga. Las medidas preventivas y terapéuticas deben ser conocidas por los odontólogos y médicos especialistas que traten esta patología
Debemos hacer hincapié en la prevención de la aparición de ésta lesión.
Cuando el médico tratante decide comenzar un tratamiento con éstos fármacos, es fundamental que los pacientes sean derivados al odontólogo, para comenzar con el protocolo preventivo.
En pacientes que reciben ésta medicación por vía intravenosa (I/V), una vez instalada la lesión, ocasiona una gran morbilidad, por lo que siempre se intentará evitar toda cirugía oral electiva. Los pacientes tratados con BFs que reciban terapias quirúrgicas, deberán ser exhaustivamente informados (Consentimiento escrito). Es importante conocer y tener en cuenta los posibles factores de comorbilidad como posibles coadyuvantes en los pacientes que se van a someter a un tratamiento con BFs.
Realizar un diagnóstico temprano de la ONMB, ya que se puede evitar o reducir la morbilidad asociada a las lesiones destructivas del hueso.
Una vez instalada la ONMB, es de suma importancia informar a Farmacovigilancia de la Facultad de Odontología.
En referencia al tratamiento de la ONMB, debe ser, inicialmente limitado, escalonado e individualizado.
La severidad de las consecuencias de la ONMB exige la correcta identificación de estos pacientes antes de ser sometidos a exodoncias o cualquier otro tipo de manipulación quirúrgica oral.
Al momento no se dispone de evidencia científica acerca de un tratamiento que asegure la remisión de la lesión.
El resultado del mismo resulta incierto, debido a que la enfermedad de base puede hacer necesaria la continuación del consumo de BFs y al extenso y duradero efecto de los mismos, por lo cual uno de los objetivos fundamentales, debe ser la mejora de la calidad de vida.
Referencias
2. Prado Bernal N, Carrasco E, Prado Bernal J. Manejo estomatológico del paciente en terapia con bifosfonatos. Rev ADM 2011; 68(1): 8-16.
3. Marx R.E. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac. Surg. 2003. 61(10): 1115-1117.
4. Muñoz Torres M, Alonso G., Mezquita Raya P., Prevención y tratamiento de la osteoporosis. Endocrinología y nutrición, 2003; 50 (1): 1-7.
5. Balson M. Osteonecrosis de los maxilares asociada a bifosfonatos . Endodoncia jul-set 2007; 25(3): 190-195.
6. Merigo E, Manfredi M, Meleti M, et al. Bone necrosis of the jaw associated with bisphosphonate treatment: a report of twenty-nine cases. Acta Biomed 2006; 77:109-17.
7. Mundy G.R, Chen D, Oyajobi B.O. Bone remodeling. En: Favus MJ editor. Primer on metabolic bone diseases and disorders of mineral metabolism. Washington: American Society for Bone and Mineral Research 2003; 46-57.
8. Manolagas SC. Birth and death of bone cells: Basic regulatory mechanism and implications for the patoghenesis and treatment of oteoporosis. Endocrine Rev 2000; 21: 115-137.
9. Jilka R.L, Biology of the basic multicellular unit and the pathophysiology of osteoporosis. REEMO- 2005; 14: 81-85.
10. Doblaré M, García J.M. On the modelling bone tissue fracture and healing of the bone tissue. Acta Científica Venezolana 2003, 54: 58-75.
11. Misch C. E. Implantología Contemporánea, 3a Edición Barcelona, España: Elsevier, 2009. Cap. 6: 71-90.
12. Gomez Font R., Martinez García M.L., Olmos Martinez J.M. Osteochemonecrosis of the Jaws due to Biphosphonate Treatments. Med Oral Patol Oral Cir Bucal, 2008 May;
13(5):318-324.
13. Farmanuario 2011. 21 ed. Montevideo: InforMédica, 2011.
14. Bocanegra Perez, M S. Osteonecrosis de los maxilares asociada a Bifosfonatos. [Tesis Doctoral] Las Palmas: Universidad de las Palmas de Gran Canaria Departamento de Ciencias Médicas y Quirúrgicas, Junio 2010; 1-196.
15. Johnell O, Kanis J. Epidemiology of osteoporotic fractures Osteoporosis Int. 2005, 16 Suppl 2 (S3-S7).
16. Lewiecki E.M, Watts N, Mc Klung M. et al. Oficial positions of the internacional society for clinical densitometry. JClin Endocrinol Metab., 2004; 89: 3651-3655.
17. Bouxsein ML Bone Quality : where do we go from here?, Osteoporos Int., 2003; 14 Suppl 5: S118-S127.
18. WHO (World Health Organization) Technical report Series, Prevention and management of osteoporosis, Geneva 2003: 1-161.
19. Kramer J, Fantasia J. Bisphosphonates and Osteonecrosis of the Jaws: A review of Clinical Features and the Drug Effect on Oral Tissue. Clinic Rev Bone Miner Metab. 2011; 9:38-46.
20. Escobar López EA, López López J, Marques Soares MS, et al. Osteonecrosis de los maxilares asociada a bifosfonatos: revisión sistemática. Av. Odontoestomatol. 2007; 23 (2): 91-101.
21. Plotkin L, Agurre J, Kousteni S, et al. Bisphosphonates and estrogens inhibit osteocyte apoptosis via distinct molecular mechanisms downstream of extracellular signal regulated kinase activation. J Biol Chem 2005; 280:7317-25.
22. Gay Escoda C, Herrero Fonollosa M, Berini Aytés L, Osteoquimionecrosis de los maxilares asociada a la administración de bifosfonatos por vía endovenosa. Avances en Odontoestomatología, 2010; 26(6):301-312.
23. Sosa H.M, Bagán S.J, Junquera G.L, Osteonecrosis de los maxilares: Documento de consenso. Rev Osteoporos Metab Miner 2009 1; 1: 41-51.
24. Landesberg R, Cozin M, Cremers S, et al. La inhibición de la cicatrización de la mucosa oral, la herida de células con bifosfonatos. J Surg Oral y Maxilofac. 2008; 66(5):839-47.
25. Burr D, Cauley J, et al. Biphosphonate-Associated Osteonecrosis of the Jaw: Report of a Task Force of the American Society for Bone and Mineral Research Sundeep Khosla, J Bone Miner Res Oct 2007; 22 (10): 1479-91.
26. Ruggiero S.L, Dodson T. B, Leon A. Assael,. Suppl 1 American Association of Oral and Maxillofacial Surgeons Position Paper on Bisphosphonate-Related Osteonecrosis of the Jaws, Update. J Oral Maxillofac Surg, 2009; 67:2-12.
27. Jaimes M, Oliveira G.R, Olate S. et al. Bifosfonatos asociados a osteonecrosis de los maxilares. Revisión de la literatura de Av. Odontoestmatol. 2008; 24 (3): 219-226.
28. Mavrokokki T., Cheng A., Stein B., et al. Nature and Frequency of Bisphosphonate-associated Osteonecrosis of the Jaws in Australia. J. Oral Maxillofacial Surg 2007 Mar; 65 (3): 415-423.
29. Assael L.A. Oral Bisphosphonates as a cause of Bisphosphonates- Related Osteonecrosis of the jaws: clinical findings, assessment of risks, and preventive strategies. American Association of Oral and Maxillofacial Surgeons J. Oral Maxillofac Surg 2009, 67:35-43, suppl 1.
30. Junquera L.M, Martín R. Diagnóstico, prevención y tratamiento de la osteonecrosis de los maxilares por bisfosfonatos. Recomendaciones de la sociedad española de cirugía oral y maxilofacial (SECOM). Cient dent 2008; 5;(3):229-237.
31. Guttenberg S.A. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2008; 106 (6): 769-772.
32. Bagán J.V, Diz Dios P, Gallego L, et al. Recomendaciones para la prevención de la osteonecrosis de los maxilares (ONM) en pacientes con cáncer tratados con bisfosfonatos intravenosos, Med Oral Patol Oral Cir Bucal. 2008 May: 13(3); 161-167
33. Grötz K.A, Schmidt B.L, Walter C, et al. Bei welchen Bisphosphonat-Patienten darf ich eigentlich implantieren? Ein systematisches Review Deutscher Ärzte-Verlag , zzi, Z Zahnärztl Impl, 2010; 26 (2): 153-161.
34. Pastor D, Garatea J, Martino R, et al. Osteonecrosis maxilar y bifosfonatos. Presentación de tres casos. Med Oral Patol Oral Cir Bucal 2006;11:76-9.
35 Bagán J, Blade J, Cozar JM,et al. Recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw (ONJ) in cancer patients treated with bisphosphonates. Med Oral Patol Oral Cir Bucal 2007;12: 336-340.
36. Torre Salaberri I., Expósito Molinero R., Ucar Angulo E., et al. Utilidad del marcador de metabolismo óseo ctx en pacientes con osteoporosis tratados con bisfosfonatos, XXXII Congreso Nacional de la Sociedad Española de Reumatología, 2006, pág. 11.
37. Lee CY. Suzuki JB. CTX biochemical marker of bone metabolism. Is it a reliable predictor of bisphosphonate-associated osteonecrosis of the jaws after surgery? Part I: biological concepts with a review of the literature. Implant Dent 2009 Dec: 18(6); 492-500.
38. Lee CY. Suzuki JB, CTX biochemical marker of bone metabolism. Is it a reliable predictor of bisphosphonate-associated osteonecrosis of the jaws after surgery? Part II: a prospective clinical study. Implant Dent 2010 Feb: 19(1); 29-38.
39. Marx R.E, Cillo J.E Jr. Ulloa J.J. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J Oral Maxillofac Surg. 2007 Dec: 65(12); 2397-2410.
40. Bornstein M, Cionca N, Mombelli A. Systemic conditions and treatments as risks for implant therapy, Int J Oral Maxillofac Implants 2009; 24(1): 12-27.
41. Albrektsson T, Zarb G, Worthington P. et al. Guidelines of the academy of osseointegration for the provision of dental implants and associated patient care, Int J, Oral Maxillofac Implants 2010; 25(3):620-627.
42. Ponte Fernandez N, Estefanía Fresco R, Aguirre Urizar J.M. Bifosfonatos y patología oral I. Aspectos generales y preventivos. Med Oral Patol Oral Cir Bucal 2006;11:E 396-400.
43. Arce K, Assael L, Weissman J.L, et al: Imaging findings in bisphosphonate-related osteonecrosis of the jaws. J Oral Maxillofac Surg 67:75, 2009 (suppl 1).
 Todo o conteúdo deste periódico, exceto onde está identificado, está licenciado sob uma Licença Creative Commons
Todo o conteúdo deste periódico, exceto onde está identificado, está licenciado sob uma Licença Creative Commons