Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Odontoestomatología
versión On-line ISSN 1688-9339
Odontoestomatología vol.13 no.17 Montevideo mayo 2011
Tratamiento odontológico integral del paciente oncológico. Parte I.
Damián Guillermo Lanza Echeveste*
Resumen
El tratamiento odontológico del paciente oncológico es quizás uno de los mayores desafíos a los que se puede enfrentar el odontólogo, ya que ésta es una situación muy compleja, que requiere de una atención meticulosa, integral, ordenada y coordinada con la participación de un equipo multidisciplinario, cuya meta es la curación completa del paciente y con la menor cantidad posible de secuelas que causa la terapia oncológica. Para llegar a esta meta se debe seguir un protocolo de atención odontológica que se dividirá en tres etapas: pre, intra y post terapia oncológica que abarcan diversos tratamientos. Este trabajo está dirigido al odontólogo general, que muchas veces es el encargado de realizar algunos o la totalidad de estos tratamientos debido a que el paciente vive lejos del centro hospitalario y sólo acude a él para realizar el tratamiento oncológico específico. En este trabajo se describirán las patologías generadas por la terapia oncológica, como prevenirlas y tratarlas.
Abstract
The odontologic treatment of the oncologic patient maybe one of the largest challenges that a dentist can confront, because it is a very complex situation, which requires a meticulous attention, comprehensive, tidy and coordinated with a multidisciplinary team, whith the aim of the complete cure of the patient with the lowest side eff ects caused by the oncologic treatment. To achieve this is essential to follow an oncologic attention protocol which will be spitted up in 3 stages: pre, intra and post oncologic therapy which include different treatments. This work is directed by the general dentist, who many times is the professional in charge of doing some or all of these treatments because the patient lives far away of the hospital centre and only goes there to do a specifi c oncologic treatment. This paper described the odontologic pathologies generated by oncologic therapy, how to prevent and treat them.
Palabras clave: Tratamiento multidisciplinario odontología-oncología
Key words: Multi disciplinary treatment oncologic-dentistry
* Ex Ayudante de Clase Grado 1, Cátedra de Cirugía Buco Máxilo Facial II, Facultad de Odontología, Universidad de la República.
Fecha recibido: 08.11.10 - Fecha aceptado: 18.04.11
Introducción
El cáncer oral, e ntre ellos el carcinoma de células escamosas, es una de las neoplasias más frecuentes en el ser humano. Si se trata en estadios tempranos con los tratamientos multidisciplinarios se logra una tasa de sobrevida del 50%, aproximadamente a los 5 años. (1, 2) La etiopatogenia del cáncer oro-faríngeo es multifactorial, entre los factores ambientales más conocidos están el alcohol y el tabaco, pero también contribuyen otros factores como la mala higiene, la malnutrición, los micro traumatismos crónicos, las bebidas muy calientes, la radiación solar, etc. En Uruguay se diagnostican anualmente entre 270 y 300 nuevos casos por año de cáncer oro faríngeo, de los cuales mueren entre 130 y 150 pacientes por año.(3)
También es importante destacar que estamos entre los primeros veinte países en el mundo en cuanto a cáncer en general. (4) El tratamiento oncológico, ya sea con radioterapia (RT) o quimioterapia (QT) produce efectos tóxicos en las células cancerosas pero también en las células normales. (5, 6, 7) Por lo tanto la cavidad oral es muy susceptible a los efectos tóxicos directos e indirectos de la RT y QT oncológica. Este trabajo está dirigido al odontólogo general, ya que muchas veces es quien detecta neoplasias de cabeza y cuello en estadíos iniciales en inspecciones de rutina, y en él también recaen los tratamientos preventivos y curativos de los efectos colaterales indeseados de la RT y QT. (4) Se describirán detalladamente los tratamientos a realizar por el odontó logo antes, durante y después del tratamiento oncológico, pero la medicación y tratamientos a realizar por el equipo médico-oncológico solo serán descritos a modo informativo, ya que ello escapa al área de responsabilidad del odontólogo.
Revisión
Para el siguiente trabajo se revisó la literatura científica más rel evante relacionada a las palabras clave como tratamiento multidisciplinario odontología-oncología, complicaciones de la terapia oncológica y su tratamiento. Los idiomas seleccionados fueron el inglés, español e italiano recurriendo a la base de datos de Pubmed (Medline) y Lilacs (Bireme) y se limitó el período de búsqueda a la literatura existente en los últimos 20 años. También se utilizaron libros de la carrera de Doctor en Odontología y Doctor en Medicina.
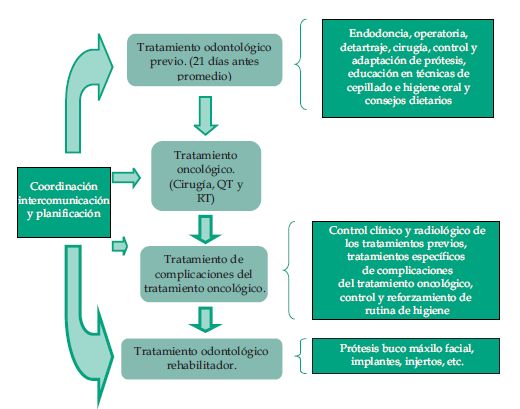
Tratamiento odontológico previo al tratamientooncológico
En esta etapa lo que se busca es identifi car las patologías orales existentes antes de la terapia oncológica, realizar su tratamiento y de esta manera evitar las complicaciones del tratamiento oncológico, o al menos reducir su gravedad. La principal razón del tratamiento odontológico previo al tratamiento oncológico es que las infecciones orales pueden ser el punto de partida de infecciones sistémicas letales, por lo que deben ser eliminadas. (8-15) Las caries, infecciones d e la pulpa y periapicales de origen dental deben eliminarse 14-21 días antes del comienzo de la terapia oncológica para asegurar un correcto período de curación y cicatrización periapical. (6, 11, 12, 15) La terapia endodóntica debe concluir por lo menos 14 días antes de la iniciación de la terapia oncológica. Aquellas lesiones periapicales radiolúcidas en dientes tratados endodónticamente deben de retratarse, realizar apicectomía o extraerse, ya que bien podrían ser lesiones donde defensa y agresión están en equilibrio pero cuando el paciente queda inmunocomprometido se reagudizaría el proceso. También se debe hacer un profundo detartraje. (2, 6, 11, 14, 15) La cirugía periodontal no se aconseja debido a que el periodonto es el sitio más común de inicio de la infección oral y sistémica. (6, 11, 15-18) Aquellos dientes con pronóstico pulpar o periodontal desfavorable (expectativa menor a un año en boca) deben extraerse. También se deben extraer los dientes retenidos y los que se hallan comprendidos en la zona de irradiación. (6, 7, 11, 14) Para las extracciones se deben seguir las siguientes pautas: usar una técnica lo más atraumática posible, estrictamente aséptica, realizar alveoloplastía si es necesario y regularización ósea, lograr cierre por primera intención, dejando 14-21 días para su completa cicatrización y control periódico de la misma. (7) Antes de realizar las extracciones se debe de tener en mente cual va a ser el tratamiento rehabilitador protésico oral o buco máxilo facial a realizar, para tener en cuenta los anclajes dentarios. (2, 12, 14) Sí en el campo de irradiación hay un implante dental, depende del criterio profesional el retirarlo o no, ya que se sabe que los metales causan sobredosis de radiación en su zona y la reducen en zonas subyacentes. (2, 6) Los dispositivos protéticos que no ajusten bien pueden traumatizar la mucosa oral y aumentar el riesgo de invasión microbiana. Deben evaluarse las prótesis y ajustarlas según sea necesario para reducir el riesgo de traumatismos y se debe recordar que durante el tratamiento oncológico sólo se deben usar para alimentarse. (1, 2) Se deben tomar Rx convencionales de las piezas a tratar y OPT al inicio del tratamiento. Luego se debe hacer control clínico y radiológico cada seis meses para evaluar el estado de las restauraciones, posible recidiva de patologías pulpares y/o periapicales. En esta etapa se debe valorar la higiene oral del paciente y establecer de común acuerdo una rutina de higiene oral sistemática y completa. (6, 14, 15) Es importante informar al paciente que en el curso del tratamiento de una enfermedad oncológica es frecuente que se desarrollen infecciones sistémicas, muchas de ellas originadas en la esfera bucomaxilar, eventualmente letales. (8) La higiene oral se debe realizar con cepillo de mango recto, cerdas blandas de nylon de 2 o 3 hileras, tres a cuatro veces por día con el método Bass modificado para limpieza del surco gingival, incluir la cara dorsal de la lengua y enju agar la boca frecuentemente para que no queden restos de la pasta dental. (2) Se deben usar pastas con concentración de 1450 ppm de flúor, o mayor concentración. Como los sabores utilizados en la pasta pueden irritar los tejidos blandos orales, se debe considerar el uso de una pasta que tenga un sabor relativamente neutro. Enjuagar el cepillo en agua caliente cada 15 o 30 segundos durante el cepillado ablanda el cepillo y reduce el riesgo de ocasionar trauma. El cepillo debe secarse al aire libre entre cada uso para evitar su contaminación y colonización bacteriana, lo que lo convertiría en un vector infeccioso y se lo debe cambiar cada 2-3 meses o cuando sus cerdas pierden forma y/o se doblan. Cuando no es posible el uso de cepillo de dientes común, una alternativa posible aunque menos eficaz es el uso de cepillo de dientes de espuma y gel fl uorado. También se debe complementar la higiene con enjuagues antimicrobianos no azucarados y sin alcoh ol, debiendo recordarle al paciente que éstos son sólo medios químicos auxiliares y que es muy importante y más eficaz la remoción mecánica de la placa. Estos enjuagues pueden ser con clorhexidina al 0,12 % libre de alcohol durante 5 minutos, media hora después del cepillado, también se puede usar povidona yodada. (2, 6, 7, 11, 19) El gluconato de clorhexidina es un fármaco antimicrobiano de amplio espectro con actividad contra organismos grampositivos y gramnegativos, levaduras y otros organismos micóticos. También se puede aplicar clorhexidina en gel en domicilio o en concentraciones del 1% o 5% en el consultorio, logrando una gran reducción en la población de Streptococus mutans. (18, 19) Se puede usar solución salina al 0,9% con o sin bicarbonato de sodio si el dentífrico produce irritación. El bicarbonato de sodio es muy útil para neutralizar la acidez del medio generada por la hiposialia y así contrarrestar la aparición de caries. (2, 14) Los enjuagues que contienen alcohol deben evitarse ya que pueden lesionar la mucosa y agravar lesiones así como también agravar la xerostomía. Todas estas medidas se deben complementar con el uso de hilo dental con técnica atraumática una vez por día, ya que la QT dejará más lábiles a los tejidos blandos. Los hisopos pueden ser útiles para limpiar los rebordes maxilares y mandibulares de áreas edéntulas, del paladar y de la lengua. Es importante evitar la resequedad de los labios para reducir el riesgo de lesiones. Los productos para el cuidado de los labios contienen aceites y ceras que pueden resultar útiles. Las cremas y ungüentos a base de lanolina pueden ser más efi caces en proteger contra este tipo d e trauma. Esta afección puede ser provocada al respirar por la boca y la xerostomía secundaria a las medicaciones anticolinérgicas; entre otros fármacos; utilizadas para el manejo de las náuseas la favorece aún más. También es importante usar medidas de fl úor sistémico y realizar frecuentemente topicaciones de flúor en el consultorio o de manera domiciliaria mediante la confección de cubetas individuales. (2, 6, 7, 12, 19) Se debe explicar al paciente la razón fundamental por la cual debe seguir el programa de higiene oral sugerido e informarle cuáles son las complicaciones posibles de la QT y la RT contra el cáncer. Esta rutina de higiene oral se debe instalar un mes antes de la terapia oncológica para que el paciente se acostumbre a ella, la sistematice y luego se debe controlar su efi cacia así como también reforzar la motivación en cada consulta. También se debe aconsejar al paciente, en conjunto con nutricionista, cómo mantener una adecuada y completa alimentación no cariogénica y aconsejar el uso de suplementos alimenticios completos antes del inicio de la terapia para que en caso de que suceda alguna complicación de la radioquimioterapia (RQT) el organismo esté en las mejores condiciones para afrontarla. (2, 6, 13, 19) Se debe informar y ayudar al paciente en el cese total del consumo de tabaco y alcohol. (6) La protección específica que puede proveer el odontólogo para evitar el daño de la radiación al hueso, dientes, mucosa y glándulas salivales que están en la cercanía del tumor es mediante la confección de prótesis de acrílico, de común acuerdo con el radioterapeuta, para proteger aquellas zonas no involucradas por el tumor. Estas prótesis se confeccionan con planchas metálicas de 1,25 cm. de espesor compuestas con 50% de bismuto, 26, 7% de plomo, 13,3% de zinc y 10% de cadmio y revestidas por acrílico. Ésta sólo se utilizará durante la sesión de RT. (2, 7, 16)
Tratamiento oncológico
La RT es radiación ionizante cuya acción biológica es desarrollar radicales libres en el agua intracelular alterando la estructura genética de las células y dificultando o impidiendo su multiplicación normal, lo que lleva a la muerte de la célula. La rapidez con que esta muerte celular sucede depende del tiempo de duplicación celular de los tejidos involucrados por el tumor. Por ejemplo el carcinoma de células escamosas tiene una alta tasa de duplicación celular de 3-5 días y por lo tanto la lisis y muerte celular ocurren rápidamente. Cada tejido tiene una susceptibilidad variable, hoy día se sabe que la mucosa oral y gastrointestinal se renueva completamente en el entorno de los 12 días, la piel en 21 días y el endotelio de los vasos sanguíneos en 3 meses. Esto influye en el momento en que los efectos indeseados de la RT serán evidentes en los tejidos normales que se encuentran en el campo de irradiación. (7) La dosis de RT es expresada en términos de dosis absorbidas por el cuerpo expresado en grays (Gy), que es igual a la energía absorbida de 1 joule/Kg. La antigua unidad de medición de dosis absorbida era el rad, 100 rads es igual a 1 Gy. Hay dos tipos de técnicas de RT: la braquiterapia y la teleterapia. En la braquiterapia o radioterapia local el dispositivo radioactivo se instala en el interior de los tejidos del paciente, generalmente son finas agujas romas de 0,6 mm de diámetro de iridio-192. Para una dosis total de 65-70 Gy se dejan estas agujas unos 5-8 días con una tasa de liberación de 0,3-0,5 Gy por hora. Esta técnica da mejores resultados que la teleterapia. La teleterapia es la más usada y es aquella en la cual el área tumoral es irradiada por un equipo de supervoltaje de RT. La teleterapia se fracciona para lograr mejores resultados y también se puede administrar al mismo tiempo que la terapia de oxígeno hiperbárico para optimizar resultados. (6, 7) Generalmente para el tratamiento de neoplasias de cabeza y cuello se necesitan dosis de radiación en el entorno de los 40-70 Gy, fraccionados en dosis diarias de 2 Gy, para un total de 4-7 semanas de tratamiento. La dosis depende de la radiosensibilidad del tumor, el tamaño, la oxigenación del tumor, etc. Así el carcinoma de células escamosas es más radiosensible que el adenocarcinoma de glándulas salivales. (6, 7, 10) Las complicaciones orales más comúnmente observadas después de la oncoterapia son la mucositis, la disfunción de las glándulas salivales, la disfunción del sentido del gusto y el dolor. Estas complicaciones pueden, a su vez, producir otras secundarias como deshidratación y malnutrición. (11) La RT a la cabeza y el cuello puede dañar irreversiblemente la mucosa oral, la vasculatura, las glándulas salivales, los músculos, los dientes y los huesos, lo que puede dar lugar a xerostomía, caries, trismus, necrosis de los tejidos blandos y osteorradionecrosis (ORN)(2)
La QT es el tratamiento médico del cáncer basado en el uso de fármacos citostáticos o citotóxicos. La gran limitación de éstos es la escasa especifi cidad, pues ataca tanto células tumorales como sanas. El mecanismo de acción es provocar una alteración celular ya sea en la síntesis de ácidos nucleicos, divis ión celular o síntesis de proteínas. Los más usados son: el metotrexato, cisplatino, vincristina y vinblastina. Se emplea usualmente en 3 o 4 ciclos. (6-8) Los efectos tóxicos relacionados a la QT inciden principalmente en la mucosa que reviste el sistema oral y gastrointestinal, a causa de su alta tasa de renovación celular, la microfl ora compleja y el trauma de los tejidos orales durante la función oral normal. (2, 5, 6, 9) Una mención aparte merecen los bifosfonatos que son muy eficaces en el tratamiento de cáncer con metástasis óseas. En los últimos años se ha constatado un aumento en el número de casos clínicos en los que su uso se relaciona con la osteonecrosis de los maxilares; por ello el odontólogo debe de estar muy alerta sobre las posibles complicaciones en los pacientes que los ingieren. En este sentido, será fundamental la colaboración con el oncólogo y el cirujano maxilofacial, en aquellos pacientes en tratamiento con bifosfonatos, y tomar las medidas necesarias para la prevención de la osteonecrosis. (18) Para reducir la frecuencia de las complicaciones causadas por la RQT la mejor acción profesional es la prevención, para así mejorar la tasa de sobrevida a los 5 años. Para este fin se pueden usar radio y quimioprotectores. (12) La amifostina es un fármaco que se usa para reducir los efectos secundarios no deseados de la RQT. Este fármaco es un agente adyuvante antineoplásico o citoprotector (protege a las células normales, no las tumorales), se ha comprobado que reduce los efectos nocivos que tiene la QT sobre los riñones, la mielosupresión y ayuda a aliviar los problemas de sequedad bucal, mucositis y xerostomía aguda o tardía en los pacientes con cáncer de cabeza y cuello. Se une a los radicales libres producidos en los tejidos expuestos al cisplatino y/o RT, neutralizándolos. Los efectos secundarios son hipotensión y vómitos. Su administración y dosis corresponden a la esfera del equipo médico oncológico. (6, 13) También se pueden usar el thiosulfato sódico, para atenuar los efectos indeseables del cisplatino intra-arterial. (1) El manejo apropiado de los pacientes oncológicos requiere de un equipo multidisciplinario constituido por: oncólogos, patólogos, cirujanos plásticos, cirujanos buco máxilo faciales, nutricionistas, enfermeros, protesistas buco máxilo faciales, odontólogos generales , higienistas, psicólogos, asistente social y fisioterapeutas. (6, 7, 12) El manejo de las complicaciones orales de la oncoterapia comprende identificación de poblaciones de alto riesgo, educación del paciente, inicio de intervenciones antes del tratamiento y manejo oportuno de las lesiones que se presenten durante y luego de la RQT. (2, 11) Para que esto tenga éxito y se vea reflejado en el paciente, el equipo oncológico multidisciplinario debe mantener una continua y correcta comunicación. En ocasiones sucede que el paciente vive lejos del centro hospitalario y realiza todo su tratamiento odontológico con su odontólogo de confianza, es en esta situación en que la comunicación y coordinación de tratamientos cobra mayor importancia, ya que pequeños retrasos o diagnósticos erróneos pueden repercutir en la incidencia de complicaciones y comprometer la vida del paciente. (8, 14) La mejor actitud es realizar los tratamientos odontológicos necesarios un mes antes de la terapia oncológica y enviar la historia clínica con el paciente para que el equipo oncológico multidisciplinario realice una evaluación final antes de comenzar la terapia oncológica. (11) Todo el equipo multidisciplinario debe conocer y compartir la información sobre: tipo de cáncer, estadio TNM y pronóstico, tratamientos a realizar, características y su fecha estimada, resultado de exámenes paraclínicos, estado de salud física y psicológica, medicamentos en uso, cantidad y severidad de las caries, dientes a ser extraídos, enfermedad periodontal, lesiones orales y tiempo de cicatrización esperado de los tratamientos odontológicos. (2, 6, 7, 14) El objetivo particular del trabajo odontológico es el de determinar un plan de atención oral integrado que elimine o estabilice las patologías orales que de otra manera podrían favorecer la ocurrencia de complicaciones durante o después de la RQT. (2)
Pronóstico de complicaciones
La frecuencia con que se presentan las complicaciones orales depende de muchos factores, entre ellos: el tratamiento realizado para el cáncer, la dosis de radiación, fraccionamiento, la QT usada, la cirugía oncológica, etc. (8-10)Las complicaciones orales de la RQT en la cabeza y el cuello pueden dividirse en dos grupos según el momento de su incidencia: las complicaciones precoces o agudas ocurren durante la terapia, mientras que las complicaciones tardías o crónicas se presentan a la finalización de la terapia. Las complicaciones orales de la RT de cabeza y el cuello son más predecibles, a menudo más severas, y pueden resultar en cambios permanentes en los tejidos, con lo cual se pone al paciente en riesgo de complicaciones crónicas serias. (2, 6) La frecuencia y severidad de las complicaciones orales agudas comienzan a disminuir aproximadamente 3 o 4 semanas después del cese de la RQT. Las complicaciones orales de la QT tienen duración menos prolongada que las de RT y se curan entre unas pocas semanas a 2 meses después de la interrupción de la misma.
Tratamiento odontológico durante el tratamiento oncológico
Si el tratamiento previo a la terapia oncológica ha sido llevado a cabo con éxito, en esta etapa el odontólogo se limitará a realizar los siguientes procedimientos: control periódico de placa, control radiológico, control de higiene, controles periodontales, remotivación, recordar el uso de prótesis sólo para alimentarse, controlar la ingesta de hidratos de carbono y azúcares, fl uoración tópica y enjuagues antisépticos. El control periodontal es muy importante ya que es la vía de entrada principal de microorganismos y una posible septicemia. También se dará tratamiento a las lesiones o patologías orales que, a pesar de nuestros esfuerzos, puedan surgir como consecuencia de la terapia antineoplásica y que se describirán a continuación. (2, 6)
Complicaciones precoces o agudas
Las complicaciones agudas incluyen mucositis orofaríngea, xerostomía y sialoadenitis, infecciones bacterianas, virósicas o micóticas (candidiasis principalmente) y disfunción del gusto. Ocasionalmente se observa la necrosis de los tejidos ya avanzada la terapia, pero esto es relativamente inusual. (2, 10)
Mucositis
La mucosa oral normal reduce los índices de microorganismos orales que la colonizan al renovarse constantemente y limitar la penetración de muchos compuestos en el epitelio mediante el mantenimiento de una barrera química, gracias a la secreción de inmunoglobulinas A, G y M en la saliva, entre otras sustancias. (2, 6, 20-23) La mucositis eritematosa orofaríngea es una reacción inflamatoria autolimitante muy común a los fármacos de la QT, o a la RT hiperfraccionada que se manifiesta característicamente como edema, eritema o ulceraciones dolorosas y puede verse exacerbada por factores locales y generales. (5, 7, 13, 16, 24-26) Su frecuencia de presentación es de entre el 70% - 80% y es más común en pacientes jóvenes, aunque en éstos cura más rápido. (5, 8, 24, 27, 29) Su proceso evolutivo se divide en cuatro fases de duración variable. Primero ocurre una etapa vascular inflamatoria en la cual la QT parece ser la más responsable, sigue una fase atrófi ca epitelial del estrato basal, luego una fase doloroso-ulcerativa y bacteriológica generalmente desencadenada por traumatismos. Por último la fase curativa y proliferativa epitelial. (5, 8, 16) Actualmente los estudios científicos sobre las causas apuntan hacia los trastornos microvasculares y la participación de ciertas citoquinas, como el factor alfa de necrosis tumoral, la interleuquina-1 e interleuquina-6, como posibles contribuyentes fundamentales al desarrollo de la mucositis. (5, 17, 21, 27) Se pueden observar áreas de ulceración y formación de seudomembrana de fibrina, blanquecina o amarillenta de 2-4 mm de diámetro. (7, 27) Las zonas más sensibles son las no queratinizadas: paladar blando, rinofaringe, suelo de boca, bordes laterales de la lengua y pilares amigdalinos. Hay muchas formas de clasificar la gravedad de la mucositis pero la más usada es la realizada por la O.M.S., que reconoce 4 grados de mucositis, cuya severidad depende de la dosis de QT, tipo de radiación y dosis de la misma, etc. Esta escala es la siguiente: grado 0: sin afectación, grado 1: dolor y eritema, grado 2: dolor, eritema y úlceras que permiten comer sólidos normalmente, grado 3: úlceras que dificultan la deglución y sólo permiten la ingesta de líquidos y grado 4: odinofagia intensa por la cual se debe recurrir a la alimentación parenteral hospitalaria. (2, 6, 20, 21, 26, 30) La mucositis oral inducida por la RT dura característicamente de 6 a 8 semanas. La mucositis provocada por la QT suele comenzar entre 7 y 10 días después de iniciarse la misma, es autolimitante si no está complicada por infección, cura entre 2 a 4 semanas después del cese de la QT, dependiendo de la dosis y del citotóxico empleado, entre otros factores. (5, 7, 26) La calidad de la mucosa se verá afectada de aquí en más, volviéndose más seca, frágil y atrófica. (2, 9) Esta diferencia de duración de la mucositis provocada por RT y QT se debe principalmente a la larga duración de los protocolos de RT como ya vimos. Los pacientes que han sido sometidos a trasplante de médula ósea tienen la inmunidad reducida lo que favorece la aparición de infecciones virales, micóticas y bacterianas que agravan el cuadro y cuya incidencia depende del uso de regímenes profi lácticos, del estado oral previo a la QT y de la duración y severidad de la neutropenia. (2, 5, 9, 16, 20, 21, 26, 27) Los pacientes con neutropenia y mucositis tienen 4 veces más probabilidades de desarrollar septicemia (24). Con neutropenias inferiores a 1.000/mm3, la incidencia y gravedad de las infecciones se eleva. (9, 27) La frecuencia de infecciones disminuye al resolverse la mucositis y la regeneración de los neutrófilos. (5) Aunque la reconstitución inmunitaria se está desarrollando, las defensas inmunitarias de las mucosas orales podrían no encontrarse en su estado óptimo. (5) Así, el paciente permanece en riesgo de sobreinfección de Candida y del Herpes virus, las cuales se verán en la segunda parte de este trabajo. (2, 25, 26) El tratamiento odontológico preventivo ya fue descrito. El tratamiento médico para cuando la mucositis ya está instalada se debe dividir en tres categorías: agentes que reducen la absorción mucosa del fármaco de QT, agentes que reducen la alteración de la proliferación epitelial y agentes antinflamatorios y antimicrobianos. Entre los tratamientos que reducen la absorción mucosa del fármaco tenemos a la crioterapia con su poder vasoconstrictor, el alopurinol que inhibe la formación de metabolitos tóxicos del 5-fl uorouracilo (5-FU) y la leucovorina que protege de los efectos tóxicos del metotrexato. Entre los agentes que reducen la alteración de la proliferación epitelial tenemos al beta-caroteno, el aminoácido glutamina, el factor de crecimiento de colonias de granulocitos y macrófagos (FCCGM) que además resuelve la neutropenia pero con resultados contradictorios, el nitrato de plata al 2%, la prostaglandina E2 y el factor de crecimiento epidérmico (FCE). Este último usado en animales como estimulante en la normalización del estrato basal y queratinización, simultáneamente a la QT aumentó la severidad y duración de la mucositis. Se cree que de administrarse FCE en la etapa curativa ésta se vería acelerada. (5, 16, 23) También se está usando factor de crecimiento recombinante de queratinocitos, Palifermin, con muy buenos resultados en cuanto a la reducción de la gravedad y duración de la mucositis. (13, 28) Entre los agentes antiinflamatorios y antimicrobianos, que puede aplicar el odontólogo, la clorhexidina contribuye a atenuar la incidencia de la mucositis y evitar el riesgo de sobreinfección cuando ya está instalada aunque puede ser algo irritante. Otros agentes pueden ser: yodo, desinfección ATB selectiva, enjuagues de betametasona en altas dosis, inmunoglobulinas, antimicóticos y antivirales. (13, 16, 26) Para el tratamiento sintomático paliativo de la mucositis se puede recurrir a anestésicos tópicos como la lidocaina viscosa al 2% en ungüentos o aerosoles, teniendo precaución de su absorción sistémica en áreas donde la erosión es muy extensa. También son útiles los fármacos que forman una película adhesiva y protectora sobre la lesión que proteja a las terminaciones nerviosas expuestas como Orabase ® y medicación con analgésicos opiáceos. (13, 14, 16, 27) El uso actual de sucralfato, vitamina E tópica (1 ml) e hidróxido de magnesio al 7,5 % como ungüentos citoprotectores está dando buenos resultados en la prevención y tratamiento de la mucositis. (5, 6, 7, 9, 13, 16, 19, 26) Están contraindicados los AINEs que afectan la adhesión de plaquetas y dañan la mucosa gástrica, especialmente si existe trombocitopenia. (6, 9, 12, 21) No se recomienda el uso repetido de enjuagues de agua oxigenada como medida preventiva diaria de higiene oral. Esto se debe al daño potencial a los fi broblastos y queratinocitos lo cual puede ocasionar una cicatrización tardía. (5, 13, 16) Los suplementos de zinc, vitaminas y otros antioxidantes, cuando se toman antes y durante la radioterapia, podrían ayudar a tratar la mucositis y reducir su severidad, pero no su incidencia. (5, 12) El uso de los caramelos de capsaicina, componente activo de los pimientos picantes, es controvertido, algunos autores relatan tener mucho éxito como método analgésico. Otros autores lo contraindican por ser extremadamente dolorosa al inicio del tratamiento por lo que se aconseja no usarlo. También se indica el láser de CO2 y de helio-neón, que además estimulan la formación de colágeno. (5, 6, 13, 16, 20, 26) Se debe interrumpir el uso de prótesis hasta que cicatrice la mucositis, usarlas sólo para alimentarse, limpiarlas dos veces al día con cepillo blando y enjuagarlas bien, dejar reposar en soluciones antimicrobianas cuando no están colocadas en boca y no usarlas mientras se duerme y durante períodos de dolor oral considerable. Se deben evitar los alimentos muy calientes o picantes, el tabaco y el alcohol. (2, 7, 14) Una alternativa muy interesante es la infusión cronomodulada de la QT o cronomodulación que se basa en los ritmos circadianos de la reproducción celular. En la mucosa oral la síntesis de ADN, que ocurre durante la fase S del ciclo celular, disminuye en un 50 % entre las 0:00 y las 4:00 hs en comparación al resto del día. Aplicando los fármacos de QT que actúan principalmente en la fase S del ciclo celular en este período de tiempo la incidencia de la mucositis se vería reducida. (16) Hay que tener en cuenta que la mucositis perjudica dos de las funciones más importantes para el relacionamiento social como son la alimentación y la fonación. La alimentación puede resultar dolorosa y haber disfagia debido a la inflamación del velo del paladar, epiglotis y pared posterior de la faringe. (2, 25) También puede afectar las vías respiratorias superiores hasta el punto en que se requiera la intubación endotraqueal. Los pacientes con estos problemas puedan alejarse del contacto interpersonal y de las relaciones sociales, y tener depresión como resultado de las dificultades y frustraciones que encuentran al vivir con el cáncer y sus complicaciones. Cuando se interviene con fármacos psicotrópicos en el tratamiento de estos pacientes, es importante escogerlos con el objetivo de mejorar
o al menos no empeorar sus complicaciones orales. Por ejemplo, en el tratamiento de la depresión de estos pacientes, los fármacos altamente anticolinérgicos deben evitarse en los pacientes con xerostomía y problemas salivales. (13, 28-32)
Xerostomía y sialoadenitis
La palabra xerostomía significa boca seca y quizás el término más adecuado para el cuadro a describir sea el de hiposialia, o sea una disminución en la secreción salival. (2, 8, 22) La función salival normal propende a la salud de la mucosa oral al lubricarla e impedir, en cierto grado, la colonización bacteriana patógena mediante la secreción de inmunoglobulina A, G y M. (2, 21, 23, 31) La hiposialia es la complicación oral tardía que se observa con mayor frecuencia; la toxicidad se reduce en un plazo de 6-12 meses, pero esta mejoría es de carácter leve a moderado. (12) La RT produce fibrosis, o sea la sustitución del parénquima glandular por un tejido fi broso cicatrizal que lleva a la pérdida de función, degeneración grasa, atrofia glandular, degeneración del epitelio ductal y necrosis celular. (12, 23, 31) Llegando a dosis de 55-60 Gy (5500-6000 rads) la hiposialia sería permanente. (7, 10) El grado de disfunción está relacionado con la dosis de RT y el volumen de tejido glandular irradiado. (31) Las glándulas parótidas (serosas) son más susceptibles a los efectos de la RT que las submandibulares, sublinguales y las glándulas salivales menores (predominantemente mucosas). Esto hace que la saliva tienda a ser más viscosa y de menor calidad en cuanto al contenido mineral, lo que lleva a una acidificación de su pH y por consecuencia cambios en la flora oral y mayor incidencia de caries. Esto sucede con frecuencia en los tumores nasofaríngeos en los cuales las parótidas se hallan en el campo de irradiación. (2, 7, 8, 10, 12) Las glándulas salivales que quedan excluidas del campo de radiación podrían volverse hiperplásicas, compensando parcialmente a las glándulas no funcionantes. (7) También la QT puede provocar hiposialia, pero ésta es más corta y la recuperación se observa de 2 a 8 semanas después de la misma. (1) La hiposialia secundaria a las drogas anticolinérgicas, entre otros fármacos, agrava el cuadro y la disfunción del sentido del gusto se detecta en esta etapa. (31) Los síntomas y signos de la hiposialia incluyen resequedad, sensación de ardor en la lengua, fisura de las comisuras labiales, atrofi a de la superficie lingual dorsal, dificultad al usar prótesis, caries, disgeusia y aumento de la sed. La saliva es necesaria para la ejecución normal de las funciones orales como el gusto, formar el bolo alimenticio, tragar y hablar. (12) Las tasas globales de flujo salival no estimulado menores de 0,1 ml/min se consideran indicadoras de hiposialia, ya que la tasa normal es de 0,3-0,5 ml/min. Para su tratamiento se puede recurrir a chicles con flúor sin azúcar, o solución salina con bicarbonato de sodio que puede mejorar directamente la lubricación oral, así como estimular las glándulas salivales para que aumenten el flujo de saliva. (5, 12) Para los casos más severos, la pilocarpina, es un fármaco sialogogo que estimula la secreción salival. (2, 6, 7, 10) También se puede recurrir a la saliva artificial compuesta por xilitol, sales minerales, flúor, agentes antimicrobianos y polímeros. (2, 7) La hiposialia también se puede observar debido al síndrome de Sjögren, trastorno auto inmunitario en el cual hay una destrucción mediada inmunológicamente de las glándulas salivales. (12) La sialoadenitis es la inflamación e hipertrofi a dolorosa de las glándulas salivales causada generalmente por citomegalovirus (CMV) o bacterias como el Staphilococus aureus y Streptococus viridans. Los pacientes inmunocomprometidos pueden desarrollar esta patología. Para su tratamiento se debe recurrir al cultivo con toma de muestra en la salida del conducto y antibiograma, antibióticos, abundantes líquidos, analgésicos y drenar el pus. (10)
Disgeusia
La disgeusia es un trastorno en el sentido del gusto que va de la mano con la hiposialia, ya que al carecer de estímulos gustativos la secreción salival refleja residual se ve aún más reducida. (6, 7) Con la exposición de la mucosa oral y faríngea a la RQT, los receptores del gusto se dañan y la discriminación del gusto se torna cada vez más comprometida (hipogeusia), o se pierde por completo (ageusia). (2, 7, 8) La etiología probablemente se asocie con varios factores, incluso neurotoxicidad directa de las células gustativas, xerostomía e infección. Después de varias semanas de RT, es común que los pacientes se quejen de no tener sentido del gusto. Por lo general los receptores del gusto recuperan la funcionalidad entre 6 a 8 semanas después de concluida la RT, aunque también podría llevar 4 meses. (2, 12) Los pacientes que están recibiendo QT pueden sentir un sabor desagradable secundario a la difusión del fármaco en la cavidad oral y suelen describir disgeusia en las primeras semanas después del cese de la misma. Sin embargo, frecuentemente los pacientes desarrollan hipogeusia permanente. Se ha postulado el daño a la microvellosidades de las papilas gustativas y a la superficie externa de las células gustativas como el mecanismo principal de la pérdida del sentido del gusto. Las papilas más sensibles son las fungiformes, relacionadas al gusto dulce y salado. (6, 7, 12) Se ha informado que los complementos con sulfato de zinc ayudan en la recuperación del sentido del gusto. (7, 12) Estas patologías: mucositis, hiposialia, disgeusia y disfagia, unido a las náuseas, vómitos y diarreas, provocados por la terapia oncológica, pueden llevar a la pérdida del apetito, malnutrición y caquexia deteriorando la calidad de vida del paciente. (2, 6, 8, 10, 12) Para evitar que esto suceda, o minimizarlo hay que asegurar una ingesta nutritiva adecuada con el uso de complementos nutricionales y vitamínicos desde antes del inicio de la terapia oncológica ya que la malnutrición y pérdida de peso agrava el desarrollo, curso y pronóstico de las lesiones e infecciones. (2, 6, 8, 12)
Dolor
El dolor es un síntoma muy común en los pacientes oncológicos. En la esfera odontológica las causas de dolor pueden ser muy variadas y muy comúnmente coagregadas: caries, hipersensibilidad dentinaria, prótesis mal adaptadas e infecciones óseas o mucosas. Para cada tipo de dolor se describe en su apartado el tratamiento específi co a realizar, además de la medicación con analgésicos, opioides o psicofármacos según la severidad. (6)
Conclusiones
Como se ha visto el tratamiento oncológico produce un gran número de complicaciones y/o secuelas orales, muchas de ellas muy graves y letales. Para evitar o disminuir la incidencia de estas complicaciones el odontólogo debe ser una pieza clave en el equipo multidisciplinario oncológico y una primera línea en la prevención y defensa. Su participación debe establecerse antes, durante y después del tratamiento oncológico propiamente dicho. Debe existir una correcta interrelación y comunicación fl uida entre todos los integrantes del equipo oncológico multidisciplinario para de esta manera asegurar el mejor resultado posible del tratamiento oncológico, lo que repercutirá favorablemente en la cantidad y calidad de la sobrevida del paciente.
Referencias bibliográficas
-
Navarro Vila C. Tratado de cirugía oral y maxilofacial. Tomo III. Madrid. Arán Ediciones S.R.L. 2004.
-
Gay Escoda C, Berini Aytés L, Sánchez Garcés Mª, Osteorradionecrosis. En:Gay Escoda C, Berini Aytés L. Cirugía Bucal. !ed. Madrid: Ediciones Ergón, 1999. 731-748.
-
Vassallo J A, Barrios E. Actualización ponderada de los factores de riesgo del cáncer. Las localizaciones de la enfermedad en el Uruguay, su distribución por incidencia y mortalidad. Comisión honoraria de lucha contra el cáncer. Uruguay. 2003. 11-13.
-
Vassallo J A, Barrios E. III Atlas de mortalidad por cáncer en el Uruguay. Comparación de dos quinquenios, 1994-1998 y 19992003. Comisión Honoraria de lucha contra el cáncer. Uruguay. 2005.
-
Barasch A, Peterson D E Risk factors for ulcerative oral mucositis in cancer patients: unanswered questions. Oral Oncol. 2003. 39 (2): 91-100.
-
De Vita Jr V T, Hellman S. Rosenberg, S. A. Cancer. Principles & practice of oncology. 5th. Lippincott-Raven Publishers. 1997.
-
Langdon J D, Henk J M Malignant tumours of the mouth, jaws et salivary glands. 2nd. England. Edward Arnold Editors. 1995.
-
Mealey B L, Semba, S E Hallmon W W. Dentistry and the cancer patient: Part 1-Oral manifestations and complications of chemotherapy. Compend. 1994. 15 (10): 12521261.
-
Rosenthal D I, Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Nat. Rev. Cancer. 2009. 19 (1):29-34.
-
Regezi J A, Sciubba, J J Patología bucal. Correlaciones clinicopatológicas. 3ª Edición. México. Mc Graw-Hill Interamericana. 2006.
-
Woo S B, Matin K, Off-site dental evaluation program for prospective bone marrow transplant recipients. I am dent assoc 1997; 128 (2): 189-193.
-
Silverman S Jr. Oral cancer: Complications of therapy. Oral Surg., Oral Med., Oral Pathol., Oral Radiol., Endod. 1999. 88 (2): 122-126.
-
Demarosi F, Bez C, Carrassi A. Prevenzione e trattamento della mucosite orale da chemio e radioterapia. Minerva Stomatol. 2002, 51 (5): 173-186.
-
Semba S E, Mealey B L, Hallmon W W. Dentistry and the cancer patient: Part 2-Oral health management of the chemotherapy patient. Compend. 1994. 15 (1): 1378-1387.
-
Akintoye S O, Brennan M T, Graber C J, et al. A retrospective investigation of advanced periodontal disease as a risk factor for septicaemia in hematopoietic stem cell and bone marrow transplant recipients. Oral Surg,Oral Med, Oral Pathol, Oral Radiol, Endod. 2002. 94 (5) p : 581- 588.
-
Lalla R V, Sonis S T, Peterson D E. Management of oral mucositis in patients who have cancer. Dent. Clin. North Am. 2008. 52 (1): 61-77.
-
Rubenstein E B, Peterson D E, Schubert M et al. Clinical practice guidelines for the prevention and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer. 2004. 100:2026-46.
-
Epstein J B, Vickars L, Spinelli J, et al. Efficacy of chlorhexidine and nystatin rinses in prevention of oral complications in leukemia and bone marrow transplantation. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod. 1992, 73 (6): 682-689.
-
Epstein, J B, Schubert M M. Orophryngeal mucositis in cancer therapy. Review of patho-genesis, diagnosis and management. Oncology. 2003; 17:1767-1779.
-
Peterson D E, Lalla R V. Oral mucositis: the new paradigms. Curr. Opin. Oncol. 2010. 22 (4): 318-22.
-
Garfunkel A A. Oral mucositis. Th e search for a solution. N. Eng. J. Med. 2004. 351 (25), 2649-2651
-
Peterson D E, Bensadoun R J, Roila F, et al. Management of oral and gastrointestinal mucositis: ESMO clinical recommendations. Ann. Oncol. 2009. (Suppl 4): 174-7.
-
Robbins S L, Cotran R S. Patología estructural y funcional. 7ª Ed. Barcelona: Elsevier. 2005.
-
Peterson D E, Barker N P, Akhmadullina L I, et al. Phase II, randomized, double-blind, placebo-controlled study of recombinant human intestinal trefoil factor oral spray for prevention of oral mucositis in patients with colorectal cancer who are receiving fl uorouracil-based chemotherapy. J. Clin. Oncol. 2009. 27 (26): 4333-8.
-
Vera-Llonch M, Oster G, Hagiwara M, et al. Oral mucositis in patients undergoing radiation treatment for head and neck carcinoma. Risk factors and clinical consequences. Cancer. 2006. 106 (2): 329-336.
-
Lugliè P F, Mura G, Mura A, et al. Prevenzione delle paradontopatie e delle stomatomuco siti in corso di chemoterapia antineoplastica. Studio clinico. Minerva Stomatol. 2002, 51 (6): 231-239.
-
Clarkson J E, Worthington H V, Furness S et al. Interventions for treating oral mucositis for patients with cancer receiving treatment. Cancer. 2010, 4(8): 15-19.
-
Spielberger R, Stiff P, Bensinger W, et al. Palifermin for oral mucositis after intensive therapy for hematologic cancers. N Engl J Med 2004, 351(25): 2590- 2598.
-
Epstein J B. Mucositis in the cancer patient and immunosuppressed host. Infect Dis. Clin North Am. 2007; 21(2): 503-522.
-
Schmid I, Schmitt M, Streiter M, et al. Parenteral nutrition is not superior to replacement fluid therapy for the supportive treatment of chemotherapy induced oral mucositis in children. Eur J Cancer. 2006. 42 (2):205-211.
-
Jones L R, Torth B B, Keene H J. Eff ects of total body irradiation on salivary gland function and caries-associated oral microfl ora in bone marrow transplant patients. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod 1992. 73 (6): 670-676.
-
Napeñas J J, Brennan M T, Mougeot F K, et al. Relationship between mucositis and changes in oral microfl ora during cancer chemotherapy. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod 2007; 103(1): 48-59.
Dr. Damián Guillermo Lanza Echeveste: damlanza@yahoo.com














