Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Odontoestomatología
versión On-line ISSN 1688-9339
Odontoestomatología vol.12 no.14 Montevideo mayo 2010
Proteolisis enzimática del colágeno dentinario
López Jordi, María del Carmen1, Amaral Schiaffino Rosana2, Bussadori Kalil Sandra3
1 Prof. Tit. Cátedra de Odontopediatría. Facultad de Odontología. UDELAR. Uruguay.
2 Prof. Adj Cátedra de Bioquímica y Biofísica. Facultad de Odontología. UDELAR. Uruguay.
3 Prof. Prof. Cátedra de Materiais Odontológicos. Facultades de Odontología UNIMES/Santos/SP y UNINOVE/São Paulo - Brasil
Endereço para correspondência: Dra. María del Carmen López Jordi - dra.lopezjordi@gmail.com, Dra. Rosana Amaral Schiaffino - reamaral@adinet.com.uy, Dra. Sandra Kalil Bussadori - skb@osite.com.br
Resumen
El presente trabajo propone una revisión de las características del tejido dentinario, analizando particularmente la estructura del colágeno, su formación, los enlaces que estabilizan la estructura cuaternaria y como se altera la fibra de colágeno por acción de las bacterias en dentina cariada así como los componentes de los agentes "removedores de tejido cariado”. Finalmente, se presenta una secuencia terapéutica clínica para la caries dentinaria con el propósito de establecer una guía de tratamiento basada en la filosofía de Mínima Intervención.
Palabras clave: Colágeno; Proteolisis enzimática; Removedores de caries.
Abstract
The present work proposes a revision of the dentin tissue's characteristics, specifically studying the collagen's structure, its formation, the bindings that stabilize the quaternary structure and the alteration of the collagen fibre by the action of microorganisms present in the carious dentin and by the components of the “caries removal agents”. Finally, a therapeutically clinic sequence for dentin caries is presented to reach the goal to provide a treatment guide based on the Minimal Intervention Philosophy.
Key words: Caries removers; Collagen; Enzymatic proteolysis.
Introducción
El Policy Statement de la Federación Dental Internacional (FDI), adoptado por la Asamblea General el 1 de octubre de 2002 en Viena, plantea el paradigma de Minimal Intervention in the Management of Dental Caries.
Los principios rectores de la mínima intervención en odontología son:
-
máximo confort del paciente,
-
preservación de los tejidos,
-
capacidad reparadora.
Dentro del capítulo de la preservación de los tejidos, se encuentran los procedimientos que plantean la “Remoción químico-mecánica de caries” basados en los conocimientos histológicos y bioquímicos de la digestión enzimática.
Tejido dentinario
La dentina es un tejido conjuntivo diferenciado, calcificado y sensible, segregado por los odontoblastos, constituido por un 50% de materia inorgánica (cristales de hidroxiapatita más pequeños que los del esmalte, calcio en menor cantidad y 5% de carbonatos), 30% de materia orgánica y 20% de fluidos (Figura 1).
Fig. 1: Dentina mineralizada
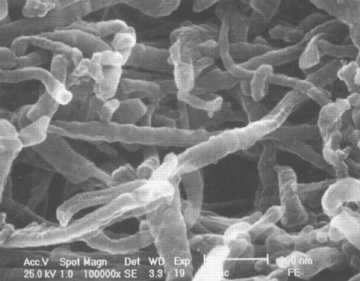
Fig. 2: Colágeno dentinario
El 90% del contenido orgánico del tejido dentinario es COLÁGENO, una glucoproteína fibrosa, insoluble con gran resistencia a la tracción; integra junto con proteoglicanos y otras glicoproteínas la matriz orgánica dentinaria (Figura 2).
Estructura dinámica del colágeno
El colágeno es una proteína estructural - fibrilar cuya unidad básica consta de tres cadenas polipeptídicas conformando una triple hélice (Figura 3), muy compacta. El 30% de los residuos de aminoácidos constituyentes son de glicina los que se ubican en posición axial; en cambio los de hidroxiprolina y de hidroxilisina (25%) se ubican en el exterior. La proporción de residuos de glicina en la molécula de colágeno es elevada en relación a las demás proteínas (en la hemoglobina por ejemplo es del 20%). La secuencia de aminoácidos del colágeno es notablemente regular y periódica a diferencia de las proteínas globulares que raramente tienen una secuencia de aminoácidos regular. La importancia de los residuos de glicina consiste en que su grupo R, un átomo de hidrógeno, ocupa muy poco espacio y por ello permite que las tres cadenas polipeptídicas se aproximen. La mutación en el gen de un solo residuo de glicina del colágeno puede dar lugar a consecuencias negativas importantes como lo muestran los estudios de DNA de pacientes con Osteogénesis imperfecta (enfermedad del tejido conjuntivo con presencia de colágeno tipo I defectuoso).
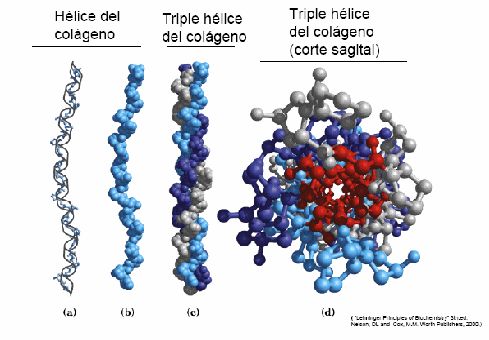
Fig. 3 : Colágeno – formación de triple hélice.
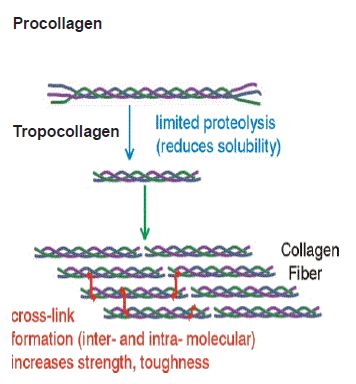
La unidad básica estructural del colágeno es el tropocolágeno, constituido por tres cadenas polipeptídicas del mismo tamaño y de composición idéntica o no, según el tipo de colágeno. El tipo I consta de dos cadenas de una clase, y una de otra, mientras que los tipos II, III y IV constan de tres cadenas idénticas para cada uno de ellos. Los fibroblastos lo secretan como procolágeno. De las regiones amino y carboxilo terminales de cada una de sus tres cadenas, son escindidas enzimáticamente por procolágeno peptidasas extracelulares, pequeños polipéptidos de estructura primaria diferente al resto de las cadenas. Así se generan las moléculas de tropocolágeno de menor masa molecular que el procolágeno.
La formación de fibras de colágeno tiene lugar en el espacio extracelular, cerca de la superficie celular y no dentro de los fibroblastos. El diseño estructural fundamental de la fibra del colágeno es el de una formación escalonada de moléculas de tropocolágeno, repetida cada cinco filas.
Cada molécula de tropocolágeno mide 300 nm de longitud y entre las moléculas de cada fila hay una brecha de 40 nm. Las brechas se “superponen” cada cinco filas, y si proyectamos el extremo de una de las moléculas hacia la fila adyacente, entre los extremos de dos moléculas de filas adyacentes, queda un espacio de 64 nm, que es responsable de la estriación que presenta la fibra de colágeno en las micrografías electrónicas. (Figuras 4 y 5).
Fig. 4: Formación de fibras
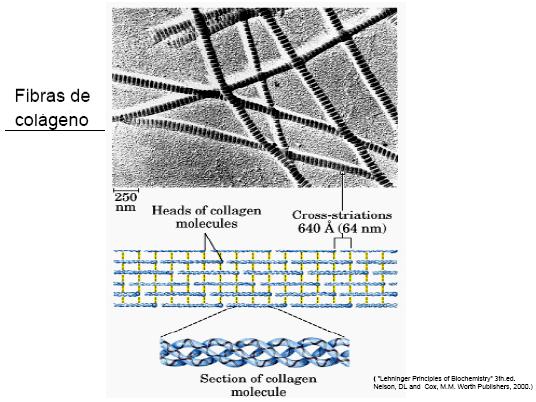
Fig. 5: Formación de fibras.
El tropocolágeno se estabiliza por puentes de hidrógeno entre las tres cadenas que lo forman y enlaces covalentes entre residuos de lisina (Figura 6) mientras que, la fibra de colágeno se estabiliza por enlaces cruzados covalentes entre las unidades de tropocolágeno que involucran residuos de lisina, hidroxiprolina e histidina. (Figura 7).
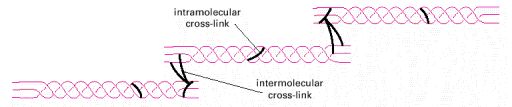
Fig. 7: Formación de “crosslink” en la fibra colágena.3
El número y tipo de enlaces varía con la función y la edad del tejido. El colágeno intacto es una estructura densa inaccesible a los solventes, en cambio en su forma desnaturalizada las enzimas proteolíticas tienen capacidad de actuar sobre algunas de sus moléculas.
En esta característica del colágeno desnaturalizado es que se basa la acción selectiva de los “removedores del tejido dentinario cariado”.
Removedores del tejido cariado
Los compuestos que integran los removedores del tejido dentinario cumplen con los siguientes objetivos:
-
remover por medios químico-mecánicos los tejidos cariados
-
cumplir lo anteriormente citado de forma atraumática (con instrumentos de mano, sin filo)
-
minimizar y aún eliminar los estímulos dolorosos
-
preservar al máximo los estructuras sanas
-
sumar propiedades antimicrobianas
La caries de dentina definida por E. Kidd4 como “catástrofe ecológica” involucra procesos celulares, reguladores de la velocidad de avance de la lesión, presentando una progresión no lineal (Figuras 8 y 9).5
Fig. 8
Fig. 9
La difusión de metabolitos bacterianos en el tejido dentinario provoca inicialmente una desorganización de la capa odontoblástica y la dentina establece un mecanismo de remineralización como respuesta fisiológica (zona oscura). El avance del proceso de caries en dentina es bastante más irregular y mucho más rápido que en el esmalte principalmente porque el contenido mineral es menor, afectando inicialmente en forma más importante la dentina peritubular que la intertubular por presentar mayor grado de mineralización.
Luego del ataque a la zona mineralizada de la dentina por la acción de enzimas proteolíticas bacterianas el colágeno comienza a desintegrarse de manera progresiva.
Histológicamente se distinguen varias zonas en el avance de la caries en dentina que FUSAYAMA (1975) (6) describe en dos capas:
-
dentina infectada, contaminada por bacterias, no vital, se tiñe con colorantes y no es remineralizable por lo que debe eliminarse.
-
dentina afectada, vital, sensible, desmineralizada (más dura), libre de bacterias y susceptible de ser remineralizada por lo que debe conservarse.
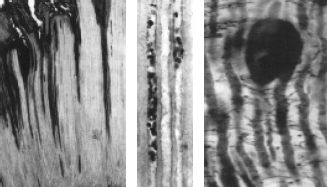
La dentina infectada muestra aglomerados de fibras colágenas dispuestas en forma dispersa, reducción del número de moléculas precursoras del colágeno y de cristales de hidroxiapatita, presencia de bacterias sellando junto con material amorfo la luz de los túbulos dentinarios alargados por la pérdida de la dentina peritubular y sin procesos odontoblásticos en su interior (Figura 10) (7). Se observan fisuras en el espesor del tejido dentinario por ruptura de muchos túbulos dentinarios y colágeno completamente desorganizado. Estas zonas pueden ir aumentando e incluso unirse entre ellas y esto hace que la dentina infectada se remueva con alguna facilidad. Cuando el colágeno se desnaturaliza se reduce su capacidad de servir como núcleos de cristalización.
Fig. 10: Ultraestructura de dentina infectada
La dentina afectada se asemeja a la dentina sana (Hall-Embery, 1997)8, la dentina peritubular es densa y mineralizada, rica en fibronectina, proteína que ejerce una función clave sobre los odontoblastos en la interacción con la matriz extracelular.
Los procedimientos de remoción de tejidos cariados con instrumentos de mano integran:
-
Tratamiento Restaurativo Atraumático -ART- (Frencken, J.E. 1994 9 - Holmgren, C. J. 1999 10) caracterizado por una eliminación mecánica del tejido reblandecido con instrumental de corte, afilado (hatchet, carver) (Figura 11).
-
Tratamiento químico de la dentina desnaturalizada y su posterior remoción con instrumental de mano no afilado, romo (Figura 12).
Fig. 12
Es importante establecer que los diferentes procedimientos de remoción manual del tejido dentinario cariado se complementan obligatoriamente con la utilización de materiales de obturación denominados bio activos que cumplen con los siguientes objetivos:
-
capacidad de sellar la cavidad
-
inhibir la desmineralización y
-
favorecer la remineralización
Los Ionómeros de Vidrio Convencionales de Alta Densidad son los materiales bio activos que además de asegurar una buena adhesión a los tejidos dentarios, han demostrado tener las mejores propiedades para cumplir los otros objetivos antes mencionados ya que se recargan de fluoruros, presentan un coeficiente de expansión térmica similar al diente, buena resistencia compresiva pudiendo preparase con consistencia fluida o condensable.
Es interesante resaltar que la adhesión basada en el mecanismo de difusión iónica, muestra la formación de una capa (difusión iónica) conformada entre el Ionómero de vidrio y el calcio de la hidroxiapatita del esmalte y la dentina. Esta estructura cristalina de fosfato de calcio-polialquenoato explica además de los patrones adhesivos, las propiedades de biocompatibilidad y el efecto mineralizador de los Ionómeros de vidrio (reprecipitación de mineral en la interface Ionómero-diente).
Acción química sobre el colágeno desnaturalizado
La remoción químico-mecánica de caries se basa en la acción de un agente químico que reblandece la dentina que ya está alterada por la acción del proceso carioso, que está desnaturalizada e infectada, lo cual se complementa con una remoción mecánica con instrumentos manuales no cortantes. El agente escinde las uniones no covalentes de la estructura del colágeno, es decir los enlaces de hidrógeno entre cadenas peptídicas que constituyen la triple hélice. Es importante tener presente que para la ruptura de los enlaces mencionados se requiere que algunas uniones covalentes que existen en la triple hélice se encuentren escindidas. Esta situación del colágeno dentinario es producto de la acción de las enzimas proteolíticas que producen las bacterias por el avance del proceso carioso y también por enzimas propias de la dentina como las metaloproteasas que se activan por la acción de iones metálicos como el calcio. El fenómeno mencionado genera que la aplicación de agentes químicos como los removedores de caries no actúen sobre el colágeno íntegro sino que disuelven solamente la dentina que se encuentra alterada por la caries dental (los enlaces destruidos se encuentran en la dentina infectada) permitiendo la remoción selectiva de la dentina.
Los productos utilizados para obtener una acción química sobre el tejido dentinario desnaturalizado han ido variando y evolucionando con el tiempo:
El primer producto disponible fue el Caridex™ en 1984, ácido-N-monocloro-DL-2 aminobutírico (NMAB) que causaba el rompimiento del colágeno de la dentina infectada facilitando su remoción. Era muy difícil de mantener en stock y no tuvo gran repercusión. Luego apareció en el mercado el Carisolv™, en 1999, en la Universidad de Gotemburgo – Suecia, compuesto por un líquido transparente (0.5 % de hipoclorito de sodio) y un gel de color rojo, mezcla de tres aminoácidos: leucina, lisina y ácido glutámico. El mecanismo de acción se explica dado que el hipoclorito de sodio produce la degradación de la sustancia orgánica a temperatura ambiente. La descomposición del tejido necrótico se produce porque el cloro rompe las uniones que mantiene la estructura fibrosa unida dentro de la matriz de colágeno, a pH 12. La selectividad de la acción sobre el tejido desnaturalizado está dada por las cloraminas. Al contacto del gel con el tejido desnaturalizado se produce una cloración de las fibras de colágeno parcialmente degradadas con la conversión de la hidroxiprolina en ácido pirrol 2-carboxílico, lo cual inicia la ruptura de las fibras colágenas y un selectivo ablandamiento de la capa superficial de dentina.
Por su elevado pH solamente la fase orgánica de la dentina es afectada. Tiene un efecto selectivo sobre el colágeno desnaturalizado, no afectando la dentina sana.
Como otro componente dentro del sistema químico-mecánico de remoción de tejidos cariados surge el Papacárie® en el 2003, UNINOVE (Universidad de São Paulo/Brasil), como un mecanismo de proteolisis enzimática del colágeno dentinario. Este producto está compuesto por Papaína, cloramina, azul de toluidina, conservante, espesante y vehículo. La enzima Papaína es una tiol-proteinasa, es decir, una enzima proteolítica cuyo centro activo posee un grupo -SH- . Se extrae del látex de la papaya o mamao verde (Carica papaya), es la responsable de las conocidas propiedades digestivas de dicha fruta y es empleada ampliamente en la industria alimenticia, farmacéutica y cosmética.
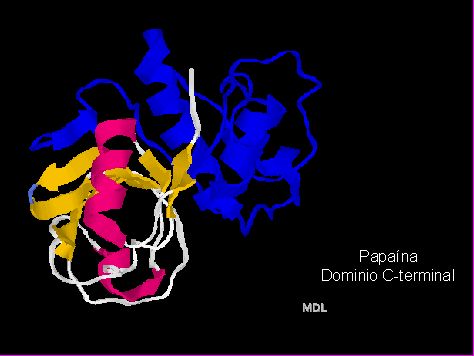
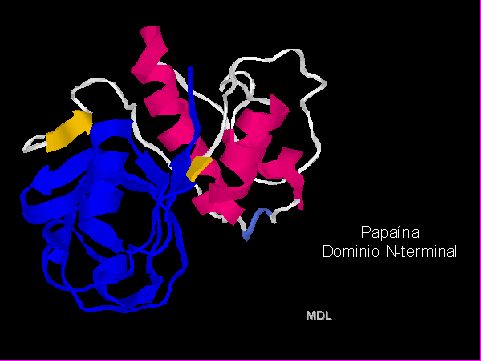
En la estructura de la Papaína (Figuras 13 y 14)11 se aprecian dos "ovillos" (dominios) separados por una zona sin estructura secundaria en particular. Así, el dominio 1, que corresponde aproximadamente a la mitad N-terminal de la molécula, presenta una estructura secundaria de tres alfa-hélices, mientras que el dominio 2 o C-terminal: tiene una estructura secundaria distinta (un meandro b antiparalelo y dos a-hélices). A menudo los dominios corresponden a diferentes funciones dentro de la misma proteína (por ejemplo, regiones catalíticas y regiones regulatorias) y casi siempre corresponden a tramos genéticos codificantes (exones) diferentes.
Fig. 14
La Papaína se identifica como una endoproteasa. Las proteasas con tiol (Stryer L.)12 ,13 son un grupo de enzimas ampliamente distribuido, que contiene un centro activo con cisteína, la cual realiza una función análoga a la de la serina 195 de la quimotripsina. La catálisis se realiza a través de un intermediario tioester y se halla facilitada por una cadena lateral de histidina próxima. Presenta propiedades: antiinflamatoria, bacteriostática y bactericida (Candido, 200114 ;Pereira, 2004 15).
Particularmente, la papaína es una tiol proteasa cuyo centro activo es Cis 25, His 159, y Asp 15816. Presenta una amplia actividad proteolítica ante las proteínas, péptidos de cadena corta, enlaces amida y ésteres de aminoácidos y se utiliza de manera muy extendida en el ámbito de la alimentación y la medicina. Su peso molecular es de 23,000 dalton y su pH óptimo es entre 3 y 7 el cual varía según el sustrato. Su número de clasificación es 3.4.22.2. Pertenece a la clase de las hidrolasas, tiene una amplia especificidad sobre las uniones peptídicas siendo una endopeptidasa (rompe enlaces peptídicos de sus sustratos que no están cerca de los extremos terminales de la proteína a romper).
Discusión
Partiendo del análisis de la estructura del colágeno y de su alteración por la acción de la caries dental se propone la comprensión de la acción de los agentes "removedores de tejido cariado” particularmente de la papaína, profundizando su acción enzimática sobre el tejido desnaturalizado, apoyados en referentes que explican la importante acción sobre el tejido dentinario. Según Flindt (1979 17- 1993 18), la papaína actúa sobre el tejido lesionado por la acción infecciosa del proceso carioso, debido a la ausencia de una antiproteasa plasmática, la a1-anti-tripsina que impide la acción proteolítica en los tejidos normales. Actúa quebrando las moléculas del colágeno parcialmente degradado por la acción de la caries, pudiendo digerir además las células inertes, lo cual facilita su remoción. Tiene un efecto selectivo sobre el colágeno desnaturalizado, no afectando la dentina sana. Silva y col., (2003 19) evaluaron la biocompatibilidad in vitro, realizando tests a corto y largo plazo en cultivos de fibroblastos, a diferentes concentraciones de papaína y cloramina (2, 4, 6, 8 y 10%), demostrando que el producto no presentaba actividad citotóxica a esas concentraciones. En la remoción químico-mecánica de caries las cloraminas son utilizadas para ablandar químicamente la dentina infectada. Esta cloración afecta la estructura secundaria y/o cuaternaria del colágeno, rompiendo los puentes de hidrógeno y facilitando la remoción del tejido infectado. Lopez y col.20 concluyen que la utilización del gel de papaína en la remoción química de tejido cariado no interfiere con la fuerza de adhesión de los materiales de restauración a la dentina. Corrêa y col.21 en un estudio in vitro demostraron que la superficie dentinaria remanente luego de la remoción de caries utilizando fresas a baja velocidad y dos métodos de remoción química (Papacárie y Carisolv), presentaba un grado de dureza menor a la dentina sana pero que no se observaron diferencias significativas en ella comparando los tres métodos de remoción de caries utilizados (p<0.05).
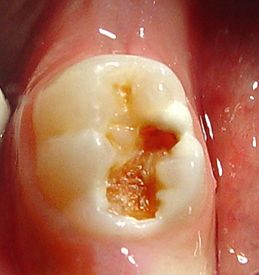
Caso clínico
Paciente niño, sexo masculino, 5 años de edad
Figura 15: Diagnóstico.
Aislación.
Profilaxis, lavado, secado.
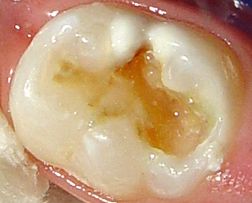
Figura 16: Cavidad (Papacarie)
Colocación del producto.
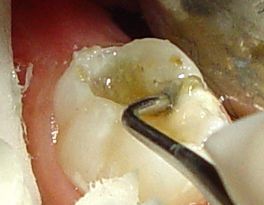
Figura 17:
Remoción de tejido infectado- movimientos laterales.
Reaplicación del gel y nuevo raspado
Constatación de transparencia del gel (aspecto vítreo)
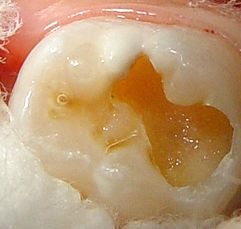
Figura 18: Limpieza cavitaria
Figura 19: Preparación del cemento de Vidrio Ionómero y su inmediata inserción. Digitopresión
Terminación de la reconstrucción.
Control oclusal.
Protección con barniz.
Conclusión
En el presente trabajo de revisión, se presenta evidencia sobre la acción de digestión enzimática por parte de la papaína sobre el tejido dentario desnaturalizado por la progresión de la caries. Asimismo y a fin de objetivizar la acción de la papaína se culmina presentando un caso clínico, a modo de guía de tratamiento, con la utilización de Papacárie®.
Referencias Bibliográficas
1. Lehninger. Principles of Biochemistry. 3th. ed. Nelson AL and Cox MM. Worth Publishers 2000.
2. Garrett RH and Grisham CM. Saunders College Publishing.1998.
3. Alberts B; Bray D; Lewis J; Raff M; Roberts K; Watson JD. Molecular Biology of the Cell. 3ª ed. New York. Garland Publishing. 1994.
4. Kidd E; Fejerskov O. Dental Caries: The Disease and Its Clinical Management. 2d. edition. Wiley, John & Sons Incorporated. 2008.
5. Bjørndal L. Dentin Caries: Progression and Clinical Management. Oper. Dent. 2002; 27: 211–7.)
6. Ohgushi K; Fusayama T. Electron microscopic structure of the two layers of carious dentin. J Dent Res 1975; 54:1019-1026.
7. Thylstrup A; Qvist V. Principal enamel and dentine reactions during caries progression. In: Thylstrup A; Leach SA; Quist V (eds): Dentine and dentine Reactions in the oral cavity. Oxford: IRL Press (1987) 3-16.
8. Hall RC; Embery G. The Use of Immunohistochemistry in Understanding the Structure and Function of the Extracellular Matrix of Dental Tissues. Adv. Dent. Res. 1997; 11; 478.
9. Frencken JE; Sognpaisan Y; Phantumvanit P. y col. Atraumatic restorative technique: evaluation after one year. Dent J. London, Vol. 44, p.460-64, 1994.
10. Frencken JE, Holmgren CJ. Atraumatic Restorative Treatment for dental caries. Nijmegen: STI book; 1999: p 99.
11. Universidad de Salamanca. Disponible en: www.usal.es /~dbbm//modmol/modmol05/mm05t04.htm
12. Stryer L. Bioquímica. 2ª ed. Barcelona. Editorial Reverté SA. 1982. p. 167-82
13. Stryer L. Bioquímica. 4ª ed. Narcelona. Editorial Reverté SA. 1995. p. 227-8.
14. Candido L. C. Nova abordagem no tratamento de feridas. São Paulo: SENAC-SP; 2001. Disponível em: URL: http://www.feridologo.com.br/curpapaina.htm [2003 dez].
15. Pereira S; Silva L; Piccini D; Santos E; Bussadori S. Comparação in vitro do potencial antimicrobiano de dois materiais para remoção químico-mecânica da cárie. Braz. Oral Res. 2004; 18: 78.
16. Enzyme EC numbers. EC (Enzyme Commission) numbers assigned by IUPAC-IUBMB. Disponible en: www.genome.jp/htbin/get_htext?ECtable
17. Flindt M. Health and safety aspects of working with enzymes. Process Biochem 1979;13(8):3-7.
18. Flindt M. Allergy to a-amylase and papain. Lancet 1979;1:430-432. Apud: Velasco MVR. Desenvolvimento e padronização do gel contendo papaína para uso tópico. [Dissertação de Mestrado]. São Paulo: Faculdade de Ciências Farmacêuticas da USP; 1993.
19. Silva L R; Tonolli G; Santos E M; Bussadori S K. Avaliação da biocompatibilidade "in vitro" de um novo biomaterial para a remoção química e mecânica da cárie. In: 20ª Reunião Anual SBPqO, 2003, Águas de Lindóia. 2003. Anais. Pesquisa Odontológica Brasileira. v.17. p.93.
20. Lopes M; Mascarini R; Silva B; Flório F; Basting R. Effect of a papain-based gel for chemomechanical caries removal on dentin shear bond strength. J Dent Child. 2007;74(2): 93-7.
21. Corrêa FN, Rocha Rde O, Rodrigues Filho LE, Muench A, Rodrigues CR. Chemical versus conventional caries removal techniques in primary teeth: a microhardness study. J Clin Pediatr Dent. 2007;31(3):187-92.