Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Odontoestomatología
versión On-line ISSN 1688-9339
Odontoestomatología vol.12 no.14 Montevideo mayo 2010
Inmunidad bucal en la primera infancia
Dr. Enrique Rotemberg Wilf * - Dra. Karinna Smaisik Frydman**
RESUMEN: La aparición precoz de enfermedades bucales infecciosas y transmisibles en niños, como caries dentales y enfermedad periodontal, resulta de un desequilibrio entre los mecanismos defensivos del huésped y la virulencia de microorganismos presentes en el medio bucal, a favor de estos últimos. La erupción dentaria que comienza desde el primer año de vida brinda nuevos hábitat a las bacterias en el medio bucal como la superficie del esmalte dental y el surco gingival en el paradencio de inserción dentaria, propicios para el desarrollo de especies bacterianas cariogénicas y/o paradenciopáticas. Este desarrollo es favorecido por condiciones adversas como dieta rica en azúcares fermentables, higiene bucal deficitaria, malposiciones dentarias, escasa secreción salival, hábitos prolongados nocivos como succión no nutritiva, respiración bucal, masticación mínima por ingesta de alimentos que casi no requieren procesamiento para ser deglutidos. Es prioritario controlar los circuitos de infectividad bucal, especialmente durante la primera infancia, cuando el sistema inmune del niño aún está inmaduro y comienza a tomar contacto con antígenos. La madre por el estrecho vínculo físico con su hijo resulta el principal transmisor de gérmenes, sumado a la fase de reconocimiento oral del niño de su propio cuerpo y el entorno. Pese a ello el niño cuenta desde el nacimiento con mecanismos de defensa innatos y otros adquiridos pasivamente en la gestación y a través de la lactancia materna, que dificultan el desarrollo de enfermedades infecciosas bucales y sistémicas.
ABSTRACT: The early emergence of infeccious and contagious mouth diseases in children, as dental caries and periodontal disease, is a result of an imbalance between the defensive mechanisms of the guest and the virulence of microorganisms in the mouth, in favor of the latter.
The teeth eruption, that begins in the first year of life, provides the bacteria with new habitat in the mouth as the surface of dental enamel and gingival furrow in the tooth insertion paradencio, propitious to the development of bacterial species cariogenic and / or periodontopathics. This development is favoured by adverse conditions as diets rich in fermentable sugar, deficit oral hygiene, teeth in a bad position, little salivary secretion, prolonged harmful habits like non-nutritive sucking, mouth breathing, minimum chewing of food that almost do not require processing to be swallowed.
Controling circuits of mouth infection is a priority, especially during early childhood, when the immune system of the child is still immature and begins to make contact with antigens.The mother, by the close physical link with the child, is the main transmisor of germs, together with the phase of oral recognition of the child of his own body and the environment.
Despite that, the child counts since his birth with innate defense mechanisms and others passively acquired in the gestation and through breastfeeding, which hamper the development of infectious mouth and systematic diseases.
PALABRAS CLAVE: inmunidad en la infancia, saliva, lactancia, circuitos de infectividad.
KEY WORDS: inmunity in childhood, saliva, lactation, circuit of infectivity.
* Profesor Adjunto Titular de la Cátedra de Fisiología General y Buco-dental, Facultad de Odontología, UDELAR.
** Doctora en Odontología, Facultad de Odontología, UDELAR.
Introducción
La cavidad bucal, porción inicial del aparato digestivo, está expuesto a una gran sobrecarga antigénica, en especial procedente de la dieta (1).
A esto se suma la función afectiva de la boca mediante la cual el niño procura en los primeros años de vida la relación cercana con la madre, así como el conocimiento oral del mundo exterior por la riqueza de receptores sensoriales periféricos que posee (2). (Fig. 1)
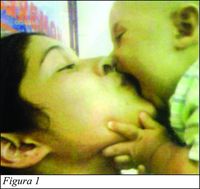
En la primera infancia, desde el momento del nacimiento hasta los dos años de edad, el niño depende de su madre para el cuidado y protección, estando fuertemente unido a ella. Entre los dos y cuatro años se desarrolla la niñez temprana, y a los cuatro y cinco años la etapa preescolar (3). A partir de los 5 años de vida del niño, la madre cumple un papel decreciente como fuente de transmisión de gérmenes a sus hijos debido a un menor vínculo físico entre ambos (2).
La mucosa bucal es portadora de gran cantidad y variedad de receptores. Contribuye por un lado a la adaptación del sujeto con el ambiente y por otro lado interviene en la regulación del equilibrio dinámico del medio interno u homeostasis. Se halla sometida a influencias exógenas por el pasaje de aire, agua y alimentos, así como a influencias endógenas que le llegan por la circulación (4).
En la boca se agrega un nuevo hábitat por la erupción de dientes deciduos. La superficie dentaria es única entre todas las superficies corporales por no ser descamativa y por ser introducida en la cavidad oral durante el primer año de vida (5).
Revisión:
Para el presente trabajo se revisó la literatura relacionada a palabras clave como circuitos de infectividad, inmunidad infantil, saliva, lactancia, caries y gingivitis precoces en niños. Los idiomas seleccionados fueron inglés, español y portugués, sin limitar el período de búsqueda, recurriendo a la base de datos Medline a través de Pubmed y Bireme. Se utilizaron libros recomendados para las Carreras Universitarias Doctor en Odontología y Doctor en Medicina, así como para la Licenciatura en Nutrición.
Desarrollo
Mecanismos defensivos del huésped:
Los seres humanos, en un gran porcentaje sanos, hospedan normalmente parásitos, en especial virus y bacterias. Los seres parásitos no procuran en general la enfermedad y/o la muerte del huésped que los aloja, sino lograr un equilibrio más o menos estable.
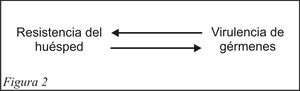
Algunos parásitos colonizan la superficie corporal (piel y membranas mucosas) y otros eligen como hábitat el interior del organismo (1). Las defensas propias del huésped contra agentes que pueden desarrollar su potencial patógeno son las barreras físicas de piel y mucosas cuando permanecen intactas, barreras mecánicas por la acción de lavado de secreciones exócrinas como saliva y lágrimas, la secreción de moco de la vía respiratoria, el desplazamiento ciliar de la mucosa respiratoria alejando partículas de los pulmones, la descamación de células de piel y mucosas, el mecanismo dinámico de remineralización - desmineralización de la superficie del esmalte dentario, la tos y el estornudo. Los mecanismos químicos de protección incluyen sustancias químicas antimicrobianas como el ácido clorhídrico en el estómago, el sudor en la piel, proteínas presentes en algunas secreciones (lágrimas, saliva, sudor, leche, mucus bronquial) como lisozima, peroxidasa, lactoferrina, inmunoglobulina A secretoria; productos de la microflora bacteriana habitual, fragmentos del complemento. Las barreras celulares incluyen células fagocíticas, células asesinas naturales NK (natural killer), linfocitos T y B. La inflamación y la fagocitosis son importantes mecanismos defensivos innatos que intentan limitar la diseminación de los microorganismos (6).
Una respuesta inmunitaria implica dos procesos, la detección de un material extraño al organismo y la elaboración de una reacción contra dicho agente a fin de eliminarlo. La respuesta inmune se integra por dos componentes, uno innato o natural y otro adquirido. La inmunidad natural es una respuesta estereotipada, inespecífica, que no genera memoria inmunológica. La inmunidad adquirida tiene un componente celular mediado principalmente por linfocitos T y un componente humoral mediado principalmente por anticuerpos o inmunoglobulinas. Esta respuesta presenta las siguientes características: es específica, presenta memoria, logra diversidad ya que a un mismo antígeno le corresponden varios anticuerpos con distinto grado de afinidad y un anticuerpo puede reconocer más de un antígeno, posee capacidad de discriminar entre lo propio y lo que resulta extraño al organismo y es autolimitada al detenerse la respuesta al cesar el estímulo antigénico (7).
La mayoría de los mecanismos de defensa del huésped que conforman la inmunidad natural están bien desarrollados en el momento del nacimiento. Los microorganismos que consiguen penetrar en los tejidos se exponen rápidamente a las células fagocíticas, principalmente leucocitos polimorfonucleares neutrófilos (PMN) y macrófagos. Estas células se adhieren, endocitan y digieren material extraño de todo tipo, con un comportamiento similar al de los protozoos primitivos de vida libre. Su función es perfeccionada por los anticuerpos que intensifican el reconocimiento y la adhesión. Los linfocitos T colaboran también con la respuesta inmune inespecífica activando diversas funciones de las células fagocíticas mediante la secreción de linfoquinas o interleucinas.
El complemento es otro integrante de la inmunidad natural presente en el plasma en condiciones normales. Los componentes de la vía del complemento interactúan con ciertos microorganismos, con anticuerpos y entre sí para estimular la fagocitosis y promover los cambios de permeabilidad vascular de la respuesta inflamatoria.
Las citoquinas forman un gran sistema de mediadores intercelulares que incluyen las interleucinas, factores de necrosis tumoral, interferones y factores de crecimiento tipo hematopoyéticos. Pueden originarse en leucocitos, fibroblastos, linfocitos T entre otras células.
Las células clave de la inmunidad adaptativa son los linfocitos T y B. La respuesta primaria implica el reconocimiento de unos pocos antígenos y el desarrollo en varios días de un pequeño número de linfocitos precursores. En cambio, las respuestas secundarias pueden ser muy rápidas y más eficaces que las primarias en eliminar antígenos (1).
En las superficies mucosas coexisten los sistemas inmune específico e inespecífico. Los gérmenes presentes en la cavidad bucal desarrollan y maduran el tejido linfoideo asociado a las mucosas (MALT: Mucous Associated Linfoid Tissue). Este tejido linfoideo se presenta en agrupamientos como las amígdalas o en forma difusa en la submucosa y lámina propia. Es la base anatómica del Sistema Inmune Común de las Mucosas (SICM) descrito por Tomasi y col. en la década del 60. El SICM asegura que una agresión bacteriana a nivel mucoso localizada en un órgano, además de inducir una respuesta inmune local sensibiliza al resto de las mucosas de modo que se produzca la eficiente reacción inmune específica en cualquier mucosa frente al mismo agresor. En especial en las glándulas salivales menores se han encontrado acúmulos linfoideos asociados a sus conductos denominados DALT (Duct Associated Linfoid Tissue), que pueden ser lugar de encuentro con antígenos locales. Los antígenos sensibilizan primero a los linfocitos y un porcentaje del grupo B madura a plasmocitos productores de IgA específica. Las dos moléculas de IgA que forman el dímero están unidas por una pieza de unión denominada cadena J. Esta es producida por células linfoideas asociadas a las glándulas exócrinas. Este conjunto de dos moléculas de IgA y la cadena J a su vez se unen a un polipéptido estabilizador que le sirve de transportador conocido como pieza secretoria, hasta la excreción en la luz ductal. El proceso de ensamblaje forma la S-IgA o inmunoglobulina A secretoria (8).
Uno de los principales factores responsables de la salud oral es la saliva, que actúa favoreciendo la lubricación de las superficies bucales, ayuda a mantener la integridad de la mucosa, posee capacidad antimicrobiana, de aclaramiento y limpieza oral, de remineralización de la superficie del esmalte y de control del pH oral debido a su capacidad tampón. Por otra parte juega un papel esencial en la masticación, deglución y fonación. Esto complementa el concepto tradicional de saliva como líquido fundamentalmente digestivo que comienza la hidrólisis del almidón. La mayoría de la saliva secretada en reposo entre comidas está producida por las glándulas mayores o principales submaxilar/sublingual, el resto por las glándulas parótidas y las glándulas salivales menores o accesorias. En la secreción estimulada por la alimentación se igualaría la secreción de las parótidas a la suma de las secreciones de la sublingual y submaxilar. Durante el sueño en cambio se produce muy poca cantidad de saliva.
La modificación en más o en menos en la producción de flujo salival conlleva una serie de cambios orales que van a deteriorar la calidad de vida del paciente (9). La hipersecreción salival, hipersalivación o ptialismo describe el aumento objetivo del flujo de saliva. El término sialorrea es un síntoma que indica la sensación subjetiva de aumento de flujo de saliva. Se denomina sialorrea falsa cuando no está aumentada la salivación sino que existe una alteración en la deglución o una incontinencia labial que hace que el individuo no trague la saliva o la vierta al exterior. Las causas de real hipersecreción salival pueden ser fisiológicas en los lactantes, durante el período de erupción de los dientes y durante el embarazo, principalmente entre el 2º y 5º mes de gestación (10). La hiposalivación por el contrario es un signo objetivo de reducción del flujo salival, es el factor etiológico más común de la xerostomía. La xerostomía, sensación subjetiva de sequedad bucal, es un síntoma relatado por el paciente. Aparece cuando el flujo salival normal se reduce en un 50%, la secreción salival diaria es de 500 cc o inferior, la tasa de secreción desciende por debajo de 0,1-0,2 ml/min en saliva de reposo en períodos interdigestivos y por debajo de 0,5-0,7 ml/min para saliva estimulada. El sexo femenino y la edad avanzada son factores predisponentes de xerostomía (10,11).
La saliva total es una mezcla de fluidos orales que incluye las secreciones del conjunto de glándulas salivales mayores y menores, el fluido gingival crevicular, expectoración bronquial y secreciones nasales, bacterias y productos bacterianos, virus, hongos, células epiteliales descamadas, otros componentes celulares y restos alimenticios. La saliva ductal se colecta en la desembocadura del conducto excretor de la glándula salival mayor, sin la presencia de contaminantes (8,12).
La alteración de la secreción de las glándulas salivales se asocia a dificultades en la masticación, deglución y fonación. La lubricación de los tejidos orales es inadecuada en caso de déficit, con mayor fragilidad y lesiones ulcerosas de la mucosa, la función de barrera de la mucosa se ve comprometida. Se puede alterar el delicado balance entre la población oral microbiana y la cavidad bucal apareciendo infecciones por microorganismos oportunistas con serio potencial patógeno (13).
La lactancia corresponde al primer período de vida, que puede durar varios meses, durante el cual el niño se alimenta de leche, de preferencia materna. Esta alimentación aporta al lactante todas las sustancias nutritivas que le permiten cubrir sus necesidades. Los mamíferos se alimentan exclusivamente con la leche segregada por las glándulas mamarias de sus madres durante los primeros meses de vida. En esta época inicial de vida la leche es un alimento completo que contiene glúcidos, proteínas lípidos, además de vitaminas, elementos químicos inorgánicos como calcio, fósforo, sodio, potasio hierro y agua que representa el 87 % del peso total de la leche (14).
Los niños reciben protección durante la vida intrauterina por anticuerpos que la madre envía al feto a través de la placenta. Esas proteínas circulan en el niño durante semanas e incluso meses después del nacimiento. Con la lactancia natural el niño goza de mayor protección contra los agentes patógenos presentes en el entorno inmediato, al recibir de su madre anticuerpos, otras proteínas y células inmunitarias como macrófagos y linfocitos (15). (Fig. 3)
La leche de una madre que tuvo un parto prematuro contiene más proteínas, grasas, calorías, calcio, inmunoglobulinas, y menos lactosa dado que el bebé no tiene desarrollada la lactasa.
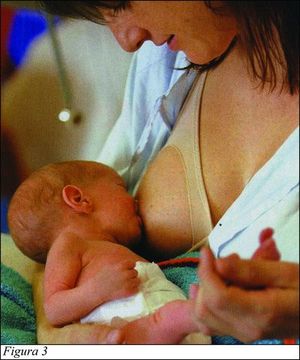
La leche materna para un niño de término normal contiene lactosa como principal hidrato de carbono y fuente de calorías. La lactosa está compuesta por glucosa y galactosa. La galactosa es indispensable para la síntesis de galactolípidos, necesarios para el desarrollo neuronal cerebral. Además contiene oligosacáridos que estimulan el desarrollo del lactobacilo bífidus, con reconocido rol protector intestinal. Los lípidos son nutrientes importantes que aportan el 50% de las calorías y están presentes como triglicéridos (ácido oleico, palmítico), ácidos grasos esenciales (linoleico, linolénico) y también ácidos grasos poliinsaturados de cadena larga (docohexanoico y araquidónico), vinculados al desarrollo del tejido nervioso y del nervio óptico. Las proteínas están compuestas 60% de proteínas del suero y 40% de caseína. Entre las primeras se incluyen alfalactoalbúmina, lactoferrina, lisozima, IgA secretoria, IgG, IgM y albúmina (16).
La secreción mamaria de los primeros días denominada calostro tiene una composición intermedia entre el suero sanguíneo y la leche. Contiene poca grasa y es muy rica en proteínas como inmunoglobulina A secretoria, muy importante para ésta etapa de vida del niño que presenta entre otros sus sistemas digestivo e inmunitario con cierta inmadurez. La leche madura o completa se segrega entre 7 y 10 días después del parto (14). Las moléculas de S- IgA proporcionan al niño una barrera defensiva que protege la superficie de las mucosas, incluida la oral, sin producir inflamación. Consiguen bloquear los microorganismos e impedir que se fijen y atraviesen la mucosa (15).
A nivel internacional en 1990 en forma conjunta la Organización Mundial de la salud (oms) y la UNICEF (United Nations Internacional Children´s Emergency Fund) adoptaron la iniciativa del Hospital amigable para el bebé a fin de aumentar la frecuencia y duración de la lactancia. El amamantamiento es el mejor método para alimentar al lactante durante los primeros cuatro a seis meses de vida en forma exclusiva y presenta las siguientes ventajas para la American Dietetic Association y la American Academy of Pediatrics respecto a cualquier otra alternativa:
-
La leche materna es mejor que las fórmulas comerciales para lactantes desde el punto de vista nutricional, las que además tienen un costo;
-
La leche materna es bacteriológicamente segura y siempre fresca;
-
La leche materna contiene diversos factores antiinfecciosos y células inmunitarias;
-
La leche materna es la menos alergénica de cualquier alimento para el lactante;
-
Los lactantes amamantados tienen menos posibilidad de sobrealimentarse;
-
El amamantamiento promueve un desarrollo satisfactorio de la mandíbula y los dientes;
-
El amamantamiento favorece automáticamente un contacto cercano entre la madre y el niño, siendo éste un proceso cómodo una vez establecido (17).
Circuitos de infectividad:
Los circuitos de infectividad, que pueden darse simultáneamente, se clasifican en:
-
De los contactos cercanos, a través de la saliva;
-
De la lactancia, por deficiente higiene de pezón y/o tetinas;
-
De la higiene de manos, chupetes, juguetes y otros objetos
(18).
a) El período de colonización de la cavidad bucal del niño con los Streptococcus mutans de la madre se ha establecido en la llamada ventana de infectividad. (window of infectivity). El manejo preventivo de la ventana de infectividad, iniciado precozmente con la madre embarazada y continuado con sus hijos resulta altamente efectivo en comparación con grupo control de características similares que no cumpla visitas periódicas al personal de salud, aun en una comunidad que recibe los beneficios de agua potable fluorada. Una de las principales estrategias en la prevención de caries es evitar la infección inicial y colonización de la cavidad bucal del niño por el Streptococcus mutans efectuando medidas profilácticas y educativas con su madre con el propósito de controlar la transmisión de bacterias cariogénicas a su hijo después del nacimiento. Diversos estudios han mostrado que la colonización temprana de la boca del niño por el Streptococcus mutans determina a futuro una alta experiencia de caries (19). La mayoría de los niños parecen adquirir los Streptococcus mutans de sus madres por contacto salival a través de besos en la boca, gotas de saliva expulsadas al hablar o al toser, o por usar los cubiertos del niño para probar su comida, entre otras causas. (Fig. 4)
La primera “ventana de infectividad” transcurre entre los 6 y 31 meses de vida del niño (20), aunque el período más crítico de colonización bucal por el Streptococcus mutans podría estar entre los 19 y 31 meses de edad, lo que sugiere una correlación con la erupción de molares deciduos, piezas con superficies retentivas más propensas de colonizar (19, 21). También se ha observado que niños más pequeños pueden ser contagiados después de la erupción de sus primeros dientes (19). Se requieren superficies sólidas para la colonización y multiplicación de Streptococcus.
La caries dental es una enfermedad infecciosa transmisible como lo demostró Keyes en 1960. Desde entonces se ha identificado a un grupo de bacterias fenotípicamente similares conocidas colectivamente como Streptococci mutans, principal bacteria implicada en el inicio y desarrollo de la caries dental (5). Streptococcus mutans incluye las especies S. mutans y S. sobrinus, considerados los mayores agentes etiológicos de caries dental, mientras que el grupo Lactobacillus estaría asociado con el progreso de lesiones cariosas activas (21). El gran número de lesiones activas en la madre representa una importante fuente de colonización y transmisión de Streptococci mutans a sus hijos (transmisión vertical). La reducción de colonias de Streptococci mutans en el ambiente bucal es un factor importante en la prevención y control de futuras caries dentales. En consecuencia, un régimen preventivo aplicado a la madre durante su embarazo resulta en una reducción significativa de sus Streptococcus mutans salivales, lo que retarda la colonización de estas bacterias en sus hijos (19). La transmisión horizontal de Streptococci mutans es otro vector de adquisición, en especial a partir de la etapa preescolar, por contacto con otros niños (22).
La presencia de Streptococcus mutans en la saliva de los niños es considerado un factor principal de destrucción cariosa de la dentición, por lo que es importante evitar hábitos como limpiar con la saliva del adulto el chupete que ha caído al suelo (2). (Fig. 5)

b) Las respuestas inespecíficas presentes desde las primeras horas de vida extrauterina son reforzadas por la inmunidad pasiva dada antes por la madre a través de la placenta, y después del parto mediante el calostro y la leche materna. La S-IgA constituye la protección contra la adherencia y colonización microbiana en la cavidad bucal, reduciendo la probabilidad de ciertas enfermedades bacterianas, micóticas y virales como son gingivitis, candidiasis y gingivoestomatitis herpética, así como la reducción de enfermedades sistémicas cuyos agentes etiológicos ingresan por la boca. El bebé presenta su boca estéril al nacer, pero puede contaminarse durante el parto si la madre padece Candidiasis vaginal. Si es colonizada su boca por los hongos, puede inocularlos en el pecho materno al mamar. Como la leche es un excelente medio de cultivo para los hongos que se alimentan de carbohidratos, no es infrecuente la aparición de mastitis por Cándida albicans. Además cuando el bebé tiene muguet puede transmitirlo a los pezones y conductos galactóforos de la mama ante la extracción de la leche (18). (Fig. 6)

Los restos de leche en la boca del bebé pueden favorecer la aparición de hongos, sumado al hecho de ser más susceptibles a padecer candidiasis por tener su sistema inmune inmaduro. Cuando no hay piezas dentarias se recomienda pasar gasa o lienzo húmedo en los rebordes y fondos de surco. Con la erupción de los primeros dientes es adecuado el uso de un dedil, que además de limpiar masajea las encías y actúa como mordillo. El cepillado dental debe ser realizado por un adulto, quien debe recurrir a técnicas de cepillado simples, sistemáticas, ordenadas, para no dejar superficies sin limpiar. El fundamento de la higiene bucal es la eliminación de la placa bacteriana que se deposita sobre las superficies dentarias y los tejidos blandos (23). En este período se recomiendan pastas dentífricas con una concentración reducida de fluoruro que contengan como máximo un 0,05% (500 ppm de fluoruro) (21).
La limpieza suave de la lengua debe formar parte de la rutina diaria de higiene bucal con un limpiador de lengua o cepillo pequeño. El uso de enjuagues bucales fluorados formulados para niños no está indicado en menores de seis años por riesgo a tragarlos (24). (Fig. 7)

c) Es muy importante la higiene de manos y uñas, chupetes, tetinas, juguetes y otros objetos que el niño pueda llevar a su boca por ser agentes de transmisión de gérmenes (18). Los cepillos de dientes según estudios de Svangers también actúan como vehículos de transmisión de gérmenes (2). El período de reconocimiento oral se inicia al nacer y se extiende hasta los dos años y medio de edad. El niño en la primera infancia satisface por la boca su necesidad de alimento y afecto, además de intentar reconocer a su propio cuerpo e interactuar con el ambiente que le rodea. Es normal que lleve a su boca objetos y extremidades de su cuerpo porque conoce al mundo a través de la boca (3).

Medidas preventivas
La salud buco-dental es parte integral de la salud general. La caries representa la enfermedad infecciosa crónica más frecuente de la infancia. La presencia de caries puede ocasionar dolor, desnutrición, baja autoestima en niños (25).
La historia de salud comienza en la concepción del niño y su crecimiento y desarrollo intrauterino (26). La premadurez y el muy bajo peso al nacer se vinculan con defectos de esmalte, a menudo subclínicos, que pueden predisponer a los dientes a caries temprana (25). El alto consumo de azúcar permite que el biofilm dental presente en la boca desde que erupcionan las piezas dentarias posea una alta disponibilidad de hidratos de carbono provenientes de la dieta o de medicamentos a base de jarabe a largo plazo (23, 25). Esta situación supone un alto riesgo de desarrollo de caries. El cepillado dentario desde la aparición del primer diente es una medida preventiva que los padres deben conocer. La desatención parental a las prácticas de higiene bucal es otro riesgo de enfermedad bucal. Ciertos padres fundamentan la inclusión de mayor cantidad de azúcar en los alimentos sobre la base de una mejor aceptación del alimento por parte del hijo. Se conservan costumbres como colocar miel, dulces o directamente azúcar en chupetes y/o mordillos (23). Los factores conductuales comprenden hábitos de higiene bucal, prácticas de alimentación y preferencias dietéticas. Una dieta rica en carbohidratos refinados, momentos de azúcar frecuentes, el biberón utilizado al momento de dormir, la lactancia prolongada a libre demanda guardan relación con caries al principio de la infancia (24). Existe apetencia innata por el gusto dulce, la cual puede ser modificada pero no anulada. La preferencia incrementada al azúcar en niños se asocia a madres que agregan azúcar a sus propios alimentos así como a exposiciones frecuentes y tempranas del niño a comidas y bebidas dulces. Corregir el hábito debe comenzar con la enseñanza a la madre. La relación entre la preferencia al azúcar y la experiencia de caries del binomio madre/hijo se incrementa en madres de condición socio-económica baja (27). El odontólogo que atiende regularmente al niño y conoce a su familia está en mejor posición de juzgar el riesgo de caries del niño. Las autoridades de la salud deben hacer énfasis en la educación de salud dental. Los costos en educación justifican los beneficios si logran reducir las enfermedades dentales y periodontales (28).
Los niños con limitaciones físicas u otras discapacidades severas dependen de quien los cuida para ejecutar procedimientos de higiene bucal. Los niños con tratamiento ortodóncico o que utilizan otros dispositivos intrabucales se hallan también en riesgo mayor (24). Para prevenir la caries dental y la gingivitis en niños el apoyo a la madre resulta esencial. Según estudios de Sasahara y col. la condición dental y gingival de la madre se asocia con la prevalencia y severidad de la caries dental en los tres primeros años de vida del niño. Sarnat y col. demuestran que la actitud favorable de la madre en hábitos de higiene bucal influye en menor número de caries en niños hasta los 5-6 años de edad (29).
La American Academy of Pediatric of Dentistry y la American Public Health Association consideran que la primera visita al odontólogo debe realizarse dentro de los seis meses de la aparición del primer diente y no más allá del año. El Equipo Materno-Infantil de la Asociación Argentina de Odontología para Niños preconiza la primera visita durante el embarazo de la mamá (23). El Programa Nacional de Salud Bucal de la Dirección General de la Salud del Ministerio de Salud Pública de la República Oriental del Uruguay, período 2005-2010, considera a las gestantes como un grupo priorizado. Es necesario el control de las enfermedades bucales, la incorporación de hábitos preventivos propios y de su bebé y la rehabilitación oral. En el post parto inmediato consulta y actividad educativa. A los niños y niñas de 0 a 36 meses se les indica seis consultas integradas al control pediátrico. Se realiza educación, prevención, protección específica, urgencias. Los tratamientos básicos son de: caries, enfermedad paradencial y maloclusiones (30).
Discusión
El avance científico en la disciplina de inmunología aumentó el conocimiento del proceso salud-enfermedad. La medicina contemporánea procura la aplicación clínica de la investigación básica. La evolución de los mecanismos defensivos del huésped es acompañada por cambios en los mecanismos agresivos de los microorganismos potencialmente patógenos (1). Los individuos están expuestos a lo largo de su vida a distintos agentes dañinos. Acontece un monitoreo continuo y recíproco entre las estrategias de supervivencia de los agresores y las tácticas defensivas del huésped. En situación de salud coexisten en equilibrio el sistema inmune y los agentes infecciosos. Las enfermedades infecciosas son producto de un desequilibrio, con cambios periódicos en la severidad de la enfermedad (31).
La maternidad requiere del apoyo e información diversa del equipo de salud prenatal, que serán correspondidas en un parto más saludable y en un ambiente doméstico más equilibrado (32). El estado nutricional y el estrés de la gestante afectan el resultado de su embarazo. En caso de dietas deficientes se limitarán el crecimiento y desarrollo normales. La alimentación insuficiente del feto y del niño después del parto disminuye la resistencia a las enfermedades (17). Las acciones preventivas en la mujer embarazada tienen marcado efecto positivo en la salud sistémica y bucal de los niños. Los hábitos alimenticios del niño como el agregado de azúcar a la leche, la mamadera nocturna para dormir y el consumo de bebidas cariogénicas entre comidas pueden ser factores predisponentes para el desarrollo precoz de caries y enfermedad paradencial.
El control preventivo debe estar dirigido hacia la ventana de infectividad, iniciado en la madre embarazada y continuado con sus descendientes. El poder interferir o retardar la transmisión vertical de Estreptococo mutans se traduce en disminución del número de dientes temporarios cariados (19), aunque la sola presencia del microorganismo en la cavidad bucal del niño no justifica el establecimiento y desarrollo de la enfermedad (18).
Conclusiones
-
El equipo de salud priorizando al niño desde antes del nacimiento, debería orientarse a su entorno familiar, incluyendo madre, padre, hermano/s, personas con las que convive y quienes lo cuidan.
-
La educación en hábitos de vida saludables mejora la calidad de vida del niño y su familia, desde la propia etapa de gestación del niño en el útero materno.
-
La cavidad bucal además de ser la porción inicial del tubo digestivo, representa el principal órgano sensorial y táctil del niño en sus primeros años. Contiene riqueza y variedad de receptores periféricos somestésico-sensoriales.
-
Con el objetivo de preservar la salud es importante controlar los circuitos de infectividad mediante los cuales se transmiten gérmenes a la boca del niño.
-
La caries y la enfermedad periodontal desde edades tempranas representan las enfermedades infecciosas bucales más frecuentes a nivel mundial, asociadas con factores socioculturales, económicos, del ambiente y del comportamiento. Constituyen un asunto de especial interés para la Salud Colectiva.
AGRADECIMIENTO
A la Licenciada en Nutrición Valeria Pérez, por el préstamo de material bibliográfico.
Referencias bibliográficas
1. Brostoff J, Scadding GK, Male D, Roitt IM, Inmunología Clínica, cap. 10 y 22, Mosby/ Doyma Libros, España, 1994.
2. Kneist S, Fuentes de infección de la caries, Quintessence (ed. esp.) Volumen XVIII, Número 3, pág. 121-130, Marzo 2005.
3. Gugelmeier V, Fundamentos psicosociales del comportamiento del paciente en la atención odontopediátrica, Odontopediatría Hoy, Cátedra de Odontopediatría, Facultad de Odontología de la Universidad de la República, Montevideo, Uruguay, 2002, pág. 9-23, Lopez Jordi M del C, Szwarc y cols.
4. Boccardo JJ, “La mucosa bucal desde el punto de vista funcional. Niveles de Integración Funcional”, Odontoestomatología, Vol. 4, Nº 4, setiembre 1992.
5. Lenander-Lumikari M, Loimaranta V, “Saliva and Dental Caries”, Adv Dent Res 14; 40-47, December 2000.
6. Miller CH, Cottone JA, Principios de infectología aplicables a la práctica dental, Clínicas Odontológicas de Norteamérica, Volumen 1/1993, Diagnóstico Bucal II, Nueva Editorial Interamericana, S.A., México, D.F., pág. 1-17.
7. Agrario C et al, Temas de Inmunopatología, cap. 1, Ciclo de Estructuras y Funciones Alteradas, Universidad de la República, Facultad de Medicina, 1ª edición, Oficina del Libro AEM, Montevideo 1999.
8. Betancor E, El Papel Fisiológico de la Saliva, Suplemento especial de la Revista Odontoestomatología 3, Editado por la Comisión de Publicaciones de la Facultad de Odontología, Montevideo – República Oriental del Uruguay, Agosto de 1990.
9. Grau DM, Silvestre FJ, Miralles L, Roig JM, La secreción salival durante el embarazo, pág. 93 – 98, Revista Europea de Odonto-Estomatología, Volumen XIV-Nº 2, Marzo-Abril 2002.
10. Lopez-Jornet P, Bermejo Fenoll A, Desórdenes del flujo salival: hiposecreción e hipersecreción salival. Investigación / Research. Medicina Oral, año 1996;1: 96-106.
11. Nederfors T, Xerostomía e Hyposalivation. Advances in Dental Research, volumen 15, diciembre 2000, pág. 48-56.
12. Kaufman E, Lamster IB, The Diagnostic Applications of Saliva – A Review, Critical Reviews in Oral Biology&Medicine, Volume 13, Issue 2, 2002, pág. 197-212.
13. Baum BJ, Salivary gland function during aging. Gerodontics 1986 Vol. 2, Nº 2: 61-64.
14. Cervera P, Clapes J, Rigolfas R, Alimentación y Dietoterapia, Nutrición aplicada en la salud y la enfermedad, Mc Graw-Hill-Interamericana de España, Madrid, 3ª edición, año 1999, cap. 10,22 y 39.
15. Newman J, “Así protege la leche de la madre al recién nacido”, Investigación y Ciencia, febrero 1996.
16. Laín A, Lactancia Materna y Puericultura, Temas de Neonatología para Pregrados, Aldao J y cols, Facultad de Medicina, Universidad de la República, Oficina del Libro FEFMUR, Montevideo, noviembre de 2005, pág. 43-55.
17. Fajen C, Nutrición durante el embarazo y la lactación, Nutrición y Dietoterapia de Krause, Kathlen Mahan L, Escott – Stump S, Mc Graw-Hill Interamericana Editores S.A., impreso en México, décima edición, 2001, pág. 181-212.
18. Castaño de Casaretto H, Dricas D, Mayocchi K et al., Circuitos de infectividad bucal entre madre-hijo. Estudio sobre información materna y disposición al cambio. Revista de la Asociación Odontológica Argentina- Vol. 91, Nº 4, Agosto-Setiembre de 2003.
19. Weber A, Gómez S, Hola L, Manejo Preventivo de la Ventana de la Infectividad, Estudio Prospectivo a 5 Años, Revista de la Facultad de Odontología Universidad de Valparaíso-Chile, Vol.2, Nº 5, Oct.2001, pág. 354-360.
20. Karletto Korber F, Cornejo LS, Giménez MG, Early adquisition of Streptococcus mutans for children, Acta Odontológica Latinoamericana; 18 (2): 69-74.
21. Al Shukairy H, Alamoudi N, Farsi N, Al Mushayt A, Masoud I, A Comparative Study of Streptococcus Mutans and Lactobacilli in Mothers and Children With Severe Early Childhood Caries (SECC) Versus a Caries free Group of Children and Their Corresponding Mothers, The Journal of Clinical Pediatric Dentistry, Volume 31, Number 2/2006, pág. 80-85.
22. Angulo Macedo M, La caries dental. Etiología y estrategias de prevención, Johnson&Johnson, año 4 /número 4/ marzo 2005, pág. 4-5.
23. Sánchez G y cols., Estudios sobre hábitos de succión no nutritiva, higiene bucal y tiempo de primera consulta odontológica en niños de 0 a 3 años, Boletín de la Asociación Argentina de Odontología para Niños, Vol 35, Nº 2, Junio/Septiembre 2006, pág. 20-25.
24. Quintero de Lucas G, Mandri MN, Halitosis Infantil, Revista del Ateneo Argentino de Odontología, Unidad Operativa de la Universidad Favaloro, RAAO – Vol. XLVII /Núm. 2 – Junio-Setiembre 2008, pág. 46-49.
25. Shafer TE y Adair SM, “Prevención de la enfermedad dental. Papel del Pediatra”, Clínicas Pediátricas de Norteamérica, Volumen 5/2000 Salud Bucal, Mc Graw-Hill Interamericana, pág. 1060-1079.
26. Morey de López A, Manual de Promoción de la Salud Bucal en el Ámbito Escolar, Sociedad Informática, Montevideo, año 2006.
27. Maciel SM, Marcenes W, Watt RG, Sheiham A, The relatioship between sweetness preference and dental caries in mother/child pairs from Maringá-Pr, Brazil, Internacional Dental Journal (2001) 51, 83-88.
28. Blinkhorn AS, Wainwright-Stringer YM, Holloway PJ, Dental health knowledge and attitudes of regularly attending mothers of high-risk, pre-school children, Internacional Dental Journal (2001) 51, 435-438.
29. Okada M et al., Influence of parents´oral health behaviour on oral health status of their school children: an exploratory study employing a causal modelling technique, Internacional Journal of Paediatric Dentistry 2002; 12:101-108.
30. Bianco P, Programa Nacional de Salud Bucal del MSP (PNSB) 2005-2010, Dirección General de la Salud, Ministerio de Salud Pública, Uruguay, 21/02/2008.
31. Pavez V, Sistema inmune en la patogenia de periodontitis asociada a diabetes, Revista de la Fundación Juan José Carraro, año 5, nº 13, diciembre 2000, p. 35-36.
32. Nogueira Coutinho N et al, Control de la enfermedad periodontal y caries en gestantes, Fundación Juan José Carraro, año 10, nº 21, Setiembre/Octubre 2005: 33-39.
Dr. Enrique B. Rotemberg Wilf: erotemb@yahoo.com.ar
Dra. Karinna R. Smaisik Frydman: karinnasmaisik@hotmail.com














