Introducción
El síndrome de Ehlers Danlos (SED) está constituido por un grupo de enfermedades del tejido conjuntivo, conocido en humanos y demás animales desde el siglo XVII. Inicialmente fue descrito como una anormalidad del colágeno por Ehlers, en Dinamarca (1901), y Danlos, en Francia (1908) (Van Lauven, 1987). En algunas especies animales, los desórdenes genéticos del colágeno de la piel son conocidos como dermatosparaxis o astenia cutánea, en los que las evidencias bioquímicas lo homologan al síndrome de Ehlers Danlos tipo VIIc en humanos (Colige et al., 1999). Esta enfermedad de herencia recesiva se explica por una falla en la síntesis del colágeno, debido a una deficiencia de la enzima procolágeno I N-proteinasa (pNPI). Esta enzima normalmente escinde los N-propéptidos de las cadenas de procolágeno tipo αI y αII, lo que resulta en la formación del colágeno maduro (Colige et al., 1999). El síndrome de Ehlers Danlos tipo VIIc ha sido reportado en humanos (Smith et al., 1992), así como la dermatosparaxis en caninos (Gething, 1971; Paciello et al., 2003), felinos (Butler, 1975; Patterson y Minor, 1977), ovinos (Fjølstad y Helle, 1974), bovinos (Hanset y Ansay, 1967; O’Hara et al., 1970), equinos (Bridges y McMullan, 1984), visones (Hegreberg et al., 1970), conejos (Sinke et al., 1997) y búfalos (Láu, 1997), puede variar la severidad de los signos clínicos entre las especies (Van Leuven, 1987). En lo que refiere al ganado bovino, se han reportado casos en razas holando, hereford, belgian blue, charolais, simmental (Jayasekara et al., 1979), drakensberger (Holm et al., 2008) y limousin (Carty et al., 2016). En bovinos de la raza belgian blue se determinó que la enfermedad se debe a una deleción de diecisiete pares de bases (pb) en el inicio del exón 2 del gen ADAMTS2 que codifica para la enzima pNPI. La mutación modifica el marco de lectura del gen produciendo una enzima truncada no funcional. Cuando esto ocurre, una acumulación de moléculas precursoras (procolágeno) se autoensamblan entre las fibrillas generando fallas en la tensión y disminución de la resistencia normal del tejido (Colige et al., 1999).
El objetivo de este trabajo fue describir un caso clínico compatible con dermatosparaxis en un bovino cruza charolais/hereford.
Materiales y métodos
Se describe el caso de un bovino macho recién nacido, cruza charolais con hereford, que presentó desgarros y desprendimientos de piel. Nació de parto eutócico con total integridad de tegumentos. Ambos padres eran cruza F1 de las razas mencionadas, había posibilidad de consanguinidad. El establecimiento de origen se ubica en Salto (Uruguay) y se dedica a la cría mixta de bovinos y ovinos a campo natural sobre suelo de basalto superficial.
Caso clínico
A los dos días de nacido, el ternero evidenció fragilidad exagerada de la piel frente al contacto con objetos y al tacto humano moderado. Dichos sucesos ocasionaron desprendimiento y pérdida de grandes extensiones de piel en diversas partes del cuerpo. Presentó aspecto penduloso de la piel en zonas umbilical y submandibular. Inclusive en esta última alcanzó a separarse del subcutáneo hasta desprenderse como colgajo. No hubo superficies sangrantes en las zonas de desgarros. Además, llamó la atención la forma de los párpados, con aspecto de “ojos achinados” y el tono gris azulado de las escleróticas.
Se observaron extensas áreas de músculos y tejido subcutáneo desprovistos de piel, sin indicios de cicatrización, con bordes necróticos y áreas de tejido gangrenoso en zonas inter mandibular, dorsal de metacarpos, babilla izquierda y cola (figura 1). No se aplicó tratamiento médico ni quirúrgico. El caso evolucionó desfavorablemente hasta la muerte a los 12 días de vida.

Figura 1: Ternero cruza charolais/hereford, 2 días de nacido. a) Desgarro de piel submandibular, tono gris azulado de la esclerótica y párpados “achinados”, b) Pérdida de piel en miembros anteriores, babilla izquierda y cola, con exposición de tejido subyacente.
Se tomaron muestras de piel de la babilla izquierda del animal enfermo y de uno sano usado como control, de la misma región anatómica, edad y cruza. Fueron remitidas en formol al 10 % al Laboratorio de Diagnóstico de la Unidad Patología de la Facultad de Veterinaria (Udelar), donde se realizó el estudio histopatológico. Las tinciones utilizadas para ambas muestras fueron hematoxilina-eosina, PAS (periodic acid-Schiff) y tricrómica de Masson.
Para el estudio de ADN se partió de una muestra de piel congelada, proveniente del ternero problema, fue remitida a la Unidad Académica de Genética y Mejora Animal de la Facultad de Veterinaria (Udelar). La extracción de ADN se realizó utilizando el kit comercial DNeasy Blood & Tissue (Qiagen, Hilden, Alemania), de acuerdo al protocolo del fabricante. Las muestras de ADN obtenidas fueron cuantificadas utilizando espectrofotómetro Nanodrop ND-1000 y estandarizadas a una concentración de 50 ng/µL. Para detectar la presencia de la mutación descrita previamente, se amplificó por PCR (Reacción en Cadena de la Polimerasa) un fragmento de 101 pb del gen ADAMTS2, utilizando los primeros descritos previamente por Colige et al. (1999). Se incluyeron muestras de ADN de dos animales normales a modo de control. La reacción se llevó a cabo en un volumen final de 25 µL que contenía 100 ng de ADN, 10 mM de cada cebador, 10 µL de 2x Master Mix (QuantiNova SYBR Green PCR Kit, Qiagen, Alemania) y agua ultrapura libre de inhibidores hasta completar el volumen. Las muestras fueron amplificadas utilizando termociclador en tiempo real Corbett-Rotor gene-6000 (Plataforma de Ácidos Nucleicos LEMA-Genética, FVET-Udelar) con el siguiente programa de amplificación: desnaturalización inicial a 95 °C por 1 min, seguida de 35 ciclos de desnaturalización a 95 °C por 30 s, hibridación a 56 °C por 30 s y extensión a 72 °C por 30 s. Se realizó una extensión final de 72 °C por 5 min. Los amplicones obtenidos fueron visualizados en una electroforesis en gel de agarosa al 4 % (UltraPureTM, Thermo Scientific, Estados Unidos), utilizando GoodViewTM (Beijing SBS Genetech Co. Ltd., China) como tinción y marcador de peso molecular AccuRuler 100 pb DNA RTU Ladder (MaestroGen, China).
Resultados
El estudio histológico de la piel del ternero afectado permitió confirmar el mantenimiento de la integridad de la epidermis mediante el uso de las tres técnicas de tinción utilizadas HE (figura 2b), PAS (figura 2d) y tricrómica de Masson (figura 2f) al compararlas con las mismas técnicas desarrolladas en las biopsias de piel del animal normal (figuras 2a, 2c y 2e); fue en la HE que se observó más nítidamente la normalidad estructural tisular y celular de la epidermis de ambos animales (asteriscos negros en figuras 2a y 2b), se observó además una adecuada conexión entre la capa basal de la epidermis y las capas más superficiales de la dermis, tanto para el enfermo como para el normal (figuras 2a y 2b). En cuanto a la dermis del ternero enfermo, estaba engrosada y presentaba una menor densidad de fibras colágenas en sus capas superficiales al compararla con la misma región de la dermis del normal (figura 2), se observó, solamente en el enfermo, una creciente desaparición de las fibras de colágeno a medida que se avanzaba hacia las zonas más profundas de la dermis. Este hallazgo se confirmó también con las tres técnicas (figuras 2b, 2d y 2f), fueron las técnicas de PAS (figura 2d) y, especialmente, la tricrómica de Masson (figura 2f) las más adecuadas para identificar esta alteración de las fibras de colágeno en la dermis del afectado. Además de la evidente reducción de la cantidad de fibras en la dermis del enfermo, se observó, también, una moderada reacción inflamatoria mononuclear con presencia de neutrófilos y algunos eosinófilos (dermatitis mononuclear moderada), la que era más notoria alrededor de los vasos sanguíneos de la dermis, acompañada de edema y necrosis tisular, estos hallazgos fueron más evidentes con la tinción HE (figura 2b).
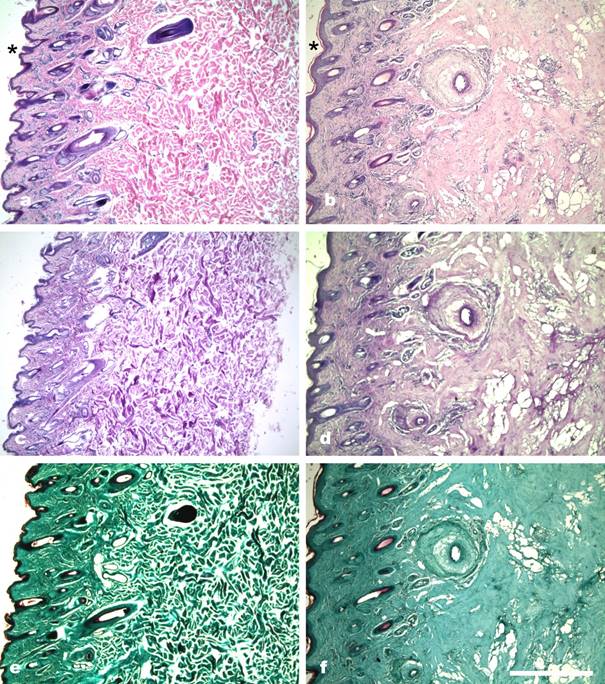
Figura 2: Comparación por diferentes técnicas de tinción de la alteración del colágeno de la piel del ternero normal y el enfermo. Ternero normal. Detalles panorámicos de la piel. a) Nótese la abundancia de fibras de colágeno normales que aparecen fuertemente eosinófilas, HE, 40x. c) Detalle del mismo campo que muestra las fibras teñidas de color fucsia, PAS, 40x. e) Detalle del mismo campo que muestra las fibras teñidas de intenso color verde azulado, tricrómica de Masson, 40x. Ternero enfermo. Detalles panorámicos de la alteración de las fibras de colágeno. b) Nótese la ausencia de fibras de colágeno, el edema extenso de subcutáneo y la infiltración inflamatoria del subcutáneo y sus anexos, HE, 40x. d) Detalle del mismo campo, PAS, 40x. f) Detalle del mismo campo, tricrómica de Masson, 40x (escala equivale a 750 µm). Los asteriscos negros en las figuras 2a (normal) y 2b (enfermos) indican la normalidad de las epidermis y de las uniones dermo-epidérmicas de ambos terneros.
El PCR determinó que el ternero enfermo no portaba la mutación (deleción de 17 pb en ADAMTS2) descrita por Colige et al. (1999). A través de la electroforesis se visualizó el producto de amplificación por PCR del ADN del ternero enfermo como una banda nítida equivalente a un fragmento de 101 pb coincidente con los amplicones obtenidos en los bovinos sanos (figura 3).
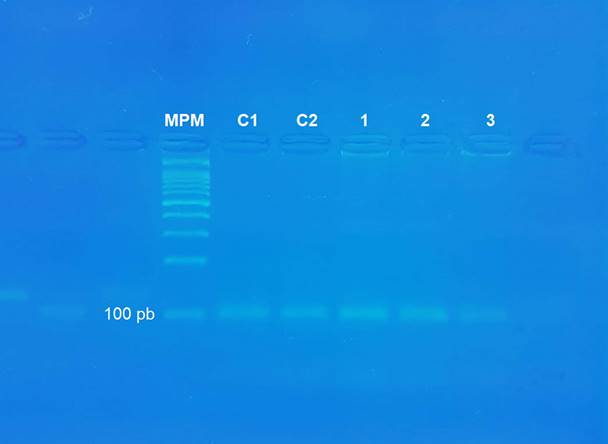
Figura 3: Resultado de PCR evaluado por electroforesis en gel de agarosa. (MPM=marcador de peso molecular AccuRuler 100 pb DNA RTU Ladder (MaestroGen, China); C1 y C2= muestras de dos bovinos sanos usadas como control; 1, 2 y 3= muestras del animal enfermo). Cada muestra de ADN se visualizó como una banda nítida correspondiente con el fragmento de 101 pb presente en bovinos sanos. Ninguno de los tres animales es portador de la mutación (fragmento de 84 pb).
Discusión
Las enfermedades agrupadas como displasias del colágeno (conocidas también como astenia cutánea, hiperelastosis cutis, dermatosparaxis, síndrome similar a Elhers-Danlos) ocurren en la mayoría de las especies domésticas y comprenden un grupo de enfermedades que son raras y que se las agrupa como de tipo hereditario (Argis y Myers, 2017; Mauldin y Peters-Kennedy, 2016). Todas ellas tienen en común algunas características generales: el fácil rasgado de la piel, su hiperextensibilidad, así como su aspecto de péndulo, que muchas veces se ve acompañado del desprendimiento de colgajos de piel necrosada, la gravedad de estas lesiones es muy variable entre las diferentes especies y razas en las que se han descrito (Argis y Myers, 2017). En todos los casos, las lesiones histológicas son más obvias en la dermis profunda no afectándose la epidermis (Argis y Myers, 2017; Mauldin y Peters-Kennedy, 2016), hallazgos histológicos que también confirmamos en el presente reporte mediante las tres tinciones utilizadas. Al igual que confirmamos en nuestro caso, la característica principal para hacer el diagnóstico histopatológico consiste en la identificación de un menor número de fibras colágenas en la dermis del animal afectado, las fibras remanentes están desorganizadas, sin constituir haces, forman parches de fibras más cortas y finas que aparecen separados entre sí por espacios claros, y dependen del tiempo de evolución. Estos parches de fibras alteradas pueden verse acompañados por reacción inflamatoria, necrosis, fibrosis y formación de tejido de granulación (Argis y Myers, 2017; Mauldin y Peters-Kennedy, 2016). Estos hallazgos histopatológicos fueron confirmados parcialmente en nuestro estudio, debido a que en nuestro caso la evolución del cuadro fue de pocos días, pero se han reportado casos en los que las lesiones pueden ser incluso más sutiles, por lo que para arribar a un correcto diagnóstico, se recomienda que la biopsia cutánea incluya la dermis profunda, que es donde se identifican las lesiones más severas, o que se complemente el estudio histopatológico con un estudio ultraestructural de las fibras mediante microscopía electrónica de transmisión y de barrido (Argis y Myers, 2017; Carty et al., 2016; Holm et al., 2008; Noito y Okada, 2020), el cual no se desarrolló en nuestro reporte.
En cuanto a las técnicas de tinción utilizadas -de forma similar a lo reportado por Sinke et al. (1997), y Carty et al. (2016)-, la combinación de las tres técnicas de tinción (HE, PAS y tricrómica de Masson) resultó una herramienta de utilidad para identificar las lesiones histológicas y arribar al diagnóstico histopatológico. En casos diagnosticados en bovinos (Carty et al., 2016; Jayasekara et al., 1979), estas técnicas también fueron de utilidad para diagnosticar la enfermedad, la tinción tricrómica de Masson es la mejor para identificar las alteraciones de las fibras colágenas. De acuerdo con Carty et al. (2016), en nuestro caso observamos infiltración inflamatoria mononuclear con presencia de neutrófilos en la dermis.
En cuanto a su presentación clínica, los signos clínicos identificados en nuestro caso se asemejan a los reportados por Jayasekara et al. (1979) y Carty et al. (2016), que también aparecen luego del nacimiento. A diferencia de lo reportado por Holm et al. (2008), donde la manifestación clínica fue similar, pero se presentó luego de varios meses del nacimiento de los animales enfermos. La fragilidad cutánea observada en este caso se asemeja a la descrita en otras especies domésticas con dermatosparaxis (Holbrook et al. 1980; Jaffey et al. 2019, Monteagudo et al. 2015) y se incluye entre los hallazgos clínicos presentados en humanos con SED tipo VIIc (Nusgens et al. 1992).
Para el caso de la especie bovina, la dermatosparaxis (síndrome de Ehlers-Danlos) ocurre como un defecto autosómico recesivo, se ha reportado en varias razas, incluyendo a las charolais y hereford entre las afectadas (Steffen, 1993), estas razas son las que componen la genética del animal cruza F1 charolais/hereford de este estudio, y sin registro del grado de consanguinidad del rodeo del que forman parte ambos progenitores. Por otra parte, Steffen (1993) también menciona que ocasionalmente esta enfermedad se ha observado en bovinos cruza, sin aclarar más detalles sobre la posible causa de la mutación en estos casos aislados. No se descartan en estos casos, entre otras posibles causas, la aparición de mutaciones genéticas espontáneas, con la consecuente evolución de esta alteración durante el desarrollo embrionario en esos animales cruza.
Para llegar al diagnóstico de dermatosparaxis del presente caso, basados en la presentación clínica y el estudio histopatológico, debimos considerar en el diagnóstico diferencial aquellas otras enfermedades de presentación clínica similar, especialmente las de origen hereditario o congénito que afectan la piel de los terneros jóvenes o neonatos (Argis y Myers, 2017). Dentro de los diferenciales se debe incluir al grupo de enfermedades mecano-bullosas que se agrupan bajo la denominación epidermólisis bullosa; este grupo de enfermedades, que son muy raras en los animales y en el hombre, han sido reportadas en varias razas bovinas, incluyendo a la hereford en Uruguay (Dutra y Baroni, 2007), esta es la raza más frecuente en el país y una de las que componían la cruza F1 del caso reportado aquí. En su presentación clínica, todas estas enfermedades tienen, como factor común, la extrema fragilidad de la unión dermo-epidérmica, la que provoca la formación de bullas extensas y, posteriormente, necrosis con desprendimientos de grandes colgajos de piel, especialmente en las patas, por lo que se las conoce vulgarmente como “enfermedad de las patas rojas” (Argis y Myers, 2017; Dutra y Baroni, 2007). La separación de la unión dermo-epidérmica es de gran utilidad diagnóstica por ser la principal lesión histológica, y ayuda a orientar la búsqueda de las alteraciones ultraestructurales características de este grupo de enfermedades en las células basales epidérmicas (Medeiros et al., 2012; Medeiros y Riet-Correa, 2015). Medeiros y Riet-Correa (2015) mencionan un reporte de caso de epidermólisis bullosa de unión en la raza charolais, en el que no se realizó el examen ultraestructural para confirmar ese daño específico (Guaguere et al., 2004 citado por Medeiros y Riet-Correa, 2012). Cabe recordar que esta raza es la del otro progenitor del ternero estudiado en este reporte. En nuestro caso, las lesiones histológicas se limitaban a la dermis, especialmente a la dermis profunda, sin afectar a la epidermis ni a la unión dermo-epidérmica, y se caracterizaban por un engrosamiento de la dermis, una marcada reducción de fibras de colágeno, inflamación, edema y necrosis.
Otra enfermedad que debe considerarse es la acantolisis familiar de terneros angus, en estos casos la presentación clínica parece también ser similar, pero a diferencia de nuestro estudio, la lesión histológica principal se ubica en la epidermis, aunque, en este caso, afecta solamente a las células de la capa espinosa (Jolly et al., 1973). En estos, el estudio ultraestructural también resulta clave para diferenciar la acantolisis familiar de la epidermólisis bullosa y de la dermatosparaxis (Carty et al., 2016; Holm et al., 2008; Jolly et al., 1973; Medeiros et al., 2012; Noito y Okada, 2020).
También cabe mencionar, dentro de los diferenciales de la dermatosparaxis, a la epiteliogénesis imperfecta (o aplasia cutis congénita), en estos casos, la presentación clínica se caracteriza por la ausencia de áreas extensas de cobertura cutánea y mucosa, se observa desde el nacimiento del animal (Argis y Myers, 2017),
Por último, mencionaremos al linfedema congénito, este es un desorden del sistema linfático periférico que comienza al nacimiento y se caracteriza por la presencia de hinchamientos subcutáneos regionales (observándose especialmente en los miembros), sin afectar específicamente la piel, esta es una enfermedad hereditaria y de severidad variable (Argis y Myers, 2017).
Una limitante de nuestro estudio, para aportarle aún mayor respaldo a la presentación clínica y a la identificación del daño histológico de la dermis mediante diferentes técnicas de tinción, fue no haber estudiado ultraestructuralmente la alteración específica de las fibras de colágeno, como ya ha sido reportado previamente por otros autores en razas como limousin (Carty et al., 2016) y drakensberger (Holm et al., 2008).
De forma similar a lo reportes de Jayasekara et al. (1979) y Carty et al. (2016), en el presente estudio no se aplicaron tratamientos. Hasta el momento no se ha descrito tratamiento eficaz para dermatosparaxis en rumiantes, ya que este incrementa la injuria a causa de la manipulación (Jayasekara et al. 1979; Monteagudo et al. 2015). En estos casos, la evolución es desfavorable, las lesiones limitan la viabilidad del animal y todos los casos reportados han culminado en muerte inminente o eutanasia por motivos humanitarios, como mencionan Prockop y Guzmán (1977).
Con los análisis moleculares no se pudo demostrar la presencia de la alteración genética previamente reportada por Colige et al. (1999), tal como también ocurrió en otros estudios de dermatosparaxis (Carty et al., 2016; Holm et al., 2008). De todos modos, sabemos que esto no indicaría la ausencia de una mutación, sino que esta sería diferente a la descrita por Colige et al. (1999) y podría encontrarse en otro sitio del gen ADAMTS2, tal como concluyeron previamente en sus reportes Holm et al. (2008) y Carty et al. (2016) en terneros de razas drakensberger y limousin, respectivamente. Este hecho concuerda además con que la presentación clínica y los hallazgos histológicos del presente caso presentan clínicamente diferentes grados de severidad a los reportados previamente. Si bien diversas mutaciones dentro del gen ADAMTS2 son responsables del SED tipo VIIc en múltiples especies (Online Mendelian Inheritance in Animals ;OMIA, 2020), no podemos descartar la presencia de mutaciones en otros genes. Para nuestro conocimiento, el presente trabajo constituye el primer reporte compatible con dermatosparaxis en un ternero cruza F1 charolais/hereford en Uruguay.
Conclusiones
Se describió la presentación clínica del primer caso compatible con dermatosparaxis en un ternero cruza charolais/hereford en Uruguay diagnosticado por histopatología mediante el uso de tres técnicas de tinción (HE, PAS y tricrómica de Masson).
Los estudios moleculares no identificaron la mutación causante del cuadro, aunque se puede afirmar que no es la previamente descrita para dermatosparaxis en la especie bovina, por lo que debe considerarse el fenómeno de heterogeneidad alélica para esta enfermedad.















