Introducción
La laminitis es una de las presentaciones clínicas mas frecuentes y frustrantes de la práctica clínica diaria. Hoy en día se considera a la laminitis como un signo clínico que puede estar presente en varias patologías de diferentes orígenes (Morgan et al., 2015). Durante décadas se consideró que la laminitis asociada a patologías que desencadenan síndrome de respuesta inflamatoria sistémica o sepsis eran las más frecuentes ya que son la principal casuística de los hospitales universitarios donde se realiza la mayor parte de la investigación a nivel mundial (Parsons et al., 2007). Karikoski et al. (2011) reportaron que el 90% de los equinos que presentaron laminitis como signo clínico primario fue en consecuencia a alguna patología endócrina, y dentro de estas un 66% secundaria a síndrome metabólico equino (SME).
Se define SME cuando están presentes las siguentes características: obesidad, resistencia tisular a la insulina (RI) y predisposición a laminitis (Morgan et al., 2015). La obesidad es un factor de riesgo para el SME, ya que el tejido adiposo es un potente secretor de adipoquinas, que interelacionadas con la insulina y la glucosa provocan disturbios del metabolismo (Hermsdorff & Monteiro, 2004). Si bien se desconocen los mecanismos, la adiposidad excesiva se asocia con un desequilibrio metabólico de los carbohidratos, puntualmente generando una disminución en la sensibilidad tisular a la insulina, por lo tanto cierto grado de insulino resistencia (Cortese et al., 2019). Durham et al. (2009) se refieren a este fenómeno como desregulación insulínica, como en otros aspectos de este síndrome existen cambios muy dinámicos en su comprensión que impactan en la terminología. Se demostró que la infusión de insulina hasta provocar una hiperinsulinemia induce laminitis en las 48 a 55 horas post infusión en animales sanos (Asplin et al., 2007; De Laat et al., 2010). De forma similar, la infusión de glucosa, hasta provocar una hiperinsulinemia endógena también genera alteraciones en el corion de los cascos compatibles con laminitis (De Laat et al., 2012). Se puede considerar a la laminitis como la disfunción vascular consecuente del síndrome metabólico en la especie equina (Katz y Bailey, 2012). Se sugiere que las altas concentraciones de insulina en sangre podrían afectar el tono de los vasos sanguíneos alterando así la irrigación del corion de los cascos (Keen et al., 2012; Venugopal et al., 2011). En equinos la resistencia a la insulina es generalmente compensada, es decir, una disminución de la sensibilidad tisular a la insulina provoca un aumento de insulina pancreática (Durham et al., 2009) y las concentraciones altas de insulina en reposo son una característica frecuente en equinos con SME (Frank y Tadros, 2014). Existen cálculos matemáticos (proxies) como el índice de resistencia a la insulina (HOMA-IR, homeostatic model assessment) y el ratio glucosa/insulina que se utilizan como indicadores de desregulación de la insulina en varias especies (Gungor et al., 2004; Uwaifo et al., 2002) y aunque en equinos no están completamente validadas podrían ser una buena herramienta diagnóstica.
Se ha reportado que existe predisposición racial a la obesidad, siendo las razas evolutivamente sometidas a climas adversos las de mayor riesgo, cuando son sometidas a muy buenos planos nutricionales (Geor et al., 2013; McCue et al., 2015; Morgan et al., 2014). Dentro de estas se encuentra la raza criolla, patrimonio cultural de nuestro país y que se encuentra en continuo ascenso. Cantarelli et al. 2018) reportaron en Brasil que yeguas criollas obesas presentaron concentraciones de glucosa e insulina basales similares a las no obesas, si bien no se reportó el HOMA-IR o el ratio glucosa/insulina.
No hemos encontrado reportes de SME en Uruguay, por lo tanto el principal objetivo del presente trabajo es reportar por primera vez en nuestro país, un caso de laminitis clínica en una yegua de la raza criolla asociado a síndrome metabólico equino. Se comparan perfiles bioquímicos, endócrinos y las relaciones glucosa/insulina e índice HOMA-IR del caso clínico con yeguas sin sintomatología clínica de laminitis con un grado de condición corporal similar en el mismo predio.
Materiales y Métodos
Caso Clínico
Se presentó a la consulta un equino, hembra (no gestante), raza criolla de 5 años de edad. En el establecimiento, criador de la raza criolla, existen antecedentes de casos de laminits sin otros signos más que obesidad. El motivo de consulta fue claudicación y renuencia a caminar. El animal se encontraba en condiciones de confinamiento, no se sometía a ningún tipo de ejercicio físico y su dieta estaba compuesta por 6 kg diarios de un concentrado hipercalórico (3.238 kcal/kg en base materia seca) y heno de alfalfa. Al examen clínico se evaluó la condición corporal acorde a Henneke et al. 1983) registrando una condición de 8 (escala 1-9, siendo 7 - 9 obeso). Además de la postura clásica de laminitis bilateral (miembos torácicos extendidos y pélvicos remetidos), el animal presentó alteraciones en el pulso de arterias digitales en ambos miembros torácicos, temperatura en los cascos, dolor a la palpación-presión con pinza de tentar y claudicación que aumentó al intentar desplazarse en superficies duras. Se tomaron muestras sanguíneas para hematología y bioquímica (muestra 1, M1), las cuales fueron remitidas a los Laboratorios de Análisis Clínicos y de Endocrinología y Metabolismo Animal de la Facultad de Veterinaria, UdelaR. Se trató al animal con fenilbutazona (4,4 mg/kg) por vía oral durante 5 días. Se realizó un herraje terapéutico que priorizó en la elevación de los talones y acortamiento de pinzas con el objetivo de aliviar la tensión ejercida por el tendón flexor digital profundo. Frente al diagnóstico presuntivo de laminitis secundaria a SME, se indicó restricción total de carbohidratos en la dieta. Además, se solicitó que una vez fueran remitidos los signos de laminitis aguda se sacara al animal del confinamiento para pasar a un potrero de campo natural. Se volvieron a tomar muestras del mismo animal 30 días después (muestra 2, M2) y se volvió a registrar la condición corporal la cual se mantuvo. El animal no presentaba sintomatología clínica. Se tomaron muestras de seis individuos clínicamente sanos de la misma raza y sexo (no gestantes) y con la misma categoría de condición corporal (entre 7 y 9). Al momento del muestreo se completó una ficha, en la que se incluyó el nombre, número de registro, edad y condición corporal. Estos animales se mantuvieron siempre en el potrero de campo natural sin acceso a concentrados.
Toma de muestras
Se extrajeron muestras de sangre de la vena yugular, y se dividieron en 3 submuestras. Una de ellas en un tubo con EDTA para la realización de hemograma, otra en tubo sin anticoagulante para la realización de funcional hepático, perfil renal y determinaciones hormonales, y una tercer submuestra en tubo con fluoruro de sodio para la determinación de la glicemia.
Análisis de laboratorio
Hematología y bioquímica sérica
El hemograma se realizó en un contador hematológico (Orphée, Mythic 18 Vet, Ginebra, Suiza). Para el recuento diferencial de los leucocitos y valoración de la morfología celular se realizó un frotis sanguíneo teñido con May Grünwald - Giemsa el cual fue evaluado con microscopio Nikon Eclipse E100.
La funcionalidad tanto hepática como renal se determinó, en suero, mediante un equipo automático CB 350i (Wiener lab Group, Rosario, Argentina) utilizando reactivos y controles comerciales del mismo proveedor. Se determinó glucosa (referencia 1400060), aspartato aminotransferasa (AST) (referencia 1752360), fosfatasa alcalina sérica (FAS) (referencia 1361402), γ glutamil transferasa (referencia 1421404), proteínas totales (referencia 1690009), albúmina (referencia 1690008), globulinas, triglicéridos (referencia 1780111), colesterol (referencia 1220114), bilirrubina total (referencia 1120008, urea (referencia 1260360), y creatinina (referencia 1260360).
El Laboratorio de Análisis Clínicos de la Facultad de Veterinaria utiliza los valores de referencia de Oregon State University, dado que no cuenta con valores de referencia propios para equinos.
La determinación de insulina se hizo por un ensayo inmunoradiométrico utilizando kits comerciales (INS-IRMA kit DIA Source Immune Assays, Belgium). Las muestras se corrieron en duplicado en un solo ensayo. La sensibilidad fue de 1.2 µUI/mL y el coeficiente de variación intraensayo para los controles 1 (22.8 µUI/mL) y (75.2 µUI/mL) fueron de 5.9% y 7.1% respectivamente. Con los valores de glucosa e isulina basal se calcularon las proxies: el índice HOMA-IR (glucosa (mg/dL) x 0.0555 x insulina)/22.5 y el ratio glucosa-insulina (G:I) (Ribeiro et al., 2017).
Resultados
Tanto los valores del eritrograma como del leucograma, en el caso clínico (Tabla 1) y en los controles se encontraron dentro del intervalo de referencia.
Tabla 1: Hemograma de las muestras (M1 y M2) del caso clínico
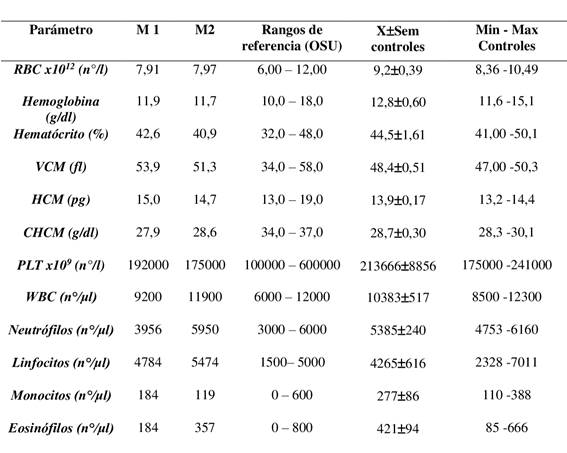
Nota: M1 (muestreo inicial) y M2 (muestreo a 30 días postratamiento), Valores de referencia del Oregon State University (OSU) para equinos.
En la Tabla 2 se muestra la bioquímica sanguínea de las muestras del caso clínico (M1 y M2), así como el valor promedio (±SEM) y los valores de los animales controles. Se ha utilizado como intervalo de referencia los valores citados por Oregon State University (OSU)”. Los valores mínimos y máximos de los animales controles se encontraban dentro del rango de referencia de la OSU, a excepción de las enzimas AST y FAS. Las concentraciones de albúmina y proteínas totales en ambas muestras del caso clínico se encontraban en el rango superior de los valores encontrados en los controles (Tabla 2). En cuanto al enzimograma, la aspartato aminotransferasa en la M1 estaba por encima de las concentraciones encontradas en los animales controles y del rango de OSU. En cuanto a las concentraciones de fosfatasa alcalina sérica en ambas muestras se encontraron por debajo de los animales controles y por encima del rango de la OSU. También se evidenció un aumento en la concentración de triglicéridos del caso clínico en su segunda muestra (Tabla 2).
Tabla 1: Bioquímica sérica de las muestras (M1 y M2) del caso clínico
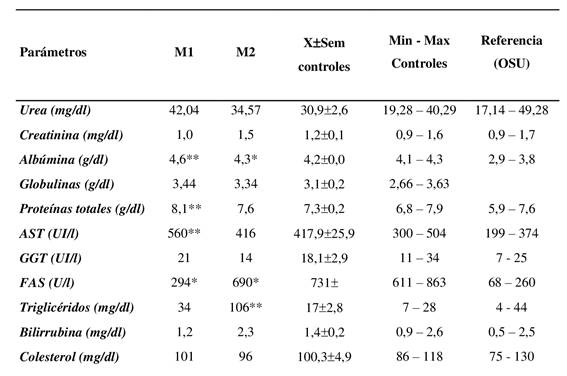
*: resultados por fuera del rango de referencia **: resultados fuera del rango de referencia y rango de Controles Nota: M1 (muestreo inicial) y M2 (muestreo a 30 días postratamiento). Valores de referencia del Oregon State University (OSU) para equinos.
La tabla 3 muestra los datos individuales de las concentraciones de glucosa basal, insulina basal y las proxies. La concentración de glucosa y de insulina de los controles se encontraron dentro de los valores de referencia. En cuanto al índice HOMA-IR, sólo 2 animales controles se encontraban dentro rango de referencia, mientras que 4 de ellos se encontraron levemente por encima. En cuanto a la relación G:I; la mayoría de los equinos controles presentaron valores por debajo del valor de referencia y sólo uno dentro del rango. La concentración de insulina en la M1 del caso clínico fue aproximadamente el doble de la concentración de los controles y por encima del valor de referencia (Tabla 3). La concentración de insulina en la M2 (30 días después del cambio de dieta y manejo) disminuyó aprox. a la mitad, manteniéndose en el rango de los controles. El índice HOMA-IR de la M1 se ubicó por encima del rango de los controles pero disminuyó luego de 30 días de tratamiento. La relación glucosa:insulina (G:I) se encontró alterada en la M1, estando en la M2 dentro del rango de los controles.
Tabla 3: Glicemia, insulina basal y calculo de proxies de la muestra 1 (M1) y muestra 2 (M2) del caso clínico, valores individuales de los animales controles y mínimos- maximos de los animales controles
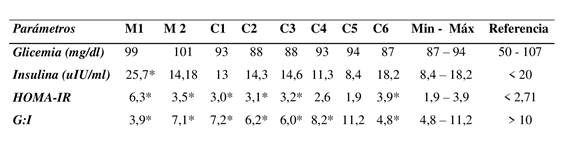
*: resultados por fuera del rango de referencia Nota: M1 (muestreo inicial) y M2 (muestreo a 30 días postratamiento). Valores de referencia para equinos (Frank et al., 2010; Hart et al., 2016).
Discusión
Los signos clínicos de laminitis bilateral aguda estan ampliamente documentados: la clásica postura con los miembros torácicos extendidos y pélvicos remetidos (Hood et al., 2001), aumento de temperatura en los cascos, pulso de las arterias digitales en ambos miembos afectados y dolor al examen con pinza de tentar (Baxter, 2020) Tomando en cuenta el leucograma del caso clínico se descartó la presencia de componentes de origen infeccioso en la fisiopatología, por lo tanto, causas de síndrome de respuesta inflamatoria sistémica o sepsis. Este es el primer reporte de un caso de laminitis clínica asociado a síndrome metabólico equino que se documenta en nuestro país.
La bioquímica sanguínea del grupo control se encontró dentro de los rangos de referencia internacionales a excepción de las enzimas AST y FAS. Los rangos de normalidad se deben establecer para cada especie en cada laboratorio, dado que existen variaciones debidas a los reactivos, el equipamiento e incluso el operador). El Laboratorio de Análisis Clínicos de la Facultad de Veterinaria utiliza los rangos de referencia de la Oregon State University (OSU), en donde no existe la raza criolla. Por esta razón es que incluimos un grupo de animales como controles, es decir, de la misma raza, sexo y condición corporal en el mismo predio. Una limitante de este trabajo es la no inclusión de yeguas no obesas (es decir, animales normopesos); este aspecto fue considerado pero el estado corporal de los animales de este predio (mismo manejo y alimentación) era perteneciente a la categoría de obesos.
Las concentraciones aumentadas de AST y FAS en los animales controles fueron llamativas, si bien estas enzimas no son hepatoespecíficas podrían ser indicativas de daño hepático. En un estudio se establece que aumentos en la AST tuvieron una sensibilidad diagnóstica de un 100% para lipidosis hepática y un 72% para necrosis hepática en la especie equina (West, 1989), mientras que la FAS no es hepatoespecífica. Se sabe que animales insulinoresistentes tienen un mayor riesgo de presentar hipertrigliceridemia (McKenzie, 2011), por lo tanto la obesidad es un claro factor de riesgo para lipidosis hepática (Walton et al., 2021). La hiperlipidemia se caracteriza por un aumento en los triglicéridos por encima de 100 mg/dL (Dunkel y McKenzie, 2003), aunque se establece que existe infiltración grasa en órganos y tejidos cuando los valores exceden los 500 mg/dL (McKenzie, 2011). Las concentraciones de los triglicéridos y colesterol de los controles se encontraron dentro del rango de referencia de OSU a pesar de pertenecer a la categoría de obesos. Los valores aumentados de enzimas indicativas de daño hepático en este estudio son un hallazgo interesante que debe contrastarse con yeguas criollas de condición normal para evaluar si es una diferencia de especie/raza o si está asociado a la condición corporal.
En el caso clínico, tanto el enzimograma como las concentraciones de colesterol se encontraban dentro del rango de los controles. Sin embargo, mientras la concentración de triglicéridos en la M1 se observó normal, en la M2 se observó por encima del rango de los controles y de los valores de referencia de OSU. Estudios realizados en ponies Welsh con pérdidas de peso vivo del 1% semanal no se asociaron con hipertrigliceridemia (Dugdale et al., 2010), sin embargo, pérdidas mayores se asociaron a aumento en las concentraciones de triglicéridos y ácidos grasos no esterificados indicativos de lipólisis (Schmengler et al., 2013). Si bien en este estudio no se estimó el peso vivo, el caso clínico mantuvo su condición de obeso en pasturas un mes luego de la restricción total del concentrado hipercalórico. Esta establecido que la hiperlipidemia (hipertrigliceridemia por encima del rango de referencia pero sin cambios macroscópicos) se considera un hallazgo frecuente en equinos con cambios o alteraciones en la ingesta (Walton et al., 2021).
La glicemia basal se puede considerar como un método indirecto de evaluar resistencia tisular a la insulina, si bien tiene una baja sensibilidad y especificidad diagnóstica de RI dado que se puede alterar por varios factores (Bertin y De Laat, 2017). Los animales controles (sin sintomatología pero obesos) presentaron concentraciones de glucosa e insulina dentro de los rangos de referencia. Estos resultados son similares a los reportados en yeguas obesas criollas en Brasil que no reportaron diferencias con animales normopesos (Cantarelli et al., 2018). En el caso clínico de este trabajo, la glicemia se encontró dentro de los parámetros normales tanto en la primer muestra como en la segunda. Sin embargo, la concentración de insulina del caso clínico fue superior al rango de referencia y al rango de los controles (aprox. el doble), sugiriendo que para mantener la glicemia normal las concentraciones de insulina debieron ser mayores, lo que es indicativo de insulino resistencia. Se reportó que una insulina basal >21 uUI/ml tiene una sensibilidad y especificidad mayores a 70% como predictor de laminitis en un período de 3 años en animales clínicamente sanos (Menzies-Gow et al., 2016). La concentración de insulina basal en la segunda muestra (post tratamiento) se redujo de forma marcada ubicándose dentro de los parámetros fisiológicos. Los tratamientos realizados implicaron cambios en la dieta y el manejo, teniendo como principal objetivo terapéutico la pérdida de de peso, disminuyendo así el grado de condición corporal. La notoria respuesta al tratamiento observada en las concentraciones de insulina basal refleja el impacto de la sobrealimentación con concentrados como factor de riesgo en animales obesos (Frank, 2009).
Más allá de que una hiperinsulinemia basal sea un fuerte indicador de la enfermedad se requiere corroborar con otros tests para llegar al diagnóstico definitivo de resistencia tisular a la insulina (Frank et al., 2010; Hart et al., 2016; Morgan et al., 2014). Una herramienta son los proxies, ampliamente utilizados en medicina humana y aunque aún no están completamente validadas en medicina equina son una opción atractiva para el diagnóstico a campo de insulino resistencia (Gungor et al., 2004; Uwaifo et al., 2002). No hemos encontrado reportes de éstos indicadores en yeguas criollas. Es importante destacar que si bien los animales controles (sin sintomatología pero obesos) presentaron concentraciones de glucosa e insulina dentro de los rangos de referencia, en 4 de los 6 controles el índice HOMA-IR estaba alterado. En nuestro caso de estudio, el índice HOMA-IR fue más del doble que los parámetros de referencia. El ratio G:I se observó notoriamente disminuído en la M1, interpretándose como una insulinoresistencia grave en animales que tienen un valor menor a 4,5 (Frank, 2011). En la M2 el ratio G:I tampoco se encontró dentro de los parámetros normales, aunque se ubicó entre 4,5 y 10, siendo estos valores más altos que en la M1 indicando una hiperinsulinemia compensatoria (Frank, 2011). Los datos en su conjunto sostienen que el tratamiento fue efectivo y además sugieren que animales obesos con alteraciones compatibles con insulino resistencia si son sometidos a una dieta hipercalórica pueden exacerbar el cuadro desencadenando laminitis. Estos datos sugieren que estas proxies son una muy buena herramienta de diagnóstico sublclínico y precoz de resistencia tisular a la insulina.
Conclusiones
Se diagnostica por primera vez un caso clínico de laminitis clínica asociado a síndrome metabólico equino en nuestro país. La laminitis se asoció a alteraciones en las concentraciones de insulina, índice HOMA-IR y ratio G:I asociadas a la obesidad y sobrealimentación. Además, reportamos que yeguas criollas obesas sin sintomatología presentan proxies fuera de los rangos de referencia internacionales.















