Introducción
El término abiotrofia cerebelosa (AC) hace referencia a una degeneración prematura o acelerada de neuronas cerebelosas completamente formadas, la característica histopatológica típica de este trastorno es la alteración de la histoarquitectura normal de las 3 capas (molecular, de Purkinje y granulosa) que componen la corteza cerebelosa (Cantile y Youssef, 2016). Esta condición se ha descrito en varias especies animales, incluyendo bovinos, ovinos, caballos, cerdos, cabras, gatos, perros y también en seres humanos (de Lahunta, 1990). Aunque se han reportado muchos casos de este trastorno, existen pocos estudios que comparen los cambios patológicos observados en el cerebelo entre animales de diferentes especies afectados por AC (de Lahunta, 1990; Scott et al., 2018). Recientemente, hemos informado sobre los cambios patológicos en un caso de AC en un canino (Verdes et al., 2020) y también tuvimos la oportunidad de investigar los hallazgos patológicos en un caso de AC confirmado por diagnóstico molecular de la mutación causal en un potrillo raza árabe (Gagliardi et al., 2018). En ambas especies, se acepta que la AC, por lo general, es de origen hereditario y de tipo autosómico recesivo, aunque aún se desconocen los mecanismos moleculares que llevan a una aparición temprana en equinos y tardía en caninos (Scott et al., 2018). Basados en estos antecedentes y haciendo uso de ambos casos de diferentes momentos de manifestación clínica, el objetivo de este trabajo fue realizar un estudio comparativo de los cambios histológicos de AC en el canino y el equino.
Materiales y métodos
Se utilizaron muestras de diferentes regiones cerebelosas (vermis, hemisferios laterales y lóbulo floculonodular) de una perra american staffordshire terrier de 6 años, que presentaba temblores, debilidad y ataxia como signos clínicos principales en el momento de la primera visita al Centro Hospital Veterinario de la Facultad de Veterinaria de la Universidad de la República (CHV, FVET-Udelar, Montevideo, Uruguay). Los signos neurológicos progresaron durante 6 meses y, debido al mal pronóstico, se realizó la eutanasia con autorización del propietario siguiendo el protocolo de eutanasia del CHV, FVET-Udelar, aprobado por la Comisión de Ética en el Uso de Animales (CEUA, FVET-Udelar) (Verdes et al., 2020). También se estudiaron muestras de las mismas regiones cerebelosas de un caso de AC en un potrillo raza árabe macho (Gagliardi et al., 2018). En resumen, el potrillo había manifestado signos neurológicos a los 40 días de edad, caracterizados por fasciculaciones en diferentes grupos musculares que fueron agravándose en pocos días, mostraba hiperexcitabilidad, mioclonias de músculos del cuello, hiperextensión, ataxia, incoordinación leve a moderada, temblor exacerbado en el cuello cuando caminaba al paso o se detenía, e hiperreflexia. Dado el rápido empeoramiento progresivo, se realizó la eutanasia según se describe en Gagliardi et al. (2018). En ambos casos se hizo una revisión macroscópica del cerebelo, registrándose fotográficamente los cambios morfológicos, así como el tamaño y distribución de las folias y surcos de ambos cerebelos. En el caso del canino, estos detalles se reportan en Verdes et al. (2020), mientras que en el caso del equino se muestran en las figuras 1 y 2. En ambos casos los cerebelos estaban reducidos de tamaño y, en el caso del equino, como se muestra en la figura 1, no llega a llenar la fosa caudal.
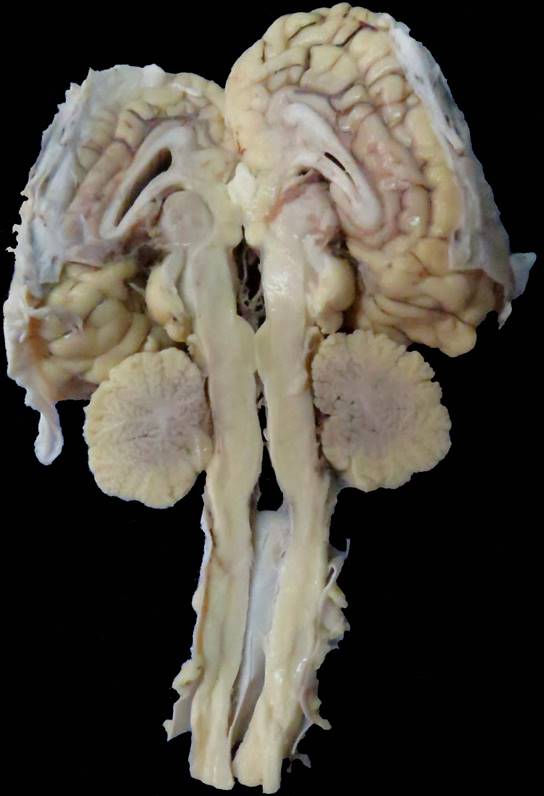
Figura 1: Abiotrofia cortical cerebelosa, equino, árabe, 40 días. El cerebelo no llega a llenar la fosa caudal. Nótese la demarcación de los espacios interfoliares que aparecen como surcos más profundos por la retracción de las folias cerebelosas.
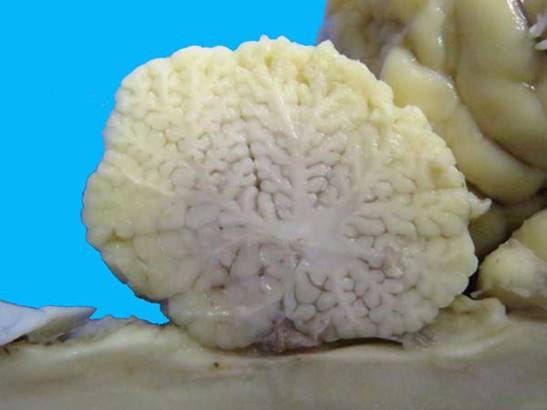
Figura 2: Abiotrofia cortical cerebelosa, equino, árabe, 40 días. Detalle del corte sagital del cerebelo que muestra su retracción.
Las muestras del cerebelo de cada animal fueron fijadas en solución de formol al 10 %, procesadas rutinariamente, seccionadas a 5 µm, coloreadas con hematoxilina y eosina, (HE) y montadas para realizar el examen histológico en microscopio óptico en el Laboratorio de Diagnóstico Patológico de la Unidad Académica de Patología de la Facultad de Veterinaria, Udelar. En ambos casos se evaluaron características histológicas tales como el espesor/adelgazamiento y reacción astroglial en la capa molecular, la cantidad de neuronas de Purkinje viables y en degeneración en la capa de Purkinje, y el espesor/adelgazamiento y celularidad de la capa granulosa. Estos cambios histológicos fueron graduados en tres grados de severidad creciente, en los que + indicaba lesiones leves, ++ lesiones moderadas y +++ lesiones severas.
Otras características histológicas evaluadas, pero no graduadas, incluyeron el espesor de las folias y los surcos cerebelosos, la ocurrencia de vacuolización en los lugares que se correspondían con la desaparición de células de Purkinje, la presencia de núcleos neuronales picnóticos en la capa granulosa y la presencia de células de Purkinje ectópicas en las otras capas de la corteza cerebelosa (granulosa y molecular).
Resultados
El resumen de los cambios histológicos y sus grados de severidad se muestran en la tabla 1. Todos los cambios histológicos incluidos en la graduación de severidad se presentaron distribuidos difusamente en las diferentes regiones cerebelosas de ambos animales. Los grados de lesiones fueron similares en ambas especies y varían de moderado a severo en el canino y de leve a severo en el equino. Las lesiones graduadas en la capa de Purkinje presentaron el mismo grado de severidad en ambas especies, así como el adelgazamiento de las capas molecular y granulosa. Se encontraron diferencias de 1 grado de severidad en la reacción astroglial en la capa molecular, esta fue moderada en el canino y leve en el equino, y en la disminución de células de la granulosa, severa en el canino y moderada en el equino (tabla 1).
Tabla 1: Resumen de los cambios histológicos en las 3 regiones cerebelosas estudiadas en un canino y un equino con abiotrofia cerebelosa.

+: leve, ++: moderado, +++: severo
Se observó además adelgazamiento de las folias cerebelosas acompañado de expansión de los surcos tanto en el canino como en el equino (figura 3).
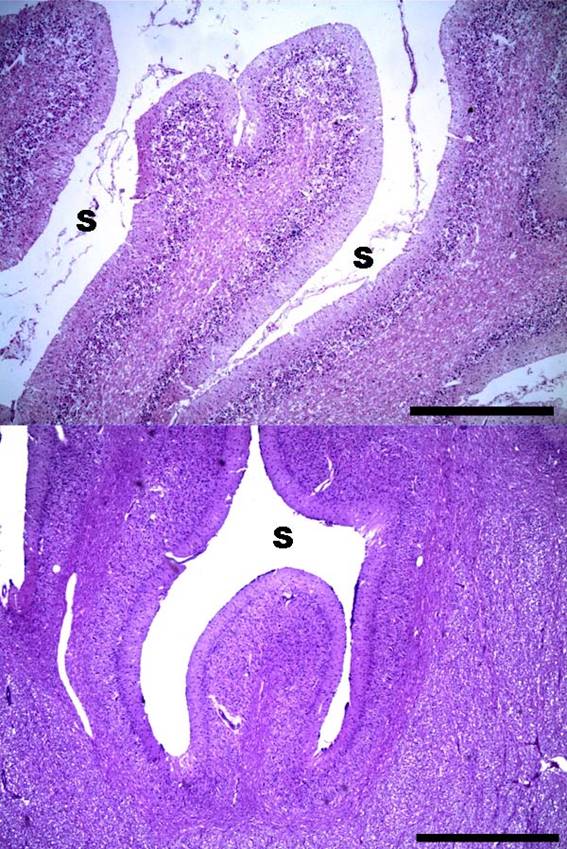
Figura 3: Abiotrofia cortical cerebelosa. Adelgazamiento de la folia cerebelosa y expansión de los surcos. Arriba: canino, abajo: equino. S = surco. HE. ×40 (escala equivale a 750 µm).
Histológicamente, se observaron cambios característicos en las 3 capas de la corteza cerebelosa en ambos animales. En la capa de células de Purkinje, hubo una disminución del número de estas neuronas, y las que aún permanecían presentaban cambios característicos de degeneración (sobre todo, cromatólisis y necroapoptosis de sus pericarios) en ambos animales (figura 4).
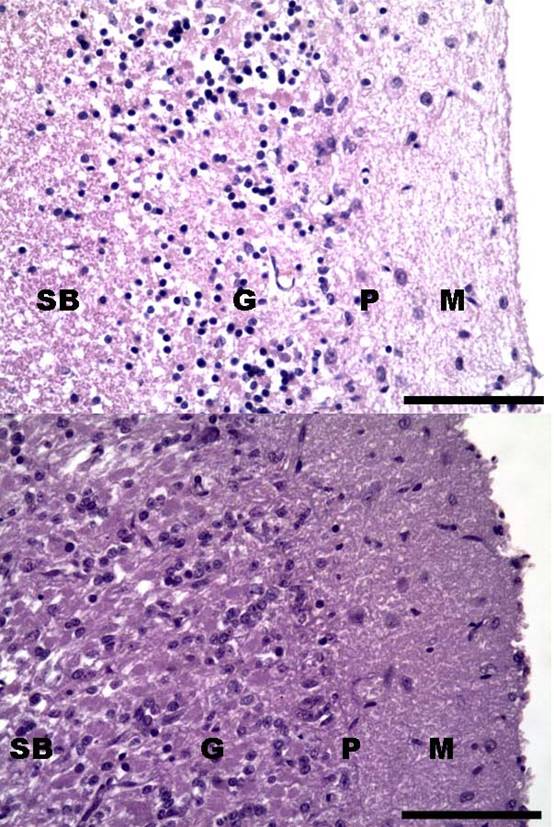
Figura 4: Abiotrofia cortical cerebelosa. Disminución de células granulosas, pérdida de células de Purkinje y adelgazamiento de la capa molecular con reacción astroglial. Arriba: canino, abajo: equino. M = capa molecular, P = capa de Purkinje, G = capa granulosa, SB = sustancia blanca. HE. ×400 (escala equivale a 75 µm).
No hubo diferencias en el grado de afectación de este cambio (disminución de células de Purkinje) entre ambas especies estudiadas, siendo este un cambio severo. También se detectó vacuolización en los lugares que se correspondían con la desaparición de células de Purkinje, se observó la lesión conocida como “cesta vacía”, generada por la desaparición de las neuronas de Purkinje, permanecieron solamente las conexiones que recibe de las células en cesta, acompañadas de agregación de células gliales. En la capa granulosa, se detectó una disminución de sus elementos celulares en ambos animales, con la presencia de núcleos neuronales picnóticos para el caso del equino; mientras que, para el canino, fue notoria una mayor severidad de esta alteración, en algunas áreas desapareció por completo la capa granulosa. En la corteza cerebelosa, también fue clara la presencia de numerosas células de Purkinje ectópicas en ambos animales estudiados, principalmente en la capa granulosa, este cambio fue característico en el equino. La capa molecular estaba adelgazada y se observaba gran número de astrocitos hipertróficos en ambos animales (reacción astroglial). No hubo diferencia entre ambas especies animales para este cambio característico de esta degeneración cortical cerebelosa.
Discusión
Los principales cambios histológicos en ambos animales fueron la disminución de células de Purkinje, la marcada reducción del número de células en la capa granulosa y el adelgazamiento de la capa molecular, junto con la presencia de astrocitos reactivos. Los hallazgos macroscópicos en el cerebelo de ambos animales en este estudio fueron descritos antes (Gagliardi et al., 2018; Verdes et al., 2020), remarcándose que ambos casos presentaban una moderada reducción del tamaño del cerebelo apreciable macroscópicamente, como es típico en casos de AC. Para ambos, es claro el diagnóstico de AC según la definición de este trastorno (Cantile y Youssef, 2016). Los cambios histológicos observados en la perra american staffordshire terrier de este estudio fueron similares a los reportados previamente para la misma raza, así como para otras razas caninas (Chieffo et al., 1994; Flegel et al., 2007; Forman et al., 2012; Henke et al., 2008; Jokinen et al., 2007; Kyostila et al., 2012; Olby et al., 2004; Sandy et al., 2002; Thomas y Robertson, 1989; Urkasemsin et al., 2010, 2017). Asimismo, los cambios observados en el equino también fueron similares a los reportes anteriores en caballos árabes (Blanco et al., 2006; Bugno-Poniewierska et al., 2019; Cavalleri et al., 2013; Sadaba et al., 2016; Scott et al., 2017, 2018). Aunque la relación entre la pérdida de células de Purkinje y la disminución de los elementos celulares en la capa granulosa se ha discutido a partir de las potenciales diferencias existentes entre las razas de una misma especie, así como por el tiempo transcurrido desde el inicio de los signos neurológicos, este detalle de las lesiones reportadas aún no se ha dilucidado de forma definitiva (Fenn et al., 2016; Huska et al., 2013; Olby et al., 2004; Shearman et al., 2011). Sato et al. (2012, 2013, 2015) sugieren que la patogénesis de esta enfermedad es el resultado de una sinaptogénesis fallida entre la capa granulosa y las células de Purkinje, según estudios en los que se usaron conejos como modelo animal de este trastorno, basándose en el mayor número de células granulosas apoptóticas observadas en las etapas tempranas de esta neurodegeneración. En nuestro caso, se detectaron cambios picnóticos nucleares en las neuronas de la capa granulosa, sin embargo, no fue posible aclarar si este cambio estaba relacionado con el inicio de la degeneración cortical cerebelosa, ya que los cambios en la capa granulosa y en la de las células de Purkinje fueron avanzados en su progresión patológica. Por otro lado, la disminución de las células granulosas fue más marcada en el canino que en el equino, se postula que este cambio estuvo vinculado al mayor tiempo de evolución clínica.
En el caso del canino examinado en este estudio, el animal tenía 6 años, se le realizó el examen post mortem 6 meses después del inicio de los primeros signos neurológicos. Para los american staffordshire terriers, se han reportado casos de AC en los que la aparición de los signos clínicos varía entre 3 y 13 años y, en todos los casos, los signos son lentamente progresivos (Hanzlicek et al., 2003; Henke et al., 2008; Olby et al., 2004). La edad de inicio y el curso clínico en nuestro caso fue consistente con estos reportes. Por otro lado, se menciona que los signos de este trastorno en los caballos árabes generalmente se reconocen desde el nacimiento hasta los 6 meses de edad (Scott et al., 2017). El tiempo de inicio en el equino estudiado coincide con lo reportado, ya que los signos neurológicos se iniciaron a los 40 días (Gagliardi et al., 2018). Como causa de esta enfermedad, se han estudiado anomalías genéticas en cada una de las especies afectadas, incluyendo caninos y equinos (Agler et al., 2014; Aleman et al., 2018; Brault et al., 2011; Bugno-Poniewierska et al., 2019; Fenn et al., 2016; Gagliardi et al., 2018; Shearman et al., 2011), examinándose la participación de diferentes genes para cada especie. Es interesante que los cambios histológicos básicos fueron similares entre ambas especies estudiadas, independientemente de las diferencias entre el momento de inicio y la progresión posterior, así como entre las potenciales alteraciones genéticas causantes de la AC. El bajo número de casos analizados en este trabajo representa la principal limitante de este estudio. Se necesita más investigación para aclarar los mecanismos de este trastorno utilizando estos y otros modelos animales.
Conclusiones
Realizamos el estudio comparativo de la AC entre un canino y un equino. La perra desarrolló síntomas neurológicos a los 6 años, estos progresaron con lentitud y fue sacrificada 6 meses después. Por otro lado, el potrillo desarrolló síntomas a los 40 días de edad, progresaron con rapidez y fue sacrificado una semana después del inicio de los signos neurológicos. Los cambios histológicos en ambos animales consistieron en disminución en el número de células en la capa granulosa, pérdida de células de Purkinje y adelgazamiento de la capa molecular con astrogliosis. Aunque el grado de severidad de los cambios fue ligeramente diferente entre ambos animales para algunas de las lesiones observadas, los tipos de lesiones fueron similares y difusamente distribuidos en las 3 regiones cerebelosas estudiadas.















