Introducción
Los micoplasmas son bacterias pleiomórficas consideradas como los organismos más pequeños capaces de reproducirse (Razin y Hayflick, 2010; Tortora et al., 2012). Suelen ser anaerobios facultativos, pero algunas especies pueden sobrevivir en microaerofilia con una concentración de CO2 entre el 5 y el 10% (Quinn et al., 2005). Pertenecen a la clase Mollicutes y son reconocidos por no tener pared celular y por la gran cantidad de hospedadores, pudiendo parasitar mamíferos, reptiles, peces, artrópodos y plantas (Razin y Hayflick, 2010).
Los micoplasmas son causantes de enfermedades en pequeños rumiantes. M. mycoides subsp. capri. puede ser uno de los agentes causantes de la pleuneumonía contagiosa caprina (PCC), además de ocasionar conjuntivitis, mastitis y artritis en caprinos, se ha detectado en ovinos (Shahet al., 2017). M. agalactiae es el agente etiológico de la agalactia contagiosa (OIE, 2013), enfermedad con notificación obligatoria que se ha detectado en Brasil, especialmente en la región noreste (Alves et al.,2013; Azevedo et al.,2006; Peixoto et al., 2018). M. conjunctivae es un agente conocido por ocasionar queratoconjuntivitis infecciosa (Van Halderen et al., 1994, Fernández-Aguilar et al., 2013) y en Brasil se aisló por primera vez en el estado de São Paulo (Gregory et al.,2003). M. conjunctivae se detectó por reacción en cadena de la polimerasa (PCR) en ovinos sanos y ovinos con conjuntivitis en el estado de Pernambuco, Brasil (Almeida Neto et al., 2004). Otras especies como M. capricolum subsp. capricolum y M. capricolum subsp. capripneumoniae (este último como causante de la pleuroneumonía caprina infecciosa) se han descrito en varios países (Awanet al., 2009; Kumar et al.,2011). Sin embargo, en Brasil, estos micoplasmas han sido inofensivos para los rebaños de ovinos.
Los micoplasmas suelen ser específicos de una especie (Whitfoord et al., 1994) y generalmente suelen estar presentes en sitios anatómicos específicos de cada infección. Sin embargo, ya se han detectado muchas especies en diferentes tejidos (Santos et al., 2009; Aguilar et al., 2019), lo que indica el papel de estos sitios como reservorios de estas bacterias en los rebaños. Se han detectado micoplasmas en el oído externo de rebaños caprinos y bovinos brasileños (Pereira et al., 2003; Santos et al., 2009), pero estas bacterias no se han estudiado en ovinos. Por esta razón, debemos de entender importancia económica de Mycoplasma spp. en la cría de ovinos. Este estudio tuvo como objetivo detectar estos microorganismos y su relevancia en la conjuntiva ocular y en el oído externo de ovinos sanos y neumónicos.
Materiales y métodos
El presente trabajo fue realizado de acuerdo con los principios éticos de la investigación animal adoptados por el Comité de Ética para el uso de animales de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Sao Paulo (Protocolo 1740110219).
Se estudiaron cuarenta y cinco ovinos machos y hembras, de tres granjas de cría semi-intensivas (N = 33ovinos) y del Hospital para Bovinos y Pequeños Rumiantes de la Facultad de Medicina Veterinaria y Ciencia Animal, Universidad de São Paulo (N = 12ovinos). Los ovinos fueron seleccionados al azar. Los animales no mostraron signos clínicos de conjuntivitis y / u otitis, pero fueron caracterizados como sanos y neumónicos, conforme descrito por Franco et al. (2019). En el examen físico se evaluaron parámetros vitales (frecuencia respiratoria, frecuencia cardíaca, temperatura rectal y movimientos ruminales) y las vías respiratorias inferiores y superiores. Se consideró que los ovinos neumónicos tenían al menos dos de los siguientes parámetros: frecuencia respiratoria superior a los 30 movimientos respiratorios por minuto, tos, temperatura rectal superior a 40 ° C y sonido anormal en auscultación torácica.
Las muestras de hisopos o con cotonetes se obtuvieron del oído externo (derecho e izquierdo) girándolos dentro durante 30-45 segundos y las muestras de la conjuntiva ocular (derecha e izquierda) se obtuvieron por frotación da conjuntiva ocular. Inmediatamente a la salida del conducto auditivo y ocular respectivamente, los hisopos se colocaron en un medio de transporte que contenía sacarosa, fosfato de sodio monobásico, fosfato de sodio dibásico, suero de caballo, acetato de talio y penicilina. Estas muestras se almacenaron en nitrógeno líquido.
El cultivo y el aislamiento de micoplasmas se realizó en agar y caldo SP-4 (Tully, 1995), como se describe: las muestras fueran homogeneizadas vigorosamente y se filtraron inicialmente con filtros estériles de 0,45 µm (Kasvi, Paraná, Brasil). Se agregaron doscientos microlitros de cada muestra filtrada a 1800 µl de caldo SP-4 y se sembraron 100 µl de cada muestra filtrada en agar SP-4. Se incubaron tubos y placas a 35±2 º Cenaerobiosis con 5% de CO2y fueron observadas durante quince días. La caracterización de micoplamas en el ágar ocurrió por la producción de colonias típicas de "huevo frito", fermentación de glucosa y / o hidrólisis de arginina. En los tubos, la presencia de micoplasma se caracterizó por ausencia de turbidez y fermentación de glucosa y / o hidrólisis de arginina (Brown et al., 2010).
La reacción en cadena de la polimerasa (PCR) se utilizó para la detección molecular de Mycoplasma spp. directamente en las muestras, así como para la confirmación de las colonias aisladas. La extracción de ADN se realizó como lo describen Boomet al., (1990) y la reacción en cadena de la polimerasa (PCR) se realizó logrado inicialmente para detectar microorganismos de micoplasmas utilizando los primers MGS0 (5'-TGCACCATCTGTCACTCTGTTAACCTC-3') y GP03 (5'-GGGAGCAAACAGGATTAGATACCCT-3) (van Kuppeveldet al., 1992). Las muestras positivas se volvieron a analizar para detectar M. agalactiae (MagF: 5’-CCT TTT AGA TTG GGA TAG CGG ATG - 3’/ MagR: 5’- CCG TCA AGG TAG CGT CAT TTC CTA C - 3’) (Chávez-Gonzales et al., 1995), M. mycoidessubsp. capri (MMMLC2-L: 5′-GATTTAACTTCTCATGCAAC-3′/ MMMLC2-R: 5′-AAGTAAAAATGAAAGAATTTTA-3′, y M. conjunctivae (McoF1: 5’- GTATCTTTAGAGTCCTCGTCTTTCAC-3 / Mco1: 51- CAGCGTGCAGGATGAAATCCCTC-3’)(Giacometti et al., 1999).
Se realizó una prueba de concentración mínima inhibitoria para colonias aisladas según Hannan, (2003). Los aislamientos fueron confrontados a los siguientes fármacos oxitetraciclina, tilosina, cloranfenicol y ácido nalidíxico, disponibles en el laboratorio y que se utilizan a menudo contra la enfermedad micoplamosis.
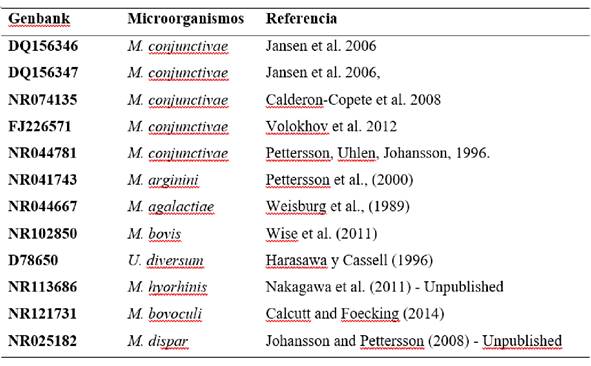
El análisis filogenético se realizó utilizando una secuencia parcial del gen 16S rRNA (van Kuppeveld et al., 1992) de los aislamientos obtenidos. Los productos de PCR fueron purificados por Exosap-IT (GE) siguiendo las instrucciones del fabricante. El kit de secuenciación Big Dyeterminator v.3.0 (Life) y el kit de purificación X-terminator (Life) se utilizaron durante el protocolo de secuenciación de ADN. Las muestras se colocaron en el secuenciador de ADN automatizado ABI 3130 (ABI). Las secuencias fueron editadas y alineadas en el software BioEdit 7 Sequence Alignment Editor. Las secuencias de nucleótidos se analizaron en MEGA X (Kumar et al., 2018). Se seleccionó el método de unión de vecinos para la reconstrucción filogenética de las secuencias de micoplasma con el método de Tamura-Neicomo modelo de sustitución (Tamura y Nei, 1993), y 10 000 bootstreps para el cálculo de estimaciones de filogenia. El porcentaje de similitud y la distancia genética se realizó con secuencias detectadas en este estudio y otros aislamientos pertenecientes a la misma especie. Los números de acceso de GenBank de las secuencias utilizadas se describen en la tabla 1.
La asociación entre la detección molecular de micoplasmas y la enfermedad respiratoria de los ovinos se evaluó mediante la prueba de Chi-Cuadrado de Pearson o la Prueba Exacta de Fisher. La significancia fue dada por P< 0,05. Los cálculos se realizaron en SPSS v. 25.0 (IBM, Estados Unidos).
Resultados
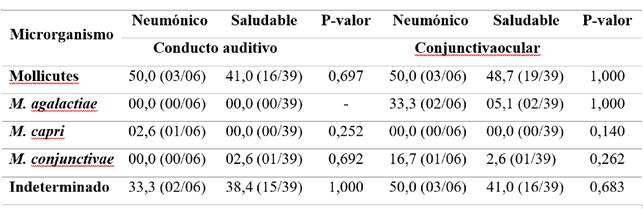
Se detectaron micoplasmas molecularmente en las muestras de conducto auditivo externo (32,2%; 29/90) y conjuntiva (26,7%; 24/90). De las muestras positivas a micoplasmas, M. agalactiae solo se detectó en la conjuntiva (16,7%; 04/24). M. conjunctivae y M. mycoides subsp. capri se detectaron en el canal auditivo externo (3,4% (01/29); 10,3% (3/29), respectivamente) y la conjuntiva (12,5% (03/24); 4,2% (01/24), respectivamente). Entre las muestras positivas a micoplasmas, el 86,2% (25/29) del oído externo y el 66,7% (16/24) de la conjuntiva ocular no tenían las especies determinadas por los primers aquí utilizados.
En cuanto a la enfermedad respiratoria, seis ovinos se consideraron neumónicos y 39 sanos. M. agalactiae se detectó solo en la conjuntiva ocular de ovinos sanos, mientras que M. capri se detectó solo en el canal auditivo de animales enfermos. M. conjunctivae se detectó en ambos sitios anatómicos de los dos grupos (Tabla 2). No hubo asociación entre la detección molecular de micoplasmas y la enfermedad respiratoria ovina.
Tabla 2: No existe asociación entre la detección de micoplasmas en el conducto auditivo externo o conjuntiva ocular y enfermedad respiratoria ovina. Los resultados se dieron en relación con el número de animales estudiados (N = 45) y se expresaron como % (N / T), siendo N el número de animales positivos y T el número total de animales. Los valores de P se obtuvieron mediante la prueba de Chi-Cuadrado de Pearson o la prueba exacta de Fischer, con significancia cuando P < 0,05.
Se aislaron colonias de “huevos fritos” fermentadores de glucosa de la conjuntiva de un ovino sano del hospital veterinario universitario. El método de PCR confirmó estas colonias como Mycoplasma conjunctivae (denominada como cepa SP317). Se extrajo el ADN y se secuenció una secuencia parcial del gen del ARNr 16S (número de acceso de Genbank: MK656520). El análisis filogenético reveló proximidad (1,1) y similitud (98.8%) con aislado de M. conjunctivae de ovino y de cabra de los Estados Unidos (tabla3), confirmando los resultados observados en el árbol filogenético (Figura 1).
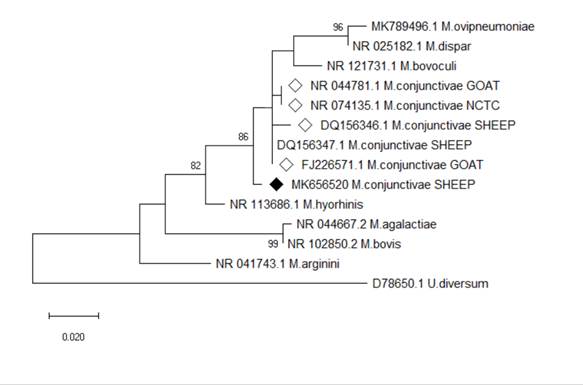
Figura 1: Árbol filogenético que demuestra la relación entre un aislado de Mycoplasma conjunctivae de la mucosa ocular de una ovino del estado de São Paulo, Brasil, y otros aislamientos de ovinos y caprinos. Nota: La muestra con un diamante negro indica el aislado obtenido en la presente investigación. Las muestras con un diamante blanco indican aislamientos de M. conjunctivae. El árbol filogenético se infirió utilizando el método de máxima verosimilitud y el modelo de Tamura-Nei (Tamuray y Nei, 1993). Los análisis evolutivos se realizaron en MEGA X (Kumar et al., 2018).
Tabla 3: Estimaciones de divergencia evolutiva y porcentaje de similitud entre el aislado brasileño y otras secuencias de Mycoplasma conjunctivae.
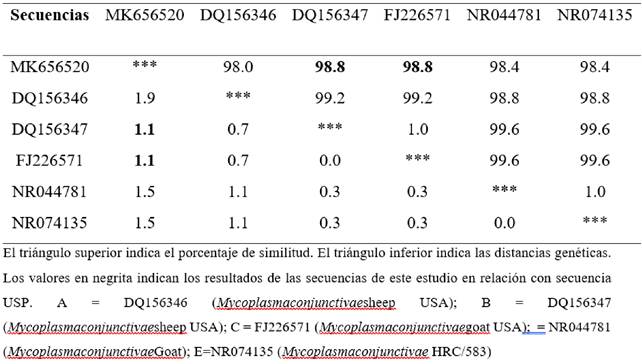
El alineamiento de las secuencias de nucleótidos mostró diferencias en los últimos nucleótidos (Figura 2).

Figura 2: Alineamiento de secuencias de nucleótidos del gen de ARNr 16S (secuencia parcial) de M. conjunctivae de un ovino brasileño (MK656520) y otros aislados de ovino (NR044781, DQ156346, DQ156347, NR074135) y de cabra (FJ226571). Los puntos indican identidad con la cepa MK656520.
Se determinó la concentración mínima inhibitoriapara el aislado de M. conjunctivae, utilizando cuatro antibióticos. La CMI fue 0,5 µg / ml para oxitetraciclina, 4 µg / ml para cloranfenicol, 0,5 µg / ml para tilosina y 32 µg / ml para ácido nalidíxico.
Discusión
Se estudió la presencia de micoplasmas potencialmente patógenos en el conducto auditivo externo y en la conjuntiva de ovinos sanos y con enfermedad respiratoria. Se detectaron molecularmente especies importantes en los dos sitios anatómicos de ambos grupos de ovinos, además del aislamiento de M. conjunctivae de un ovino sano. Los resultados indican que el canal auditivo y la conjuntiva son importantes reservorios de micoplasmas y posibles puntos de entrada silenciosos para enfermedades en el rebaño.
La presencia de micoplasmas potencialmente patógenos en rumiantes como bovinos y caprinos es recurrentemente mencionada en la literatura (DaMassa, 1983; Mercier et al., 2007; Amores et al.,2010) por lo que en ovinos no son mencionados. En este trabajo, fueron detectadas por la técnica laboratorial de PCR las especies M. mycoides subsp. capri y M. agalactiae, patógenos bien conocidos de la agalaxia contagiosa (Scott, 2011). Estos microorganismos se han identificado en los sitios auriculares y oculares de bovinos brasileños (Pereira et al.,2003) y caprinos y ovinos de otros países (Motha et al., 2003), siendo en este presente estudio la primera identificación en ovinos brasileños. Estas especies pueden causar enfermedades respiratorias en pequeños rumiantes (Scott, 2011). Aunque estos microorganismos se han identificado en la conjuntiva ocular y el conducto auditivo externo de ovinos neumónicos, la asociación de la presencia de estos agentes y la enfermedad respiratoria de los ovinos no fue significativa en este estudio. Cabe mencionar que la evaluación de los agentes causales de enfermedad respiratoria está fuera del alcance del presente trabajo y que ningún ovino mostró signos clínicos de agalaxia contagiosa, pero la detección de ambos microorganismos debe tratarse con precaución.
La mayoría de las muestras positivas para micoplasma no se han confirmado su especie y es probable que otras especies podrían estar presentes en ambos sitios anatómicos. De hecho, M. putrefaciens, M. alkalensis, M. arginini, M. bovirhinis (Pereira et al., 2003) y M. bovoculi ya se han detectado en el oído externo de pequeños rumiantes y bovinos, y para conocer todos los agentes presentes en el conducto auditivo y en la conjuntiva, el estudio del microbiota debe realizarse mediante la secuenciación de una nueva generación.
M. conjunctivae es el agente etiológico de la queratoconjuntivitis infecciosa (Van Halderenet al., 1994) y en este trabajo se identificó tanto en la conjuntiva como en el canal auditivo de animales sin esta infección ocular, indicando la posible participación de otros sitios anatómicos además de los ojos como reservorios de este microorganismo en los rebaños. Aguilar et al., (2019) estudiaron el papel de diferentes sitios anatómicos en la transmisión y preservación de M. conjunctivae en rebaños de caprinos y verificaron que el conducto auditivo es uno de los sitios anatómicos con mayor persistencia de este agente. Ya se ha descrito la persistencia de M. conjunctivae en la población de pequeños rumiantes tras un brote de queratoconjuntivitis (Fernández-Aguilar et al., 2017) y se cree que los mecanismos de evasión del sistema inmunológico, como mutaciones en proteínas de superficie, son responsable de esta persistencia (Rosengarten et al., 2000).
En la presente investigación, un ovino sano del hospital veterinario portaba M. conjunctivae en la conjuntivaque fue aislado y cultivado en el laboratorio. El entorno hospitalario puede presentar condiciones en las que favorece una salud más frágil y con mayor estrés. Las situaciones que generan estrés como enfermedades, transporte, vacunación y destete son predisponentes a infecciones oportunistas, como la micoplasmosis.
El análisis filogenético mostró que el aislado brasileño fue cercano genéticamente a un aislado estadounidense de un ovino y de una cabra, este hallazgo puede ser explicado por las relaciones comerciales entre estos países. Describiendo nuestros valores de CMI para tilosina y oxitetraciclina se pudo observar que eran inferiores a los descritos por Egwu, (1992), lo que indica que las infecciones por el agente aislado aún se pueden tratar con éxito, inclusive si se ha aislado en un entorno hospitalario, donde estos dos principios activos se utilizan ampliamente en la clínica de rumiantes.
Conclusiones
La detección y aislamiento de importantes especies de micoplasmas tanto en el conducto auditivo externo como en la conjuntiva de ovinos indica el posible papel de estos sitios anatómicos en el mantenimiento de estos microorganismos en el rebaño. La proximidad genética entre M. conjunctivae aislado en Brasil y en de los Estados Unidos indica una posible ruta para la introducción de estos microorganismos. Incluso con la ausencia de una asociación entre la presencia de estas bacterias y la enfermedad respiratoria, los resultados de este documento amplían las alertas a los médicos y epidemiólogos sobre una posible fuente silenciosa de estos microorganismos en los rebaños (en particular, en los entornos de corrales de engorda) y en los sitios hospitalarios donde los animales están más predispuestos a la infección. Hasta donde sabemos, esta es la primera investigación para estudiar la susceptibilidad antimicrobiana de aislados de M. conjunctivae de ovinos brasileños. Se necesita más investigación para determinar una descripción más detallada del perfil de susceptibilidad a los antibióticos de M. conjunctivae en Brasil.












 Curriculum ScienTI
Curriculum ScienTI