Introducción
La peritonitis infecciosa felina (PIF) es la principal causa infecciosa de muerte en gatos (Greene, 2008). El agente causal es el virus de la peritonitis infecciosa felina (FIPV), un patógeno de distribución mundial y que pertenece a la familia Coronaviridae. Está estrechamente relacionado con el coronavirus entérico felino (FECV) (Tomoyoshi et al., 2020) y diferentes estudios indican que el FIPV proviene de la mutación del FECV (Felten y Hartmann, 2019). En este sentido, se estima que luego del contagio por FECV entre el 5 y el 10% de los infectados desarrollarán PIF (Rubio y Chavera, 2018). De acuerdo con la revisión realizada por los autores no hay datos de incidencia de PIF en Uruguay ni datos comparativos con VIF ni ViLeF. La PIF es predominantemente una enfermedad de gatos jóvenes (entre 6 meses y 2 años de edad) estando sobre-representados los felinos de raza pura y machos enteros (Rohrbach et al., 2001). Factores medioambientales como el estrés y la alta densidad de población felina predisponen a la enfermedad y determinan el cuadro clínico (Greene, 2008); Tasker, 2018). La PIF puede manifestarse clínicamente con derrame (forma efusiva o húmeda), sin derrame (forma no efusiva o seca) y en forma mixta, dependiendo de la inmunidad individual (Prieto y Acuña, 2012). Las manifestaciones clínicas asociadas a la PIF son variables ya que puede afectar a varios órganos (hígado, pulmones, bazo, serosas, riñones, ojos y sistema nervioso central), generando necrosis e inflamación granulomatosa piógena. En la forma efusiva y mixta se observa acumulación de líquido en cavidad pleural y abdominal, siendo el hallazgo clínico más importante y altamente sugestivo de esta patología (Pedersen, 2014).
El diagnóstico de la forma no efusiva o seca de la PIF, es considerado un desafío clínico ya que los signos clínicos presentes son inespecíficos y no concluyentes como anorexia, letargia, pérdida de peso, pirexia, signos neurológicos y oculares, pudiendo variar a lo largo del tiempo (Felten y Hartmann, 2019; Tasker, 2018). Los hallazgos hematológicos y bioquímicos son también inespecíficos, observándose con frecuencia anemia no regenerativa, leucocitosis con neutrofilia y linfopenia, hiperproteinemia, hiperglobulinemia y relación albúmina/globulina menor a 0,8 (Prieto y Acuña, 2012). Por otro lado, los distintos test inmunocromatográficos, así como la RT-PCR, no tienen la capacidad de diferenciar entre felinos infectados por FECV o por PIF (Kipar y Meli, 2014; Tasker, 2018). En este mismo sentido, tanto la histopatología como la inmunotinción (siendo esta última la técnica gold standard), tampoco son contundentes en el diagnóstico de PIF, ya que gatos con serología positiva pueden no tener alteraciones histopatológicas típicas de esta enfermedad (Tasker, 2018). La inmunotinción tiene como desventaja que no distingue entre FECV y PIF, y solo detecta el agente causal cuando los macrófagos afectados poseen carga viral alta (Pedersen, 2014).
La dificultad diagnóstica a la que se enfrenta el veterinario clínico radica entonces en la dificultad de interpretar los signos clínicos y en que los métodos paraclínicos ante mencionados suelen no ser concluyentes. Esto hace necesario utilizar herramientas metodológicas complementarias (principalmente en la presentación no efusiva de PIF), como el proteinograma electroforético capilar (PEF) que contribuyan al diagnóstico de la misma. El 95,1% de los felinos afectados por PIF presenta alteraciones en el PEF, siendo la más consistente el incremento en las γ-globulinas acompañado de un patrón policlonal y una relación albúmina/globulina menor a 0,8 (Taylor et al., 2010). Incorporar el PEF al panel diagnóstico de rutina ante la sospecha clínica de PIF no efusiva no solo permite su confirmación, sino que brinda un pronóstico y tratamiento certero a esos pacientes (Felten y Hartmann, 2019; Paltrinieri et al., 2002). Al presente no hemos encontrado reportes en nuestro país al respecto.
El presente trabajo tiene como objetivo reportar como el proteinograma electroforético capilar contribuyó a confirmar el diagnóstico de PIF en un gato, con diagnóstico presuntivo de PIF en su forma no efusiva, atendido en una clínica privada de nuestro país y cuyos exámenes colaterales se realizaron en el Laboratorio de Análisis Clínicos de Facultad de Veterinaria, UdelaR.
Materiales y Métodos
Caso Clínico
Se presentó a consulta un felino, hembra, cruza, de 5 años de edad, de nombre “Clarita”, que cohabitaba con otros 6 gatos, todos recogidos de la calle. Se constata por la anamnesis realizada que en la vivienda existían antecedentes de peritonitis infecciosa felina. Motivó la consulta la pérdida de peso constatada por el tenedor desde hacía 3 meses, además presentaba mucosas pálidas, pelaje áspero e hirsuto. Al examen clínico se evidenció ataxia e incoordinación en los cuatro miembros, déficit propioceptivo y caquexia. A la palpación abdominal se constataron varias masas de tamaño variable. En base al antecedente de presencia de PIF en el domicilio, la convivencia con otros gatos y la sintomatología clínica nos planteamos como diagnóstico presuntivo la PIF no efusiva. No fue posible comprobar la presencia de otros agentes infecciosos como virus de inmunodeficiencia felina, virus de la leucemia felina y/o toxoplasmosis, debido a limitantes económicas de la tutora de la paciente. Como aproximación diagnóstica se tomaron muestras para hemograma, funcional hepático y perfil renal, para luego realizar serología para PIF y PEF. Las muestras fueron remitidas al Laboratorio de Análisis Clínicos de la Facultad de Veterinaria, UdelaR.
Toma de muestras
Se extrajeron 2 mL de sangre de la vena cefálica, con aguja 21G y se dividió la muestra en 2 submuestras. Una de ellas se colocó en un tubo con EDTA para la realización de un hemograma, y la otra en un tubo sin anticoagulante para la realización de un funcional hepático, perfil renal, test serológico inmunocromatográfico y proteinograma electroforético capilar.
Estudios paraclínicos
Hematología y bioquímica sérica
El hemograma se realizó en un contador hematológico (Orphée, Mythic 18 Vet, Ginebra, Suiza). Para el recuento diferencial de los leucocitos y valoración de la morfología celular se realizó un frotis sanguíneo teñido con May Grünwald - Giemsa el cual fue evaluado con microscopio Nikon Eclipse E100.
El funcional hepático y el perfil renal se determinaron en suero en un equipo automático CB 350i (Wiener lab Group, Rosario, Argentina) utilizando reactivos y controles comerciales del mismo proveedor. Se determinó alanina aminotransferasa (referencia 1762360), aspartato aminotransferasa (referencia 1752360), fosfatasa alcalina sérica (referencia 1361402), γ glutamil transferasa (referencia 1421404), proteínas totales (referencia 1690009), albúmina (referencia 1690008), globulinas, colesterol (referencia 1220114), bilirrubina total (referencia 1120008), urea (referencia 1260360), creatinina (referencia 1260360) y fósforo (referencia 1382321).
Test serológico
Se determinó la presencia de anticuerpos contra virus de la PIF FCoV por inmunocromatografía mediante la utilización de un kit comercial FASTest® FIP (Megacor Diagnostik, Hörbranz, Austria), con una sensibilidad y especificidad de 97,4% y 94,6%, respectivamente (referencia 990025RK1).
Proteinograma electroforético capilar (PEF)
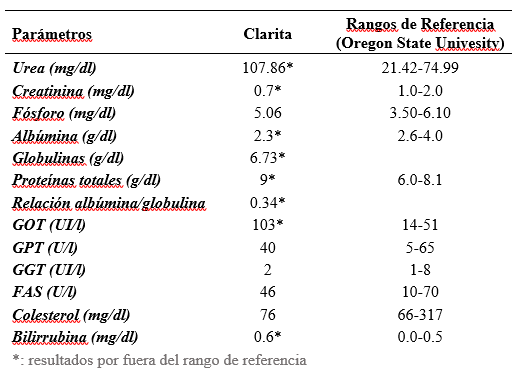
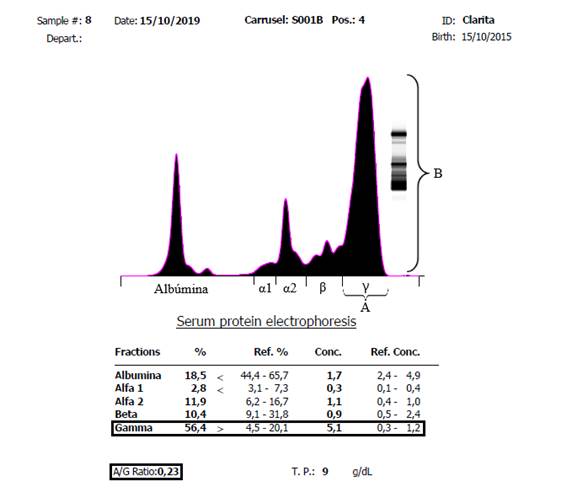
El proteinograma electroforético capilar fue realizado en el Laboratorio de Análisis Clínicos de Facultad de Veterinaria de la UdelaR, utilizando un equipo automatizado (Minicap, Sebia, Barcelona, España). Esta técnica separa electrocinéticamente las proteínas séricas obteniendo el siguiente orden de migración: γ globulinas, β-2 globulinas, β-1 globulinas, α-2 globulinas, α-1 globulinas y albúmina (Figura 1). Nótese en la figura un primer pico predominante correspondiente a la albúmina y una segunda elevación correspondiente a la fracción de α1 y α2 globulinas dentro de las que se encuentran proteínas de fase aguda como ceruloplasmina, haptoglobina y α2-macroglobulinas. La tercera fracción corresponde a las β-globulinas comprendiendo a la transferrina, lipoproteínas, proteínas del complemento e inmunoglobulinas como IgA e IgM. La cuarta elevación corresponde a las γ-globulinas, estando compuesta principalmente por inmunoglobulinas (principalmente IgG), así como la proteína C reactiva (Taylor et al., 2010).
Figura 1: Representación gráfica del resultado de una corrida electroforética realizada a partir de una muestra de suero obtenida de un felino macho, de 5 años de edad, clínicamente sano, en un equipo automático (Minicap, Sebia) en el Laboratorio de Análisis Clínicos de Facultad de Veterinaria, UdelaR
Resultados
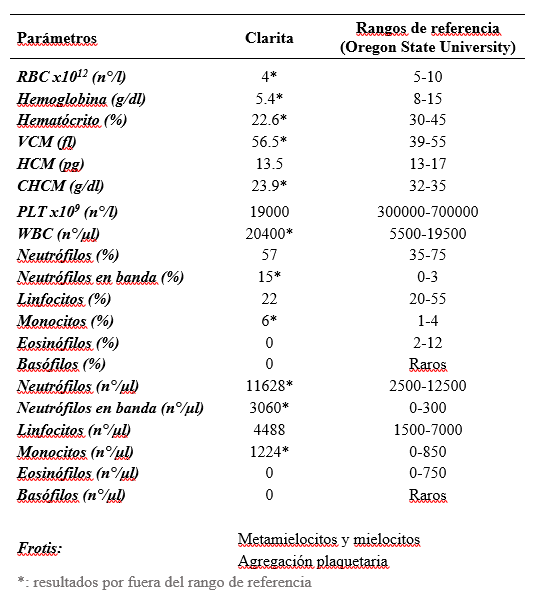
El hemograma realizado evidenció una leucocitosis moderada con neutrofilia, desviación a la izquierda y monocitosis. En cuanto a la serie roja se observó una anemia de tipo macrocítica e hipocrómica (Tabla 1).
Tabla 1: Hemograma realizado a felino, hembra, 5 años, “Clarita” en un contador hematológico (Orphée, Mythic 18 Vet), Laboratorio de Análisis Clínicos, FVet, UdelaR
Los resultados de la bioquímica sérica mostraron una azotemia elevada y una creatininemia disminuida, con valores de 108 mg/dl y 0,7 mg/dl respectivamente. En el funcional hepático se observó una elevación de las proteínas totales (9 g/dl) y una disminución en la concentración de albúmina (2,3 g/dl), lo que conduce a una relación albúmina/globulina baja (0,34). La concentración de colesterol no estuvo afectada, en tanto la bilirrubina total se encontró levemente por encima del rango de referencia (0.6 mg/dl). En cuanto al enzimograma hepático solo se vio un aumento en la concentración sérica de la aspartato aminotransferasa (103 UI/l) (Tabla 2).
El test serológico rápido inmunocromatográfico para detectar la presencia de anticuerpos contra FCoV arrojó un resultado positivo.
El resultado del PEF mostró la fracción correspondiente a la albúmina francamente disminuida, tanto en valor porcentual como en su concentración (1,7 g/dl). La fracción correspondiente a la α-1 globulina muestra una leve disminución porcentual, pero su concentración (0,3 g/dl) está dentro del rango de referencia para la especie. La fracción α- 2 globulina por el contrario, si bien el valor porcentual es adecuado, mostró un leve aumento en su concentración (1,1 g/dl). La fracción β se encontró dentro del intervalo de referencia tanto en su valor absoluto como relativo. La alteración más significativa observada en esta corrida electroforética fue el marcado pico en la región γ, mostrando un aumento porcentual y en la concentración de las γ globulinas (56,4% y 5,1 g/dl, respectivamente). Este pico además de ser alto (concentración elevada), presentó una base ancha evidenciando la presencia de una gammapatía policlonal, en la que varias poblaciones de células B se encuentran produciendo distintos tipos de inmunoglobulinas (Figura 2).
Discusión
Este trabajo pone en evidencia la relevancia del uso del PEF capilar para contribuir al diagnóstico de la PIF en su forma no efusiva, siendo a nuestro saber el primer reporte en Uruguay en describir la importancia de uso. Dado que en la forma no efusiva de la enfermedad el diagnóstico clínico es difícil de realizar, ya que no hay acumulación de líquido en cavidad peritoneal ni pleural, toman relevancia los estudios paraclínicos.
En el caso presentado se evidenció una anemia de tipo macrocítica hipocrómica. La información disponible al respecto en pacientes con PIF es discordante, reportándose casos de pacientes con anemia de tipo normocítica normocrómica, atribuida al proceso inflamatorio de tipo crónico (Pedersen, 2014; Tasker, 2018) así como también la presencia de anemia de tipo microcítica (Felten y Hartmann, 2019; Riemer et al., 2016).
La leucocitosis con neutrofilia y desviación a la izquierda evidenciada en el caso concuerda con lo descrito por Tasker (2018). Sin embargo no encontramos linfopenia, la cual se describe con mayor (77%) o menor (49,5%) frecuencia en gatos con PIF dependiendo de la bibliografía consultada (Pedersen, 2014; Riemer et al., 2016; Tasker, 2018).
Los cambios en la bioquímica sérica de felinos que padecen PIF suelen ser inespecíficos y muy variados. En este sentido las alteraciones encontradas en nuestra paciente no permitieron orientar el diagnóstico a excepción del aumento observado en la concentración de las proteínas séricas totales. Estos resultados son concordantes con lo reportado a nivel internacional para gatos con PIF (Tasker, 2018). Sin embargo cabe señalar que este aumento es inespecífico ya que puede observarse también en otras afecciones (infecciones o por deshidratación). No obstante, el perfil de proteínas observado en nuestra paciente, con un aumento de las proteínas totales a base de globulinas y niveles de albúmina disminuidos, coincide con lo reportado para gatos con PIF (Taylor et al., 2010).
Otro hallazgo importante y que contribuye al diagnóstico de PIF es el bajo índice albúmina/globulina observado en la paciente, encontrándose por debajo de 0,4, siendo altamente sugestivo de esta patología acorde a lo reportado en la bibliografía (Pedersen, 2014; Prieto y Acuña, 2012; Tasker, 2018).
El test inmunocromatográfico realizado a nuestra paciente, si bien arrojó un resultado positivo y en este caso nos ayudó al diagnóstico de PIF, como herramienta per se no es concluyente ya que todos los animales que hayan estado expuestos al virus y desarrollado anticuerpos serán positivos al test, no discriminando entre FECV y FIPV (Kipar y Meli, 2014).
Es sabido que en pacientes felinos con PIF se incrementa la producción de inmunoglobulinas, proteínas del sistema del complemento y reactantes de fase aguda (Prieto y Acuña, 2012). En lo que respecta al PEF en nuestro caso clínico se observó que la concentración de globulinas α-2 se encontró levemente por encima del límite superior de referencia, mientras que las γ globulinas evidenciaron una concentración elevada con un pico del tipo policlonal. Este hallazgo coincide con lo reportado a nivel internacional donde se menciona que en fases tempranas de la patología predomina un aumento de la fracción α-2, mientras que en fases más avanzadas se observa con mayor frecuencia un incremento en la concentración de γ-globulinas (Stranieri et al., 2017; Tasker, 2018). Esto nos permite pensar que nuestra paciente podría estar en un momento de transición entre ambas fases de la enfermedad. Taylor et al. (2010) señalan que en el 95,1% de los felinos infectados con PIF se observa un incremento de la fracción γglobulina con patrón policlonal. Si bien esta hipergamaglobulinemia puede deberse también a otras patologías (neoplasias, procesos inflamatorios y/o estimulación antigénica), la causa más frecuente de gammapatía policlonal en felinos es la PIF (Fontana, 2016). Los resultados obtenidos mediante PEF capilar (relación albúmina-globulina, cuantificación de γ-globulinas y su patrón de base ancha y altura aumentada) son sugestivos de la presencia de esta enfermedad.
De acuerdo a la historia clínica de la paciente, la sintomatología clínica, los estudios paraclínicos de rutina y el perfil proteico característico observado en el PEF nos permitimos concluir que la paciente padecía un cuadro de PIF de tipo no efusivo. El poder confirmar mediante el PEF la patología evidenció la gravedad del pronóstico y a pesar de comenzar inmediatamente un tratamiento paleativo (inmunosupresores y antibioticoterapia) la no remisión de los signos clínicos llevo a realizar la eutanasia humanitaria de la paciente.