Introducción
La tricomoniasis bovina es una enfermedad venérea causada por el protozoario extracelular flagelado Tritrichomonas foetus (Rae y Crews, 2006). La enfermedad está mundialmente distribuida (Yao, 2013), principalmente en regiones que utilizan la monta natural como manejo reproductivo (Rae y Crews, 2006).
Los toros son portadores asintomáticos y diseminadores del protozoario. La transmisión ocurre principalmente en el momento del coito, aunque también puede ocurrir por inseminación artificial (IA) ya que T. foetus puede permanecer viable en semen criopreservado (Eagleasome y Garcia, 1992). El parásito se aloja en las criptas prepuciales y en la mucosa peneana de los toros sin afectar la libido (BonDurant, 2005). En condiciones in vitro el parásito altera la motilidad progresiva de los espermatozoides, lo que sugiere una posible influencia negativa en la calidad seminal (Ribeiro et al., 2010).
La enfermedad afecta directamente el desempeño reproductivo de las hembras, pudiendo obtenerse entre 45,3% y 57% de vacas no preñadas al final del servicio y, consecuentemente, una reducción del 14% al 50% de la cantidad de terneros al pie de las madres (Ondrak, 2016). Esto se debe a que la infección en vacas y vaquillonas suele resultar en infertilidad, muerte embrionaria, piometra poscoital, aborto o maceración fetal (BonDurant, 2005; Ondrak, 2016; Rae y Crews, 2006). Se ha estimado que las pérdidas por vaca infectada con T. foetus en lecherías de California, EEUU, han alcanzado los US$665 (Goodger y Skirrow, 1986). No se reportan en países de Sudamérica estimaciones del impacto económico de esta enfermedad.
Teniendo en cuenta el hábitat de T. foetus, el diagnóstico de tricomoniasis bovina se ha basado en el cultivo y la examinación microscópica de muestras clínicas de esmegma prepucial de toros (Clark y Diamond, 2002; Schonmann et al., 1994). Cuando se producen pérdidas gestacionales, el mucus cervicovaginal de vacas/vaquillonas afectadas, y los órganos y fluidos de los fetos abortados representan muestras adecuadas para el diagnóstico ((BonDurant, 2005).
Tritrichomonas foetus también puede ser detectada mediante amplificación de secuencias de ADN ribosomal por PCR convencional con cebadores específicos que permiten la amplificación del gen 5.8S y secuencias ITS1 e ITS2 del parásito (Felleisen et al., 1998). También se han desarrollado protocolos de PCR cuantitativa o en tiempo real (qPCR) que proporcionan además de alta especificidad, una alta sensibilidad (McMillen y Lew, 2006), aunque este último abordaje es más costoso que la PCR convencional (Oyhenart, 2018).
La tricomoniasis bovina está reportada en Argentina como una enfermedad persistente en los establecimientos, con una prevalencia predial que varía del 3% al 19,4% en diferentes regiones del país (Molina et al., 2018a; Rojas et al., 2011; (Suárez et al., 2008). En la provincia de La Pampa se implementó, primero en forma voluntaria y actualmente de forma obligatoria, el Programa Provincial de Control y Erradicación de enfermedades venéreas bovinas (tricomoniasis bovina y campilobacteriosis genital bovina). Este programa demostró ser eficaz, reduciendo la prevalencia predial de estas enfermedades de aproximadamente 10% a 3% en un período de 7 años (2007-2014), utilizando como diagnóstico únicamente el cultivo (Molina et al., 2018b). En Brasil, considerando distintos estudios regionales, la prevalencia a nivel de rodeos de tricomoniasis bovina es de 1,88% a 66,7% (Alves et al., 2011; Filho et al., 2018; Oliveira et al., 2015), con regiones donde no se reporta la enfermedad (Rocha et al., 2009).
En Uruguay la enfermedad se diagnosticó por primera vez en la década de 1940 en tambos, tanto en vacas como en fetos abortados (Cassamagnaghi y Cassamagnaghi, 1944). Varias décadas después se observó una frecuencia de 6,5% (50/768) de establecimientos positivos al parásito en la cuenca lechera del país (Errico et al., 1978; Herrera et al., 1986). La última referencia del parásito data del año 2005, cuando se reportó su observación por campo oscuro en el líquido abomasal de un feto bovino abortado, en coinfección con Campylobacter fetus subespecie venerealis (Easton, 2006), otro agente abortivo de transmisión venérea. En un estudio a nivel nacional en ganado de carne, se evaluaron por cultivo 1754 muestras de esmegma prepucial de toros, sin detección de animales positivos para T. foetus (Repiso et al., 2005).
Sin embargo, debido que no se han implementado masivamente programas de control y erradicación de tricomoniasis bovina en Uruguay, es esperable que la enfermedad continúe presente en los rodeos bovinos. El objetivo de este trabajo es mostrar el potencial del uso de PCR para la detección de T. foetus en muestras de esmegma prepucial de toros negativas por cultivo.
Materiales y métodos
Obtención de las muestras
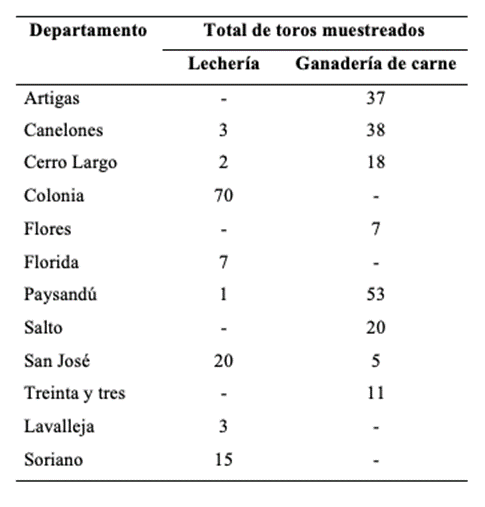
Entre julio de 2016 y febrero de 2019, se obtuvieron 310 muestras de esmegma prepucial de toros de 56 establecimientos distintos, localizados en 12 departamentos de Uruguay (Tabla 1).
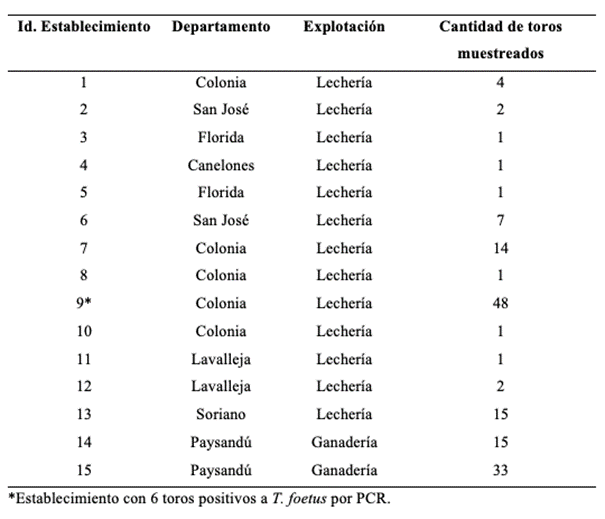
Se muestrearon 121 toros en 32 establecimientos de sistemas productivos lecheros y 189 toros de 29 predios de producción de carne, 5 establecimientos tenían toros de leche y carne (explotaciones mixtas). Los muestreos se realizaron de dos formas distintas: 1) directamente en establecimientos con problemas de abortos ocasionados por diferentes y/o indeterminadas etiologías (146 toros de 15 establecimientos) y 2) en dos plantas de faena, de toros sin conocimiento de los datos reproductivos de los establecimientos. Se visitaron 15 establecimientos de los cuales 13 eran tambos y 2 predios dedicados a la ganadería de carne, tomándose muestras de 98 y 48 respectivamente (Tabla 2).
Tabla 2: Identificación, departamento, tipo de explotación y cantidad de toros muestreados en los establecimientos visitados.
Los toros aptos para el estudio habían estado en descanso reproductivo por al menos 7 días previo al muestreo. En los tambos, los muestreos se realizaron de forma seriada con intervalos de aproximadamente 7-10 días entre muestreos, hasta completar un total de 3, antes de ser considerados negativos. En los dos predios dedicados a la producción de carne sólo se realizó un muestreo por motivos ajenos a este trabajo, debido a dificultades de logística. El esmegma en estos toros se obtuvo por el método de raspaje prepucial (Tedesco et al., 1977) utilizando raspadores estériles descartables. El raspador se introdujo en el orificio prepucial, se alcanzó la mayor profundidad posible en la cavidad prepucial y se realizaron entre 20 y 30 movimientos en sentido anteroposterior. Inmediatamente el raspador se introdujo en tubos de 15 mL de capacidad que contenían 8 mL de solución salina tamponada con fosfato (PBS) sumergiendo toda la punta del raspador y transfiriendo la mayor cantidad posible del esmegma obtenido. Una vez obtenida la suspensión se tomó 1 mL y se inoculó inmediatamente a un medio de cultivo comercial para tricomonas (CM0161, Oxoid Ltd, Basingstoke, UK). (CM0161, Oxoid Ltd, Basingstoke, UK). Las muestras se enviaron a temperatura ambiente al laboratorio de la Plataforma de Investigación en Salud Animal de Instituto Nacional de Investigación Agropecuaria (INIA) para su procesamiento.
En los frigoríficos, se obtuvieron muestras de 23 toros originarios de 19 tambos y de 141 toros de carne provenientes de 27 predios distintos. Para obtener las muestras de esmegma prepucial, la parte externa del pene y el prepucio fueron recuperados postmortem y se raspó la mucosa prepucial con una espátula descartable (Terzolo et al., 1992). Las muestras se transfirieron a tubos con PBS estéril. La suspensión así obtenida se inoculó para cultivo como se describió arriba.
Cultivo de T. foetus
Para cultivo de T. foetus se utilizó el medio de cultivo Trichomonas (CM0161, Oxoid Ltd, Basingstoke, UK) adicionado con cloranfenicol 1% (100 µg/L; ION S.A., Montevideo, Uruguay) y suero bovino inactivado por calor en baño maría (8%; 56°C por 30min), siguiendo las recomendaciones del fabricante. Todas las muestras se incubaron a 37°C y alícuotas del cultivo se examinaron en microscopio óptico cada 24 horas durante 7 días (BonDurant, 2005). Para verificar cada lote de medio de cultivo se inocularon al menos 5 tubos con una cepa viable de T. foetus mantenida en el laboratorio, siguiendo el protocolo descrito anteriormente.
PCR para la detección de T. foetus
Para la extracción de ADN, 2 mL de la suspensión del esmegma en PBS se centrifugaron a 9500 g por 1 minuto. Luego, el sobrenadante se descartó y la extracción se realizó sobre el sedimento utilizando el kit comercial “Quick-DNATM Fecal/Soil Microbe Miniprep Kit” (Zymo Research, USA) siguiendo las instrucciones del fabricante.
Para la detección de T. foetus se amplificó el gen que codifica para el ARNr 5.8S y las regiones ITS1 e ITS2 utilizando los cebadores TRF-3 (5’-CGGGTCTTCCTATATGAGACAGAACC-3’) y TRF-4 (5’-CCTGCCGTTGGATCAGTTTCGTTAA-3’ (Felleisen et al., 1998). Para cada reacción se utilizaron 2,5 µl de MgCl2 (25mM), 0,2 µl de dNTPs (10µM), 2,5 µl de albumina sérica bovina (BSA, 1%), 2,5 µl buffer (10x), 0,5 µl de cada cebador, 0,1 µl de ADN polimerasa Taq (5U; Invitrogen), 3 µl de ADN de la muestra y agua bidestilada hasta completar un volumen final de 25 µl. La amplificación se realizó en un termociclador “Applied Biosystems ProFlex PCR System” (Thermo Fisher Scientific) utilizando un protocolo que incluyó una desnaturalización inicial (94°C, 3 min); 30 ciclos de: desnaturalización (94°C, 30 s), hibridación (65°C, 30 s) y extensión (72°C, 60 s); y una extensión final de 5 min a 72°C. Los productos amplificados se analizaron por electroforesis en gel de agarosa al 1,5%, teñido con Good ViewTM y se visualizaron en un fotodocumentador “Gel DocTM EZ Imager” (Bio-Rad). El tamaño del fragmento esperado (347 pb), se determinó comparando con HyperLadder 100 pb (Bioline, UK).
Secuenciación de los amplicones
Para confirmar que los fragmentos amplificados correspondían a T. foetus se realizó la purificación y secuenciación en el servicio de Macrogen Inc. (Seúl, Corea). Las secuencias se ensamblaron y editaron utilizando el programa BioEdit (Versión 7.2.5; Ibis Biosciences, Carlsbad, CA) y se compararon con la base de datos del GenBank del NCBI utilizando la herramienta BLAST (Altschul et al., 1997).
Resultados
Ninguna de las 310 muestras fue positiva por cultivo para T. foetus. La PCR reveló que el 2,25% (7/310) de los toros analizados fueron positivos para este agente. De los toros destinados a producción de leche, 5% (6/121) fueron positivos, todos ellos pertenecientes al mismo establecimiento de origen (establecimiento 9; Tabla 2). En los toros de carne, se detectó un animal positivo de 189 (0,5%).
El establecimiento lechero positivo está localizado en el departamento de Colonia, los 6 toros positivos eran de la raza Normando y tenían entre 1,5 y 3,5 años, los animales habían sido muestreados por visitas al predio. El toro de carne positivo, un Hereford de 6 años, era originario de un establecimiento del departamento de Treinta y Tres, y había sido muestreado en un frigorífico.
Del total de rodeos evaluados, 3,5% (2/56) tenían animales positivos para T. foetus, siendo un rodeo lechero y uno de ganado de carne. La frecuencia predial fue de 3,4% (1/29) en rodeos de carne y de 3,1% (1/32) en rodeos lecheros. Ninguno de los 5 establecimientos con explotación mixta fue positivo.Las secuencias obtenidas a partir de las muestras positivas tuvieron 100% de similitud con secuencias publicadas de T. foetus (MK770858.1; MK770848.1; MK770847.1 entre otras).
Discusión
En este trabajo se detectó por PCR la presencia de ADN de T. foetus en toros de leche y de carne, aunque no se logró cultivar el agente. En Uruguay hacía más de una década que no se reportaba la circulación de T. foetus en bovinos.
Herrera et al., (1986) en la cuenca lechera del país, evaluaron muestras de esmegma prepucial, mucus vaginal y fetos y placentas de ganado abortado y determinaron una frecuencia de T. foetus a nivel predial de 6,5% (50/768). Sumando curiosamente, que entre los años 1973 y 1985, solamente dos toros de carne evaluados fueron positivos a la infección por este parásito. Similar a lo reportado en dicho trabajo, aproximadamente 30 años después nuestros resultados sugieren que T. foetus está presente con mayor frecuencia en ganado lechero que de carne, aunque la proporción de predios con toros positivos fue similar en ambos sistemas productivos.
Los principales factores de riesgo para la tricomoniasis bovina son: la cantidad de toros en un mismo establecimiento, reproducción por servicio (monta) natural, y extenso periodo de servicio (servicio continuo) (Ondrak, 2016). En este trabajo todos los toros positivos destinados a lechería pertenecían al mismo establecimiento, donde había 48 toros en total, todos los cuales fueron incluidos en el muestreo. En este trabajo todos los toros positivos destinados a lechería pertenecían al mismo establecimiento, donde había 48 toros en total, todos los cuales fueron incluidos en el muestreo.Rae et al., (2004) indican que los predios que tienen más de 10 toros por grupo de reproducción tienen 3,9 veces más oportunidades de tener infección por T. foetus. En Argentina, este último también es un factor de riesgo para la infección por T. foetus, sumado el manejo reproductivo continuo (Odds Ratio=1,59) (Molina et al., 2018a).
En Uruguay, 41,3% de los tambos usan servicio continuo como manejo reproductivo (Schild, 2017). Se reporta que 50% de los predios lecheros en el país usa únicamente servicio con toros (monta natural), y un 29% adicional utiliza la combinación de monta natural con IA, es decir que en el 79% de los tambos uruguayos la monta natural es el manejo de elección (INALE, 2014). El uso de toros para repaso como manejo reproductivo en gran parte de los establecimientos lecheros del país minimiza el uso de grandes grupos de estos animales. Por otro lado, la monta natural es un factor de riesgo que puede perpetuar el parásito y consecuentemente la enfermedad en los rodeos.
La detección de T. foetus por PCR ha sido previamente reportada (Felleisen et al., 1998; Gookin et al., 2002; Riley et al., 1995). Esta es una herramienta diagnóstica rápida independiente del cultivo que permite obtener resultados en pocas horas (Cobo et al., 2007; Mutto et al., 2006), mientras que el cultivo requiere de una semana para la obtención de resultados negativos (Cobo et al., 2007). La PCR convencional tiene una sensibilidad y especificidad de 78-98,38% y 93,75-96,7% respectivamente, más altas que las pruebas de cultivo (Cobo et al., 2007; Ho et al., 1994; Mukhufhi et al., 2003; Mutto et al., 2006).
Si bien los cebadores utilizados en este trabajo se reportan como específicos para T. foetus, Felleisen et al., (1998) reportaron que con estos mismos cebadores también amplificaron el ADN de Tritrichomonas mobilensis y Tritrichomonas suis. T. mobilensis es un parásito intestinal que ha sido identificado en monos ardilla (Saimiri spp.) (Culberson et al., 1986) y T. suis se encuentra en la cavidad nasal y el tracto digestivo de los cerdos (De Carli y Guerrero Ramírez, 1975). Sin embargo, más recientemente la similitud morfológica, genética y de patogenicidad entre las cepas de T. foetus y T. suis están siendo ampliamente discutidas. Los autores indican que estas dos especies de Tritrichomonas son idénticas, proponiendo cambio en la nomenclatura de T. suis, ya que es sinónimo de T. foetus (Tachezy et al., 2002; Lun et al., 2005; Slapeta et al., 2012). Los factores arriba mencionados sugieren que la posibilidad de observación de T. mobilensis en muestras de esmegma prepucial bovino es baja y que la reacción cruzada con T. suis no influye en el diagnóstico ya que es una cepa equivalente a T. foetus en todos los aspectos. La secuenciación realizada desde las muestras positivas por PCR en ese estudio demostró 100% de similitud con T. foetus, lo que refuerza la confiabilidad de los resultados positivos.
La sensibilidad de la PCR convencional puede ser mejorada utilizando la qPCR para la detección de T. foetus (Dufernez et al., 2007; McMillen y Lew 2006), sin embargo, esta técnica no está ampliamente distribuida en los laboratorios veterinarios en Uruguay, entre otros motivos porque requiere técnicos altamente calificados para su ejecución y la validación e interpretación de los resultados, así como equipos y reactivos específicos costosos (Oyhenart, 2018).
La sensibilidad de la técnica de cultivo de T. foetus es baja. Perez et al., (2006) reportaron una sensibilidad del 72% a partir un muestreo de 2838 toros usados para producción de carne. En nuestro trabajo no fue posible cultivar T. foetus. Este resultado puede deberse a diferentes factores que afectan negativamente a la sensibilidad. Una vez obtenidas las muestras la viabilidad del parásito se ve afectada por el medio de cultivo o transporte empleados, por cambios en la temperatura y por la agitación. Además, una vez crecidas es complejo diferenciar con precisión la contaminación por tricomonas saprófitas, incluso para técnicos capacitados. Existen también factores inherentes a los toros, como la edad y estado reproductivo. La tasa de infección tiende aumentar en toros mayores a 3 años y en animales en servicio. Las chances de detectar animales positivos aumentan con la cantidad de muestreos, por esto se recomienda la realización de tres tomas de muestras antes de diagnosticar un animal negativo (Yao, 2013).
Debido al alto costo de un resultado falso negativo o positivo a T. foetus, es primordial utilizar pruebas que permitan identificar la mayor cantidad de verdaderos positivos y negativos, incluso animales que podrían estar recientemente infectados. Con esta intención, y para lograr una comparación entre las dos pruebas más comúnmente usadas, utilizamos el cultivo y PCR de forma simultánea sobre las mismas muestras. Otra opción es utilizar el PCR en muestras positivas al cultivo para descartar cultivos falsos positivos de esmegma de toros, especialmente proveniente de toros vírgenes (Cobo et al., 2007).
El cultivo de T. foetus directamente de esmegma prepucial representa un desafío para los laboratorios diagnósticos ya que el medio de cultivo utilizado promueve el crecimiento de otros microorganismos. Esto afecta directamente el crecimiento de T. foetus, por la replicación más rápida de la microbiota acompañante y la acumulación de sus productos metabólicos que disminuyen el pH del medio (Clothier et al., 2015). A su vez, la contaminación de las muestras con materia fecal es otro inconveniente. En las heces puede haber protozoarios saprófitos no patogénicos, como Tetratrichomonas spp., Pentatrichomonas hominis y Pseudotrichomonas spp. que crecen en el medio de cultivo utilizado y son similares en tamaño, forma y motilidad a T. foetus (Dufernez et al., 2007). Estas interferencias pueden conducir a un diagnóstico incorrecto de tricomoniasis bovina con importantes consecuencias debido a la eliminación de toros sanos o la perpetuación en el uso de reproductores falsos negativos.
Conclusiones
Tritrichomonas foetus es un patógeno que sigue circulando en Uruguay, tanto en bovinos de leche como de carne. El cultivo del parásito es la prueba que más se ha utilizado para el diagnóstico de tricomoniasis en el país, aunque es posible que su empleo como única técnica resulte en sub-detección de la infección por T. foetus. La PCR convencional podría ser implementada en la rutina de los laboratorios de diagnóstico veterinario para la detección de este agente en muestras prepuciales de toros vivos o faenados, aunque se requieren esfuerzos adicionales para la validación de la técnica en nuestras condiciones. Estudios epidemiológicos y de estimación de pérdidas económicas deberían realizarse para determinar la prevalencia y la real importancia de la tricomoniasis bovina para la ganadería uruguaya.












 Curriculum ScienTI
Curriculum ScienTI