Introducción
La pitiosis es una enfermedad causada por el Oomiceto Pythium insidiosum, el cual forma parte del reino Straminipila, clase Peronosporomicetes (Gaastra et al., 2010). El género Pythium está comprendido principalmente por organismos saprófitos del suelo y patógenos de plantas. P. insidiosum es patógena para animales, afectando a equinos, bovinos, caninos, felinos y el hombre (Gaastra et al., 2010). Se encuentra normalmente en regiones tropicales y subtropicales, principalmente en cuerpos de agua estancados, suelos y pasturas (Presser y Goss, 2015). El estadio de zoospora biflagelada es la forma infectiva que normalmente se encuentra en el agua, para la formación de estas es necesario al menos un día con temperaturas mayores a 30 °C, en periodos de precipitación constantes (Marcolongo et al., 2012). Las mismas, por medio de mecanismos de quimiotaxis, son atraídas hacia las lesiones en la piel de los animales o tejido vegetal dañado, donde estas se enquistan (Gaastra et al., 2010). Marcolongo et al. (2012) proponen un período de incubación de 3 semanas para la aparición de los primeros signos clínicos de pitiosis en equinos.
Las lesiones que provoca en equinos se caracterizan por concreciones de aspecto granulomatoso de color amarillento a nivel de la piel comúnmente llamados “kunkers”. Estas concreciones se encuentran limitadas al área de la lesión, donde se dio el ingreso del patógeno (Supabandhu et al., 2008). Los “kunkers” son lesiones específicas para la pitiosis equina y las mismas no se manifiestan en otras especies afectadas por el oomiceto. Las lesiones se presentan más comúnmente en la zona distal de las extremidades, ventral del abdomen y tórax (Monteiro et al., 2001; Mendoza et al., 1996; Mendoza y Newton, 2005).
En Uruguay se ha descripto la enfermedad en equinos en la región Este (Dutra, 2012; García et al., 2018). Ésta es comúnmente reportada en la zona de Río Grande do Sul, Brasil y el norte de Argentina afectando principalmente equinos (Marcolongo et al., 2012; Viegas et al., 2003), caninos y felinos (Cardozo et al., 2016; Galiza et al., 2014) y en menor medida rumiantes (Allassia et al., 2016; Gabriel et al., 2008). El objetivo del presente trabajo es describir un caso de pitiosis equina y su diagnóstico en la región litoral oeste de Uruguay.
Materiales y métodos
Descripción del caso
En el mes de Mayo del año 2017 se consultó al Laboratorio Regional Noroeste DILAVE “Miguel C. Rubino” respecto a un equino, hembra, raza criolla, de 24 años que presentaba una lesión en la zona ventral del abdomen. Este animal se encontraba pastoreando en un potrero con zona de bañados, con costa al arroyo Sacra, Paysandú (32° 21' 23.5" S 58° 01' 52.9" O). Esta alteración se observó por primera vez en el mes de Marzo, siendo la presentación de la misma una lesión circular de unos 8-10 cm de diámetro aproximadamente y 3 cm de profundidad con un diagnóstico presuntivo de miasis. Se trató la misma localmente con un desinfectante iodado y antimiásico diariamente. Como el animal no presentaba mejoría y presumiendo un caso de habronemiasis, el propietario administró Doramectina intramuscular (0.2 mg/kg peso vivo). El animal comenzó a perder peso y manifestaba prurito en la zona por lo que el propietario decidió realizar la consulta con su veterinario.
Se efectuó la visita y recorrido del predio constatándose zonas de agua estancada en el potrero, en conjunto con la presencia de vegetación semiacuática del tipo de nenúfares. El equino convivía con bovinos, los cuales no presentaban síntomas clínicos evidentes de alguna enfermedad, ni lesiones de piel.
Datos climáticos
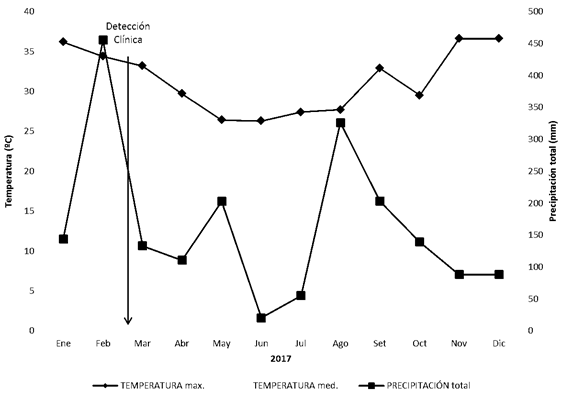
Los datos climáticos fueron obtenidos de los registros de la Estación Meteorológica perteneciente a Estación Experimental Mario Cassinoni (EEMAC) de la Facultad de Agronomía, UdelaR ubicada a 4 km del predio. En los meses de Enero y Febrero previos a la detección clínica de la infección se registraron temperaturas mayores a 32°C durante 22 días y constantes precipitaciones en el departamento (Estación Experimental “Dr. Mario A. Cassinoni”, 2018) (Figura 1).
Toma de muestras y necropsia
Se realizó una biopsia de piel de la zona afectada por parte del veterinario actuante, remitiendo el material extraído en formol al 10 %. Frente a la sospecha de un caso de pitiosis equina, se concurrió al establecimiento junto al veterinario realizándose la extirpación quirúrgica total de la lesión. El animal murió luego de la cirugía, realizándose la necropsia. El material obtenido, parte se acondicionó en formol al 10 % y el resto refrigerado.
Histopatología e inmunohistoquímica
Los materiales fueron incluidos en parafina, seccionados a 5 µm y coloreados por la técnica de rutina, hematoxilina-eosina (H&E) (AFIP, 1995). Además se realizó una tinción argéntica (Grocott) para detección de morfologías fúngicas (AFIP, 1995).
Se utilizó la técnica de inmunohistoquímica (IHQ) para la detección de P. insidiosum en los cortes histológicos de las lesiones. La misma fue realizada en el Laboratorio de Patología de la Facultad de Veterinaria, Universidad Federal de Pelotas, Brasil. Se bloqueó las peroxidasa endógena con peróxido de hidrogeno al 3 %, seguido por una recuperación antigénica con tripsina al 1 % a 37 °C por 10 min y buffer citrato (pH 6.0 por 2 min en microondas). El bloqueo de las reacciones inespecíficas fue realizado con solución de caseína al 5 %, por 20 min. Las láminas se sometieron al anticuerpo primario monoclonal anti-P. insidiosum 1:100, durante 60 min a 37 °C. Se utilizó el anticuerpo secundario biotinilado y el complejo estreptavidina-peroxidasa5 (MACH4 Universal HRP-Polymer Detection System, BIOCARE, EU), incubados a temperatura ambiente por 30 min, y marcados con tetracloruro de 3-3'diaminobenzidina 5 (DAB). Las secciones fueron contra coloreadas con hematoxilina de Harris.
Aislamiento e identificación del agente
El aislamiento se realizó a partir del material refrigerado en el Laboratorio Regional Noroeste. Para esto se lavaron fragmentos de “kunkers” y de tejido conjuntivo con una solución de benzilpenicilina y estreptomicina, estos fueron sembrados en SDA (Agar Sabouraud Dextrosa, BIO-RAD, EU) y agar levadura al 0.1 % e incubados a 37 °C. Los cultivos fueron observados a intervalos de 24 horas para la verificación del desarrollo de micelios durante 5 días. Una vez obtenido el aislamiento se procedió a realizar la caracterización morfológica de las hifas y se empleó la técnica de zooesporogénesis descripta por Mendoza y Prendas (1988) realizada en el Departamento de Microbiología y Parasitología, Universidad Federal de Pelotas, Brasil.
Caracterización molecular
Se realizó la caracterización molecular en el Departamento de Microbiología y Parasitología, Facultad de Veterinaria, Universidad Federal de Santa Maria, Brasil. El aislamiento fue cultivado en 150 mL de caldo Sabouraud (2 % de glucosa y 1 % de peptona) e incubado bajo agitación (120 rpm) a 37 ˚C. Después de cinco días el micelio fue recogido por filtración, lavado con agua estéril y almacenado en ultra freezer a -80 °C. El ADN fue extraído de acuerdo con el protocolo descrito por Möller et al. (1992) con modificaciones (Klassen et al., 1996), los aislamientos congelados fueron macerados en buffer de lisis (2-β mercaptoetanol, SDS 2 %), CTAB 10 % y NaCl 5 N, seguido de la extracción fenólica. El ADN total fue resuspendido en TE estéril y almacenado a -80 ºC. Las concentraciones de ADN total se determinaron utilizando espectrofotometría. Se llevaron a cabo dos reacciones de PCR-anidado realizadas empleando cebadores para las regiones ITS. En primera instancia, la amplificación de los segmentos génicos de la región ITS (ITS1, 5.8s rARN y ITS2 del rADN) fue realizada por PCR, utilizando los cebadores universales ITS1 (5'-GTAGTCATATGCTTGTCTC-3) ") e ITS4 (5'-CTTCCGTCAATTCCTTTAAG-3 ') (White et al., 1990). Las reacciones se realizaron en un volumen total de 50 μL, conteniendo 20 pmol de cada cebador, 1,25 unidades de Taq DNA polimerasa (Invitrogen, USA), 200μM de deoxinucleotideos (dNTP), 1 X del buffer de enzima 10 X, 1,5 mM MgCl2, y 200 ng de las muestras de ADN. Las amplificaciones se realizaron utilizando termociclador PTC-100 (Programable ThermalController, MJ Research, EU), con un perfil de ciclo: 94 ˚C por 5 min, y 30 ciclos de 94 ˚C por 1 min, 55 ˚C por 1 min y 72 ˚C por 2 min, finalizando con 72 ˚C por 10 min. Posteriormente, una segunda reacción de PCR fue realizada empleando los cebadores para la región ITS1, específicos para P. insidiosum (Grooters y Gee, 2002). En esta reacción se procedió como cita Botton et al. (2011), empleando una alícuota (5 μL) de los productos de la reacción anterior (incluyendo controles positivos y negativos) fueron empleados como molde para los iniciadores específicos de P. insidiosum: PI1 (5'-TTCGTCGAAGCGGACTGCT-3`) y PI2 (5'-GCCGTACAACCCGAGAGTCATA-3`) (Grooters y Gee, 2002). Las reacciones de PCR se realizaron en las mismas condiciones descritas por Botton et al. (2011) y en los siguientes parámetros de ciclo: desnaturalización inicial a 94 °C durante 3 min, 28 ciclos de desnaturalización a 94 °C durante 30 seg, unión a 65 °C por 30 seg, extensión A 72 °C durante 30 seg, extensión final a 72 °C durante 10 min. Una alícuota de 10 μl de cada reacción de ambas reacciones de PCR fue sometida a electroforesis en gel de agarosa al 2 %, coloreadas con bromuro de etidio y visualizadas bajo luz ultravioleta. Después de la verificación, los productos fueron purificados por el kit PureLink (Invitrogen, EU) y los productos de PCR generados fueron enviados a secuenciar empleando el secuenciador automático MegaBACE500 empleando el kit DYEnamic ET (Amersham, RU).
Como control positivo de la reacción se utilizó la cepa estándar de P. insidiosum CBS101555 y como control negativo agua ultra pura.
Resultados
Datos clínicos
Equino hembra, raza criolla, de 24 años de edad, que el 3 de Marzo del año 2017 se observó una lesión ulcerada de la piel, de color amarillento, circular en la región ventral del abdomen, de 8 cm de diámetro y 3 cm de profundidad con presencia de miasis. El animal si bien mantuvo el apetito y las grandes funciones normales (micción y defecación), comenzó a desmejorar y perder peso rápidamente, manifestando prurito en la zona afectada. A su vez, la masa de tejido empezó a aumentar de tamaño rápidamente, triplicando su tamaño en 30 días (Figura 2).
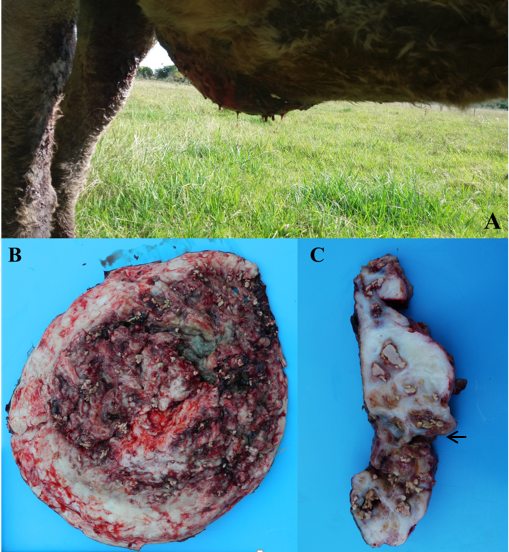
Figura 2: A: Equino. Deformación a nivel de abdomen ventral. B: Equino. Tejido extirpado en su cara adyacente a la pared abdominal. Se observa abundante tejido de granulación, extensas áreas de fibrosis y focos amarillentos de textura caseosa (“kunkers”). C: Equino. Corte transversal del tejido extirpado. Tejido de granulación, áreas multifocales de necrosis con contenido supurativo hemorrágico y concreciones blanco amarillentas (“kunkers”) (flechas).
Se realizó biopsia el 8 de abril, con un diagnóstico histopatológico de un proceso inflamatorio proliferativo, crónico compatible con pitiosis, por lo que se resolvió la extirpación quirúrgica el 28 de abril. Se realizó hemograma el 18 de Abril destacándose anemia macrocítica, leucocitosis moderada, neutrofilia con eosinofilia. La lesión ventral de piel había aumentado de tamaño significativamente (30 cm de largo y 8 cm de espesor), exudando permanentemente un líquido viscoso de color amarillo. El 7 mayo se realizó la extirpación quirúrgica. El animal muere después del acto quirúrgico, por paro respiratorio como consecuencia al estado de debilidad y anemia.
Macroscopía
La piel en la zona de la lesión, se presentaba ulcerada, húmeda, exudando líquido serosanguinolento. Se extrajo una masa de tejido de 40 cm de largo x 25 cm de ancho x 13 cm de espesor pesando 3,337 Kg. Al corte se observó abundante proliferación de tejido conjuntivo, de coloración amarillenta, que abarcaba piel y subcutáneo infiltrando músculo del recto abdominal y la vaina del recto, con múltiples formaciones blanco-amarillentas de textura caseosa, tipo coral (Figura 2).
En la necropsia del animal se destacaba hemorragias difusas en el miocardio, severo edema y congestión pulmonar sin otros hallazgos de significación.
Histopatología e inmunohistoquímica
A nivel de piel se observó extensa ulceración de la epidermis. En dermis superficial y profunda se visualizó una severa proliferación de tejido conjuntivo, neovascularización, áreas multifocales de necrosis rodeada por abundantes polimorfonucleares y macrófagos. Los focos necróticos (“kunkers”) consisten de una densa colección de eosinófilos con núcleos pobremente definidos y escasas trabéculas de colágeno degenerado. En el tejido conjuntivo se encontraba un infiltrado de eosinófilos difuso y en menor número de plasmocitos (Figura 3).
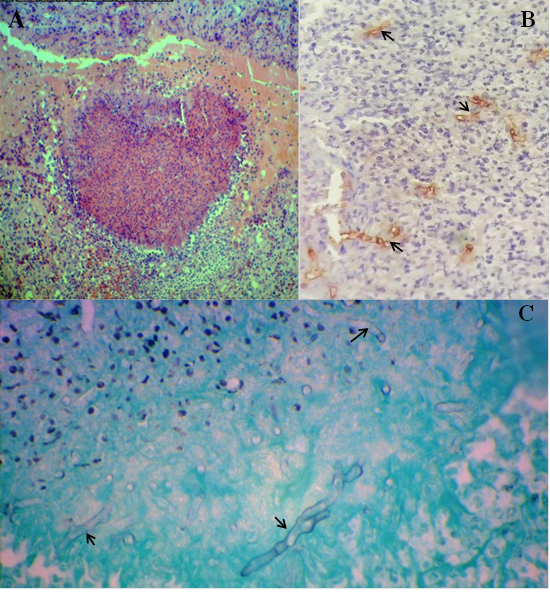
Figura 3: A: Equino, piel. Foco de necrosis rodeada por polimorfonucleares y macrófagos. Se observan también en el tejido conjuntivo un infiltrado difuso de eosinófilos. H-E 100x. B: Equino, piel. Inmunohistoquímica. Marcación positiva a P. insidiosum (flechas). DAB, 100x. C: Equino, piel. Presencia de hifas (flechas) en lesión de subcutáneo. Grocott, 400x.
Dentro de las áreas de necrosis se observó la presencia de hifas coloreadas positivamente con la coloración argéntica de Grocott (Figura 3).
La técnica de inmunomarcación en los cortes histológicos fue positiva a P. insidiosum (Figura 3).
Aislamiento e identificación
Después de 48 horas de incubación a 37ºC de los “kunkers” se observó el crecimiento de un micelio aéreo transparente, corto y delicadamente radiado en agar levadura al 0,1%. En el agar Sabouraud se observó el desarrollo de un micelio radiado, exuberante y blanquecino. La observación microscópica reveló la presencia de hifas cenocíticas con ramificaciones perpendiculares laterales en ángulo recto. La zooesporogénesis se obtuvo en tres horas de incubación a 37ºC. Las observaciones microscópicas de los fragmentos de césped revelaron la presencia de hifas con formación de vesículas que posteriormente dieron origen a zooesporangios en sus extremos (Figura 4).
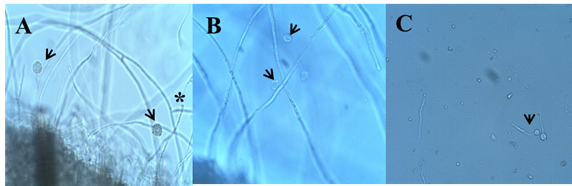
Figura 4: Zooesporogénesis in vitro de P. insidiosum, 3 horas de incubación a 37ºC. A: Presencia de vesícula (asterisco) en la extremidad de la hifa e esporangios conteniendo zoosporas en su interior (flechas) 20x. B: Zoosporas con forma ovoide (flechas) 40x. C: Zoosporas emitiendo tubos germinativos (flecha) 20x.
En el interior de los zooesporangios se podía observar la formación de los zooesporas. Estas estructuras presentaron movimientos rápidos de sus flagelos, resultando en la ruptura de la membrana del zooesporangio con liberación de los zooesporas en el medio de inducción. Los zooesporas liberadas presentaban forma ovoide y nadaban en diferentes direcciones por medio de movimientos de rotación alrededor de su propio eje. Posteriormente, cesaban sus movimientos, se volvían globosos y emitían tubos germinativos (Figura 4).
Caracterización molecular
En la reacción de PCR-anidado se determinó un resultado positivo a los cebadores empleados obteniendo fragmentos de ~800pb generados con los cebadores universales (ITS1 y ITS4) y en la segunda reacción de PCR se obtuvieron amplicones de ~105pb generados con los cebadores específicos de P. insidiosum (PI1 e PI2) (Figura 5).
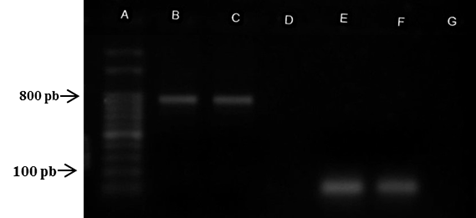
Figura 5: PCR-anidado en gel agarosa A: Marcador de peso molecular 100pb DNA ladder (Ludwig Biotec, Brasil). B: aislamiento de P. insidiosum, fragmentos de ~800pb generados con los cebadores (ITS1 e ITS4); C: P. insidiosum CBS 101155 (control positivo); D: agua ultra pura (control negativo); E: aislamiento de P. insidiosum con amplicones de ~105pb generados con los cebadores específicos de P. insidiosum (PI1 y PI2). F: P. insidiosum CBS 101155 (control positivo); G: agua ultra pura (control negativo).
Las secuencias de ADN de las regiones ITS1, 5,8r RNA y ITS2 fueron comparadas con las secuencias depositadas en GenBank con el registro MF767408, confirmando la identificación (100% de homología) molecular del aislamiento como P. insidiosum.
Discusión
La pitiosis es una enfermedad emergente en Uruguay usualmente diagnosticada en Brasil (Marcolongo et al., 2012; Viegas et al., 2003) siendo este trabajo el primer caso reportado en la región litoral norte del país. Dadas las condiciones ambientales descriptas por Gaastra et al. (2010) y Supabandhu et al. (2008), Uruguay cuenta con áreas con características adecuadas para mantener este microorganismo y permitir su proliferación en el entorno. La región Sureste se encuentra particularmente predispuesta a esta enfermedad, ya que se encuentra dominada por zonas de suelos con pobre drenaje y cuerpos de agua estacionarios (Dutra 2012; García et al., 2018).
En el caso aquí descrito, las condiciones climáticas y ambientales de lluvias abundantes, terrenos anegados y temperaturas elevadas serían causas predisponentes para la presencia de dicho patógeno en el potrero donde se encontraba el animal, incrementando de esta forma la posibilidad de la infección (Presser et al., 2015). Otro hallazgo fue la presencia de plantas acuáticas en el predio del tipo nenúfares las cuales según describen Mendoza et al. (1993) actúan como reservorio del patógeno.
La ubicación ventral en la pared del abdomen de la lesión podría estar relacionada, con los períodos de descanso donde el animal permanecía en decúbito durante tiempo prolongado en la zona inundada en el potrero. De esta forma se incrementa el reblandecimiento de la piel y formación de heridas de la zona, por donde es posible que haya penetrado el agente. La ubicación de las lesiones en equinos están asociadas en general con áreas propensas a recibir laceraciones o heridas que permaneciendo en contacto directo con agua contaminada pueden brindar acceso a las zooesporas de P. insidiosum (Mosbah et al. 2012). De acuerdo con Johnston y Henderson (1974), en los estadios crónicos en equinos se observa además del proceso inflamatorio granulomatoso característico, focos de necrosis compuesta por eosinófilos, moderado colágeno degenerado y pequeños vasos necrotizados. Otro factor que sugiere una evolución crónica de la enfermedad en el animal, fue el aislamiento del agente exclusivamente de muestras provenientes de los “kunkers”. Siendo estos, el único lugar donde se pueden encontrar las hifas de P. insidiosum en equinos con pitiosis crónica (Martins et al., 2012). La infiltración de los planos musculares encontrados en la necropsia también indica un estado expansivo y de evolución en el tiempo.
Los hallazgos histopatológicos fueron consistentes con aquellos descriptos en casos de pitiosis equina caracterizada por la presencia de focos de degranulación de eosinófilos sobre las hifas invasoras de P. insidiosum (Mendoza y Alfaro, 1986). Este tipo de reacción inmune contribuye al progreso de la enfermedad la cual se puede tornar crónica (Mosbah et al., 2012). Los resultados del hemograma muestran una respuesta característica de estas infecciones en equinos, la cual fue marcada por un incremento de eosinófilos en la sangre. Los bovinos poseen una respuesta inmune que difiere de la de los equinos, se caracteriza por proliferación de células mononucleares sobre la respuesta eosinofílica de los equinos. Esta diferencia resulta eficaz en evitar el progreso de la enfermedad en estos animales y en ciertos casos llevar a la cura espontánea (Gabriel et al., 2008). La baja susceptibilidad a este agente por parte de los bovinos puede ser una explicación al hecho de que no han sido reportados casos de pitiosis en esta especie en Uruguay.
Para este tipo de lesiones en equinos es necesario realizar un diferencial con otras lesiones de piel como: habronemiasis, sarcoide equino o neoplasias, donde el estudio histopatológico es fundamental para su diagnóstico (Miller y Campbell, 1982). Por otra parte la detección y diagnóstico temprano de esta enfermedad es vital para la obtención de un pronóstico favorable. El tratamiento se basa en la extirpación quirúrgica del tejido afectado (Viegas et al., 2003). Varios trabajos han demostrado que la inmunoterapia en conjunto de la extirpación quirúrgica, ha sido efectiva en el tratamiento de lesiones en equinos (Mendoza y Newton, 2005; Pereira et al., 2011).
El análisis patológico de las lesiones asociado con el aislamiento y posterior identificación molecular del agente permiten obtener un diagnóstico preciso. En el caso de no ser posible de aislar al agente por medios microbiológicos es gravitante la realización de pruebas inmunohistoquímicas para la detección de antígenos específicos para infecciones causadas por P. insidiosum. El aislamiento del agente por sí mismo no permite la identificación adecuada ya que este comparte un gran número de características morfológicas con los hongos filamentosos causantes de lesiones similares (Basidiobolus ranarum y Conidiobolu scoronatus) (Reis et al., 2003). Para diferenciarlo de los mismos es necesaria la realización de la zooesporogénesis. La producción de zooesporas es una característica presente en los miembros de la clase Oomycota por lo que se requiere de técnicas moleculares para la identificación del agente (Gaastra et al., 2010).
Conclusión
Se confirma el diagnóstico de pitiosis equina en el litoral noroeste del Uruguay, a través de la histopatología, inmunohistoquímica, aislamiento y técnicas moleculares de Pythium insidiosum. Ante lesiones proliferativas de piel en equinos de evolución crónica, la pitiosis debería de incluirse en el diagnóstico diferencial.