Introducción
La acidosis ruminal es un desorden que cursa con disminución del pH ruminal ocasionando desequilibrios en el ecosistema microbiano con trastornos digestivos y metabólicos. Esto da lugar a una sintomatología digestiva que incluye disminución de la motilidad ruminal, estasis ruminal, heces blandas, ruminitis e hiperqueratosis (Keunen et al., 2002; Nocek, 1997), además de repercusiones patológicas generales, como abscesos, laminitis y otros trastornos locomotores, debidas a la absorción de sustancias tóxicas que ejercen su efecto deletéreo a distancia (Gozho et al., 2005; Nocek, 1997; Zhang et al., 2019).
La disminución del pH ruminal es ocasionada por la acumulación de ácidos grasos volátiles (AGV) acompañada por un desequilibrio en sus proporciones y por la acumulación de ácido láctico (Beauchemin y Yang, 2005; Nocek, 1997).
La acidosis ruminal subaguda (SARA por su sigla en inglés), es una condición subclínica caracterizada por episodios de pH ruminal bajo (5,2-5,6) que ocurren durante más de 3 horas al día (Gozho et al., 2005). Si bien la sintomatología es muy poco aparente, como todo padecimiento subclínico, SARA tiene una presentación insidiosa. Afecta fundamentalmente el consumo y la absorción de nutrientes desde el rumen comprometiendo la economía del productor y la salud y el bienestar de los animales de alta producción cárnica y lechera (Enemark, 2009; Kleen et al., 2003; Martin et al., 2006; Moate et al., 2019). Debido a su gran repercusión económica es importante diseñar modelos sobre los cuales estudiarla y ensayar acciones dirigidas a su prevención.
El ambiente ruminal puede ser estudiado a través de métodos experimentales in vivo, in vitro e in situ. Los métodos in vivo implican el trabajo con animales, lo que acarrea una importante demanda de tiempo, espacio y recursos económicos, siendo técnicas costosas y laboriosas además de estar sujetas a mayor variabilidad. Los métodos in vitro son más sencillos y menos costosos, pero simulan la fisiología ruminal de una manera limitada ya que, aunque se pueda ejercer control sobre algunos aspectos que definen las condiciones fisiológicas digestivas de los rumiantes, no es posible hacerlo con todas ellas (Blümmel y Ørskov, 1993; Carro et al., 2005; Fondevila y Pérez-Espés, 2008; Giraldo et al., 2007). El objetivo de todos los sistemas de fermentación in vitro consiste en crear un entorno que simule de la mejor manera posible una sección específica del tracto gastrointestinal. En la actualidad hay pocos trabajos que empleen el método gas in vitro y reproduzcan la acidosis ruminal con un seguimiento de la dinámica de descenso del pH desde el inicio del experimento (Eger et al., 2018). Aldrovandi et al. (2009) simularon acidosis ruminal en un ensayo in vitro empleando un sustrato acidogénico con varias mediciones del pH a lo largo de 24 horas. En cambio, se han realizado experimentos que desde su inicio presentaron un pH inferior al fisiológico debido a la adición de ácidos (cítrico, sulfúrico, clorhídrico o fosfórico) con el objetivo de estudiar la capacidad de la biota ruminal para digerir diferentes sustratos en condiciones de estrés (Colombatto et al., 2007; Kozloski et al., 2008).
Las técnicas de fermentación con medición del gas acumulado in vitro, fueron desarrolladas para estudiar la capacidad digestiva del rumen, pudiendo realizar además de este estudio, otros como la cinética de fermentación, grado de digestibilidad de los alimentos y evaluación del pH (Akinfemi et al., 2009; Beuvink y Spoelstra, 1992; Mauricio et al., 1999; Menke et al., 1979; Vázquez-Armijo et al., 2011).
El conjunto de los experimentos realizados en este trabajo tuvo como meta adaptar la técnica de fermentación in vitro para estudiar la acidosis ruminal. Esto implicó el desafío de encontrar condiciones adecuadas para simular en forma sencilla y rápida, cambios medibles en una variable que resultara fiel a la hora de estudiar dicha patología (Carro y Ranilla, 2003; Fontenot y Huchette, 1993; Martin, 2005; Vyas et al., 2014).
En suma, en este trabajo se procuró adaptar, mediante la modificación de las condiciones de tamponamiento, el método de fermentación anaeróbica, comúnmente utilizado para estudiar la funcionalidad ruminal a través de la medición de la producción de gas, para estudiar la acidosis ruminal simulando su instalación a partir de la fermentación de sustratos acidogénicos y midiendo la evolución del pH como variable de control.
Materiales y Métodos
Sistemas experimentales de fermentación
Los sistemas de fermentación utilizados consistieron en frascos de 125 mL de capacidad, cerrados herméticamente con tapón de goma y precintados, manteniendo en su interior una atmósfera anaerobia. Cada frasco se consideró una unidad experimental.
En todos los ensayos, se utilizó como inóculo 10 mL de líquido ruminal obtenido de una vaca donadora, canulada en el rumen y alimentada con una mezcla de forraje ensilado (17 % proteína cruda (PC), 45 % de fibra neutro detergente (FND)) y concentrado (cascarilla de soja: 15,4 % PC y 57 % FND) en partes iguales.
Se empleó líquido ruminal fresco obtenido luego de 2 horas de suministrado el concentrado e inmediatamente antes de su uso en los ensayos y mantenido en condiciones de anaerobiosis. Para ello se realizó el siguiente procedimiento: se extrajo contenido ruminal de la vaca donadora unos minutos antes de su utilización en los sistemas de fermentación; dicho contenido se filtró mediante una tela de quesería plegada en cuatro capas, colectando el líquido en un recipiente isotérmico mantenido a 39 °C. El líquido obtenido se transportó inmediatamente al laboratorio, donde se mantuvo con barboteo de CO2 permanente hasta su dosificación en las unidades experimentales, llevando, todo el proceso anterior, menos de 30 minutos.
Los testeos se realizaron con un único sustrato, que para que tuviera potencial acidogénico se utilizó una mezcla, en base a partes iguales de materia seca (MS, m/m), de granos de cebada (PC=9,4%; FND=22,9%) y avena en estado vegetativo (PC=14,9%; FND=54,6%). Ambos alimentos fueron secados (70°C, hasta peso constante) y, con el fin de incrementar su potencial acidógeno, finamente molidos (0,5 mm) previo a su mezcla. En los tratamientos que se usaron como control no se incluyó este sustrato.
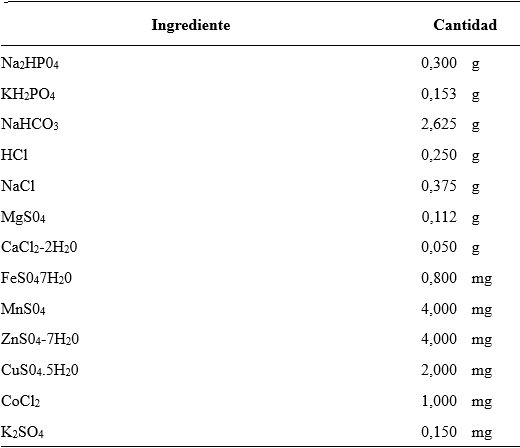
En cada unidad experimental (frasco) se agregaron 40 mL de una solución buffer (saliva artificial), cuya composición varió según los objetivos de cada ensayo (ver Tablas 1 a 4). La saliva artificial base, denominada SA01 (Tabla 1) se elaboró modificando la composición de la saliva descrita por Williams et al. (2005), que posee un elevado poder de amortiguación del pH dado que los ensayos de producción de gas tienen varios días de duración.
Tabla 1: Saliva artificial SA01 - solución basal* (composición por litro)

1.Solución de minerales traza:MnCl2 4H2O 0,025g; FeSO4 7H2O 0,0200g; ZnCl2 0,025g; CuCl 2H2O 0,025g; CoCl2 6H2O 0,050g; SeO2 0,050g; NiCl2 6H2O 0,250g; Na2MoO4 2H2O 0,250g; NaVO3 0,0314g; H3BO3 0,250g. Se disuelven los ingredientes en el orden citado, en HCI 0,02M y se lleva a 1L con agua destilada. 2.Solución de Heminia: 0.1g de Heminia disuelta en una pequeña cantidad de NaOH 0,05 M, llevada a 1L con agua destilada hervida (con CO2 burbujeando). *Esta saliva artificial se completa con una solución de bicarbonato a razón de 38 mL de solución principal y 2 mL de solución de bicarbonato (82g de Na2CO3 disueltos en 1 L de agua destilada, haciendo burbujear CO2). Tomada de Williams et al, 2005
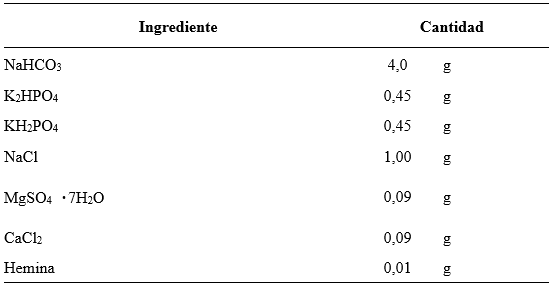
Las salivas artificiales SA01a, SA01b, SA01c, SA01d y SA01e fueron modificaciones de la SA01 buscando reducir o sustituir los componentes identificados como de mayor efecto amortiguador (Tabla 2).
Las salivas artificiales SA02 y SA03 fueron elaboradas a partir de la composición descrita por Tung y Kung (1993) y modificada a partir de la composición descrita por Duncan et al. (2003) respectivamente. La composición de SA02 y SA03 se muestra en la Tabla 3 y Tabla 4.
Para mantener las condiciones de anaerobiosis se empleó una solución de Na2S al 6%, en una dosis de 0,5 mL por unidad experimental.
Condiciones de fermentación
Las unidades experimentales fueron incubadas a 39°C, en baños de agua termostatizados, durante períodos de 18 a 36 h, según el objetivo de cada ensayo.
Las excepciones, fueron aquellos tratamientos identificados como de inicio de cada experimento (tiempo 0).
A las 2, 4, 6, 8, 10, 12, 18 y 24 h se igualaron las presiones interna y externa mediante la punción de los tapones de goma, de manera que no se acumulara gas, debido a que la presión acumulada podría inhibir la multiplicación bacteriana (Rymer et al., 2005; Tagliapietra et al., 2010).
Para medir el pH, fue necesario abrir cada sistema de fermentación y extraer inmediatamente todo el contenido a un recipiente en el cual se realizó la medida propiamente dicha. Se utilizó un dispositivo potenciométrico digital (Oakton, Acorn pH 5, USA).
Se realizaron tres experimentos diferentes en los sistemas de fermentación con las diferentes salivas artificiales para evaluar su efecto en el descenso del pH al simular la instalación de una acidosis ruminal.
Primer experimento
En esta instancia se realizó un ensayo de 36 h de fermentación a 39°C estudiando el efecto de la saliva SA01 sobre la dinámica de descenso del pH al simular una acidosis ruminal en los sistemas de fermentación. Para ello se emplearon dos tratamientos, fermentadores con un sustrato acidogénico (TAC) y fermentadores sin sustrato que se empleó como tratamiento control (TSS) por sextuplicado; se seleccionaron cuatro tiempos de medición de pH (medición destructiva): 0, 4, 12 y 36 h (las unidades experimentales correspondientes al tiempo cero, no fueron incubadas). Se preparó un conjunto de unidades experimentales (6 x TAC; 6 x TSS) para cada tiempo de medición, totalizando 48.
Una vez cumplido cada tiempo de fermentación se procedió a la apertura de las unidades experimentales y se procedió a la medición del pH de su contenido tal como fue descrito anteriormente.
Segundo experimento
Para este caso se sustituyó la saliva SA01 por variaciones basadas en la reducción o sustitución de componentes que podrían tener un mayor efecto amortiguador del pH (CaCO3; KH2PO4; Na2HPO4) y se incorporó un ensayo blanco sustituyendo la saliva artificial por solución salina (SA00) de manera de evidenciar la variación del pH cuando el sistema de fermentación no cuenta con tamponamiento (Tabla 2).
En este experimento se optó por acortar el tiempo de fermentación (18 h) con dos momentos de medida, inicial y final. Se prepararon, para cada saliva (SA01a, SA01b, SA01c, SA01d, SA01e) y para el blanco (SA00) pares tratamientos con (con) y sin sustrato (sin) por triplicado. Los tratamientos sin sustrato se consideraron como controles para la saliva artificial correspondiente.
Se elaboró un conjunto completo de tratamientos para medir luego de 18 h de fermentación a 39°C y otro que no se puso a fermentar (0h).
Para medir el pH del contenido de las unidades experimentales se aplicó el procedimiento descrito previamente.
Tercer experimento
Para este experimento se seleccionó una de las variaciones de la SA01 estudiadas anteriormente, la identificada como SA01e y dos nuevas salivas artificiales identificadas como SA02 (tomada de Tung y Kung, 1993) y SA03 (modificada a partir de Duncan et al., 2003).
La fermentación a 39°C en este caso tuvo una duración total de 24 h.
Se prepararon los tratamientos experimentales por triplicado, para cada saliva artificial, en pares con (con) y sin sustrato acidogénico (sin) y en cuatro tiempos: 0, 4, 12 y 24 h de fermentación (un conjunto completo de tratamientos experimentales para cada tiempo). El conjunto de frascos correspondientes al tiempo 0 no se incubó, pero el resto se colocó el baño de agua termostatizado y cada conjunto de frascos se extrajo en el tiempo correspondiente para la medida del pH de su contenido, la cual se realizó siguiendo el procedimiento mencionado anteriormente.
Para cada saliva, los frascos sin sustrato se consideraron como tratamiento control.
Análisis de los datos
Los datos obtenidos de la evolución del pH, del primer y del último ensayo fueron contrastados con un modelo de descenso logarítmico mediante una regresión no lineal. Posteriormente, para estudiar el ajuste del modelo elegido con los datos experimentales, se realizó una regresión lineal entre los valores experimentales y los predichos, siendo estos últimos la variable dependiente. Los parámetros del modelo elegido fueron identificados como:
VpH: Variación del pH. Representa el descenso total del pH en las condiciones experimentales; marca indirectamente el valor inicial de pH;
d: Velocidad de descenso; marca la velocidad de descenso del pH en las condiciones experimentales;
pHF: pH final o pH límite (valor mínimo que es capaz de alcanzar el sistema en las condiciones experimentales)
siendo las variables pH SIS: la variable de respuesta, pH obtenido en el sistema; t: la variable independiente; corresponde al tiempo de fermentación, en horas.
En la Figura 1 se muestra el modelo exponencial utilizado en la regresión no lineal.
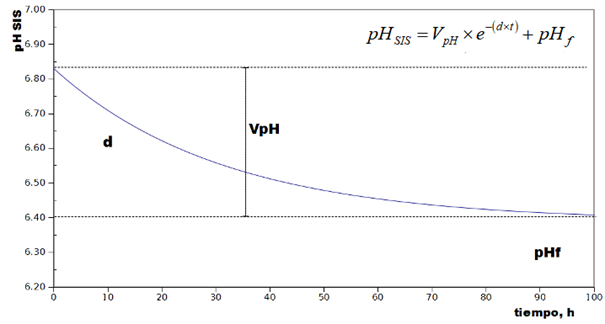
Figura 1: Representación gráfica del modelo exponencial utilizado para la regresión no lineal practicada al pH en función del tiempo, en fermentadores anaeróbicos. Se muestran los parámetros de la regresión. V pH representa la variación total del pH a lo largo del experimento; d representa la velocidad de producción de ácidos; pH f representa el valor que tendría el pH hacia el final del experimento.
Los datos obtenidos en el primer ensayo fueron estudiados mediante el estadístico t de Student para comparar los pares con y sin sustrato en cada tiempo de medida y mediante ANOVA simple para comparar las medidas tomadas a lo largo del tiempo, seguido del Test de Tukey, considerando en todos los casos un valor α=0,05.
Para los datos del segundo ensayo se estudiaron los pares de tratamientos con y sin sustrato para cada modificación de la SA01 mediante t de Student. También se aplicó t de Student para comparar cada tratamiento a las 0 y a las 18 h. En ambos casos se trabajó con un valor de α=0,05.
En el caso del tercer experimento los datos se analizaron de la siguiente manera: los pares de tratamientos con y sin sustrato para cada saliva artificial en cada tiempo mediante t de Student; los datos de pH de todos los tratamientos con sustrato entre si y los de los tratamientos sin sustrato entre sí fueron analizados mediante ANOVA simple seguido del test de Tukey; los parámetros obtenidos de las regresiones no lineales del pH fueron analizados mediante el test de Mann-Whitney para cada parámetro comparando los pares con y sin sustrato de los tartamientos con cada saliva artificial y mediante el test de Kruskall-Wallis seguido de Mann-Whitney para cada parámetro comparando los tratamientos de las diferentes salivas.
En todos los casos se empleó un valor de α=0,05.
Resultados
Ensayo de fermentación inicial con la Saliva Artificial Base (SA01)
Los datos obtenidos en este primer ensayo mostraron un descenso de pH poco marcado en el tratamiento experimental con sustrato acidogénico. Los pares con y sin sustrato mostraron diferencias significativas (p<0,05) solamente a las 4 y a las 12 h.
El tratamiento experimental con sustrato (TAC) mostró diferencias significativas (p<0,05) entre todos los tiempos en los que se registró el pH.
Modificaciones de la saliva SA01
Los datos obtenidos en este segundo ensayo en el cual se emplearon modificaciones en la composición de SA01, mostraron dos tipos de comportamiento. Un primer grupo de tratamientos (SA01a, SA01b y SA01c) exhibieron un descenso moderado del pH no llegando a 6,0 en 18 h de fermentación mientras que los otros tratamientos (SA01d, SA01e, SA00) exhibieron desde el comienzo valores de pH menores y a las 18 h mostraron valores compatibles con los que podrían darse en una acidosis ruminal, por debajo de 5,5. El pH mostró diferencias significativas (p<0,05) entre los frascos de los tratamientos con sustrato y sin sustrato correspondientes a las 18 h para todas las salivas artificiales estudiadas, siendo menores los valores de pH en aquellos tratamientos con sustrato, que simulaban la acidosis ruminal (Tabla 5).
Tabla 5: Estudio del pH en fermentadores in vitro con modificaciones en la composición de la Saliva SA01 - Comparación de los pares con y sin sustrato.
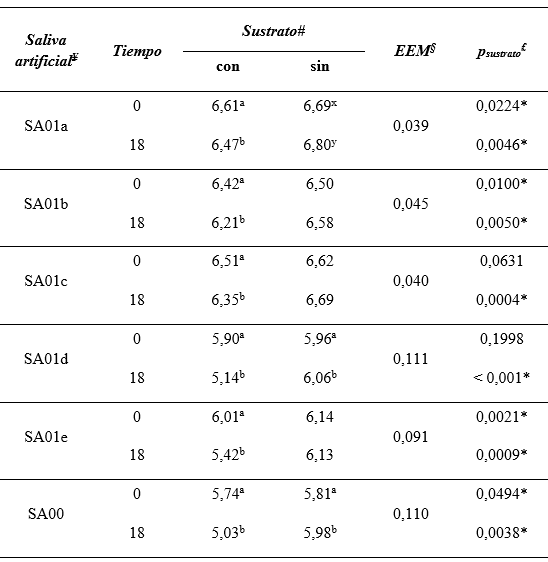
# Se muestran los valores medios de pH al inicio y al final del experimento, con sustrato acidogénico (con, columna izquierda) y sin sustrato (sin, columna derecha), para cada saliva artificial. ¥ Identificación de las salivas artificiales: SA01=saliva empleada en experimento anterior; SA01a=Sustitución de Na2CO3 + CO2, por NaHCO3; SA01b=Dilución de la solución basal con solución salina + sustitución de Na2CO3 + CO2, por NaHCO3; SA01c=Preparación de solución basal con fosfatos reducidos; SA01d=Eliminación del Na2CO3 (sin agregado de NaHCO3) + Saliva diluida a la mitad; SA01e=Eliminación del Na2CO3 (sin agregado de NaHCO3) + Reducción de fosfatos; SA00=Solución Salina Fisiológica. § EEM=Error Estándar de las Medias; £ están tabulados los valores “p” reales de los correspondientes t de Student. Superíndicesa, b distintos superíndices indican diferencias significativas (p<0,05) entre horas; Superíndices x, y indican tendencias (0,01<p>0,05) entre horas
Considerando esta variable, en pares 0 y 18 h, se encontraron diferencias significativas (p<0,05) en todos los casos que incluyeron el sustrato acidogénico, mientras que sólo hubo diferencias significativas (p<0,05) en los tratamientos experimentales sin sustrato, con las salivas artificiales SA01d y SA00 en los cuales el pH ascendió hacia las 18 h (Tabla 5).
Comparación de la saliva SA01e y otras dos salivas artificiales con diferente formulación
Los pares con y sin sustrato no presentaron diferencias significativas (p>0,05) al inicio del ensayo para ninguna saliva artificial. En cambio, en los tiempos posteriores (4, 12 y 24 h), se encontraron diferencias significativas entre los pares con y sin sustrato para todas las salivas (p<0,05) mostrando menor valor de pH aquellos tratamientos con sustrato, que simulaban la acidosis ruminal. Al comparar los tratamientos con sustrato entre sí y aquellos sin sustrato entre sí, en ambos casos se encontraron diferencias significativas (ANOVA y Tukey, p<0,05) entre todos los tratamientos durante todo el experimento.
Al analizar los parámetros de las regresiones no lineales realizadas, no se encontraron diferencias significativas (p>0,05; Tabla 6) en VpH, excepto cuando se comparó el par con y sin sustrato correspondiente a la saliva artificial SA03 (Mann-Whitney, p<0,05; Tabla 6).
Tabla 6: Comportamiento de los parámetros VpH, d y pHf correspondientes a 24h de fermentación, utilizando tres diferentes salivas artificiales.
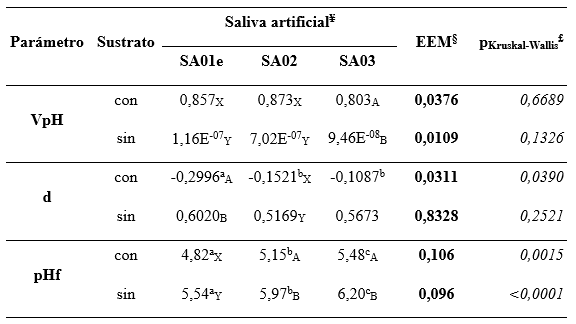
Se muestran los valores medios de dichos parámetros y el error estándar de las medias del conjunto de datos de los mismos. ¥ Identificación de las salivas artificiales: SA01e= Saliva artificial original a la que se eliminaron los carbonatos y bicarbonatos; SA02= Saliva artificial adaptada de Tung y Kung, 1993; SA03= Saliva artificial modificada de Duncan et al., 2003; § EEM=Error Estándar de las Medias; £ están tabulados los valores “p” reales de los correspondientes tests de Kruskall-Wallis. En los casos que se encontró diferencias significativas mediante el test de Kruskall-Wallis (p<0,05) se aplicó el test de Mann-Whitney, indicándose con letras diferentes en cada fila. SubíndicesA,B distintos superíndices indican diferencias significativas (p<0,05) entre pares con y sin sustrato; Subíndices x, y indican tendencias (0,01<p>0,05) entre pares con y sin sustrato.
Para el parámetro d (que expresa la velocidad de descenso del pH), se encontraron diferencias significativas (Kruskall-Wallis y Mann-Whiney, p<0,05; Tabla 6) entre la saliva SA01e (valor absoluto mayor implicando una mayor velocidad de descenso del pH) y las otras dos en aquellos tratamientos con sustrato. También hubo diferencias significativas (Mann-Whitney, p<0,05; Tabla 6) entre los tratamientos con y sin sustrato con la saliva SA01e. Respecto al parámetro pHf, tanto los tratamientos con sustrato como los que no lo tenían mostraron diferencias significativas (Kruskal-Wallis y Mann-Whitney, p<0,05), resultando todos diferentes: SA01e<SA02<SA03 (ver Tabla 6). Los pares con y sin sustrato resultaron significativamente diferentes (Mann-Whitney, p<0,05) para las salivas artificiales SA02 y SA03 solamente (Tabla 6).
Tanto la saliva SA01e como las SA02 y SA03 permitieron mostrar la evolución del pH en los fermentadores asimilable a acidosis ruminal en un período relativamente breve (24 h), apto para experimentos in vitro en los cuales se podrían probar diversas estrategias para tratar de incidir sobre la enfermedad en forma preventiva. La SA03 es la que comienza en valores más elevados de pH.
Discusión
Diversos autores han trabajado en modelos in vitro estudiando la funcionalidad ruminal midiendo, entre otras variables, el pH (Nisbet y Martin, 1991; Callaway y Martin, 1996; Martin, 1998; Eger, 2018). Si bien se han realizado estudios in vitro sobre la acidosis ruminal basados en el método de producción de gas in vitro midiendo el pH, la mayoría han basado sus ensayos partiendo de una situación de acidosis instalada, mediante el agregado de ácidos al inicio de los mismos (Martin, 1998; Martin, 2004; Colombatto et al., 2007; Kozloski et al., 2008). En el presente trabajo, en cambio, se trabajó simulando las condiciones de producción de la acidosis conducida por la propia microbiota ruminal actuando sobre un sustrato acidogénico.
Normalmente, en los experimentos de producción de gas in vitro se suelen emplear salivas artificiales con un gran poder tamponante ya que el objetivo es medir directa o indirectamente el volumen de gas producido y es necesaria una duración más prolongada del ensayo (Beuvink y Spoelstra, 1992; Kozloski et al., 2008; Elghandour et al., 2013). En nuestro trabajo se procuraron seleccionar sustancias que crearan condiciones de una menor capacidad de amortiguación del pH para permitir el registro de la dinámica de descenso de esta variable en el proceso de instalación de la acidosis ruminal que se estaba procurando simular.
La saliva de los rumiantes es una fuente de sustancias amortiguadoras del pH, principalmente bicarbonato (Dijkstra et al., 2012). El agregado de soluciones con efecto tampón en los ensayos in vitro (salivas artificiales) tiene como objetivo permitir la fermentación en las unidades experimentales sin afectar demasiado la integridad de los microorganismos que conducen dicha fermentación.
El efecto tampón de dichas salivas artificiales es algo normalmente buscado en los experimentos in vitro ya que asegura la vitalidad de los microorganismos más sensibles, generalmente los fibrolíticos (Russell y Wilson, 1996). Sin embargo, en nuestro caso necesitábamos estudiar sin interferencias los cambios de pH y ello no ocurrió en el primer ensayo, realizado en base al protocolo tradicional, ya que se empleó una saliva artificial muy potente en su capacidad tampón. El ajuste de las curvas de variación del pH a lo largo de las 36 h de fermentación respecto al modelo propuesto fue adecuado para el tratamiento con sustrato, pero no ajustó para el tratamiento sin sustrato ya que no mostró descenso de pH sino ascenso durante la mayor parte del ensayo disminuyendo a las 36 h, momento en el cual se finalizó el experimento (más similar a un modelo cuadrático).
En base a los resultados obtenidos se realizó un ensayo breve (18 h) para evaluar la posibilidad de cambiar las condiciones de tamponamiento durante la fermentación, para poder evidenciar mejor los cambios de pH. Del mismo resultó seleccionada la saliva artificial identificada como SA01e. Esta saliva artificial se comparó con otras que tenían composiciones diferentes y con una forma de elaboración más sencilla, en un nuevo ensayo de 24 h de duración. Las unidades experimentales con las tres salivas artificiales tuvieron una evolución del pH semejante en cuanto a la expresión de la acidosis ruminal simulada (Figura 2).
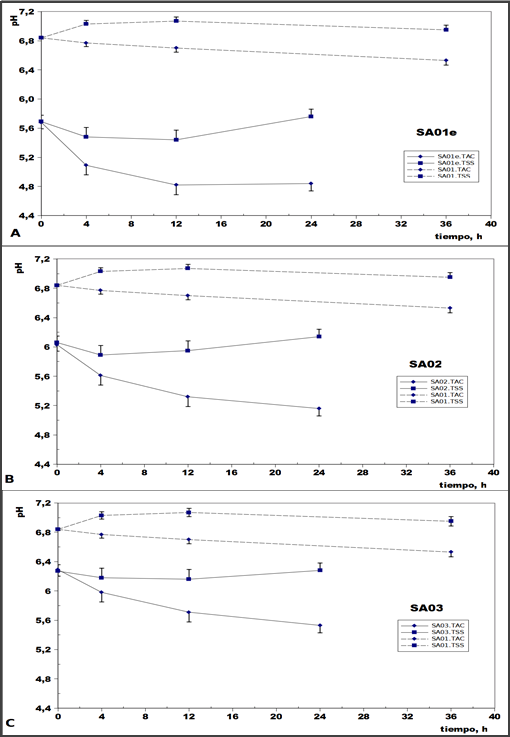
Figura 2: Evolución de pH en los fermentadores. Comparación de la variación del pH a lo largo de 24 h de fermentación empleando tres diferentes salivas artificiales (en los tres casos se compara con los valores de pH obtenidos de la fermentación anaeróbica con la saliva artificial inicial durante 36 h).
Sin embargo, se eligió la saliva identificada como SA03 por permitir visualizar en mejores condiciones el descenso de pH producido por la acción de la biota ruminal sobre el sustrato acidogénico. Otra ventaja de esta saliva artificial fue su mayor sencillez de preparación con menor cantidad de ingredientes.
Meschy et al. (2004) haciendo un metaanálisis de 40 reportes de trabajos in vivo mostraron que el uso de sustancias tampón, principalmente bicarbonato, además de tener un efecto sobre el pH, podían producir modificaciones en las relaciones entre los AGV, aunque no modificaba su valor total. Cobos-Peralta et al (2005) ensayaron in vitro el efecto de dos sustancias tampón, entre ellas bicarbonato de sodio, que mostró la esperada amortiguación en el descenso del pH, disminuyendo además la cantidad de lactato y la relación acético:propiónico, pero incrementando los niveles de todos los AGV. Estos trabajos dan cuenta de efectos propios que tendría el bicarbonato, por lo que su uso en ensayos in vitro como los realizados en este trabajo interferirían con los efectos que se pretendían investigar.
Tanto la saliva artificial SA01e como la SA03 resultaron apropiadas para hacer estudios in vitro de simulación de la acidosis ruminal ya que, al tener menor cantidad de bicarbonatos y mayor proporción de fosfatos, permitieron variaciones en el pH de los fermentadores sin interferencias. Se puede asumir entonces que los valores de pH obtenidos se habrían debido fundamentalmente a la acción de la microbiota ruminal y no a componentes de dichas salivas artificiales.
Conclusiones
A partir de este trabajo, se observó que dos de las salivas artificiales evaluadas poseen un leve efecto amortiguador del pH. Estas salivas permitieron la expresión de diferencias nítidas entre aquellos tratamientos con sustrato acidogénico y los que no lo tienen, por lo que pueden ser utilizadas en estudios de fermentación ruminal in vitro de hasta 24 h simulando una acidosis ruminal. Debido a ello se podrán ensayar diferentes intervenciones para combatir esta enfermedad productiva en forma relativamente económica y descartar aquellas no viables antes de pasar a realizar ensayos in vivo.