Ordenamiento taxonómico
Leishmania Ross, 1903 es un protozoario actualmente incluido en el Phylum Euglenozoa Cavalier-Smith, 1993, Clase Kinetoplastida Honigberg, 1963, Familia Trypanosomatidae Doflein, 1901. El género Leishmania está subdividido en tres subgéneros: L. (Leishmania) y L. (Viannia) y L. (Sauroleishmania), siendo este último subgénero parásitos de lagartijas (no contemplados en esta revisión). Una clasificación taxonómica actualizada se detalla en la Tabla 1. A lo largo del tiempo ha habido muchas idas y vueltas con respecto a la denominación del género Leishmania y sus especies. Varios taxónomos optaron por una clasificación basada en una combinación de caracteres morfológicos, ecológicos y clínicos. Por lo tanto, las denominaciones dadas referían, en muchas ocasiones, a estos aspectos. Por ejemplo, Leishmania infantum fue denominada por ser más frecuentemente hallada en infantes, mientras que, Leishmania braziliensis o Leishmania mexicana por su localización geográfica. En tiempos más recientes, se ha abordado un enfoque filogenético (basado en un ancestro común), confeccionando árboles filogenéticos a partir de diferentes marcadores moleculares. Esto último, ha tendido a simplificar las denominaciones y eliminar especies sinónimas (Fraga y col., 2010; Schönian y col., 2010).
Tabla 1: Clasificación taxonómica de las especies de Leishmania que afectan mamíferos y su localización geográfica.
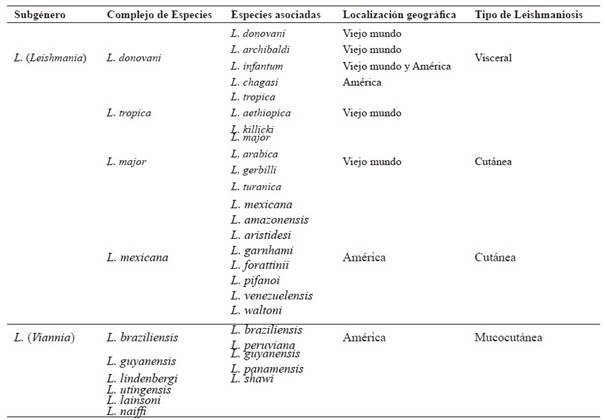
A la fecha, existe una fuerte controversia acerca de Leishmania chagasi y L. infantum, ya que varios autores las consideran especies sinónimas, mientras que otros, las catalogan como especies distintas. Los autores que defienden a L. chagasi como especie independiente, argumentan que esta tiene un ciclo autóctono en el continente americano que involucra a Lutzomyia longipalpis (como vector principal) y cánidos salvajes, en especial zorros. Mientras que, L. infantum es transmitida por otro género de flebotomíneo en el viejo mundo (Europa, Asia y África) y que, de haber sido introducida en América, no pudo haber hecho un salto tan abrupto en su adaptación a un nuevo vector en un lapso tan corto. Asimismo, otros autores han encontrado diferencias entre L. infantum y L. chagasi también a nivel molecular (Martinez y col., 2003). Por el contrario, varios autores consideran que son la misma especie, o que a lo sumo se trata de dos subespecies y que L. infantum fue introducida desde el viejo continente a través de perros parasitados durante la colonización de América, encontrando un ambiente propicio para su propagación (Lainson y Rangel, 2005; Lainson y Shaw 2005; Leblois y col., 2011).
Breve historia de la Leishmaniosis
La interacción Leishmania-flebotomíneos se remonta a la era Cretácica. La evidencia más antigua se halló en un ámbar de aproximadamente 100 millones de años donde se encontró en la probóscide de un flebotomíneo (Palaeomyia burmiti) una especie fósil de Leishmania denominada Paleoleishmania proterus, en lo que hoy es Birmania (Poinar Jr y Poinar, 2004). En República Dominicana, también fue hallado otro ámbar, que data de 10-30 millones de años atrás, conteniendo un ejemplar de la también extinta Lutzomyia adiketi parasitada con Paleoleishmania neotropicum (Poinar, 2008). Los hospederos definitivos de estas especies de Paleoleishmania probablemente fueron reptiles o mamíferos primitivos (Tuon y col., 2008).
Las primeras descripciones de lesiones compatibles con leishmaniosis cutánea humana se remontan al 2500 a.C. encontradas en antiguas escrituras del viejo mundo. Así mismo, la leishmaniosis tampoco es algo nuevo en el continente americano. Los hallazgos más antiguos en Sudamérica datan del 2000 a.C., en una momia de una niña de aproximadamente 6 años, en Perú (Akhoundi y col., 2016). También existen diseños de lesiones desfigurativas reminiscentes a leishmaniosis mucocutáena (LMC) en cerámicas precolombinas del siglo V d.C (después de Cristo) (Tuon y col., 2008). Asimismo, durante la colonización de América tanto los conquistadores como los misioneros detallaron lesiones similares a LMC en trabajadores de plantaciones de coca en los andes peruanos (Steverding, 2017).
Por otro lado, la historia de la leishmaniosis visceral (LV) no es tan clara. Si bien se cree que también tiene un origen muy antiguo, las primeras descripciones datan del siglo XIX, en India (Steverding, 2017). En el continente americano, los primeros reportes de LV fueron en Brasil, a comienzos del siglo XX cuando se encontró post mortem Leishmania sp. en el hígado de pacientes que se creía habían muerto por fiebre amarilla (Lainson y Rangel, 2005).
La primera descripción documentada de Lu. longipalpis fue realizada por Lutz y Neiva (1912), también en Brasil, aunque su rol como vector de Leishmania sp. no tomó relevancia hasta mediados de la década del ’30, cuando, Evandro Chagas (hijo del célebre Dr. Carlos Chagas), observó una alta carga de Lu. longipalpis en el domicilio de un paciente diagnosticado con leishmaniosis visceral en el estado de Sergipe, noreste de Brasil (Lainson y Rangel, 2005).
Distribución geográfica
La leishmaniosis está catalogada como una de las diez enfermedades desatendidas más importantes en el mundo, junto con la enfermedad de Chagas y Schistosomiasis (Fenwick, 2012). Si bien tiene una distribución mundial, el 90% de los casos están concentrados en Sudán, Bangladesh, India, Etiopía, Nepal y Brasil (Chappuis y col., 2007). Otros países con alta prevalencia de leishmaniosis son: Siria, Afganistán, Irán, Sudán del Sur, Colombia, Bolivia y Perú (Akhoundi y col., 2016; Steverding, 2017).
Las diferentes especies de Leishmania tienen un amplio rango de hospederos y reservorios, pero su distribución geográfica está estrechamente ligada a la presencia de los flebotomíneos. Esto puede ser explicado en parte a la coevolución vector-parásito (Akhoundi y col., 2016). Los complejos de L. braziliensis y L. mexicana son exclusivos del continente americano mientras que L. major y L. tropica son del viejo continente.
La LV o Kala-azar es causada por Leishmania donovani sensu stricto, Leishmania archibaldi y L. infanutm. Las dos primeras son antrofílicas y se distribuyen en el este de África y el subcontinente Indio, mientras que L. infantum se encuentra en el norte de África, Europa y América (Chappuis y col., 2007).
Vectores competentes
Los flebotomíneos son dípteros de la familia Psychodidae de pequeño tamaño, menor a 4 mm (Young y Duran, 1994). Las hembras son hematófagas ya que necesitan una alta demanda de energía para producir los huevos. Tienen un aparato bucal altamente especializado, que consiste en un fascículo con seis estiletes arriba del labro, mandíbulas con las que cortan la piel del hospedador y una lacinia generalmente armada con dientes que le da estabilidad a las piezas bucales durante la penetración dérmica. Su cuerpo está cubierto de finas setas, sus patas son largas y sus alas son pequeñas (Galati y col., 2017). Su ciclo biológico es de tipo holometábolo y es enteramente terrestre, es decir, las hembras de flebotomíneos depositan los huevos en materia orgánica, gallineros, madrigueras de roedores y troncos de árboles (Feliciangeli, 2004), a diferencia de lo que ocurre con los culícidos que necesitan un medio acuoso para el desarrollo larvario. Los flebotomíneos adultos tienen diferentes grados de domesticación. Algunas especies son meramente salvajes y solo entran en contacto con humanos de forma ocasional, mientras que otras tienen un ciclo totalmente adaptado a ambientes domésticos o peridomésticos (Rangel y Vilela, 2008; Werneck, 2014).
Se han identificado a la fecha, seis géneros de flebotomíneos, tres en el viejo mundo: Phlebotomus, Sergentomyia, y Chinius y tres en América: Lutzomyia, Brumptomyia y Warineya. Dentro de los flebotomíneos americanos, el género Lutzomyia es el más importante por su vasta distribución y desde el punto de vista médico-veterinario, por su implicancia como vector de varias enfermedades. El principal vector biológico en América de Leishmania spp. es Lu. longipalpis. Asimismo, Lu. evansi y Lu. cruzi han sido reportadas como vectores alternativos en zonas endémicas de LV, en varias regiones de Colombia y Venezuela, y, en Brasil, respectivamente (dos Santos y col., 1998; Bejarano y col., 2002). Sin embargo, el rol de Lu. longipalpis como vector principal de LV es indudable ya que varios reportes han logrado evidenciar la transmisión de Leishmania spp. por ejemplares de Lu. longipalpis infectados tanto natural como experimentalmente (Lainson y col., 1977, 1987). Cabe destacar que no todas las especies de flebotomíneos son capaces de transmitir o han sido comprobados como vectores de Leishmania spp. Para que sean catalogados como vectores competentes se deben cumplir ciertos requisitos: efectuar un análisis detallado de datos epidemiológicos, estudiar patrones de alimentación en animales, comprobar que se efectúe el ciclo biológico en un supuesto vector y realizar estudios de transmisión experimental a través de flebotomíneos infectados, tanto sea experimental como naturalmente (Akhoundi y col., 2016). Algunas especies de flebotomíneos son altamente específicas y solo transmiten una especie de Leishmania, como es el caso de Phlebotomus papatasi y L. major, mientras que otras como por ejemplo Lu. longipalpis es un vector “permisivo” ya que es capaz de transmitir varias especies de Leishmania (Kamhawi, 2006).
Tipos de leishmaniosis
Leishmaniosis es un complejo de enfermedades causadas por varias especies de Leishmania. Algunas de las especies son antropofílicas mientras que otras son zoonóticas (Tabla 1). Se estima que se infectan cada año entre 900.000 a un 1.700.000 personas, pero solo una pequeña fracción de estas desarrollará síntomas y alrededor de 20.000 a 30.000 morirán (Steverding, 2017). Las presentaciones más típicas son: leishmaniosis cutánea (LC), leishmaniosis mucocutánea (LMC), y leishmaniosis visceral (LV). Las lesiones y la progresión de cada enfermedad están dadas por la especie de Leishmania. A continuación, se describe brevemente las diferentes formas en humanos.
La LC tiene diferentes presentaciones que incluyen pápulas, nódulos y lesiones cutáneas ulcerativas que, en muchas ocasiones es acompañada de infecciones bacterianas secundarias (González y col., 2009). La progresión de las lesiones puede ser lenta y tomar varios meses, incluso años y está muy ligada a la especie de Leishmania, la carga parasitaria y el estado inmunológico del paciente (Bruschi y Gradoni, 2018).
La LMC tiene una presentación crónica y se han reportado casos mayormente en poblaciones de Centro y Sudamérica o en viajeros de otras partes del mundo que hayan visitado zonas endémicas (Ahluwalia y col., 2004). Las lesiones destructivas afectan generalmente la mucosa nasal, faríngea y laríngea, aunque pueden extenderse a la piel de la nariz y labios (Torres-Guerrero y col., 2017). En algunos casos, las lesiones pueden ser vistas varios meses o incluso años después de la lesión cutánea inicial o presentarse sin ningún síntoma previo (Amato y col., 2008).
La LV es una enfermedad sistémica crónica donde se presenta fiebre intermitente, pérdida de apetito y de peso, anemia, agrandamiento progresivo de órganos (hígado, bazo) y linfonódulos (Chappuis y col., 2007). Tiene una alta mortalidad si no se trata a tiempo. En pacientes con inmunodeficiencia la presentación clínica es aún más crítica, aumentando los índices de letalidad (Cota y col., 2017; Lindoso y col., 2018).
Leishmaniosis visceral por L. infantum en la región
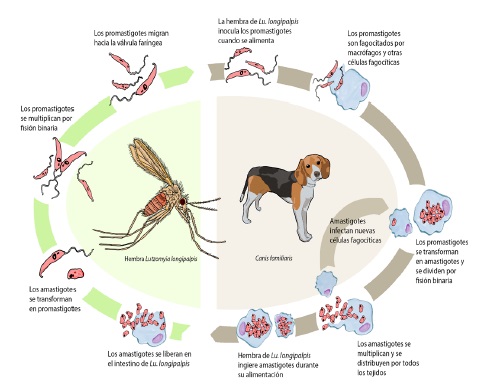
Ciclo biológico de L. infantum (Figura 1).
El ciclo de L. infantum involucra a un vector biológico (Lu. longipalpis) y un hospedero vertebrado (en nuestra región, el perro). El perro contrae L. infantum cuando una hembra infectada de Lu. longipalpis inocula promastigotes al momento de su alimentación. Los promastigotes son fagocitados por macrófagos y otras células monoucleares fagocíticas. Dentro de estas células se transforman en amastigotes, dividiéndose por fisión binaria. Luego, ocurre la liberación de los amastigotes, que nuevamente entran en nuevas células fagocíticas e invaden todos los órganos de su hospedero. Para ser transmitidas a un nuevo vector, es necesaria la presencia de amastigotes en la dermis, por lo tanto, cuando una hembra de Lu. longipalpis succiona sangre, los amastigotes pasan a su aparato digestivo donde se transformarán en promastigotes. La frecuencia y la dinámica de transmisión de L. infantum en una población canina depende de varios factores, como ser: transmisión continua o estación de transmisión, densidad de vectores, densidad poblacional de perros y susceptibilidad de los mismos, sitio y forma de vida de los perros (confinados al interior de las viviendas o fuera de ellas), grado de exposición a los flebotomíneos, presencia de otros reservorios salvajes y por último, la actitud de los dueños para adoptar medidas preventivas (Dantas-Torres y col., 2012).
Síntomas clínicos en perros
Tal cual ocurre en humanos, la LV en perros es una enfermedad crónica y multisistémica. El espectro y gravedad de los síntomas varía ampliamente, teniendo perros que presentan una conjunción de síntomas (polisintomáticos) u otros en que solo se evidencian uno o muy pocos de ellos (oligosintomáticos). La gran preocupación por los médicos veterinarios es que los síntomas de LV no son patognomónicos y que, a su vez, un alto porcentaje de los perros son asintomáticos. Los síntomas generales más comúnmente encontrados son: lesiones de piel, linfoadenomegalia generalizada, pérdida de peso progresiva, atrofia muscular, esplenomegalia, poliuria, polidipsia, epistaxis, onicogrifosis, cojera, vómito y diarrea (Solano-Gallego y col., 2009). En particular, los signos cutáneos son los más frecuentes, destacándose: a) alopecia difusa no pruriginosa que puede estar localizada en la región dorsolumbar o diseminada por todo el cuerpo, b) hiperqueratosis que puede estar presente en cabeza, nariz y almohadillas plantares, y c) úlceras cutáneas o mucosas asociadas con necrosis. También pueden desarrollarse signos oculares como: conjuntivitis, keratoconjuntivitis, blefaritis ulcerativa o nodular, uveítis, glaucoma (Gharbi y col., 2016).
Leishmaniosis en Uruguay y la región
A nivel regional, Brasil concentra la mayoría de los casos de leishmaniosis tanto visceral como cutánea. En particular, la LV está presente en las 5 regiones del país vecino y tiene una letalidad de 5,8%. Se estiman entre 4.200 a 6.300 nuevos casos en humanos por año. Los otros países que le siguen en la lista son: Paraguay, Colombia, y Venezuela (Peixoto y col., 2015). En Argentina, el primer caso de LV humana fue diagnosticado en 2006, en un niño de 8 años de la ciudad de Posadas, provincia de Misiones. A partir de ese momento, se han hecho varios reportes de hallazgos tanto de Lu. longipalpis como de casos de leishmaniosis canina (Salomón y col., 2011).
Si bien en las primeras décadas del siglo XX se reportaron dos especies de flebotomíneos en Uruguay (Lutzomyia gaminarai y Lutzomyia cortelezii), no se logró capturar ningún otro ejemplar de flebotomíneo hasta 2010, cuando se realizó un estudio colocando trampas en diferentes puntos de las ciudades de Salto y Bella Unión, hallándose un total de dos ejemplares machos de Lu. longipalpis (Salomón y col., 2011). La vigilancia en búsqueda de más ejemplares de Lu. longipalpis siguió realizándose en estas ciudades, hasta que, en febrero de 2015, luego de un estudio en Arenitas Blancas (barrio de la ciudad de Salto) que involucró 49 perros, 11 de ellos resultaron positivos serológicamente a Leishmania sp. La confirmación de los casos se realizó por medio de frotis, a partir de biopsias de linfonódulos y aspiración de médula ósea, visualizándose amastigotes. Por PCR y secuenciación se confirmó L. infantum como el agente etiológico (Satragno y col., 2017). Además, con la colocación de trampas en esa zona, se logró capturar 3 ejemplares de Lu. longipalpis, cerrando así el ciclo autóctono. Hasta la fecha, se sigue realizando la vigilancia epidemiológica en perros, así como el diagnóstico entomológico de flebotomíneos a cargo de la Comisión de Zoonosis (MSP). Los casos de perros serológicamente positivos ascienden a varias centenas y se prevé que siga aumentando la cifra (Diario El País, 2017). En diciembre de 2018, se confirmó el primer caso de LV humana en un niño de la ciudad de Salto (comunicado del Ministerio de Salud Pública, 2018).
Diagnóstico
Debido a que los síntomas clínicos de LV son generales o si se trata de animales asintomáticos, el diagnóstico clínico resulta, en muchos casos, imposible. Por lo tanto, se debe recurrir al diagnóstico de laboratorio. Existen diferentes abordajes para el diagnóstico de LV, que básicamente se dividen en métodos directos (constatación de la presencia de los agentes o su ADN) o indirectos (por medio de la detección de anticuerpos anti-Leishmania). Los métodos directos para la visualización de amastigotes incluyen frotis de médula ósea o aspirado de linfonódulos y biopsias de piel. Por medio de técnicas de diagnóstico molecular (por ejemplo, PCR), se puede detectar la presencia de ADN y, hacer la caracterización molecular de la especie. Por otra parte, se puede realizar el xenodiagnósitco (infección de un flebótomo con sangre de pacientes sospechosos de leishmaniosis) o cultivo celular (Duthie y col., 2018). Los métodos indirectos se basan en la respuesta inmunitaria, más específicamente en la detección de anticuerpos (IgG) anti-Leishmania. Los métodos más utilizados son aglutinación directa, inmunofluorescencia indirecta, ELISA e inmunocromatografía (Gomes y col., 2008; Travi y col., 2018). Los métodos que utilizan antígenos crudos de promastigotes son altamente sensibles para detectar infecciones clínicas y subclínicas, pero tienen poca sensibilidad. Por otro lado, las proteínas recombinantes son ampliamente empleadas en estudios de vigilancia epidemiológica, entre ellas, la más usada es la rk39. Está constituida por una cadena de 39 aminoácidos repetidos de una proteína relacionada a la kinesina que es altamente conservada entre las especies de Leishmania causantes de LV (Ritmeijer y col., 2006). Tiene una alta sensibilidad con perros sintomáticos, pero desciende al momento de detectar asintomáticos (Mettler y col., 2005). En Uruguay, se realizan test de inmunocromatografía en tira basando en la detección de rK39 con muestras de sangre entera y/o suero (Satragno y col., 2017).
Control de la leishmaniosis visceral
La epidemiología de la LV es multifactorial, por ende, las estrategias para minimizar el impacto en la población humana y canina deben abordar, en la medida de lo posible, sus actores principales (reservorios y vectores).
Debido a la compleja ecología de los flebotomíneos, el control sobre los mismos resulta extremadamente complicado (Feliciangeli, 2004). Como se mencionó anteriormente, los lugares donde las hembras depositan sus huevos son muy variados, esto hace que sean difíciles de ubicar, y por lo tanto, la aplicación de medidas de control sobre las formas inmaduras se torna virtualmente imposible (Otranto y Dantas-Torres, 2013). Se ha visto que la aplicación de insecticidas en paredes y techo de viviendas, así como de gallineros o lugares de cobijo de animales, ha producido una reducción en la población de flebotomíneos (Alexander y Maroli, 2003). Esta es una medida a corto plazo y las continuas aplicaciones de insecticidas tienen la limitante del costo y los peligros para la salud humana.
Varios mamíferos salvajes como zorros, diferentes roedores y comadrejas (didélfidos) han sido propuestos como reservorios de L. infanutm en áreas rurales (Dantas-Torres y col., 2012). En zonas urbanas y suburbanas, los perros son los reservorios más importantes (Otranto y Dantas-Torres, 2013). Por lo tanto, son uno de los pilares en los cuales se basan las estrategias de control.
En algunos países de Europa, se estila realizar el tratamiento de los animales sintomáticos (Solano-Gallego y col., 2009). Esta medida si bien reduce la sintomatología, no produce la curación completa y se ha visto que luego del tratamiento, puede ocurrir recidiva (Travi y col., 2018). Además, si bien la parasitemia se reduce considerablemente, estos perros pueden ser fuente de infección para otros perros e incluso humanos. Por otro lado, es importante destacar que el número de drogas efectivas contra Leishmania spp. es muy limitado, y se ha argumentado que el uso en clínica veterinaria puede promover en el desarrollo de resistencia (Oryan y Akbari, 2016).
La eutanasia de los perros seropositivos se ha empleado en varios países, pero su efectividad es cuestionable (Dantas-Torres y col., 2019). A la fecha, es la medida que se está utilizando en nuestro país. En Brasil, el país con la mayor tasa de infección de LV en América, se han llevado a cabo varias campañas de eutanasia de perros seropositivos, aunque los resultados no parecen disminuir el riesgo tanto de infección a otros perros o a humanos cuando la leishmaniosis ya es endémica en esas zonas (Costa, 2011).
La implementación de vacunas anti-Leishmania se encuentra todavía en una etapa muy temprana. Existen tres “generaciones” de vacunas (Jain y Jain, 2015). La primera generación de vacunas se generó a partir de organismos atenuados o muertos. Estas vacunas demostraron un cierto grado de protección, sin embargo, se dejaron atrás ya que tenían como limitación principal su alta toxicidad. La segunda generación incluye proteínas purificadas a partir de cultivos in vitro de Leishmania spp. o sus productos de excreción-secreción (E/S). En Brasil, Leishmune® (Zoetis, Brasil), una vacuna que contiene un ligando de fucosa-manosa de L. donovani, con una eficacia reportada fue de 76 a 92%, fue comercializada desde 2004 a 2014 (Borja-Cabrera y col., 2002). En la actualidad, una vacuna en base al antígeno recombinante A2 llamada, también de L. donovani, Leish-Tec® (Hertape Calier Saúde Animal, Brasil), es la única disponible en el mercado del país vecino (Solano-Gallego y col., 2017). Los desafíos de campo reportan que Leish-Tec® tiene una protección de 71% (Regina-Silva y col., 2016). En Europa, se encuentran disponibles CaniLeish® (Virbac Santé Animale, Francia) y LetiFend ® (Laboratorios Leti, España). La primera es una vacuna producida a partir de antígenos de E/S de cultivos de promastigotes de L. infanutum y la segunda es una proteína recombinante quimera (contiene 5 fragmentos antigénicos de L. infantum). CaniLeish® y LetiFend® han demostrado tener una eficacia del 68,4% y 72%, respectivamente (Oliva y col., 2014; Regina-Silva y col., 2016). Tanto, Leishmune®, Leish-Tec® y CaniLeish® usan derivados de saponinas como coadyuvantes, mientras que, LetiFend® no tiene ningún adyuvante (Solano-Gallego y col., 2017). Hasta la fecha estas son las únicas vacunas con resultados alentadores que confieren una cierta protección contra la infección y/o desarrollo de la enfermedad clínica (Gradoni, 2015). La tercera generación de vacunas se encuentra aún en desarrollo (Jain y Jain, 2015).
La medida preventiva más aceptada es la aplicación de insecticidas (piretroides sintéticos) en perros, tanto sea en collares o en productos spot-on. Los piretroides tienen una acción tóxica e irritativa sobre los flebotomíneos causando desorientación y muerte, previniendo la alimentación y, por ende, bloqueando la transmisión de L. infantum (Otranto y Dantas-Torres, 2013). El efecto repelente es variable, dependiendo de la forma de aplicación o formulación de cada producto, pudiendo ser de 1 a 8 meses (David y col., 2001; Reithinger y col., 2004).
Consideraciones finales
La leishmaniosis es una enfermedad extremadamente difícil de controlar debido a la complejidad de su ciclo biológico. Su erradicación es, con las herramientas que se cuentan en la actualidad, aún impensable. Por lo tanto, las medidas profilácticas, como la colocación de collares repelentes, la vigilancia serológica de los perros, así como la implementación de un sistema de detección precoz de casos en humanos, son las medidas fundamentales que se deben adoptar para poder convivir con la misma.