Introducción
El Distemper Canino (DC) es una enfermedad multisistémica causada por un virus ARN monocatenario, no segmentado, de polaridad negativa perteneciente al género Morbilivirus y a la familia Paramoxyviridae (Lempp y col., 2014; Monteiro y col., 2010). Presenta alta tasa de morbilidad dada la alta infectividad del virus, su eliminación a través de todo tipo de secreciones, exudados y fluidos y la existencia de animales infectados que eliminan el virus previa manifestación de signos clínicos (Monteiro y col., 2010).
El DC puede afectar a una amplia gama de carnívoros terrestres y acuáticos incluyendo miembros de la familia Canidae, Felidae, Procyonidae, Mustelidae y Phocidae (Blixenkrone-Møller y col., 1991; Goldstein y col., 2009; Griot y col., 2003; Monteiro y col., 2010; Roelke-Parker y col., 1996). Esta enfermedad es una de las enfermedades infecciosas más importantes que afectan caninos en todo el mundo (Monteiro y col., 2010), siendo, después de la rabia, la que presenta mayor letalidad (Appel, 1995). En el periodo comprendido entre 1992 y 2005, en el Hospital de la Facultad de Veterinaria de la UDELAR se diagnosticaron clínicamente 799 casos de Distemper Canino, con una media mensual de 4,78 casos encontrándose en nuestro país la enfermedad en una situación de endemismo (Feijóo y col., 2009).
La enfermedad puede afectar a perros de cualquier edad, pero son más susceptibles los animales entre 3 y 6 meses. Existen grandes variaciones en la duración, severidad y presentación clínica del DC dependiendo principalmente de la edad, el estado inmune del huésped, la historia previa de vacunación, así como de la cepa del virus (Beineke y col., 2009; Lempp y col., 2014). Los sistemas respiratorios, gastrointestinal, piel y sistema nervioso central (SNC) son los más comprometidos (Nelson y Couto, 2010). Respecto a este último, la encefalitis por DC puede ser clasificada en diferentes subtipos de acuerdo a los cambios histopatológicos y las áreas cerebrales afectadas (Baumgärtner y Alldinger, 2005).
A grandes rasgos, se pueden distinguir una polioencefalitis y una leucoencefalitis que presentan patrones de distribución de lesiones y patogénesis diferente (Beineke y col., 2009).
La polioencefalitis es una manifestación esporádica del DC en las que las lesiones a nivel del SNC se asientan en la materia gris, estas son, la Encefalitis del perro viejo, (“Old dog encephalitis”), Encefalitis postvacinal y Encefalitis a cuerpos de inclusión. La infección en estos casos está localizada predominantemente en las áreas corticales y los núcleos del tronco encefálico (Nesseler y col., 1999).
La leucoencefalitis desmielinizante es la forma más frecuente de DC neurológico, tanto en la enfermedad espontánea, como en la reproducida de manera experimental (Alldinger y col., 1993; Amude y Alfieri, 2010). Las regiones del SNC más frecuentemente afectadas por la desmielinización son la sustancia blanca del cerebelo, de la región periventricular (especialmente alrededor del cuarto ventrículo), los tractos ópticos y la médula espinal (Marc Vandevelde y Zurbriggen, 2005).
Estudios acerca de la patogenia de la leucoencefalitis desmielinizante producida por el virus del DC han demostrado que el desarrollo de la desmielinización es un evento bifásico. Presenta una fase inicial aguda, en la que el daño es producido por la acción directa del virus y una crónica en la cual el daño ocurre a expensas de un proceso inmunopatológico (Beineke y col., 2009).
Las lesiones iniciales ocurren alrededor de tres semanas post infección y se desarrollan durante un período de inmunosupresión inducida por el virus, por lo tanto, no son lesiones inflamatorias, no hay presencia de manguitos perivasculares (Vandevelde y col., 1982). Se ha demostrado que esta desmielinización coincide con la replicación del virus del DC en las células gliales de la sustancia blanca, astrocitos y oligodendrocitos (Pan y col., 2013).
En las fases tardías de la enfermedad, la desmielinización continúa avanzando a pesar de una clara disminución del ARN y antígeno viral a nivel del SNC. Así mismo, comienza a haber una fuerte respuesta inflamatoria humoral y celular, caracterizada por infiltración de células mononucleares y un aumento de las IgG. Por lo tanto, se han considerado mecanismos inmunopatogénicos dirigidos hacia antígenos propios como causa de la progresión del proceso desmielinizante (Alldinger y col., 1996).
El DC comparte similitudes en los cambios neuropatológicos con enfermedades desmielinizantes humanas, como por ejemplo la esclerosis múltiple (EM) (De Keyser y col., 2001; Scherer, 1994). Tal es así que médicos neuropatólogos como Scherer (1994) describieron el DC como la “esclerosis múltiple aguda de los caninos” (Amude y Alfieri, 2010). Por esta razón, esta enfermedad, ha sido utilizada como modelo animal de experimentación sobre EM (Baumgärtner y Alldinger, 2005).
La EM es una enfermedad inflamatoria crónica, que afecta a los humanos e involucra los tractos sensitivos, visuales, auditivos y motores tanto de forma clínica como subclínica. Afecta exclusivamente el SNC, no provocando lesiones a nivel del sistema nervioso periférico. En esta enfermedad la generación y propagación de los impulsos nerviosos se ven alteradas. Esto puede ocurrir por desmielinización, daño axonal, entre otros (Hardmeier y col., 2017). El diagnóstico de la misma se basa en los signos clínicos, hallazgos a través de resonancia magnética (RM), análisis del líquido cefalorraquídeo y técnicas electrofisiológicas (Schlaeger y col., 2012, 2016). La RM es el biomarcador más ampliamente utilizado en los ensayos con EM. Sin embargo, existe una baja correlación entre la progresión de la discapacidad una vez que el diagnóstico está establecido. Además, el valor predictivo de la RM es limitado (Barkhof, 2002). Los potenciales evocados pueden brindar información de la diseminación topográfica de lesiones del sistema nervioso, si bien permiten evaluar la funcionalidad del SNC, requieren integridad del sistema nervioso periférico para su correcta interpretación (Chiappa, 1997).
Un potencial evocado es una onda o variación de voltaje producida en el sistema nervioso por un estímulo sensorial. Dependiendo de la modalidad a estudiar, dicho estímulo puede ser táctil (para los potenciales evocados somatosensitivos), visual o auditivo. Las amplitudes y latencias de las ondas obtenidas proveen información sobre la capacidad funcional del sistema nervioso (Chiappa, 1980).
En la EM, se ha demostrado que existe una fuerte correlación entre las anormalidades encontradas en los potenciales evocados y los síntomas clínicos (Leocani y col., 2000) y que permiten detectar precozmente lesiones que se sospechan a nivel clínico (Djuric y col., 2010). Ramanathan y col. (2013) demostraron que las alteraciones en los potenciales evocados visuales y somatosensitivos, especialmente en el nervio tibial son un biomarcador neurofisiológico sólido a la hora de determinar lesiones subclínicas provocadas por la enfermedad. Esto resulta de suma importancia ya que entre un 70 y 80% de los pacientes con EM desarrollan una enfermedad progresiva, pero es difícil predecir cuales serán esos pacientes basándose únicamente en los síntomas clínicos (Fernández y col., 2015).
Antiguamente se consideraban los potenciales evocados visuales (PEV) como los más sensibles a la hora de confirmar un diagnóstico de EM. Sin embargo, Djuric y col. (2010) han demostrado que los potenciales evocados somatosensitivos (PESS) de los miembros pélvicos (principalmente el PESS del nervio tibial) superan la sensibilidad de los PEV.
La razón es que el PESS del nervio tibial evalúa los tractos ascendentes a través de todo el largo de la médula espinal, tronco encefálico y cerebro. Cuanto mayor sea el tejido atravesado, mayor es la probabilidad de que áreas afectadas por la enfermedad sean halladas (Bergknut y col., 2013; Chiappa, 1997).
No hemos encontrado trabajos que describan cómo se afectan los PE somatosensitivos en los caninos con Distemper. En nuestro país no contamos con resonador magnético para uso veterinario, por lo cual es importante desarrollar una herramienta más accesible que ayude a determinar la severidad de la enfermedad. Dadas las similitudes en la fisiopatología de la EM y el DC se planteó la hipótesis de que los PE somatosensitivos son afectados en esta última patología.
El objetivo de este trabajo fue determinar si existe alteración en la respuesta, tanto de la amplitud como en las latencias de los PESS del nervio tibial en caninos con Distemper.
Materiales y Métodos
Animales
Para este estudio se utilizaron 16 caninos, 8 hembras y 8 machos, con sintomatología clínica de Distemper que asistieron al hospital de Facultad de Veterinaria o que fueron derivados de clínicas privadas. La edad de los animales enfermos varió entre los 4 meses a los 5 años, ocurriendo en algunos casos desconocimiento de la edad del animal por parte del propietario. Se utilizaron como controles 6 caninos hembras, con una media de edad de 2 años. Se solicitó a los propietarios firmar un consentimiento informado de que los animales fueron parte de un proyecto de investigación. En los animales sanos se realizó un examen clínico completo previo a realizar los PESS con el fin de asegurar un buen estado sanitario.
El protocolo utilizado fue aprobado por la Comisión de Ética en el uso de Animales de la Facultad de Veterinaria, (CEUA-FVET-PI-138).
El diagnóstico de la enfermedad fue confirmado mediante un test de detección de antígeno mediante inmunocromatografía, de uso comercial (FASTest Distemper Diagnostik MEGACOR) utilizando secreciones nasales y oculares.
Con el fin de disminuir el estrés en los animales y los artefactos generados por movimiento los PESS fueron realizados bajo sedación con xilacina (1mg/kg) vía I/M.
Los PESS fueron obtenidos por estimulación del Nervio Tibial por medio de electrodos de agujas subdérmicas de 15 mm de longuitud (Akonic S.A., Argentina). Los mismos fueron colocados en forma subcutánea en la cara lateral del miembro a estimular tomando como referencia la vena safena colocando el ánodo distal por debajo de la misma. Los estímulos aplicados fueron pulsos cuadrados de 0,1 ms de duración a 5 Hz, con intensidad supra-máxima generados por un estimulador eléctrico (Akonic S.A.). Se obtuvieron registros a nivel espinal y craneal. Los potenciales a nivel espinal fueron adquiridos por medio de la colocación de dos electrodos, el electrodo activo cerca de la línea media a la altura del espacio intervertebral L7-S1, y un electrodo de referencia el cual se insertó en el proceso espinoso correspondiente a L7. Un electrodo de tierra fue colocado para cerrar el circuito (Meij y col., 2006; Pellegrino y Sica, 2005; Vanderzant y col., 1989). Los potenciales craneanos se registraron insertando el electrodo activo, en forma subcutánea a nivel de Fz (nomenclatura del sistema internacional 10-20 de colocación de electrodos) ya que en dicha región subyace al área somato-sensitiva correspondiente al miembro posterior (Uzuka y col., 1995). El electrodo de referencia se ubicó a nivel de la apófisis espinosa de la vértebra C1 (Chiappa, 1997; Uzuka y col., 1995) (Figura 1). Un cabezal de dos canales con interfase analógica digital de 16 bits se conectó a amplificadores y a un sistema de promediación de la señal (Akonic S.A. - Sistema Bio Pc, modelo CH 32- Buenos Aires, Argentina). En todos los registros se promediaron un total de 500 muestras. Los registros se obtuvieron con una amplificación que varió entre 0,625 y 2,5 µV/div. La señal fue filtrada con un filtro de alta y baja frecuencia 30 y 300 Hz respectivamente y una velocidad de barrido de 5 ms/ div. Los electrodos fueron siempre testeados para corroborar que poseían una impedancia menor a 5 kohms.
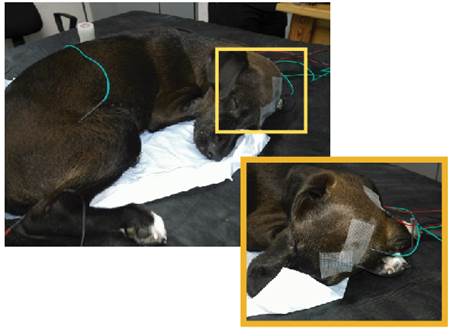
Figura 1: Colocación de electrodos para el registro craneal y electrodos de estimulación. En la imagen aumentada se observa localización del electrodo de registro (Fz) (negro), electrodo de tierra (Cz) (verde) y electrodo de referencia a nivel de la apófisis espinosa de C1 (rojo).
Se determinaron amplitud (distancia entre el valor máximo, positivo o negativo, a la línea de base) y latencia (tiempo transcurrido entre la aplicación del estímulo y el pico o valle máximo) de las ondas obtenidas; P1, N1 y P2 en el registro craneal y N1, P1, N2, P2 en el registro espinal.
Se determinaron amplitud y latencia de las ondas obtenidas, P1, N1 y P2 en el registro craneal y N1, P1, N2, P2 en el registro espinal.
Resultados
Se obtuvieron datos de amplitudes y latencias de las ondas que conforman los potenciales evocados somatosensitivos tanto a nivel espinal como craneal. En la Figura 2 se muestra un registro de un animal sano y uno con DC.
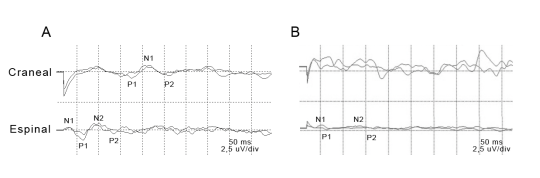
Figura 2: Ejemplos representativos de registros de PESS craneal (Cr.) y espinal (Esp.) de un canino normal (A) y de un canino con Distemper (B). Se puede apreciar a simple vista una disminución de la amplitud, así como un incremento de la latencia de las ondas en el canino enfermo a nivel espinal, así como una desaparición de los potenciales evocados a nivel craneano.
En cuanto a las latencias (Figura 3), a nivel craneano, se observó un incremento significativo de la latencia de P1 en el miembro posterior izquierdo (MPI), siendo la media y el desvío estándar de los animales controles 18,4 ± 3,5, y la de los animales enfermos 24,8 ± 5,8 ms (W (6,16)= 34, p= 0,02). Así mismo, existió una tendencia al aumento de las latencias de N1; W(6,16)= 39,5, p=0,07 y de P2; W(6,16)= 37, p= 0,06. En el miembro posterior derecho (MPD) no se observaron diferencias entre los individuos controles y los enfermos. A nivel espinal, no se observaron cambios significativos.
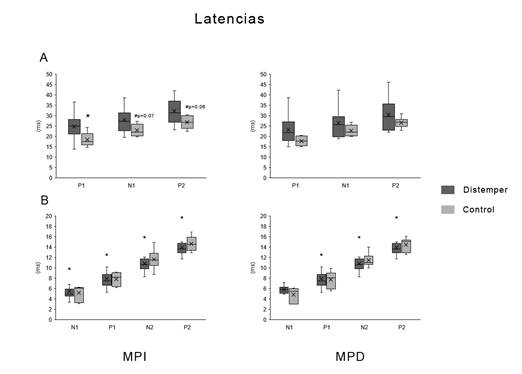
Figura 3: Diagrama de cajas y bigotes de las latencias de las distintas ondas que componen los PESS. A: Craneal. B: Espinal. * diferencias significativas (p <0,05) # indica tendencia. Los puntos indican valores extremos (outliers). MPI: Miembro posterior izquierdo; MPD: Miembro posterior derecho.
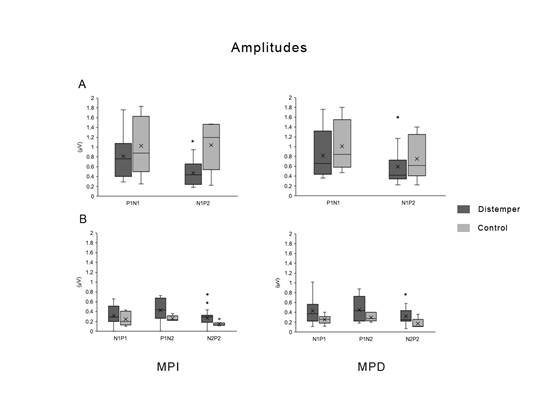
Al respecto de las amplitudes de los PESS (Figura 4), nuevamente a nivel craneal, las diferencias significativas fueron observadas al estimular el miembro izquierdo y no así el derecho. A nivel craneano, existió una disminución de la amplitud N1-P2 siendo la media y el desvío de los controles 1,03 ± 0,61 µV y 0,81 ± 0,46 µV (W (6,16)= 86, p= 0,02) la de los animales afectados. A nivel espinal, existió un aumento de la amplitud N2-P2 tanto en MPI (W (6,16)= 28 , p= 0,02) como en el MPD (W (6,16)= 35, p= 0,03).
Discusión
En este trabajo se demostró que los PESS difieren en los caninos con DC con respecto a los caninos sanos. La principal alteración ocurre en el potencial craneal. Por un lado, existió un aumento de la latencia de la primera onda positiva (P1) y por otro, una disminución de la amplitud N1-P2. Ambas alteraciones ocurrieron al estimular el MPI, no así en el MPD. De todas maneras, al estimular el MPD el comportamiento de las ondas fue similar al izquierdo, creemos que, aumentando el número de animales estudiados, las variaciones ocurridas podrían aparecer en ambos miembros. Sin embargo, existe un reporte en humanos que establece que en la EM los individuos afectados presentan diferencias en las latencias de los potenciales evocados por estimulación del nervio mediano en los miembros torácicos derechos e izquierdos (Cowan y col., 1984; Lehmann y col., 1979), por lo cual el resultado obtenido en este trabajo puede que se mantenga incluso incrementando el número de animales.
El incremento de la latencia en los potenciales era de esperar dado la similitud de esta enfermedad con la EM de los humanos. En la EM ha sido demostrado que ocurre un aumento en la latencia de las ondas, tanto en los potenciales del nervio tibial así como en los del mediano y peroneo (Comi y col., 1999; Leocani y col., 2000; Rossini y col., 1985; J. C. Walsh y col., 1982). Se ha asociado el retraso en la latencia de los PESS con trastornos de la mielinización (Comi y col., 1999). El virus del DC provoca infección de los oligodendrocitos lo que lleva a lesión de las vainas de mielina y vacuolización de la sustancia blanca. Asimismo, en la etapa crónica de la infección ocurre una reacción inflamatoria en las lesiones desmielinizantes lo que lleva a una progresión del daño en el tejido (Schobesberger y col., 2002). Por lo tanto, el incremento de la latencia de la P1 de los potenciales craneales obtenido en este trabajo está de acuerdo con lo esperable de acuerdo con los conocimientos de la fisiopatología de esta enfermedad y de su similitud con la EM de los humanos.
De acuerdo al presente trabajo podríamos obtener un diagnóstico precoz de las lesiones neurológicas, dado que, muchas veces los síntomas relacionados con afección del sistema nervioso de los pacientes con DC aparecen más tardíamente que los síntomas en otros sistemas. Por lo tanto, la realización de estos estudios podrían ser una herramienta para detectar lesiones de sustancia blanca aún subclínicas. Sin embargo, todavía es necesario realizar PESS en un número mayor de animales sanos para definir tablas de normalidad. Esto es de suma importancia dado que para aseverar que un animal presenta una anormalidad en un PESS, es necesario que la latencia o la amplitud del mismo se aleje 2 desvíos estándares de la media establecida en dichas tablas (Van Dijk y col., 1992).
En cuanto a los potenciales espinales, si bien se observó una tendencia al aumento de la latencia de la onda N1, no hubo cambios significativos. Consideramos que sería apropiado aumentar el número de animales con el fin de disminuir la variabilidad y evaluar si esas tendencias se vuelven significativas. De todas formas, en la EM se ha visto mayor incidencia de alteraciones en los registros craneanos que en los espinales (Rossini y col., 1985), lo cual puede ser debido a que la señal eléctrica debe recorrer mayores distancias para alcanzar el encéfalo, y además en estas patologías las lesiones se limitan al SNC y no a los nervios periféricos (Eisen y Odusote, 1980).
Se observó una disminución de la amplitud de los PESS a nivel craneano, lo cual concuerda con resultados obtenidos en pacientes con EM (Matthews y col., 1977; Small y col., 1978). Se considera que la reducción de la amplitud de los PESS está relacionada con daño a nivel axonal y pérdida de fibras nerviosas; al estimular las fibras restantes se genera un potencial evocado de menor amplitud (Thamer y col., 2014; Walsh y col., 2005). Sin embargo, la amplitud de los PESS suele presentar alta variabilidad inter individuos y por lo tanto no es considerada un marcador tan fiable de lesión como lo es el aumento de la latencia (Chiappa, 1997; Walsh y col., 2005).
Por otra parte, se observó un incremento de la amplitud N2-P2 a nivel espinal. Este resultado no era esperado dado que en los reportes de alteraciones de potenciales evocados debido a lesiones en la conducción nerviosa suele ocurrir un incremento de latencia y una disminución de la amplitud. Existe un reporte en el que se demuestra que la disminución de la temperatura corporal puede aumentar la latencia de los potenciales evocados, pero con disminución de la amplitud de los mismos; estos autores plantean que ese incremento de amplitud puede deberse a que el retardo en la conducción genera una liberación prolongada de neurotransmisores lo que podría provocar una superposición de los potenciales individuales (Gagliardo y col., 2007). Esto nos permite plantear la hipótesis de que, si en el Distemper canino las lesiones ocurrieron principalmente a nivel de la mielina y no a nivel axonal, la conducción nerviosa hacia la médula espinal se vio retardada provocando esta posible superposición de potenciales individuales dando una onda N2-P2 de mayor amplitud. Sin embargo, el mecanismo por el cual ocurrió ese aumento de amplitud debe ser estudiado en profundidad.
Conclusiones
Las características de los potenciales evocados somatosensitivos del nervio tibial en caninos con Distemper difieren de los animales sanos.
Por lo tanto, consideramos los PESS una herramienta útil en el diagnóstico de lesiones a nivel del SNC de los pacientes con Distemper canino, y planteamos como perspectiva un estudio donde se correlacionen las alteraciones es estos potenciales con la sintomatología clínica y el curso de la enfermedad con el fin de contar con una base de datos sólida para predecir la evolución que podrán tener animales enfermos. Así mismo, consideramos que son una herramienta de utilidad para evaluar mejoras a nivel subclínico en pacientes que se encuentren con diversos grados de paresia o parálisis. En estos pacientes las mejorías pueden tardar varios meses y sería de gran utilidad contar con técnicas de diagnóstico que permitan controlar la evolución del animal a lo largo del tiempo.