Introducción
Los tripanosomas de mamíferos (incluido el humano) parasitan sangre y en ocasiones tejidos de estos hospedadores. Son protozoos que pertenecen al orden Kinetoplastida, familia Trypanosomatidae, género Trypanosoma. Son parásitos digenéticos, que cumplen su ciclo de vida en dos hospedadores, un animal vertebrado como hospedador final y diversos invertebrados como hospedadores intermediarios (Aguilar y col., 2002). Los tripanosomas de interés médico-veterinario se agrupan en 2 secciones: Stercoraria, los cuales se desarrollan en la parte posterior del tracto digestivo de los insectos, como por ejemplo Trypanosoma cruzi, responsable de la enfermedad de Chagas, y Salivaria que se desarrollan en la parte anterior del tracto digestivo de insectos (Coura y Borges-Pereira, 2010; Desquesnes y col., 2013). Dentro de los salivarios con importancia sanitaria en América del Sur se encuentran: Trypanosoma evansi, Trypanosoma vivax y Trypanosoma equiperdum.
La tripanosomiasis causada por T. evansi es comúnmente conocida como surra o mal de las caderas, o también como murrina y derrengadera, y afecta una amplia diversidad de mamíferos (CFSPH, 2009; OIE, 2018), siendo potencial zoonótico en el hombre, con un caso reportado en India (Joshi y col., 2005).
Esta especie puede parasitar a la mayoría de los mamíferos domésticos, siendo caballos, perros, camellos y bovinos las especies que enferman con mayor gravedad. Además, también son parasitados una amplia variedad de animales silvestres como por ejemplo el carpincho (Hydrochoerus hydrochaeris) en Sudamérica, el cual es considerado un reservorio (Wells, 1984; CFSPH, 2009; OIE, 2018).
Trypanosoma evansi se encuentra distribuido en regiones tropicales y subtropicales en varios continentes y es transmitido principalmente de forma mecánica por la alimentación de insectos hematófagos como tábanos y moscas del género Stomoxys. Además se ha mencionado la transmisión iatrogénica por agujas o instrumentos quirúrgicos, transmisión oral por lamidos, peleas o por la alimentación de tejidos y sangre infectada, así como por la mordida de murciélagos hematófagos en América. Así mismo, también es posible la transmisión por la leche y por vía venérea (Raina y col., 1985, Singh y col., 2000; CFSPH, 2009; OIE, 2018).
En caninos T. evansi causa una grave enfermedad anemizante. Cuando transcurre en su período agudo provoca fiebre intermitente, inapetencia, caquexia, edemas subcutáneos, letargia, ceguera y alteraciones en la homeostasis. Por otro lado, en su fase crónica hay compromiso del estado general del animal con reagudización de los síntomas (Braccini y col., 2005; Correa-Salgado y col., 2010). En Uruguay, la enfermedad ha sido recientemente reportada en un perro de raza Cimarrón de la ciudad de Rivera, a partir del cual se realizó la caracterización molecular y aislamiento de T. evansi, demostrando la expansión del parásito en nuestro continente (Greif y col., 2018).
El diagnóstico de esta enfermedad se realiza principalmente en base a síntomas clínicos, frotis de sangre y PCR. Otros análisis paraclínicos como hemograma completo, funcional hepático y renal también ayudan a orientar el diagnóstico. Esta tripanosomiasis es de alta letalidad si no se tratan los animales en fases tempranas de la enfermedad (Seidl y col., 2001). La droga de elección utilizada para su tratamiento es Aceturato de Diminaceno a dosis de 3,5-7,0 mg/kg intramuscular (Peregrine, 1994).
En el presente trabajo se reporta el diagnóstico de dos casos fatales de tripanosomiasis canina por T. evansi en perros provenientes de dos localidades del Departamento de Artigas en el noroeste de Uruguay.
Materiales y métodos
Animales del estudio
Dos caninos, un macho (canino 1) de 3 años (28kg) procedente de la ciudad de Bella Unión (30°15’40’’S; 54°36’21’’O) y una hembra (canino 2) de 2 años (25kg) de pueblo Cuareim (30°13’30’’S; 57°34’05’’O), localidades que pertenecen al Departamento de Artigas. Ambos animales eran de raza cruza y utilizados para la caza de jabalí (Sus scrofa). Dicho caninos comenzaron a presentar signos de enfermedad en los meses de setiembre (canino 1) y noviembre (canino 2) del año 2017. Ante el desmejoramiento progresivo de los animales, ambos perros fueron remitidos a una clínica veterinaria particular de la ciudad de Bella Unión, donde se les realizó un examen clínico general.
Toma de muestras y análisis paraclínicos
En la clínica se les tomó muestras de sangre con y sin anticoagulante de forma aséptica. Las mismas fueron remitidas para posterior remisión al Laboratorio Clínico Veterinario (Laclivet) en Montevideo para realizar frotis de sangre, hemograma completo en ambos animales y bioquímica al canino 1. Una alícuota de sangre con anticoagulante fue remitida al Laboratorio de Vectores y enfermedades transmitidas (LVyET), CENUR Litoral Norte-Salto, UdelaR, para realizar el diagnóstico molecular.
También se obtuvieron muestras de sangre con anticoagulante de perros que convivían con los dos anteriormente mencionados y realizaban las mismas actividades de cacería. Cuatro perros proceden de la ciudad de Bella Unión y cinco de pueblo Cuareim.
Frotis, coloración, morfologías parasitarias
Con la sangre (2 animales enfermos + 9 animales compañeros) se realizaron frotis finos por extensión, fueron fijados con alcohol metílico durante 5 minutos y coloreados con Giemsa durante 2 horas. La visualización de los frotis se realizó bajo objetivo 100x de inmersión. Una vez visualizado el parásito se procedió a la descripción morfométrica de 30 ejemplares.
Extracción de ADN, PCR y secuenciación
La extracción de ADN se llevó a cabo utilizando un kit comercial PureLink®Genomic DNA Mini Kit (Invitrogen, Alemania) a partir de 200 µl de sangre fresca siguiendo las instrucciones del fabricante. La concentración de ADN fue cuantificada con un espectrofotómetro Nanodrop 2000 (ThermoScientific). Con el ADN obtenido se realizaron tres PCRs para tripanosomátidos. La primera reacción amplifica una porción de 800 a 900 pb del gen ARNr 18S (Maia da Silva y col., 2004; Ramírez y col., 2012) y fue realizada a todos los perros muestreados (2 animales enfermos + 9 animales compañeros) utilizando los primers 609 F y 706 R (Tabla 1). Como control positivo para esta PCR se utilizó una muestra de ADN de Leishmania infantum.
Posteriormente se realizaron otras dos PCRs que amplificaron fragmentos solapantes de la región del espaciador transcrito interno (ITS1 + 5,8S + ITS2), las cuales se realizaron únicamente a las muestras de los perros clínicamente enfermos (2). En la primera de ellas se utilizaron los primers IR1 - IR2, mientras que en la segunda se emplearon los primers ITS1 CF - ITS1 BR. Los primeros amplifican 1000 a 1200 pb y los segundos 480 pb (Tabla 1) (Cupolillo y col., 1995; Njiru y col., 2005). El control positivo para ambas PCRs fue Trypanosoma sp.
El producto resultante de cada PCR se visualizó utilizando un transiluminador UV inmediatamente luego de una corrida de electroforesis en gel de agarosa al 1,5%, conteniendo un intercalante GoodView® Nucleic Acid Stain (Beijing SBS Genetech Co., LTd). Los amplicones de tamaño esperado fueron purificados mediante el kit comercial PureLink® Quick PCR Purification kit (Invitrogen, Alemania) y enviados a secuenciar al Instituto Pasteur Montevideo (Uruguay) y Macrogen (Corea del Sur). Las secuencias obtenidas fueron editadas y ensambladas utilizando el programa MEGA 7 (Kumar y col., 2016). Para la determinación de las homologías se compararon con secuencias disponibles en el GenBank mediante la búsqueda BLASTn (http://www.ncbi.nlm.nih.gov/BLAST).
Resultados
Signos clínicos
Ambos animales presentaron signos similares como decaimiento, inapetencia, linfoadenopatía de ganglios mandibulares, pre-escapulares y poplíteos, adelgazamiento progresivo, salivación, mucosas pálidas, temperatura entre 39,5°C y 39,8°C, secreciones oculares, edemas en zona ocular, oral y más marcado en miembros posteriores. El cuadro clínico en ambos casos fue de larga evolución, durando aproximadamente un mes hasta la muerte de ambos animales. Los dos casos fueron reportados a la OIE (Organización Mundial de Sanidad Animal).
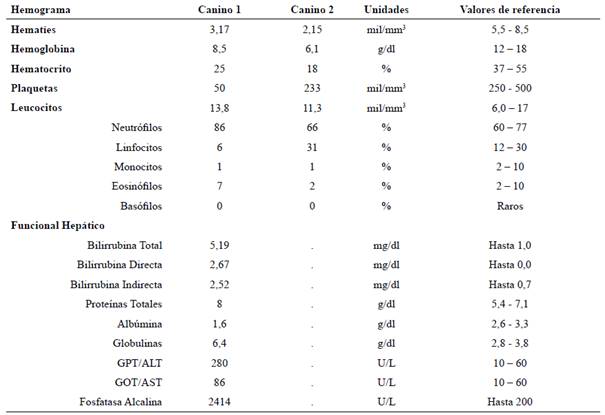
Datos hematológicos y bioquímicos
En el hemograma se visualizó una marcada anemia hipocrómica en ambos caninos, con trombocitopenia marcada en el canino 1 (Tabla 2). Al canino 1 además se le realizó un funcional hepático, obteniendo como resultados: concentraciones elevadas de bilirrubina total, directa e indirecta, relación albumina/globulina disminuida, proteínas totales aumentadas, y los perfiles enzimáticos de GPT, GOT y fosfatasa alcalina aumentados (Tabla 2).
Frotis y morfometría de parásitos
En la observación microscópica de los 11 extendidos de sangre, solo en los dos perros clínicamente enfermos se observaron morfologías parasitarias compatibles con tripomastigotes de Trypanosoma sp. (Figura 1). Los mismos poseen un cuerpo ahusado, alargado, de forma tortuosa, con extenso flagelo y núcleo redondeado y central. Las dimensiones tomadas sobre 30 ejemplares por cada perro promediaron 23,3 µm ± 3,4 (min. 17,08 - máx. 29,28) de largo. En los frotis observados de los perros muestreados sin sintomatología no se visualizaron formas parasitarias.
Diagnóstico por PCR y secuenciación
Ambas muestras de los perros clínicamente enfermos fueron positivas tanto para la PCR que amplifica el gen ARNr 18S (Figura 2) como las PCRs que amplificaron los fragmentos solapantes de ambas ITS (Figura 3). Mientras que la PCR que amplifica el gen ARNr 18S en los animales sanos que convivían con los enfermos fueron negativas. De las secuencias editadas se obtuvieron fragmentos de 721pb para el gen ARNr 18S, 1000 y 400 pb para la región ITS. Las secuencias parciales obtenidas de la región ITS se ensamblaron formando una secuencia final de 1175 pb.
El análisis a través de la herramienta BLASTn demostró que las secuencias obtenidas para el gen ARNr 18S tienen una homología del 100% con secuencias correspondientes a T. evansi y T. brucei. Por otro lado, las secuencias ensambladas de los genes ITS tienen una homología del 99% con secuencias correspondientes a T. evansi.
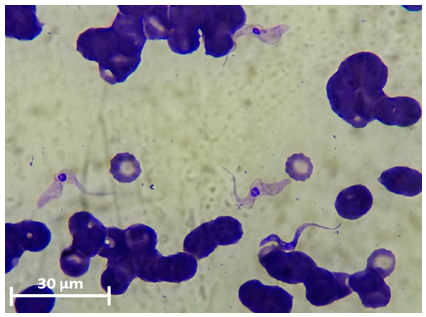
Figura 1: Tripomastigotos de Trypanosoma sp. en frotis de sangre de canino 1 coloreado con Giemsa. Escala = 30 µm (100x).
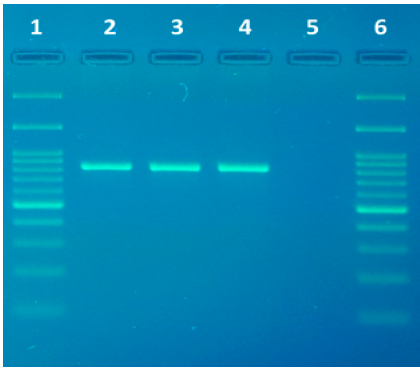
Figura 2: Gel de electroforesis mostrando los amplicones obtenidos luego de la reacción de PCR para amplificar un fragmento del gen ARNr 18S de tripanosomátidos (tamaño de banda esperada ~900 pb). Carril 1 y 6: marcador de peso molecular (100-1500 pb); carril 2: canino 1; carril 3: canino 2; carril 4: control positivo; carril 5: control negativo.
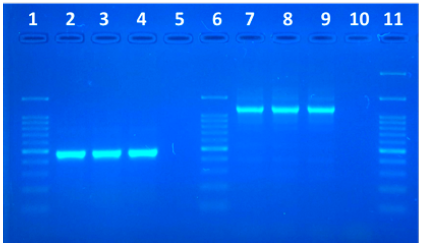
Figura 3: Gel de electroforesis mostrando los amplicones obtenidos luego de las reacciones de PCRs utilizados para detección de las regiones ITS. Carril 1 y 6: marcador de peso molecular (100-1500 pb), carril 2: canino 1, carril 3: canino 2, carril 4: control positivo, carril 5: control negativo (para los primers ITS1 CF y ITS1 BR, tamaño de banda esperada 480 pares de bases), carril, carril 7: canino 1, carril 8: canino 2, carril 9: control positivo, carril 10: control negativo (para los primers IR1 y IR2) tamaño de banda esperada 1000 a 1200 pb), carril 11: marcador de peso molecular (100-3000 pb).
Discusión
La tripanosomiasis causada por T. evansi es una importante enfermedad que afecta mamíferos domésticos y silvestres en regiones tropicales y subtropicales (CFSPH, 2009). El perro es una de las especies que puede ser seriamente afectada, en el cual predomina un cuadro anemizante, acompañado de fiebre, edema en zona ocular, letargia y adenomegalia generalizada, signos observados en los animales de este estudio y lo reportado por Greif y col. (2018). En el hemograma de ambos perros clínicamente enfermos de este estudio, se constató marcada anemia hipocrómica y trombocitopenia, lo cual es frecuentemente reportado en casos clínicos similares causados por este parásito (Silva y col., 1995). Las posibles causas para la anemia incluyen, supresión eritropoyética, hemodilución, hemólisis y acción directa de los parásitos (Brandão y col., 2002). En cuanto a la trombocitopenia en los perros parasitados, Jain (1993) menciona que es debida a la disminución de la sobrevida de las plaquetas.
Durante el período agudo los animales enfermos presentaron fiebre intermitente, inapetencia, caquexia, edemas subcutáneos, letargia, ceguera y alteraciones en la homeostasis, signos semejantes reportados por Braccini y col. (2005). Por otro lado, en su fase crónica hay compromiso del estado general del animal con reagudización de los síntomas (Braccini y col., 2005; Correa-Salgado y col., 2010). En cuanto a las alteraciones bioquímicas observadas en el canino 1, el aumento de la AST/ALT y Fosfatasa alcalina, probablemente se deba a una necrosis de los hepatocitos por hipoxia, y el aumento de bilirrubina causado por la hemólisis (Meyer y col., 1992). Tanto los signos clínicos como los resultados de los análisis paraclínicos nos indican que los animales estaban cursando la fase crónica de la enfermedad (Brandão y col., 2002). Los perros que enfermaron murieron, coincidiendo con los datos reportados para esta enfermedad que presenta alta letalidad (Seidl y col., 2001).
Desde el punto de vista epidemiológico, ambos casos deben ser considerados autóctonos ya que los caninos eran nacidos y residentes de ambas localidades y sin reportes que hayan salido del país. Según datos recabados, ambos perros eran utilizados para la caza de jabalí en desembocaduras de arroyos en el río Cuareim.
Es probable que la transmisión en ambos casos se produjera durante las cacerías en los montes mediante la picadura de dípteros como tábanos (transmisión mecánica), los cuales son comunes en estos ambientes (Raina y col., 1985). Además, algunos animales silvestres como el carpincho pueden actuar como reservorios, los cuales podrían ser la fuente de infección ya que es una especie presente en esos montes y frecuentemente cazada (Wells, 1984; CFSPH, 2009; OIE, 2018). El resto de los perros muestreados que integraban el grupo de caza junto a los clínicamente enfermos resultaron negativos tanto en los frotis sanguíneos como las PCRs. Teniendo en cuenta que los animales convivían en la misma casa y practicaban las mismas actividades, es probable que la transmisión fuera individual en cada caso mediante la picadura de un díptero insecto hematófago infectado, ya que si fuera por la ingestión de carne o vísceras de algún animal portador del hemoparásito se hubiesen enfermado más perros (Raina y col., 1985; Singh y col., 2000).
En cuanto a la distribución de la enfermedad, en la región se han reportado casos en perros en Los Charrúas, Provincia de Entre Ríos en Argentina (Bono Battistoni y col., 2016) y en Uruguayana, Santana do Livramento y Santa María, tres localidades del Estado de Rio Grande do Sul en Brasil (Braccini y col., 2005; Franciscato y col., 2007; Guim y col., 2013). Para Uruguay la enfermedad ha sido recientemente reportada en un perro de la ciudad de Rivera a partir del cual se realizó la caracterización molecular y aislamiento del parásito (Greif y col., 2018). Por lo tanto, es de esperar que se produzcan nuevos casos en la región.
Como diagnóstico, la visualización de los tripomastigotes de Trypanosoma sp. en los frotis de sangre continúa siendo una forma rápida y económica de realizarlo, en este estudio la longitud promedio fue de 23.3 µm, siendo medidas semejantes a las reportadas por Aguilar y col. (2002). Si además de la observación microscópica se la complementa con técnicas de biología molecular como la PCR, la cual ha demostrado ser una técnica de alta sensibilidad, será de gran ayuda al momento de confirmar esta enfermedad en determinadas regiones o zonas donde no se había registrado anteriormente (Masiga y col., 1992; Desquesnes y Dávila, 2002; Maia da Silva y col., 2004; Njiru y col., 2005; Fernández y col., 2009; Greif y col., 2018).
Es importante destacar que T. evansi pertenece el subgénero Trypanozoon y dentro del clado Trypanosoma brucei que incluye cinco tripanosomas genéticamente muy similares: Trypanosoma brucei brucei, que causa nagana en mamíferos no humanos en la región sub-Sahara de África (Finelle, 1983), Trypanosoma brucei gambienseyTrypanosoma brucei rhodesiense, que causan el mal del sueño en humanos en la región sub-Sahara de África (Simarro y col., 2010), Trypanosoma equiperdum, que causa durina en equinos de vida salvaje (Zablotskij y col., 2003) yT. evansi, causante de surra (mal de cadeiras en Brazil, mal de caderas en Argentina, derrengadera en Venezuela y murrina en América Central) en mamíferos de la región tropical y subtropical (Desquesnes y col., 2013). Es por esto que las secuencias de los animales de este estudio tienen similares homologías con secuencias de T. brucei y T. equiperdum. Lo mismo sucede con la morfología parasitaria, ya que los tripomastigotos de T. evansi, T. brucei y T. equiperdum son indiferenciables (Brun y col., 1998). Por lo tanto es muy importante acompañar el diagnóstico “morfológico” con la situación epidemiológica, ya que por ejemplo T. brucei necesita de las moscas hematófagas tse-tse (Glossina spp.) para su trasmisión y solo se encuentra en África (Masiga y col., 1992), por otro lado T. equiperdum causa una tripanosomiasis que afecta principalmente a equinos y es de trasmisión venérea (Zablotskij y col., 2003). Por otro lado, T. evansi causa importantes pérdidas por mortalidad en equinos, reportado por Seidl y col. (2001), en la zona del Pantanal, Brasil, lo cual se debe estar alerta por eventuales focos de esta enfermedad.