Introducción
Las células madre mesenquimales (CMM), conocidas en la literatura internacional como MSCs (del inglés, mesenchymal stem cells), son una población proveniente de varios tejidos de individuos adultos y anexos embrionarios que tiene la capacidad de diferenciarse en células del linaje mesodérmico (mutipotencialidad) como: adiposo, cartilaginoso, óseo, músculo estriado (Bourin y col., 2013). Una de las fuentes más populares para la obtención de CMM es el tejido adiposo (TA), debido a su fácil extracción y gran cantidad de células obtenidas (Strem y col., 2005). En el caso de caninos y felinos la extracción generalmente es realizada por biopsia de la zona abdominal a nivel subcutáneo o visceral (Gómez y col., 2015; Guercio y col., 2013; Requicha y col., 2012). En cambio, en equinos la extracción es realizada en la mayoría de las descripciones a nivel subcutáneo en la base de la cola (Alipour y col., 2015; Vidal y col., 2007).
Una vez aisladas las células del TA deben cumplir con ciertos criterios internacionalmente aceptados para poder denominarse como CMM, para humanos deben presentar adherencia al plástico, poseer morfología fibroblástica, presentar determinados marcadores de superficie y poseer la capacidad de tridiferenciarse in vitro en los linajes: adiposo, cartilaginoso y óseo, en cambio en animales domésticos las exigencias son menores (Bourin y col., 2013). Por último, a nivel nacional en medicina veterinaria, hay escasas descripciones y/o incompleta caracterización de las CMM-TA en caninos (Yaneselli y col., 2013; Yaneselli y col., 2018), en equinos (Fernández y Ríos, 2016) y en felinos (Algorta y col., 2017). Por lo tanto, surge el objetivo del presente trabajo de aislar y caracterizar in vitro las CMM-TA de caninos, equinos y felinos.
Materiales y métodos
Extracción de TA
a) Caninos y Felinos
Se utilizaron como donantes 5 caninos (Canis familiaris) y 6 felinos (Felis catus), el TA fue obtenido de hembras saludables, destinadas a ovariectomía de rutina, raza mestiza, edad de 1-5 años. Luego de la incisión de piel, se retiraron 0,5-4 gramos de TA de origen subcutáneo y luego de atravesar los planos musculares se colectó de origen visceral (zona periovárica y/o intrabdominal). El TA fue depositado en tubos estériles con el medio de trasporte (MT): Dulbecco's Modified Eagle's medium(DMEM) bajo en glucosa, 10% suero fetal bovino (SFB) y 2% antibiótico (penicilina/estreptomicina) y procesado en un tiempo máximo de 24 h. El protocolo de extracción contó con la previa autorización de la Comisión de Ética en Uso de Animales (CEUA), CEUAFVET PI Nº 13/12 y CEUA n° 144.
b) Equinos
Fueron tomadas 4 muestras post-mortem de equinos (Equus caballus) adultos saludables sacrificados con destino a frigorífico. Cuando se obtenía la media res, resultante del proceso de faena, se tomó una muestra de la zona posterior en la base de cola. La toma de muestra se realizó con pinza y tijera quirúrgica estéril, tomando entre 5-10 gramos de TA y transportado bajo refrigeración (4-8 °C) en tubo estéril con MT y procesada en un tiempo máximo de 24 h.
Aislamiento de CMM-TA
El protocolo fue adaptado de lo descrito por Yaneselli (Yaneselli y col., 2018), brevemente, el TA se cortó en trozos con pinza y tijera estéril, lavado dos veces con solución tampón fosfato salino. Luego, fue sometido a una digestión enzimática durante 20-40 minutos a 37 °C en una solución de DMEM bajo en glucosa con 0,1 mg/ml de colagenasa tipo I. Posteriormente, se centrifugó a 700g durante 10 minutos, y por último, el pellet se resuspendió y sembró en un frasco de cultivo T25. El medio de crecimiento (MC) para el asilamiento utilizado fue compuesto por DMEM bajo en glucosa, 20% suero fetal bovino (SFB) y 2% antibiótico (penicilina/estreptomicina).
Cultivo y criopreservación de las CMM
Las células fueron sembradas en botellas de cultivo con MC e incubadas a 37ºC con 5% de CO2. Diariamente se evaluó la morfología y el crecimiento celular, cada 48 h se cambió el MC. Cuando llegaron al 80-90% de confluencia se realizaron sucesivos pasajes hasta el cuarto (P4). El MC para los P1-P4 tenía una concentración de SFB diferente según la especie, en caninos y equinos se utilizó un 10% y 15% para felinos. Para la criopreservación, las células una vez que alcanzaban una confluencia de 80-90% fueron levantadas con tripsina-EDTA y contadas, centrifugadas a 700 g durante 10 min, posteriormente resuspendidas en 1 mL del medio de criopreservación compuesto por: 95% de SFB y un 5% de dimetilsulfóxido (DMSO) y almacenadas a -80°C.
Caracterización de las CMM
a) Unidades formadoras de colonias fibroblastoides (UFC-F)
Para comprobar el poder clonogénico de las CMM-TA entre los P2-P4, las mismas fueron sembradas a una concentración de 1 x103 células/hoyo, por triplicado, en placas de cultivo celular de 6 hoyos, adaptado del protocolo de Guercio (Guercio y col., 2013). Se utilizó el MC correspondiente para cada especie y cada 3 o 4 días se realizaba el cambio de medio. Transcurridas las 2 semanas los cultivos fueron fijados con metanol frío (-20 °C) y teñidos con Giemsa.
b) Tridifereciación in vitro
Las CMM-TA entre P2-P4 fueron sembradas a una concentración de 9,4 x103 células/hoyo en placas de cultivo celular de 24 hoyos, por duplicado. Después de 24-48 horas de siembra se cambia el MC sin antibiótico. Fueron mantenidas por 3 semanas con los medios de inducción y se realizaron los cambio de medio cada 3-4 días, además se sembraron controles negativos (sin inducir) con el MC utilizado para la propagación in vitro. Por último, una vez terminado el periodo de inducción las células eran fijadas con 4% de paraformaldehído y teñidas con Oil Red O, Alcian Blue o Alizarin Red S, dependiendo a que linaje fueron inducidas.
Los medios de inducción a linaje adipogénico, condrogénico y osteogénico fueron adaptados de lo descrito por Yaneselli (Yaneselli y col., 2018), para caninos, Alipour (Alipour y col., 2015), para equinos y para felinos lo descrito por Quimby (Quimby y col., 2013).
Resultados
Aislamiento, propagación in vitro y criopreservación de las CMM-TA
Fue posible aislar y propagar in vitro las CMM-TA de todas las muestras de caninos, equinos y felinos. Al inicio del cultivo se encuentra baja cantidad de células con morfología fibroblástica y adherentes al plástico (Figura 1, A-C). A los 4-5 días, las primeras células adherentes comienzan a multiplicarse y a la semana llegaban a un 70-80% de confluencia, realizándose el pasaje celular a una superficie de cultivo mayor. Se consiguieron criopreservar CMM-TA de todas las especies entre los P2-P4 con una concentración de 0,5-1 x106/mL.
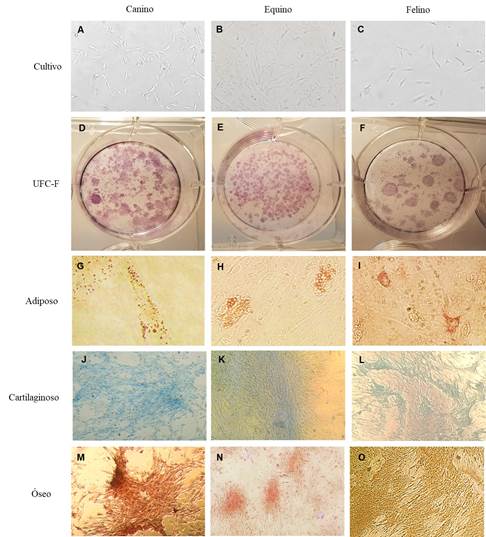
Figura 1: Imagen microscópica del cultivo celular de las CMM-TA 40x de las especies: A canina, B equina y C felina. Imagen macroscópica de UFC-F: D, E y F de las tres especies, respectivamente. Imagen microscópica de la prueba de tridiferenciación in vitro de las CMM-TA provenientes de caninos, equinos y felinos: G, H y I: diferenciación adipogénica 200x con la presencia de vacuolas lipídicas; J, K y L: diferenciación condrogénica 40x; M, N y O: diferenciación osteogénica 40x.
Caracterización de las CMM-TA
Las CMM-TA presentaron la capacidad de formar colonias, lo cual se pudo ver en la prueba de UFC-F para todas las especies (Figura 1, D-F). Además, se observó que las células poseían la capacidad de diferenciarse in vitro en los linajes: adiposo, cartilaginoso y óseo (Figura 1, G-O). En la inducción adiposa fue observada una diferencia morfológica en las primeras semanas con presencia de vacuolas. Posteriormente, al finalizar la inducción fue confirmada la diferenciación (positivas a Oil Red O) observando la presencia de gotas lipídicas intracitoplasmáticas, indicando la diferenciación a pre-adipocito (Figura 1, G-I). Para el linaje cartilaginoso se pudo observar posterior a la inducción, la coloración azulada, positiva a Alcian Blue, que indicó la formación de matriz cartilaginosa (Figura 1, J-L). El linaje óseo en las primeras semanas de inducción se pudo observar cambios morfológicos y formación de matriz extracelular, que luego de la inducción se confirmó con la tinción roja (positiva a Alizarin Red S) la síntesis de matriz mineralizada (Figura 1, M-O).
Discusión
En nuestro trabajo fue posible el aislamiento y caracterización de CMM-TA de las fuentes subcutánea y visceral de caninos y felinos, coincidiendo con otros autores (Arzi y col., 2016; Clark y col., 2017; Guercio y col., 2013). El TA es una fuente de células muy atractiva debido a que los donantes son animales jóvenes, sanos y la ovariectomía es una cirugía de rutina. Asimismo, en equinos fue posible aislar CMM-TA de la base de la cola (región supraglútea) al igual que otros autores (Alipour y col., 2015; Vidal y col., 2007). Sin embargo, en nuestro trabajo la extracción de TA hecha post-mortem (animales destinados a faena) tiene la ventaja de no tener que disponer de donantes vivos.
Las células aisladas consiguieron adherirse al plástico, proliferar in vitro y se pudo comprobar su capacidad clonogénica a través de la prueba UFC-F para las tres especies. Coincidiendo con Friedensetin (Friedenstein y col., 1970), quienes destacaron esas características en su descubrimiento. Además, otros autores también han descrito este comportamiento en células provenientes de las especies canina (Guercio y col., 2013; James y col., 2017), equina (Alipour y col., 2015; Vidal y col., 2007) y felina (Martin y col., 2002).
En el presente trabajo, se utilizó el término de CMM para todas las especies, dado que se cumplieron las recomendaciones de la International Society of Cellular Therapy (ISCT) para animales domésticos (Bourin y col., 2013), debido a que mostraron morfología fibroblástica, adherencia al plástico, capacidad de formar colonias y potencial de tridiferenciación in vitro (linajes: adiposo, cartilaginoso y óseo). El criterio de referencia para estas especies es la prueba de tridiferenciación in vitro (Dominici y col., 2006). Sin embargo, los primeros trabajos sobre terapia celular en especies domésticas comenzaron por describir aplicaciones terapéuticas de “CMM” sin una adecuada caracterización (Arinzeh y col., 2003; Bruder y col., 1998; de Mattos Carvalho y col., 2011; Pacini y col., 2007). Posteriormente, en consecuencia, a las recomendaciones de la ISCT aparecieron trabajos enfocados en la caracterización celular de estas especies de interés veterinario (Clark y col., 2017; Hillmann y col., 2016; Kang y col., 2012). La importancia de la adecuada caracterización permite estandarizar las terapias celulares, ya que sin una mínima caracterización de las células utilizadas es difícil atribuirle los resultados beneficiosos a una población celular indefinida y también dificulta su reproducibilidad experimental (Bourin y col., 2013; Hoffman y Dow, 2016).
Para las CMM de origen humano las exigencias son mayores debido que también debe realizarse la inmunofenotipificación por citometría de flujo (Bourin y col., 2013). En cambio, para animales domésticos la inmunofenotipificación, queda en un plano secundario, debido a la escasa información que existe actualmente de los marcadores adecuados para células caninas, equinas y felinas, sumado al difícil acceso a anticuerpos diseñados específicamente para dichas especies (Dominici y col., 2006; Hillman y col., 2016; Gómez y col., 2015; Screven y col., 2014).
En el presente trabajo nuestros resultados coincidieron con las anteriores descripciones a nivel nacional en cuanto a la morfología fibroblástica, adherencia al plástico, capacidad de formar colonias fibroblastoides (UFC-F) y la capacidad de diferenciación in vitro de las células estromales, pero con algunas diferencias según la especie. En el caso de caninos, nuestros resultados coinciden con la descripción de la morfología y capacidad de tridiferenciación de las CMM-TA de Yaneselli (Yaneselli y col., 2018), pero en esta última publicación no fue comprobada la capacidad de UFC-F. Por otra parte, algunos trabajos incluyen a la caracterización celular la inmunofenotipificación (Yaneselli y col., 2013; Yaneselli y col., 2018), la cual es exigida en células humanas y solo recomendada para las provenientes de especies domésticas. En la especie equina coincidimos con los resultados de Fernández y Ríos (Fernández y Ríos, 2016), en el aislamiento y la morfología de las células estromales mesenquimales. Sin embargo, ellos solo describen la diferenciación al linaje óseo y cartilaginosos in vitro, mientras que, en este trabajo si se pudo comprobar la tridiferenciación.
Conclusiones
Por primera vez a nivel nacional se describe el aislamiento y la caracterización recomendada internacionalmente de las CMM-TA provenientes de caninos, equinos y felinos. Las células presentaron morfología fibroblástica, adherencia al plástico, capacidad clonogénica y de tridiferenciación in vitro. Por último, se ha generado un banco de células madre criopreservadas de origen animal, las cuales pueden ser utilizadas para otros estudios de caracterización in vitro o también con fines terapéuticos en medicina veterinaria.














