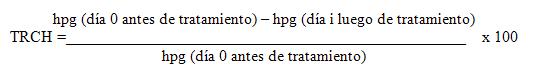Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Veterinaria (Montevideo)
versión impresa ISSN 0376-4362versión On-line ISSN 1688-4809
Veterinaria (Montev.) vol.52 no.204 Montevideo dic. 2016
Eficacia clínica antiparasitaria contra Ancylostoma caninum y Trichuris sp de una formulación de liberación modificada en base a Ricobendazole para administración oral en perros
Antiparasitic efficacy of a Ricobendazole controlled release formulation against Ancylostoma caninum and Trichuris sp intended for oral administration in dogs
Dib A1*, Paredes A2, Aldrovandi A3, Allemandi A2, Lanusse C4, Palma S2. Sánchez Bruni S4.
1 Área Farmacología. Facultad de Veterinaria, Universidad de la República, Uruguay
2 Departamento de Farmacia, Facultad de Ciencias Químicas, UNITEFA, Universidad Nacional de Córdoba, Córdoba, República Argentina.
3 Instituto de Ciencias y Tecnología de los Alimentos, Facultad de Veterinaria, UdelaR.
4 Laboratorio de Farmacología, Facultad de Medicina Veterinaria, CIVETA-UNCPBA, Tandil, República Argentina.
*Autor para correspondencia: aliciadib2014@gmail.com
Recibido: 11/5/2016 Aceptado: 12/7/2016
Resumen
El objetivo de este trabajo, fue evaluar la eficacia clínica antiparasitaria en perros de dos diferentes dosis (20 mg/kg y 10 mg/kg), de una formulación experimental de liberación modificada (LM) en base a Ricobendazole (RBZ) formulada en una matriz lipídica con Alcohol Cetílico y compararla con la eficacia clínica de una formulación experimental de RBZ (20 mg/kg) de liberación inmediata (LI) y una formulación comercial de Albendazole (ABZ) LI (25 mg/kg) (3 dosis sid consecutivas). Se trabajó con perros (n=30) naturalmente parasitados con Ancylostoma caninum y Trichuris sp agrupados aleatoriamente en 5 grupos (n = 6). Los datos estadísticos se analizaron mediante un test t (p<0,05) y un test Kruskall-Wallis – Test posthoc: Mann-Whitney (p<0,05). Se observó que la aparición del máximo efecto antiparasitario de la formulación RBZ LM, fue al día 2 post administración, en contraste con el de RBZ LI y ABZ LI. La reducción del conteo de huevos observados contra las especies parásitas luego de la administración de la dosis de 10 m/kg de RBZ LM, estarían relacionados con la potencia del principio activo y su mínima dosis efectiva. Serían necesarios estudios farmacocinéticos a la dosis de 10 mg/kg para determinar la biodisponibilidad de RBZ por vía oral en perros a dicha dosis. No se observaron reacciones adversas o toxicidad en los animales, luego de la administración de los diferentes tratamientos farmacológicos.
Palabras clave: Caninos, benzimidazoles, sistemas de liberación modificada
Summary
The aim of this work was to evaluate the clinical oral efficacy in dogs of two different single doses (20 mg/kg and 10 mg/kg) of a controlled release (CR) Ricobendazole (RBZ) based formulation formulated within a lipid matrix of Cetyl Alcohol and compare it with those of one single dose RBZ immediate release (IR) formulation (20 mg/kg) and one Albendazole (ABZ) IR formulation (25 mg/kg) (3 consecutive doses q/24 h). Thirty naturally parasitised dogs with Ancylostoma caninum and Trichuris sp were randomly allocated to five groups (n=6). A pair-sample t- Test (p<0.05) and a Kruskall-Wallis - Test posthoc: Mann-Whitney (p<0.05) were performed. The potency and the minimum effective dose of RBZ could be related to the high clinical efficacy observed against the gastrointestinal parasite species after the administration of 10 mg/kg. More pharmakinetics assays in order to determine the bioavailabity of RBZ in dogs after the administration of the mentioned dose would be required. No adverse reactions or toxicity were observed in the animals after the administration of the different treatments.
Keywords: canines, benzimidazoles, modified release systems
Introducción
El tratamiento y el control de los parásitos internos en pequeños animales, es muy importante dado que afectan su normal desarrollo y crecimiento, pueden producir diarreas severas y disturbios metabólicos (Diez, 1999; Soulsby, 1987). Ancylostoma caninum y Trichuris sp. son las especies parásitas más importantes de nematodes gastrointestinales (GI) del perro adulto en nuestro país.
En la actualidad, son muchas las presentaciones farmacológicas presentes en el mercado veterinario para el combate de estos helmintos parásitos. Los benzimidazoles (BZD), son fármacos que han sido incluidos en formulaciones que se usan en todas las especies domésticas, tanto de producción como en animales de compañía (Campbell, 1990). Albendazole (ABZ), es un BZD metil-carbamato efectivo contra especies parásitas de nematodes patógenos GI y pulmonares, cestodes y trematodes como Fasciola hepática (Campbell, 1990; McKellar, 1990). En rumiantes, el ABZ es efectivo para el control de formas maduras y larvarias de diferentes especies de nematodes GI de los géneros Haemonchus, Trichostrongylus, Ostertagia, Cooperia, Nematodirus, Bunostomun, Oesophagostum, Neoascaris, Chabertia, Strongyloides y Trichuris. Además, nematodes pulmonares del género Dictyocaulus y cestodes como Moniezia. En caninos, es indicado para especies del género Toxocara, Ancylostoma, Uncinaria, Stongyloides y Trichuris y cestodes como Dipylidium y Taenia sp. (Campbell, 1990). Se ha demostrado la eficacia de ABZ y su metabolito activo sulfóxido (ABZSO), contra el protozoo Giardia duodenalis en humanos (Oxberry y col., 2000), así como su actividad ovicida contra Ascaris summ en la especie suina (Belo y col., 1999).
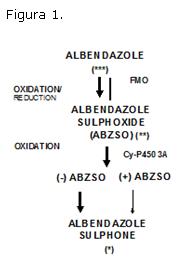
El metabolito activo ABZSO también conocido como Ricobendazole (RBZ), se forma mediante un proceso de oxidación mediado por la enzima flavin monooxigenasa hepática (Fig 1). Se encuentra disponible en el mercado veterinario de algunos países de Sudamérica, excepto Uruguay, como preparados farmacéuticos en forma de comprimidos ranurados de liberación inmediata (LI) para administración oral en dosis única (20 mg/kg) en perros.
En los sistemas LI, la liberación de la sustancia activa no está deliberadamente modificada por un diseño de formulación particular ni por un método de fabricación especial. La velocidad de disolución del principio activo depende de sus propiedades intrínsecas y existe siempre un control reducido en la liberación del principio activo (Veiga y col., 2001). La concentración que alcanza el sitio de acción, no siempre es igual, lo cual puede redundar en cambios constantes e impredecibles y muchas veces derivar en concentraciones sub o supra terapéuticas en el sitio de acción (Verma y Garg, 2001). La baja solubilidad acuosa de los BZD, puede limitar su absorción durante el tránsito GI, lo cual es particularmente importante en perros, dado su corto tracto GI (García Sacristán y col., 1995), comparado al de otras especies domésticas, como por ejemplo rumiantes y equinos (Mc Kellar y col., 1993) e incluso al de los seres humanos (Ganong, 1995). En caninos, un sistema LI en base a BZD, puede pasar a través del duodeno, que es la porción intestinal con más capacidad de absorción, antes de que pueda producirse la completa disolución y liberación del fármaco, afectando por ende su biodisponibilidad. Los sistemas LM, son capaces de mantener y liberar una cantidad de principio activo, en forma predecible y medible durante un período prolongado de tiempo (Choi y col., 2002).
Se forman cuando un polímero u otro sistema matricial se combina con una fármaco u otro agente farmacológicamente activo, formando una formulación de la cual el principio activo, se libera en forma prediseñada. La base racional de estos sistemas, es la optimización de las propiedades biofarmacéuticas, farmacocinéticas y farmacodinámicas de un fármaco, así como el de proveer un control terapéutico seguro (Srikanth y col., 2013).
En los sistemas LM, la tasa de liberación del fármaco está principalmente controlada por las propiedades físico-químicas del polímero (Hjorth y Karlsen, 2002; Juárez y Villafuerte, 2011), pero además otros factores como el pH del medio, en el cual se produce la liberación del principio activo, debe ser tomado en cuenta (Sáez, 2004). Por ejemplo, con excipientes formadores de matrices hidrofílicas, es posible modificar el ambiente de disolución del fármaco para controlar la velocidad de liberación, creando un micro-pH en la matriz (Costa y col, 2004). Por tanto, estos sistemas poliméricos, pueden favorecer la liberación prolongada del fármaco, independientemente de la velocidad de pasaje por el tracto GI. Los materiales usados para el diseño y desarrollo de sistemas LM, pueden ser hidrofílicos, como por ejemplo la Hidroxipropil metil celulosa y el Ácido Algínico o lipofílicos como el Alcohol Cetílico y los Gelucires®. Dib y col. (2015) evaluaron el comportamiento farmacotécnico (in vitro) y farmacocinético (in vivo) de diferentes formulaciones LM, en las cuales se utilizaron los materiales formadores de matriz antes mencionados.
El Alcohol Cetílico, es ampliamente utilizado en preparaciones farmacéuticas sólidas como comprimidos, formas semisólidas, como cremas y ungüentos y formas líquidas como emulsiones y lociones. Alcohol Cetílico, es una mezcla sólida alifática de alcoholes que comprenden principalmente 1-hexadecanol (C16H30O) (Rowe y col., 2009).
La hipótesis de trabajo fue que la formulación de RBZ LM podría mejorar las propiedades biofarmacéuticas y optimizar su eficacia antiparasitaria.
El objetivo de este trabajo, fue evaluar la eficacia clínica antiparasitaria de dos diferentes dosis (20 mg/kg y 10 mg/kg), de una formulación en base a RBZ LM, formulada en una matriz lipídica con Alcohol Cetílico, administradas en dosis única por vía oral en perros y comparar dicha eficacia con la de una formulación en dosis única de RBZ LI (20 mg/kg) y una formulación de ABZ LI (25 mg/kg) en 3 dosis consecutivas, (sid).
Materiales y métodos
Este estudio fue llevado a cabo de acuerdo a la normativa de la Asociación Mundial para el Avance de la Parasitología Veterinaria (WAAVP) (Jacobs y col., 1994). El protocolo de investigación se realizó siguiendo las normativas y con la aprobación de la Comisión Honoraria de Experimentación Animal (CHEA), de la Universidad de la República.
Animales
Se trabajó con perros (n=30) naturalmente parasitados con Ancylostoma caninum y Trichuris sp. procedentes de un refugio canino del Departamento de Canelones, Uruguay. Los animales, estaban alojados en caniles individuales con piso de cemento y techo de lata, cada canil tenía además una superficie a cielo abierto. Todos los animales estaban quirúrgicamente esterilizados. Los perros (18 machos y 12 hembras), eran de raza cruza y sus edades estaban comprendidas entre 2 y 10 años y sus pesos promedios fueron de 25 ± 5,5 kg. Todos los animales tenían acceso libre al agua y eran alimentados con comida de tipo balanceada.
Se recogió materia fecal de cada perro, desde el piso de su canil, el mismo día de la emisión y se analizó con un método tradicional de flotación (Willis, 1921) y se verificó la morfología de los huevos (Boch y Supperer, 1992; Thienpont y col., 1979).
Grupo experimentales
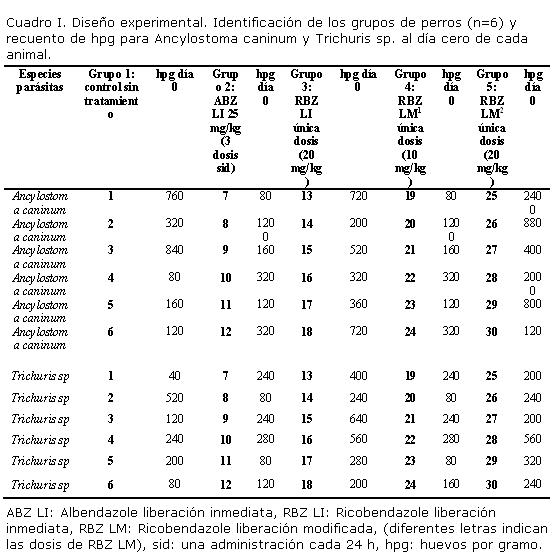
Los animales fueron distribuidos en forma aleatoria en 5 grupos (n = 6 cada uno). Los grupos fueron identificados de la siguiente manera: Grupo 1: control sin tratamiento, Grupo 2: ABZ LI, Grupo 3: RBZ LI, Grupo 4: RBZ LM1, Grupo 5: RBZ LM2. El valor de huevos por gramo (hpg) de materia fecal al día 0 (pre- tratamiento) en todos los perros, fue de un promedio de 537 para Ancylostoma caninum (rango entre 2400 y 80 hpg) y de un promedio de 246 hpg para Trichuris sp. (rango entre 640 y 40 hpg). El Cuadro I muestra el diseño experimental y los valores de hpg al día 0 de todos los animales incluidos en el ensayo.
Formulaciones farmacológicas administradas
Las formulaciones en forma de comprimidos ranurados administradas por vía oral a los animales fueron: una formulación experimental en base a RBZ LM con una matriz lipídica de Alcohol Cetílico, una formulación experimental en base a RBZ LI y una formulación comercial en base a ABZ LI (Prazibek®, Vetcross).
El diseño, formulación y evaluación farmacotécnica de todas las formulaciones experimentales en base a RBZ usadas en este trabajo, se hizo en el Departamento de Farmacia de la Facultad de Ciencias Químicas, UNITEFA, Universidad Nacional de Córdoba, Argentina (Dib y col., 2015).
Administración de las formulaciones y toma de muestras fecales post-administración
Los perros positivos incluidos en este trabajo, fueron sometidos a un ayuno de 12 horas previo a la administración de los tratamientos farmacológicos.
Se tomó materia fecal de cada perro, el mismo día de su emisión desde el piso de su canil a los días 1, 2, 3, 7, 14 y 30, post- administración de la última dosis de cada formulación. La toma de muestras se hizo en forma manual, con la protección de guantes descartables, se utilizó un guante diferente para cada animal. Cada muestra fecal, se guardó en heladera (4°C), en frascos debidamente rotulados hasta su análisis parasitológico.
Se utilizó una técnica de flotación de Willis (Willis, 1921) y una técnica McMaster (Thienpont, 1979). El análisis de todas las muestras fecales, se realizó en el Departamento de Parasitología de la Facultad de Veterinaria, Universidad de la República.
Bioquímica sanguínea y hematológica
Se evaluó actividad enzimática (alanino amino transferasa ALT, aspartato aminotransferasa, AST y fosfatasa alcalina, ALP), a las 24 horas previas y a las 48 horas posteriores a la administración de la última dosis de cada formulación farmacológica. Para ello, se recolectaron muestras sanguíneas (5 ml), de la vena cefálica antebraquial de cada perro utilizando mariposa y jeringa 18G. La sangre extraída, se introdujo inmediatamente en tubos estériles BD Vacutainer® identificados para tal fin y se almacenó en heladera (4°C), hasta su posterior análisis. El mismo, se realizó dentro de las 24 h posteriores a la extracción, en el Laboratorio de Análisis Clínicos de la Facultad de Veterinaria, UdelaR. Se utilizó un equipo CB 350i Wiener Lab group Italia, mediante el método de acuerdo a la Federación Internacional de Química Clínica (IFCC).
Eficacia clínica parasitológica
El test de reducción de conteo de huevos (TRCH), de cada especie de parásito en cada perro, fue determinado por la siguiente fórmula:
Los animales fueron rutinariamente observados por personal experimentado, durante varias horas post- tratamiento, para reportar la aparición de posibles reacciones adversas.
Análisis estadístico
Se utilizó el test t (p<0,05), para muestras pareadas para evaluar la eficacia clínica de RBZ LM en dos dosis diferentes (10 mg/kg y 20 mg/kg), dado que se midieron los valores de hpg y TRCH de cada grupo de perros a diferentes tiempos, comparándolos con los respectivos valores de hpg al día 0.
Se usó el test de Kruskal-Wallis – Test posthoc: Mann-Whitney (p< 0,05), para comparar las eficacias clínicas entre las diferentes formulaciones utilizadas, ya que los diferentes grupos de perros, que fueron seleccionados aleatoriamente, presentaron contajes muy dispares mostrando alta heterogeneidad.
Se utilizó el test t (p<0,05) para muestras pareadas para evaluar la significancia estadística entre los valores de la bioquímica sanguínea previo y post administración para cada animal.
Todos los datos estadísticos, se examinaron utilizando el software gratuito Past 3.07 (Hammer y col., 2001).
Resultados
Los animales no presentaron signos de toxicidad a las dosis utilizadas, la constitución de los comprimidos demostró ser fácilmente fraccionable para administrar dichas dosis. Ningún animal presentó dificultades para ingerir los comprimidos ni tampoco se produjo regurgitación.
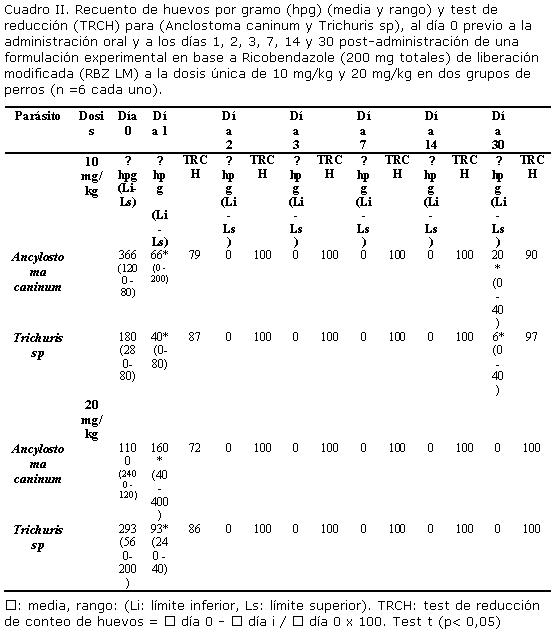
Los cuadros II, III y IV, muestran los recuentos de hpg (media y rango) y TRCH para Ancylostoma caninum y Trichuris sp. al día cero previo a la administración y a los días 1, 2, 3, 7 y 30 post-administración de las diferentes formulaciones, a los distintos grupos de perros de la población de estudio, así como su significancia estadística (límites de confianza del 95%), mediante el test t (p< 0,05).
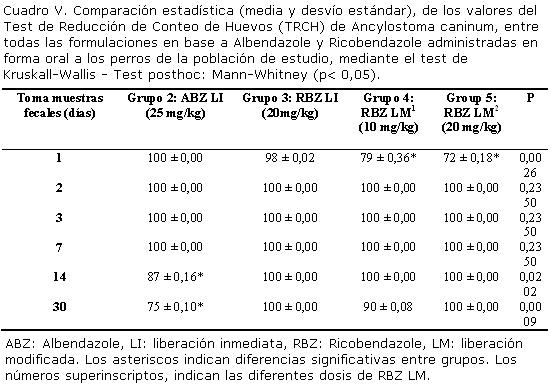
Los recuentos de hpg, fueron negativos al día 2 post tratamiento para las formulaciones en base a RBZ LM (10 mg/kg y 20 mg/kg). Sin embargo, se observó una TRCH de 90% y 97% para Ancylostoma caninum y Trichuris sp. respectivamente al día 30 post administración de la formulación en base a RBZ LM administrada a 10 mg/kg (Cuadro II).
En referencia a la formulación comercial de ABZ, se observó una eficacia antiparasitaria del 100% para Ancylostoma caninum desde el día 1 hasta el día 7 post-administración, sin embargo a los días 14 y 30 la eficacia antiparasitaria, disminuyó a 87% y 75% respectivamente. El TRCH para Trichuris sp, no superó el 56% durante todo el ensayo experimental (Cuadro III).
La formulación RBZ LI (20 mg/kg), demostró una efectividad del 100% al primer día post-administración, la cual se mantuvo durante todo el ensayo (Cuadro IV).
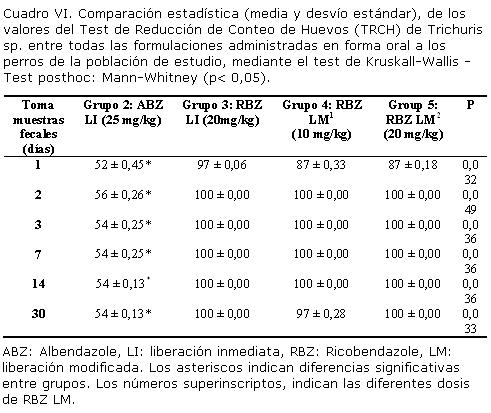
Los Cuadros V y VI, comparan los TRCH de las diferentes formulaciones administradas a los perros participantes en el ensayo, contra Ancylostoma caninun y Trichuris sp. respectivamente, así como su significancia estadística (p<0,05).
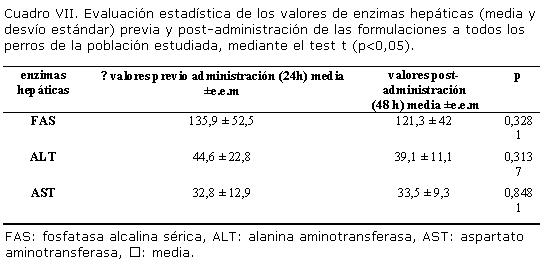
El Cuadro VII muestra la comparación estadística mediante el test t (p<0,05), entre la media de los valores de enzimas hepáticas (FAS, ALT y AST), medidos en todos los perros de la población, a las 24 horas pre-administración y a las 48 horas post administración de todas las formulaciones farmacéuticas. No se observaron diferencias estadísticas en los tiempos estudiados.
Discusión
Los tiempos de aparición de los efectos farmacológicos, pueden variar según la vía de administración utilizada y las características físico-químicas y biofarmacéuticas del fármaco. Entre el tiempo que transcurre desde la administración y la aparición de los efectos farmacológicos, el principio activo debe atravesar diferentes barreras biológicas. Este pasaje, va a depender no solamente de las propiedades físico-químicas de la molécula administrada, sino también de la naturaleza de dichas barreras (Sánchez Bruni y col., 2006). La baja solubilidad de los BZD, puede limitar la liberación, la absorción y por ende la biodisponibilidad del fármaco administrado durante su tránsito por el GI (McKellar y col., 1990; Mc Kellar y col., 1993). Una dosis terapéutica convencional de ABZ por vía oral (25 mg kg cada 24hs) durante 3 a 5 días (Campbell, 1990), ha sido indicada en perros para alcanzar concentraciones plasmáticas estables de la droga, debido a su baja solubilidad (0,01 mg/ml) (Galia y col., 1999) y al corto tránsito GI de esta especie, a diferencia del de las especies rumiantes. En estas especies los BZD se administran en única dosis por vía oral, sufren un efecto reservorio a nivel ruminal, un atrapamiento iónico en el abomaso y un pasaje lento del principio activo al intestino, donde se producirá su absorción (Lanusse y Pritchard, 1993).
Hollenwegger y col. (1987), evaluaron la eficacia antiparasitaria de una formulación comercial de ABZ contra nematodes GI en perros, administrada por vía oral en tres diferentes dosis (10, 20 y 30 mg/kg). En ese trabajo, se obtuvieron recuentos negativos de huevos de Ancylostoma caninum y Trichuris sp. a la dosis de 30 mg/kg. Sin embargo, en dicho trabajo, el producto se utilizó en forma extra-rótulo, ya que su presentación era en forma de suspensión para toma oral, indicada para la especie ovina.
La solubilidad del RBZ es mayor (0,062 mg/ml) (Wu y col., 2005), que la de ABZ. Esta molécula se encuentra formulada en productos comerciales LI para perros, en forma de comprimidos de administración oral en única dosis (20 mg/kg), que contienen 200 mg totales de RBZ por cada comprimido. La indicación terapéutica del laboratorio de referencia (AFFORD S.A., Argentina), es de administrar un comprimido cada 10 kgs de peso vivo, como se indica en su producto APTOMAX®, el cual está registrado en el Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA) de la República Argentina, con el número 04-133 (senasa.gov.ar). Saumell y col. (2006), evaluaron la eficacia clínica parasitológica de dicho producto comercial en perros, administrándolo a la dosis indicada de 20 mg/kg. En ese trabajo, se obtuvo un recuento negativo de huevos de Ancylostoma caninun y Trichuris sp. al día 4 post-dosificación.
En el presente trabajo, se evaluó la eficacia clínica de una formulación experimental en base a RBZ LM, formulada en una matriz lipídica con Alcohol Cetílico, dado que la hipótesis, afirmaba que la modulación de la liberación del principio activo RBZ por parte de dicha matriz, optimizaría su eficacia antiparasitaria y sus propiedades biofarmacéuticas.
La formulación experimental en base a RBZ LM con Alcohol Cetílico utilizada en este estudio, fue la que exhibió el mejor perfil farmacocinético como liberación modificada in vivo, cuando fue comparada con otras formulaciones experimentales en base a RBZ LM testadas por Dib y col. (2015). En ese trabajo, se demostró que el tiempo de aparición del pico plasmático (Tmax) de la formulación en base a RBZ LM con Alcohol Cetílico, fue mayor que el de otras formulaciones experimentales en base a RBZ LM y RBZ LI.
En el presente estudio, se evidenció que ambas dosis (10 mg/kg y 20 mg/kg) de la formulación RBZ LM con Alcohol Cetílico, alcanzaron un TRCH del 100% contra Ancylostoma caninum y del 96% contra Trichuris sp. al día 2 post- administración, mientras que la formulación en base a RBZ LI, obtuvo un TRCH cercano al 100% contra ambos parásitos GI al día 1 post-administración.
Este resultado, sugirió que la matriz lipídica con Alcohol Cetílico de la formulación experimental en base a RBZ LM, pudo demorar la aparición de la máxima eficacia clínica antiparasitaria observada, tanto luego de la administración de la dosis completa convencional (20 mg/kg), como luego de la administración de la mitad (10 mg/kg) de dicha dosis, lo cual no se consideró una desventaja desde el punto de vista clínico. Se sugirió la existencia de un paralelismo entre el tiempo de aparición de la máxima eficacia clínica de esta formulación experimental con su perfil farmacocinético (Tmax) observado in vivo por Dib y col., (2015).
Los autores consideraron interesante observar, que la elevada eficacia clínica antiparasitaria observada luego de la administración de la dosis de 10 mg/kg de la formulación experimental con Alcohol Cetílico, podría estar relacionada con la potencia del principio activo, dado que aunque la cantidad de fármaco que llegó a los parásitos fue menor, igualmente se obtuvo una elevada eficacia antiparasitaria. Esto supuso que la molécula RBZ, podría tener una dosis efectiva mínima más baja que la dosis convencional. Sin embargo, esto deberá ser confirmado mediante la evaluación farmacocinética correspondiente con dicha dosis.
Es preciso destacar que Dib y col., (2010), demostraron que una única dosis oral convencional (20 mg/kg), de la misma formulación experimental en base a RBZ LI que se usó en el presente trabajo, alcanzó un 500% de más alta biodisponibilidad plasmática, que una dosis convencional (25 mg/kg), de una formulación experimental en base a ABZ LI administrada también en única dosis. Por tanto, cabe considerar que la administración de la mitad de la dosis convencional de RBZ, podría mejorar el margen de seguridad para esta molécula, basado en su comportamiento farmacocinético.
Los perros utilizados en el presente trabajo, no presentaron signos de toxicidad a las dosis administradas de las formulaciones experimentales en base a RBZ o de la formulación comercial en base a ABZ. Tampoco se encontró diferencia significativa en los valores de enzimas hepáticas de los perros de la población de estudio, luego del análisis de los resultados bioquímicos, previa y post-administración de las formulaciones (Cuadro VII). El interés de realizar este estudio bioquímico, fue dado por la extensa metabolización en segundo pasaje hepático, que sufre la molécula RBZ hacia su metabolito inactivo sulfona (Figura 1).
Secuencia metabólica propuesta para ABZ y sus metabolitos. Los procesos de oxidación son mediados por la enzima flavin-monoxigenasa (FMO) y citocromo- P450 (CY-P450 3A). Paso enantiomérico del metabolito activo sulfóxido (ABZSO) o Ricobendazole (RBZ): los enantiomeros (-) y (+) en caninos fueron demostrados por Delatour y col., (1990). La potencia antihelmíntica de la droga madre y metabolitos están representados como: (*) muy pobre o sin actividad, (**) buena actividad y (***) muy buena actividad. Adaptado de Sánchez Bruni y col., (2006).
Se ha estudiado que los medicamentos, pueden presentar reacciones adversas o tóxicas inesperadas, por lo que la farmacovigilancia continuada es necesaria una vez que los productos se registran para su venta (Batalha, 1997). No se encontraron a la fecha del presente ensayo, trabajos científicos que hubieran estudiado la toxicidad aguda de RBZ en animales de experimentación o reportes de notificaciones adversas o tóxicas de perros tratados con esta molécula. Sin embargo, los trabajos publicados sobre toxicidad aguda y valores de dosis letal 50 (DL50), del fármaco madre ABZ en animales de experimentación, indican que la DL50 de ABZ en ratas por vía oral, oscila entre 1.320 a 2.400 mg/kg (Dayan Stokol y col., (1997), indicaron que una dosis de 30 a 40 mg/kg de ABZ durante 4 a 90 días en perros, causó anemia reversible, leucopenia y pérdida de peso. También, observaron que un perro desarrolló toxicidad de la médula ósea, luego de la administración de ABZ (25 mg/kg, c/24 hs) durante 5 días, seguido por la administración de 50 mg/kg per os cada 12 hs durante 5 días. Los resultados observados por Stokol y col., (1997), permiten evidenciar que las reacciones adversas que se detallaron en los animales de ese estudio, pudieron ser debidas a que los perros recibieron durante varios días, dosis superiores a la dosis terapéutica convencional.
La eficacia parasitológica de la formulación comercial en base a ABZ LI fue del 100% al día 1 contra Ancylostoma caninum, la cual se mantuvo hasta el día 7, sin embargo se observó un recuento del 87%, al día 14 post administración de la última dosis, lo cual sugirió una reinfestación con esta especie de nematode en los perros que recibieron este tratamiento. Se observó una actividad moderada (TRCH: 56%) contra Trichuris sp. durante todo el ensayo, como estudiado por Campbell, (1990).
Conclusiones
Los TRCH observados contra Ancylostoma caninum y Trichuris sp. luego de la administración de la mitad de la dosis convencional (10 m/kg), de RBZ LM, redundaría en una mejora del margen de seguridad de la molécula RBZ. Sin embargo, harían falta evaluaciones farmacocinéticas de la molécula in vivo en perros tratados con esa dosis.
Serían necesarios realizar ensayos donde se evalúen los niveles de toxicidad aguda de RBZ en animales de experimentación, administrado por vía oral u otras vías de administración.
Bibliografía
1. Batalha A. (1997). Veterinary pharmacovigilance in the EU. Proceedings 2nd International Symposium on Veterinary Pharmacovigilance, 29-30. BGVV, Berlin.
2. Belo M, Castagnoli K, Gomes R, Costa A, Nascimento A, Morais D. (1999). Assay on the efficacy of an albendazole sulphoxide, praziquantel and pyrantel pamoate association for helminth parasite control in cats. ARS Vet Sup 45-49.
3. Boch J, Supperer R. (1982). Parasitología en Medicina Veterinaria. Buenos Aires, Argentina, Ed. Hemisferio Sur 627 p.
4. Campbell W. (1990). Benzimidazoles: veterinary uses. Parasitol Today 6:130-133.
5. Choi B, Park H, Hwang S, Park B. (2002). Preparation of alginate beads for floating drug delivery system: effects of CO2 gas-forming agents. International Journal of Pharmaceutics 239:81-91.
6. Costa E, Arancibia A, Aïache JM. (2004). Sistemas Matriciales. Acta Farm Bonaerense 23:259-265.
7. Albendazole, mebendazole and praziquantel. Review of non-clinical toxicity and pharmacokinetics. Acta Trop 86:141–159.
9. Dib A, Paredes A, Eliópulos N, Farías C, Suárez G, Allemandi D, Lanusse C, Sánchez Bruni S. (2015). Pharmacokinetic Assessment of Novel Controlled Release Formulations of Ricobendazole Intended for Oral Administration in Dogs. Clinical & Experimental Pharmacology 5- 6. Doi: 10/4172/2161-1459.1000198.
10. Dib A, Suárez G, Farías G, Cabrera P, Castro S, Allemandi D, Moreno L, Lanusse C, Sanchez Bruni S. (2010). Albendazole sulphoxide kinetic disposition after treatment with different formulations in dogs. J Vet Pharmacol Therap 34:136-141.
11. Dίez P, Dίez N, Morrondo M. (1999). Nematodosis: Toxocariosis, Toxascariosis, Ancilostomatidosis, Tricuriosis, Estrongiloidosis, Espirocercosis y Ollulanosis. En: Cordero del Campillo M, Rojo F. Parasitología Veterinaria. Madrid, Ed. Mc Graw Hill. Interamericana pp. 615-651.
12. Galia E, Horton J, Dressman J. (1999). Albendazole Generics – a comparative in vitro study. Pharm Res 16: 1871-1875.
13. Ganong W. (1995). Digestión y Absorción. En: Fisiología Médica. 20a ed. México, Ed. Panamericana pp. 535-568.
14. García Sacristán A, Castejón F, de la Cruz L, Gonzalez J, Murillo M, Salido G. (1995). Transportes de los alimentos en el tracto digestivo. En: Fisiología Veterinaria. México, ed. Interamericana – Mc Graw Hill pp. 528-568.
15. Hammer O, Harper D, Ryan P. (2001). Past: Paleontological Statistics software package for education and data analysis. Paleontología Electrónica 4: 9.
16. Hjorth H, Karlsen J. (2002). Alginate in Drug Delivery Systems. Drug Development and Industrial Pharmacy 28:621–630.
17. Holenwegger J, Waserman A, Pérez R, Mato B. (1987). Estudio de la eficacia nematocida de Albendazol en los caninos. Veterinaria Argentina 4:165-167.
18. Jacobs D, Arakawab A, Courtney C, Gemmeld M, McCalle J, Myers G, Vanoarujsg O. (1994). World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) guidelines for evaluating the efficacy of anthelmintics for dogs and cats’. Vet Parasitol 52:179-202.
19. Juárez D, VillaFuerte L. (2011). Gelucire 39/01 as excipient for gastroretentive metronidazole sustained delivery. Int J Pharm Pharm Sci 3:86-91.
20. Lanusse C, Prichard R. (1993). Cinical Pharmacokinetics and metabolism of benzimidazole anthelmintics in ruminants. Drug Metabol Rev. 25:235-279.
21. Lumsden JH, Mullen K, McSherry BJ. (1979). Canine hematology and biochemistry reference values. Canadian Journal of Comparative Medicine 43:125–131.
22. McKellar Q, Galgraith E, Baxter P. (1993). Oral absorption and bioavailability of fenbendazole in the dog and the effects of concurrent ingestion on food. J Vet Pharmacol Therap 13:223-227.
23. McKellar Q, Harrison P, Galbraith E, Inglis I. (1990). Pharmacokinetics of fenbendazole in dogs. J Vet Pharmacol Therap 13:386-392.
24. Oxberry M, Reynoldson J, Thompson R. (2000). The binding and distribution of albendazole and its principal metabolites in Giardia duodenalis. J Vet Pharmacol Therap 23:113-120.
25. Rowe R, Sheskey P, Quinn M. (2009). Cetyl Alcohol. En: Handbook of Pharmaceutical Excipients. 6a. ed. London UK, Ed. Pharmaceutical Press pp.155-156.
26. Sáez V, Hernáez E, Sanz L, Katime I. (2004). Liberación controlada de fármacos. Micropartículas. Revista Iberoamericana de Polímeros 5:87-101.
27. Sánchez Bruni S, Jones D, McKellar Q. (2006). Pharmacological approaches towards rationalizing the use of endoparasitic drugs in small animals. J Vet Pharmacol Therap 29:443-457.
28. Saumell C, Fuse L, Monfrinotti A, Iglesias L, Steffan P, Fiel C. (2006). Evaluación de Ricobendazole vía oral en caninos. Rev Med Vet 87:160-165.
29. senasa.gov.ar/Archivos/File/File831-productos.xls. Fecha de consulta: 25 de julio de 2016
30. Soulsby E. (1987). Parasitología y Enfermedades Parasitarias. 7a. ed. México, Ed. Interamericana 823 p.
31. Srikanth P, Narayana R, Wasim Raja S, Brito Raj S. (2013). A review on oral controlled drug delivery. Advanced Pharmaceutics 3:51-58.
32. Stokol T, Randolph F, Nachbar S, Rodi C, Barr S. (1997). Development of bone marrow toxicosis after albendazole administration in a dog and cat. Am Vet Med Assoc 210:1753-1756.
33. Thienpont D, Rochette F, Vanparijs O. (1979). Diagnóstico de las helmintiasis por medio del examen coprológico. Beerse, Bélgica, Ed. Janssen Research Foundation 187 pp.
34. Veiga D, Gil E, Torrado J. (2001). Aspectos fundamentales de los sistemas farmacéuticos. Preformulación. En: Vila Jato JL. Tecnología farmacéutica. Madrid, Ed. Universidad Complutense de Madrid pp. 27-73.
35. Verma R, Garg S. (2001). Current status of Drug Delivery Technologies and Future Directions. Pharmaceutical Technology on-line 25:1-4.
36. Willis HH. (1921). A simple levitation method for the detection of hookworm ova. Med J Aust 2:375-376.
37. Wu Z, Razzak M, Tucker I, Medlicott N. (2005). Physicochemical Characterization of Ricobendazole: Solubility, Lipophilicity, and ionization characteristics. Int J Pharm Sci 94:983-993.