Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Veterinaria (Montevideo)
versión impresa ISSN 0376-4362versión On-line ISSN 1688-4809
Veterinaria (Montev.) vol.52 no.202 Montevideo mayo 2016
Desarrollo y dinámica de los folículos ováricos desde la etapa fetal hasta la prepuberal en bovinos
Development and follicular dynamics from fetal life until puberty in cattle
Filipiak Y1, Viqueira M2, Bielli A2*
1Biotecnología de la Reproducción, Departamento de Reproducción Animal, Facultad de Veterinaria, Universidad de la República, Lasplaces 1620, 11600 Montevideo, Uruguay.
2Histología y Embriología, Departamento de Morfología y Desarrollo, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
*Autor para correspondencia: Alejandro Bielli biellialejandro@gmail.com
Recibido: 4/11/2015 Aceptado: 13/4/2016
Resumen
Esta revisión compila el desarrollo y la dinámica folicular con una perspectiva histológica y de biología del desarrollo, desde la etapa fetal hasta prepuberal en bovinos (Bos taurus). Se trata de un proceso complejo y coordinado, con cambios fisiológicos y morfológicos que intervienen en la diferenciación y el desarrollo ovocitario. Los folículos son la unidad fundamental del ovario y comandan los procesos reproductivos y las fases del ciclo estral, con dos funciones fundamentales, la producción de hormonas y de ovocitos. La formación de folículos primordiales se conoce como el proceso de ensamblaje folicular, en el cual “nidos” de ovocitos completan su proliferación mitótica y comienzan la meiosis, mientras que muchos de estos folículos se vuelven apoptóticos, favoreciendo la desorganización de los nidos. El proceso de formación de folículos primordiales comienza durante el desarrollo fetal en bovinos, aproximadamente a los 80 días de gestación. Existe gran variación individual en el número de folículos, existiendo un pool de reserva ya al nacimiento. De unos 2.700.000 folículos primordiales constituidos al final del ensamblaje folicular, 90% degeneran, quedando al nacimiento aproximadamente 135.000 células germinales, las cuales declinan rápidamente hasta la pubertad y luego de ella. Los folículos primordiales se desarrollan a folículos primario, secundario, antral y preovularorio (en hembras adultas). Estas transiciones implican cambios citológicos, histológicos y morfológicos que son descritos. En terneras, igual que en animales adultos, ocurren ondas de crecimiento folicular, que aparecen a la segunda semana de vida. En la pubertad se observan importantes cambios endócrinos y ováricos y es influida por múltiples factores. El desarrollo folicular está íntimamente vinculado al futuro desempeño reproductivo de las hembras, por lo cual su conocimiento es fundamental para un adecuado manejo reproductivo de la hembra bovina y para ampliar las investigaciones vinculadas a esta disciplina.
Palabras clave: desarrollo folicular, folículos, ovocitos, dinámica folicular, bovinos.
Summary
We review the follicular development and follicular dynamics from a histological and developmental perspective, from fetal to prepubertal life in cattle (Bos taurus). This is a complex and coordinated process accompanied by physiological and morphological changes involved in oocyte differentiation and development. The ovarian follicles are the fundamental unit of the ovary and command both reproductive processes and the phases of the estrous cycle, with two main functions, production of hormones and of oocytes. The formation of primordial follicles is a process called follicular assembly, whereby "nests" of oocytes complete their mitotic proliferation and enter meiosis, while many of such follicles become apoptotic, promoting the disruption of oocyte nests. The formation process of primordial follicles begins during fetal development in cattle, approximately at 80 days of gestation. There is considerable individual variation in the number of follicles, and there is a pool of reserve follicles built before birth. Cow’s ovaries hold about 2,700,000 primordial follicles, but 90% degenerate, with approximately 135,000 germ cells surviving at birth and declining promptly until puberty and even later in life. Primordial follicles develop into primary, secondary, antral and preovulatory follicles (in adults). This developmental process involves cytological, histological and morphological changes. In calves, follicular waves similar to those in adult animals occur from 2 weeks of age on. Important endocrine and ovarian changes are observed at puberty and are influenced by multiple factors. Follicular development is closely linked to the future reproductive performance of females. Thus, knowing this process is essential in order to manage adequately cattle breeding as well as to deepen research regarding this subject.
Keywords: follicular development, follicles, oocytes, follicular dynamics, bovine cattle
Introducción
El estudio del desarrollo folicular en bovinos en etapas tempranas de la vida aporta valiosa información sobre una serie de eventos coordinados que inducen cambios fisiológicos y morfológicos en el ovario y que intervienen en la diferenciación y en el desarrollo ovocitario y por lo tanto, en el futuro desempeño reproductivo de las hembras. Nos proponemos revisar y ordenar esta información desde etapas tempranas del desarrollo embrionario hasta la pubertad, considerando aspectos del desarrollo embrionario y fetal, de la diferenciación celular de los tejidos involucrados, del comienzo de la meiosis en los gametos femeninos, del desarrollo folicular pre y posnatal y de la dinámica folicular hasta la pubertad en bovinos.
Otras revisiones han abordado la temática desde diferentes perspectivas, Moran y col. (1989) centraron su trabajo en los aspectos que vinculan el desarrollo y los eventos que determinan la pubertad en los bovinos. Newman (1991), así como Fortune (1994; 2001), abordan el desarrollo folicular en mamíferos describiendo los eventos que ocurren desde una perspectiva histológica y funcional. Las revisiones de Mogollón y col. (2003) y de Mhim y Bleach (2003) refieren fundamentalmente a las hormonas involucradas en el crecimiento y la dinámica folicular, así como su control exógeno. Otras revisiones más recientes abordan la dinámica folicular en mamíferos, describiendo en diferentes especies los eventos y factores que intervienen (Espinosa-Villavicencio y col., 2007), mientras que Palma y col. (2012), enfocan esta temática desde el punto de vista molecular, mencionando detalladamente las interacciones celulares, los factores autócrinos y parácrinos, así como los genéticos. En relación al desarrollo folicular en rumiantes, Rosales-Torres (2012) explica los factores involucrados en generar los estímulos e inhibiciones que sufre este proceso en cada etapa, mientras que Motta-Delgado y col. (2011) y Aerts y Bols (2010) se dedican a la dinámica folicular en bovinos, entendiendo los procesos de la foliculogénesis durante todas las etapas fisiológicas de la vida de la hembra y los eventos que tienen lugar. En esta revisión abordamos específicamente el desarrollo folicular, con una perspectiva histológica y de la biología del desarrollo, centrando el estudio desde la etapa fetal hasta la prepuberal en las hembras bovinas. Conocer los aspectos vinculados al desarrollo folicular es fundamental para ampliar las investigaciones vinculadas a esta temática.
Características generales del ovario
Los ovarios son órganos pares; en el bovino presentan un cuerpo irregular firme, de forma prácticamente ovoide algo aplastada y pequeño en relación al tamaño corporal (mide unos 4 x 2,5 x 1,5cm). Uno de sus bordes, el hilio, está unido por el mesovario al ligamento ancho, que lo une a la pared corporal inmediatamente antes de la entrada de la pelvis y al tracto reproductor (Dyce y col., 1991). El ovario tiene una zona periférica gruesa o corteza, que rodea la médula. La corteza se encuentra rodeada por el epitelio germinal (o germinativo), formado por células planas o cuboideas. El epitelio germinal es un epitelio mesotelial que recubre al ovario y corresponde así al peritoneo visceral ovárico. Por lo tanto, la denominación de epitelio germinal resulta engañosa, ya que no da origen a tipo celular o estructura ovárica alguna (de él no germina nada). Por dentro del epitelio germinativo existe una capa de tejido conjuntivo denso y resistente, muy rico en fibras colágenas, la túnica albugínea. En la corteza, rodeados por tejido conjuntivo correspondiente al estroma ovárico, por dentro de la túnica albugínea, se encuentran incluidos los folículos ováricos, los cuales contienen a los ovocitos. Los folículos aparecen en la corteza en varios tamaños de acuerdo a su estado de desarrollo. La médula está constituida básicamente por tejido conjuntivo laxo conteniendo vasos sanguíneos tortuosos y grandes en relación al tamaño del ovario, así como nervios y vasos linfáticos (Bloom-Fawcett, 1992).
Los folículos son la unidad fundamental del ovario y son las estructuras que comandan los procesos reproductivos y las fases del ciclo estral (Motta-Delgado y col., 2011). El folículo contiene al ovocito cubierto de células epiteliales pregranulosas o granulosas. Los ovocitos de los mamíferos se desarrollan y alcanzan la madurez ovulatoria dentro de los folículos (Palma, 2008). El folículo es una estructura ovárica con 2 funciones fundamentales, la producción de hormonas y de ovocitos aptos para ser fecundados. Estas funciones son llevadas a cabo por los folículos antrales, los cuales poseen una pared interna de células de la granulosa delimitadas por una lámina basal, que separa las células granulosas de los tejidos de origen mesenquimatoso y que afecta la migración celular, la proliferación y la diferenciación de las células que se encuentran junto a ella.
Clasificación de los folículos
Los diferentes estadios foliculares de desarrollo han sido descritos en una serie de clasificaciones de nomenclatura distinta. Aquí presentamos la clasificación más utilizada a nivel internacional:
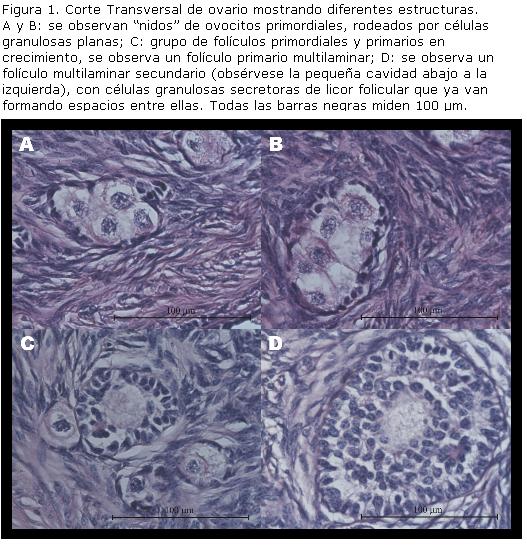
Folículos primordiales: son estructuras algo ovaladas, casi siempre se verán aproximadamente circulares al corte, en cortes sagitales se apreciará un perfil algo más alargado. Están constituidos por un ovocito cuyo crecimiento se encuentra detenido en la fase de diploteno de la profase I de la meiosis (etapa exclusiva de la meiosis de las hembras de mamífero, denominada dictioteno) y que está rodeado por una sola capa de células epiteliales foliculares pregranulosas (células planas de aspecto fusiforme) (Nilsson y Skinner, 2001). En bovinos, se observa un promedio de 5 células pregranulosas en la sección que corta al folículo primordial por su mayor diámetro (Rajakoski, 1960). En total, el complejo presenta menos de 10 células planas pregranulosas. El diámetro del ovocito en esta etapa es de unos 30 µm, mientras que el folículo primordial tiene un diámetro total menor a 40 µm (Fortune, 2003).
Folículos primarios: constan de un ovocito rodeado por una capa de células granulosas que adquieren una forma cuboidal (Hirshfield, 1991). El folículo aumenta su tamaño a unos 40-80 µm, rodeado por 10 a 40 células de la granulosa (Fortune, 2003). Las células granulosas cuboidales se dividen formando varias capas alrededor del ovocito (folículo multilaminar).
Folículos secundarios: éstos tienen varias capas de células granulosas, que se rodean a su vez por células de la teca (células fusiformes, más alargadas que las células granulosas) y el folículo aumenta de tamaño (80 a 250µm). Las células granulosas comienzan a segregar un líquido (licor folicular) que va formando espacios entre ellas; estos espacios confluyen posteriormente en una cavidad conocida como antro folicular; a su vez estas células segregan mucopolisacáridos que forman un halo protector (zona pelúcida) alrededor del ovocito.
Folículo antral: el antro folicular irá aumentando su tamaño hasta adquirir (exclusivamente en el animal que ha alcanzado la pubertad) las características de folículo preovulatorio o también conocido como folículo de de Graaf (Alba, 1964; Palma, 2001). La formación del antro ocurre en folículos de 0,2-0,4 mm de diámetro en bovinos, el ovocito ya mide unos 93 µm (Fortune, 2003) de diámetro. Los folículos preovulatorios alcanzan los 15 mm aproximadamente en animales adultos (Fortune, 1994). Las células granulosas continúan multiplicándose, esta proliferación va acompañada de una organización del estroma conjuntivo que las limita, formándose así las tecas foliculares interna y externa.
Ovogénesis y foliculogénesis
Etapa embrionaria y fetal: el proceso de formación de células germinales incluye varias etapas: (i) formación de las células germinales primordiales (CGP) en el saco vitelino; (ii) migración de las CGP a los pliegues gonadales; (iii) colonización de las gónadas por las CGP; (iv) diferenciación de las CGP en ovogonias; (v) proliferación de las ovogonias; (vi) iniciación meiótica; (vii) arresto (dictioteno) en el estado de diploteno de la profase de la 1ª división meiótica (Palma y col., 2012).
El desarrollo de los ovarios comienza entre las 3 y 6 semanas después de la concepción. En esta etapa tienen lugar numerosos eventos celulares: la masiva colonización del ovario fetal con células mesonéfricas (provenientes del riñón primitivo o mesonefros) precursoras de las células foliculares, la migración de las células germinales primordiales, la diferenciación sexual gonádica, la mitosis y apoptosis de células germinales (McNatty y col., 2000). En la mayoría de los animales domésticos, incluyendo el bovino, el desarrollo y la atresia foliculares ya tienen lugar durante la vida fetal (Palma, 2008).
La cresta germinal es una estructura alargada y convexa, par (derecha e izquierda), que corre a lo largo del techo del celoma (cavidad corporal embrionaria que dará origen a las cavidades peritoneal y pleural). Se encuentra a medial de cada cresta urinaria (la cresta que dará origen a los riñones) y está presente en forma rudimentaria en el embrión a partir de los 32 días luego del coito. Las células germinales se reconocen sin embargo, a partir de los 35 o 36 días de gestación. El ovario fetal bovino, entre los días 40 y 70 de gestación, no presenta aparentemente una organización interna, pero pueden ser observadas microscópicamente células somáticas y células germinales (Erickson, 1966b)
Desarrollo de las células germinales primordiales
Palma (2008) describe el desarrollo de las células primordiales del bovino de la siguiente manera: los ovocitos se diferencian a partir de las células no alineadas del epiblasto que durante la gastrulación se desprenden de la parte posterior de la línea primitiva para desarrollarse en células germinales primordiales. Estas células se alojan en el endodermo del saco vitelino, donde proliferan y emigran luego hasta la cresta genital, vía saco vitelino y endodermo del intestino caudal al extremo caudal del embrión. Este proceso ocurre simultáneamente a la metamorfosis en la conformación del embrión (de una forma inicial discoide a una tubular). Este proceso de plegamiento del embrión permite que el endodermo del saco vitelino sea incorporado al intestino posterior y que las células primordiales foliculares ocupen una posición intraembrionaria. Finalmente, las células primordiales foliculares migran a través de la matriz extracelular del mesénquima del mesenterio dorsal, hasta su localización definitiva en los pliegues o primordios gonadales (cresta genital) a los lados ventromediales del mesonefros (riñón primitivo).
Las células germinales primordiales se diferencian a ovogonias y la meiosis de éstas comienza en el feto bovino a los 75 a 80 días de gestación, mientras que se forman los cordones ovígeros y el ovario se organiza en una porción cortical periférica y una porción medular central. La mitosis de las ovogonias se discontinúa cerca del día 150 de gestación, mientras que los cordones ovígeros se fragmentan y por el día 170, el ovario se caracteriza por presentar una estrecha banda cortical de tejido germinativo y una médula prominente (Erickson, 1966b).
Coincidente con la iniciación de la meiosis, los folículos primordiales individuales emergen de los cordones ovígeros, en su porción más distal (periférica). Las células de origen mesonéfrico que originalmente constituyeron el cordón de células somáticas, a donde luego llegarán las células germinales primordiales, actualmente se denominan células pregranulosas (Juengel y col., 2002). El origen del cordón de células pregranulosas de los folículos primarios, proviene de las células epiteliales de la superficie del ovario, que emigran hacia el interior, como también de las células derivadas del mesonefros, que emigran en forma ascendente a través del ovario (Palma, 2008).
El peso de los ovarios aumenta abruptamente desde los días 50-60 hasta el día 110 de gestación (de 7 a 101±17 mg), junto con un pronunciado aumento en el número de células germinales, con un pico en el día 110 (pasan de ser 16.000 a 2.700.000 células germinales totales) pero luego disminuye (a unas 108.000) hacia el día 170. También se revela un rango de diferencias individuales, variando entre 18.000 y 200.000 células germinales entre ovarios de fetos de 170 a 270 días de gestación (Erickson, 1966b).
Aparición de los folículos primordiales
Los ovocitos de los mamíferos se mantienen quiescentes, alojados en unas estructuras conocidas como folículos primordiales (Nilsson y Skinner, 2009), que ya hemos descrito. Los ovarios de los mamíferos ya al nacimiento tienen una reserva de folículos primordiales, el número de folículos primordiales (reserva folicular) es determinante de la vida reproductiva de las hembras, así como de su vida fértil (Hirshfield, 1991): a cada ciclo estral, un número de folículos ováricos se desarrolla, secreta hormonas y luego terminan ya sea atresiándose u ovulando. El crecimiento de las células germinales comienza antes del desarrollo del folículo y continúa durante el mismo (McNatty y col., 2000).
La formación de los folículos primordiales es un proceso que se conoce como ensamblaje folicular. Durante el ensamblaje folicular, grupos o “nidos” de ovocitos completan su proliferación mitótica y comienzan la meiosis, separándose para formar folículos primordiales individuales (Pepling, 2006). Al mismo tiempo muchos de los ovocitos se vuelven apoptóticos y mueren, favoreciendo la desorganización de los nidos (Pepling y Spradling, 2001; Tilly, 1996). El proceso de formación de folículos primordiales ocurre durante el desarrollo fetal en los bovinos (Sakai, 1955; Tanaka y col., 2001), aproximadamente a los 80 días de gestación (Nilsson y Skinner, 2009); sin embargo, el ensamblaje folicular no es sincrónico, los nidos de ovocitos, folículos primordiales y otros estados de desarrollo folicular coexisten (Mbassa, 1989; Sakai, 1955; Tanaka y col., 2001; Nilsson y Skinner, 2009).
En los bovinos, de un máximo de 2.700.000 folículos primordiales, el 90% se perderán por degeneración en las divisiones meióticas iniciales. El número de folículos primordiales disminuye en un 90% en los bovinos, quedando al nacimiento un número aproximado de 135.000 folículos primordiales (Van Den Hurk y Zhao, 2005).
Desarrollo folicular y ovocitario
La foliculogénesis es un proceso complejo donde interactúan gonadotrofinas, esteroides ováricos y otros factores. Este proceso es continuo, es decir, la emergencia de folículos desde el grupo de reserva ocurre diariamente. Habiendo descrito las características morfofuncionales que permiten clasificar a los folículos ováricos, describiremos ahora los procesos paulatinos que llevan al desarrollo de cada tipo folicular.
Folículo primario unilaminar: la transición de un folículo primordial a un folículo primario en desarrollo, implica cambios citológicos en el ovocito, en las células foliculares y las células del estroma vecino. A medida que el ovocito se agranda y multiplica sus organelos, las células foliculares se hacen cuboideas o cilíndricas bajas y por proliferación mitótica, dan origen a un epitelio estratificado de células de la granulosa.
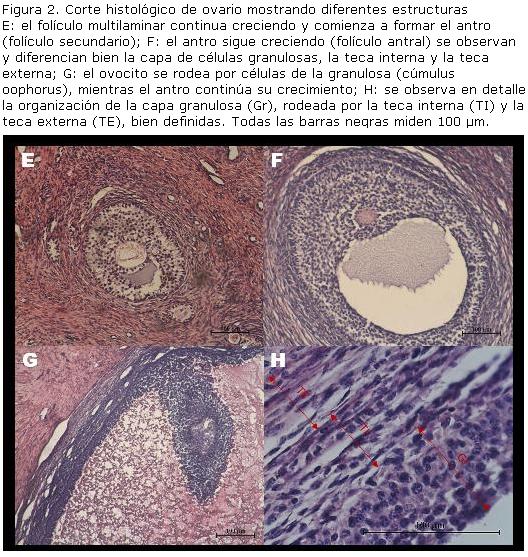
Folículo primario multilaminar y folículo secundario: se forma por proliferación de las células foliculares. Cuando el ovocito se rodea por 6 a 12 capas de células, aparecen entre ellas espacios irregulares conteniendo un líquido claro (folículo secundario), que se conoce como líquido (licor) folicular. Junto con el crecimiento del ovocito se producen cambios notables en la distribución de sus organelos y se forma entre las células granulosas y el ovocito un espacio, en el que penetran microvellosidades del oolema y de las células granulosas. En este espacio se acumula un material amorfo glicoproteico que se condensa y recubre al ovocito, formando así la zona pelúcida, por lo tanto, la zona pelúcida (antiguamente denominada membrana pelúcida) es una estructura no celular. Las únicas estructuras con unidad de membrana que se encuentran en la zona pelúcida son las microvellosidades pertenecientes al ovocito y a las células granulosas. Sobre la lámina basal que separa las células de la granulosa con el estroma vecino, se produce el reclutamiento de células del estroma que en torno al folículo se diferencian para formar la teca folicular interna. En los bovinos, la teca se forma en estados avanzados de los folículos preantrales. A medida que crece el folículo, los espacios irregulares van confluyendo para formar una única cavidad que al principio tiene forma de media luna, llamada antro. De aquí en adelante, se le llamará folículo antral pequeño (Bloom-Fawcet, 1992) (Figura 1)
Folículo antral: los folículos vesiculares o antrales son observables en ovarios bovinos a partir de los 250 días de gestación. Un folículo antral pequeño cuenta con más de 250 células de la granulosa, alineadas en más de 6 capas; su diámetro oscila entre 250-500 µm. El diámetro del ovocito alcanza las 93 µm y en esta etapa ya está completamente formada la zona pelúcida (Erickson, 1966b). El comienzo de la formación del antro, la formación de la zona pelúcida en su totalidad y la diferenciación de la teca externa establecen el desarrollo del folículo antral (Aerts y Bols, 2010). Los folículos antrales grandes, también conocidos como folículos de de Graaf, presentan una cavidad antral completamente desarrollada, rodeada por varias capas de células de la granulosa y el ovocito rodeado por un grupo de células de la granulosa llamadas células del cumulus oophorus (literalmente: “acúmulo que sostiene al huevo”, Aerts y Bols, 2010). El folículo antral dominante continúa creciendo hasta alcanzar los diámetros de los folículos preovulatorios; según Adams y col. (1994), el folículo dominante en bovinos alcanza un diámetro promedio de 11,2 mm (Figura 2).
El crecimiento folicular responde a una secuencia de eventos organizados, que incluyen la ocurrencia de ondas foliculares, que promueven el reclutamiento de pequeños folículos antrales, la selección de un folículo dominante que alcanza un diámetro marcadamente superior y la dominancia, mediante la cual el folículo dominante promueve la atresia de los folículos subordinados (Mogollón y col., 2003).
Un estudio llevado a cabo por Hiershfield (1991) analiza los patrones de crecimiento y atresia folicular de una manera particular, considerando el desarrollo folicular como series de generaciones de células de la granulosa, definiendo a una generación como el tiempo requerido para duplicar el número de células granulosas que se observan rodeando un corte del folículo que atraviesa su diámetro mayor. Este estudio permite observar en folículos de rata, que la transición de folículo primordial a los estadios de folículo primario, es más prolongada; o sea, las generaciones iniciales de células de la granulosa, que coinciden con los primeros estadios de crecimiento folicular, durante las primeras generaciones de células de la granulosa (tiempo requerido para duplicar el número de células de la granulosa), se suceden más lentamente que en los estadios finales de crecimiento folicular. Por otro lado, en bovinos, se ha observado que es frecuente la atresia folicular de varios de los folículos en desarrollo, en el curso de unas pocas generaciones de células de la granulosa, cerca del final del desarrollo folicular, entre la décima y decimotercera generación, que son las generaciones que preceden a la penúltima generación (Fortune, 1994). En el bovino, menos del 1% de los folículos primordiales que crecen completan la maduración final (García, 2002).
En un estudio realizado en hembras Hereford, a partir de una muestra de 116 animales de diferentes edades que oscilaban entre el nacimiento y los 20 años de edad, se encontró que el número de folículos y de células germinales en bovinos, aún dentro de la misma raza y edad, presenta una gran variación individual. Esta variación oscilaba entre 0 (estériles) y 700.000 células germinales. Las células germinales alojadas en folículos primordiales permanecen numerosas en los ovarios de hasta 180 días de edad y declinan rápidamente en número hasta la pubertad y luego de ella. El número de folículos primordiales se mantiene estable hasta los 4 a 6 años y luego declinan hasta cerca del punto 0, alcanzando los 20 años de edad (Erickson, 1966a).
Erickson (1966a) encontró en terneras recién nacidas (1 a 14 días de edad), un promedio de 156.000 folículos primordiales, 53 folículos en crecimiento (primarios y secundarios) y 7 folículos antrales, de los cuales 2 eran atrésicos. Los folículos en crecimiento, de más de una capa de células foliculares, aumentaron rápidamente entre los 50 y los 80 días y se incrementaron gradualmente hasta los 120 días, mientras que los folículos antrales se incrementaron en número paralelamente a los folículos en crecimiento, alcanzando los 63 folículos en promedio a los 180 días, produciéndose luego una disminución a partir de los 8 meses de edad. Desjardins y Hafs (1969) no encontraron folículos visibles macroscópicamente en terneras recién nacidas (1 a 3 días), mientras que el número de folículos pequeños (<5mm) y grandes (>5mm) se incrementó hasta un máximo a los 4 meses (22 vs. 5), decreciendo luego desde los 4 a los 8 meses, estableciéndose así un número relativamente constante a partir de los 8 meses.
Dinámica folicular en bovinos
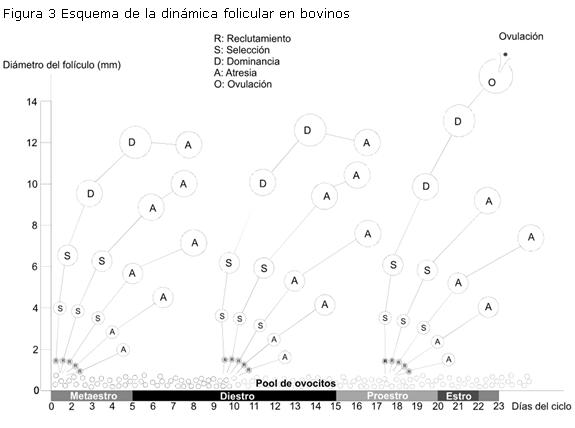
El crecimiento folicular en bovinos sexualmente maduros ocurre en “ondas” de crecimiento folicular (Pierson y Ginther, 1988; Savio y col., 1988; Sirois y Fortune, 1988). Un grupo de folículos antrales emerge de forma sincrónica y un folículo dominante crece a un diámetro mayor que el resto (folículos subordinados) (Adams y col., 1992). Cada ciclo estral en bovinos comprende dos o tres ondas de desarrollo folicular. Cada onda se inicia con el reclutamiento de pequeños folículos antrales (4 a 5 mm de diámetro), los cuales crecen, uno de ellos adquiere dominancia, alcanzando un diámetro marcadamente superior y regula el crecimiento de los folículos subordinados. El folículo dominante de la última onda folicular ovula en vacas maduras (Ginther y col., 1989a). Cerca de la ovulación, se observa un crecimiento secuencial y regresión de folículos grandes utilizando ultrasonografía (Roche y Boland, 1991) (Figura 3).
Dinámica folicular prepuberal en bovinos
En terneras prepúberes, se ha documentado de la misma manera un patrón de desarrollo folicular en ondas de crecimiento (Adams y col., 1994a,b). En edades tan tempranas como 2 semanas de vida, este patrón ya está presente en terneras, tal como se ha visto en vacas adultas (Evans y col., 1994a); de la misma manera que se describe en animales postpuberales, emerge simultáneamente un grupo de pequeños folículos en crecimiento, seguido por el mayor crecimiento de un folículo dominante (fase de crecimiento) y regresión de los subordinados; el folículo dominante se mantiene durante una fase estática en su mayor tamaño, para luego entrar en atresia y producirse la emergencia de una nueva onda folicular.
En términos generales, estas ondas son similares desde el punto de vista cualitativo pero difieren cuantitativamente a las descritas en animales postpuberales (Ginther y col., 1989a,b). Adams y col. (1994) encontraron las siguientes diferencias estudiando mediante ultrasonografía transrectal la dinámica folicular de terneras Hereford durante los 5 meses que anteceden a la pubertad: (i) todas las ondas son anovulatorias en animales prepúberes; (ii) la fase de crecimiento del folículo dominante y del primer folículo subordinado tienen menor duración en animales prepúberes (4,7±0,3 vs. 6,1±0,3 y 2,2±0,2 vs. 2,4±0,2 días respectivamente); (iii) los diámetros de los folículos dominantes y del primer folículo subordinado durante la fase estática son marcadamente menores en animales prepúberes que en postpuberales (11,2±0,2 vs. 15,8±0,5mm y 7,1±0,3 vs. 8,2±0,4mm, respectivamente); (iv) la fase estática del folículo dominante y del primer folículo subordinado es de menor duración en animales prepuberales (5,1±0,3 vs. 5,8±0,5 y 1,8±0,2 vs. 2,1±0,3 días, respectivamente); (v) el intervalo entre ondas es más corto en prepúberes (8,0±0,4 vs. 9,7±0,2 días).
Evans y col. (1994a) observaron que este patrón de ondas foliculares es observable desde las 2 semanas de edad y durante toda la vida reproductiva del animal, con la diferencia sustancial que el diámetro máximo del folículo dominante y el del mayor folículo subordinado se incrementa con la edad. El mayor incremento de estos diámetros ocurre entre las 2 y las 8 semanas de edad. También se observa un incremento en el número de folículos tanto grandes como pequeños. Ya a partir de los 8 meses de edad, son pocas las variaciones que ocurren en la dinámica folicular de las hembras hasta la primera ovulación, no encontrando variación significativa en el diámetro máximo de los folículos dominantes o subordinados, mientras que sí se encontró una pequeña diferencia en el intervalo entre las ondas foliculares.
Evans y col. (1994b) encontraron una pequeña diferencia en el intervalo entre ondas foliculares de terneras prepúberes en comparación con vaquillonas postpuberales, siendo de más larga duración en vaquillonas postpuberales de 2 ondas foliculares por ciclo, que en terneras prepúberes o vacas de 3 ondas foliculares.
Estas investigaciones sugieren que los mecanismos endócrinos que conducen a la emergencia, crecimiento y selección de un folículo dominante son similares entre las ondas en el período anovulatorio prepúber y las ondas durante los ciclos ovulatorios en hembras maduras.
Primer ciclo estral
La pubertad determinada por la etapa en la que tiene lugar la primera ovulación, se puede definir como el proceso a través del cual los animales adquieren la capacidad de reproducirse (Robinson, 1977). El período en que ocurre la pubertad es influido por múltiples factores, incluyendo edad, peso y tamaño corporal, nutrición, raza, estación del año y hasta factores sociales o fases de la luna. El tamaño y el peso corporal, junto con la nutrición son determinantes aún más significativos que la edad del animal para predecir el momento de la pubertad (Moran y col., 1989).
Cerca de la primovulación en vaquillonas se ha observado importantes cambios endócrinos y ováricos. Durante los 2 meses que preceden la pubertad, se ha observado que las concentraciones de LH y la frecuencia de los pulsos de LH se incrementan (Day y col., 1984; Kinder y col., 1987). Observaciones similares se realizaron en ovejas (Rawlings y Churchill, 1990) y cerdas (Lutz y col., 1984). Se ha sugerido que este incremento en la secreción de LH ocurre como resultado de un descenso de la sensibilidad del eje hipotálamo-hipofisario al feed-back negativo de los estrógenos ováricos (Day y col., 1987).
A la primera ovulación le sigue un ciclo ovulatorio pero silencioso, de corta duración y luego un ciclo de duración normal (Adams y col., 1992; Evans y col., 1994b). En un estudio realizado por Evans (1994b), examinando el desarrollo folicular en los meses que anteceden y siguen a la primera ovulación y relacionando los cambios ováricos y hormonales que suceden durante este período, observaron un patrón de crecimiento folicular en ondas en todos los casos estudiados. La ovulación se produjo a las 56±1,2 semanas, con peso corporal de 391,9±12,0 kg. Tras la primera ovulación todas las hembras presentaron un ciclo ovulatorio corto (7,7±0,2 días), acompañado por una sola onda de crecimiento folicular. Este ciclo fue seguido por un ciclo de duración normal (20,3±0,5 días) de 2 o 3 ondas foliculares. Las concentraciones de FSH se incrementaron formando un pico el día de la emergencia de la onda folicular. Se observó concentraciones máximas de estradiol plasmático en el desarrollo de cada onda folicular, las cuales fueron en aumento hasta obtener las mayores concentraciones asociadas a los folículos ovulatorios de los ciclos de duración normal. Las concentraciones de progesterona en plasma se incrementaron por 3 días durante el ciclo corto y por 11 y 12 días para los ciclos de duración normal para las vaquillonas de 2 y 3 ondas foliculares respectivamente. La concentración de progesterona fue mayor en los ciclos de duración normal que en los de corta duración (10,15±0,58 ng/ml vs 2,75±0,55 ng/ml). Las concentraciones de FSH a las 12 semanas fueron mayores que los valores a las 20 semanas o a las 4 semanas previas a la primera ovulación. Las concentraciones basales de LH fueron mayores y la frecuencia de los picos de LH de mayor amplitud a medida que se acercaba la fecha de la primera ovulación.
Los diámetros máximos de los folículos dominantes fueron menores que los diámetros reportados en vacas maduras (Savio y col., 1988; Ginther y col., 1989b). Esto indica que la primera ovulación no es el final del período de desarrollo reproductivo, sino que la maduración reproductiva continúa luego de la primera ovulación.
Para explicar el incremento en la secreción de estradiol y LH a medida que se acerca la primera ovulación, la hipótesis de inhibición gonadal (Ramirez y McCann, 1963) sugiere que en los estadios tardíos de maduración sexual, la respuesta del eje hipotálamo-hipofisario hacia el feed-back negativo del estradiol decrece, permitiendo incrementos en la secreción de LH, lo cual a su vez estimula un aumento de la producción de estradiol. La maduración de la regulación de la secreción de gonadotrofinas, es considerada el mayor componente del proceso de maduración sexual (Ojeda, 1991).
Conclusión
El desarrollo folicular es un proceso complejo, que comienza en etapas tempranas de la vida, antes del nacimiento, aproximadamente a los 80 días de gestación en bovinos y que continúa durante la vida posnatal y hasta la pubertad, resultando en un proceso continuo. Se ha encontrado una gran variación individual en cuanto al número de folículos y de células germinales en bovinos, existiendo un pool de folículos de reserva ya al nacimiento de las terneras, el cual podría determinar la fertilidad a largo plazo de las hembras bovinas. Este pool permanece elevado en ovarios de hasta 180 días de edad y declina rápidamente hasta la pubertad y luego de ella.
En terneras prepúberes, se reconoce un patrón de desarrollo folicular en ondas de crecimiento. En edades tan tempranas como 2 semanas de vida, este patrón ya está presente en terneras, de la misma manera que en vacas adultas. Estos hallazgos sugieren que los mecanismos endócrinos que conducen a la emergencia, crecimiento y selección de un folículo dominante son similares entre los ciclos de hembras prepúberes y adultas.
Hemos revisado la literatura referente al desarrollo folicular en bovinos prepúberes, intentando contribuir al entendimiento de aspectos vinculados a esta temática, con énfasis en el desarrollo morfológico. Su conocimiento es fundamental para ampliar las investigaciones vinculadas a esta disciplina.
Bibliografía
1. Adams GP, Evans ACO, and Rawlings NC. (1994). Follicular waves and circulating gonadotrophins in 8-month-old prepubertal heifers. J Reprod Fertil 100:27-33.
2. Adams GP, Matteri RL, Kastelic JP, Ko JHC and Ginther OJ. (1992). Association between surges of follicle-stimulating hormone and the emergence of follicular waves in heifers. J Reprod Fertil 97:177-188.
3. Aerts JM y Bols PE. (2010). Ovarian folicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and pre-antral follicle development. Reprod Domest Anim 45:71-179.
4. Alba J. (1964). Reproducción y Genética Animal. 1ª Edición. Turrialba, Costa Rica. Instituto Interamericano de Ciencias Agrícolas de la OEA.
5. Bloom W y Fawcett DW. (1992). Tratado de Histología. 11ª Edición. México: Editorial Interamericana, McGraw-Hill.
6. Day ML, Imakawa K, García-Winder M, Zalesky DD, Schanbacher BD, Kittok RJ, y Kinder JE. (1984). Endocrine mechanisms of puberty in heifers: estradiol negative feedback regulation of luteinizing hormone secretion. Biol Reprod 31:332-341.
7. Day ML, Imakawa K, Wolf PL, Kittok RJ y Kinder JE. (1987). Endocrine mechanisms of puberty in heifers: role of hypotalamo-pituitary estradiol receptors in the negative feedback of estradiol in luteinizing hormone secretions. Biol Reprod 37:1054-1065.
8. Desjardins C and Hafs HD. (1969). Maturation of bovine female genitalia from birth through puberty. J Anim Sci 28:502-507.
9. Dyce KM, Sack WO, Wensing CJG (1991). Anatomía Veterinaria. Buenos Aires, Argentina. Editorial Médica Panamericana SA.
10. Erickson BH (1966b). Development and radio-response of the prenatal bovine ovary. J Reprod Fertil 10:97-105.
11. Erickson BH. (1966a). Development and senescence of the postnatal bovine ovary. J Anim Sci 25:800-805.
12. Evans ACO, Adams GP and Rawlings NC. (1994a). Follicular and hormonal development in prepubertal heifers from 2 to 36 weeks of age. J Reprod Fertil 103:463-470.
13. Evans ACO, Adams GP y Rawlings NC. (1994b). Endocrine and ovarian follicular changes leading up to the first ovulation in prepuberal heifers. J Reprod Fertil 100:187-194.
14. Evans ACO, Currie WD y Rawlings NC. (1992). Effects of Naloxone on circulating gonadotrophin concentrations in prepubertal heifers. J Reprod Fertil 96:847-855.
15. Fortune JE (1994). Ovarian follicular growth and development in mammals. Biol Reprod 50:225-232.
16. Fortune JE, Rivera GM, Evans ACO y Turzillo AM. (2001). Differentiation of dominant versis subordinate follicles in cattle. Biol Reprod 65: 648-654.
17. Fortune JE. (2003). The early stages of follicular development: activation of primordial follicles and growth of preantral follicles. Anim Reprod Sci 78:135–163
18. García A. (2002). Monitoring follicular development in cattle by real-time ultrasonography. Embryo Transfer Newsletter 20:1-25.
19. Ginther OJ, Kastelic JP and Knopf L (1989a). Composition and characteristics of follicular waves during the bovine estrus cycle. Anim Reprod Sci 20:187-200.
20. Ginther OJ, Knopf L and Kastelic JP. (1989b). Temporal associations among ovarian events in cattle during oestrus cycles with two and three follicular waves. J Reprod Fertil 87:223-230.
21. Hirshfield AN (1991). Development of follicles in the mammalian ovary. Int Rev Cytol 124:43-101.
22. Juengel JL, Sawyer HR, Smith PR, Quirke LD, Heath DA, Lun S, Wakefield SJ, McNatty KP (2002). Origins of follicular cells and ontogeny of steroidogenesis in ovine fetal ovaries. Mol Cell Endocrinol 191:1–10.
23. Kinder JE, Day ML y Kittok RJ. (1987). Endocrine regulation of puberty in cows and ewes. J Reprod Fertil S 34:167-186.
24. Lutz JB, Rampacek GB, Kraeling RR y Pinkert CA. (1984). Serum luteinizing hormone and estrogen profiles before puberty in the gilt. J Anim Sci 58: 686-691.
25. Mbassa GK. (1989). Studies on the ovarian development in zebu cattle (Bos indicus). Anat Histol Embryol 18:143–149.
26. McNatty KP, Fidler AE, Juengel JL, Quirke LD, Smith PR, Heath DA, Lundy T, O'Connell A y Tisdall DJ. (2000). Growth and paracrine factors regulating follicular formation and cellular function. Mol Cell Endocrinol 163:11-20.
27. Mhim M y Bleach ECL. (2003). Endocrine regulation of ovarian antral follicle development in cattle. Anim Reprod Sci 78: 217-237.
28. Mogollón GF, Correa JE. (2003). Efecto del crecimiento folicular en el bovino. Facultad de Ciencias Veterinarias. Universidad Austral de Chile, Valdivia, Chile.
29. Moran C, Quirke JF y Roche JF. (1989). Puberty in Heifers: a Review. Anim Reprod Sci 18: 167-182.
30. Motta-Delgado PA, Ramos-Cuéllar N, González-Sánchez CM, Castro-Rojas EC. (2011). Dinámica folicular en la vida reproductiva de la hembra bovina. Vet Zootec 5(2):88-99.
31. Nilsson EE y Skinner MK. (2001). Cellular interactions that control primordial follicle development at folliculogenesis. J Soc Gynecol Invest 8:17-20.
32. Nilsson EE y Skinner MK. (2009). Progesterone Regulation of Primordial Follicle Assembly in Bovine Fetal Ovaries. Mol Cell Endocrinol 14(1–2):9–16
33. Ojeda SR. (1991). The mystery of mammalian puberty: how much more do we know? Perspect Biol Med 34:365-383.
34. Palma GA, Argañarez ME, Barrera AD, Rodler D, Mutto AA and Sinowatz F. (2012). Biology and Biotechnology of Follicle Development. Cient World J. Article ID 938138.
35. Palma GA. (2001). Biotecnología de la Reproducción. 1ª Edición. Argentina. Instituto Nacional de Tecnología Agropecuaria.
36. Palma GA. (2008). Biotecnología de la Reproducción. 2ª Edición. Córdoba, Argentina. Talleres Pugliese Siena.
37. Pepling ME y Spradling AC. (2001). Mouse ovarian germ cell cysts undergo programmed breakdown to form primordial follicles. Develop Biol 234: 339–351.
38. Pepling ME. (2006). From primordial germ cell to primordial follicle: mammalian female germ cell development. Genesis 44:622–632.
39. Pierson RA y Ginther OJ. (1988). Ultrasonic imaging of the ovaries and uterus in cattle. Theriogenology 29:21-38.
40. Rajakoski E. (1960). The ovarian follicular system in sexually mature heifers with special reference to seasonal, cyclical and left-rigth variations. Acta Endocrinol 34 (suppl52):1-68
41. Ramirez DV y McCann SM. (1963). Comparison of the regulation of luteinizing hormone (LH) secretion in immature and adult rats. Endocrinology 72:452-464.
42. Rawlings NC y Churchill IJ. (1990). Effects of Naloxone on gonadotrophin secretion at various stages of development in the ewe lamb. J Reprod Fertil 89: 503-509.
43. Robinson TJ. (1977). Reproduction in cattle. In: H.H. Cole and P.T. Cupps (Editores), Reproduction in Domestic Animals. 3era Edición. N.Y. Academic Press, Nueva York, Estados Unidos. pp. 433-441.
44. Roche JF y Boland MP. (1991). Turnover of dominant follicles in cattle of different reproductive states. Theriogenology 35:81-90.
45. Rosales-Torres AM, Sánchez AG y Aguilar CG. (2012). Follicular development in domestic ruminants. Trop Subtrop Agroecosyst 15 (2012) SUP 1:S147-S160.
46. Sakai T. (1995). Studies on the development of the embryonic ovary in swine, cattle and horse. Jpn J Vet Res 3:183–194.
47. Savio J, Keenan L, Boland M, Roche J. (1988). Pattern of growth of dominant follicles during the oestrus cycle in heifers. J Reprod Fertil 83:663-671.
48. Sirois J and Fortune JE. (1988). Ovarian follicular dynamics during the estrous cycle in heifers monitored by real time ultrasonography. Biol Reprod 39: 308-317.
49. Tanaka Y, Nakada K, Moriyoshi M, Sawamukai Y. (2001). Appearance and number of follicles and change in the concentration of serum FSH in female bovine fetuses. Reproduction 121: 777-782.
50. Tilly JL. (1996). Apoptosis and ovarian function. Rev Reprod 1:162–172.
51. Van Den Hurk R y Zhao J. (2005). Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Theriogenology 63, 1717–1751.